miRNA 在缺血性脑卒中神经保护领域的研究进展
李泓宇兰 瑞付雪琴王玮玮邹旭欢王漫漫张 勇唐 琛刘 双
(1.河南中医药大学,郑州 450000;2.河南中医药大学第一附属医院,郑州 450000;3.郑州大学第三附属医院,郑州 450000)
脑卒中是一种残疾率、复发率和死亡率都很高的脑血管疾病,严重影响了患者的生活质量[1]。 脑卒中可以分为缺血性脑卒中(ischemic stroke,IS)和出血性脑卒中,其中87%的病例属于缺血性脑卒中[2]。 尽管组织纤溶酶原激活剂( tissue plasminogen activator,tPA)溶栓和血管内血栓切除术是临床治疗的重要手段,但改善卒中后长期恢复的方法仍然有限。 因此,保护神经细胞免受脑缺血性损伤一直是IS 的治疗目标。
miRNA 属于小的非编码RNA 分子,可以通过靶向mRNA 的3’UTR 或促进mRNA 的降解来调节基因表达[3]。 miRNA 主要调节脑内关键基因的表达,在细胞凋亡、抗炎、抗氧化应激、神经分化、脑血管生成等过程中均发挥了重要作用[4]。 本文综述了近年来miRNA 参与缺血性脑卒中的神经保护的文献证据,从而指出其在神经元保护方面的潜力。
1 miRNA 概论
miRNA 是由18 ~25 个核苷酸组成的小的单链非编码RNA 分子,miRNA 来源于细胞核,它首先被RNA 聚合酶Ⅱ转录为初级miRNA,然后通过微处理器切割成前体miRNA,随后又被转移到细胞质中并加工成双链RNA,成为成熟的miRNA。 成熟的miRNA 被释放到受体细胞中参与转录并进行基因表达,同时调节多种细胞和分子途径[5]。 miRNA 几乎在所有细胞活动中都起着至关重要的作用,它可通过多种途径发挥生物学功能[6-7]。 并且不同的miRNA 可在缺血性损伤后负责脑细胞之间的通信,缺血后脑细胞产生的miRNA 可以穿过细胞外囊泡或外泌体中的血脑屏障(blood brain barrier,BBB),然后在脑缺血再灌注后的神经修复机制中起着调节作用[8]。
2 miRNA 在缺血性脑卒中神经保护作用
据报道,miRNA 在中枢神经系统疾病发生发展中起着重要的作用[9-10]。 Gámez-Valero 等[11]研究表明,miRNA 对不同退行性痴呆疾病具有神经保护作用,还反映了痴呆疾病差异性特征,有助于路易体痴呆和阿尔茨海默病的鉴别诊断。 Bai 等[12]研究证实,在帕金森疾病中,miRNA 抑制了神经胶质细胞中的NF-κB 信号传导,减少了神经胶质细胞活化和神经炎症,多巴胺产生增多,进而达到了神经保护作用。 然而miRNA 在IS 中的神经保护机制了解甚少,有研究认为[3,13-15],miRNA 对缺血性脑卒中的神经保护作用与抑制炎症、减少凋亡、促进血管新生、抑制氧化应激、增强神经可塑性和神经发生等机制有关。
2.1 miRNA 抑制炎症反应
炎症反应是IS 神经元死亡的主要原因之一[16],炎症反应在脑缺血再灌注损伤(ischemia/reperfution,I/R)后几分钟内开始,它的发生机制包括脑驻留细胞的激活和外周白细胞通过BBB 浸润到脑实质中,活化的小胶质细胞和星形胶质细胞与浸润的外周免疫细胞一起释放活性氧(reactive oxygen species,ROS)、促炎细胞因子和其他神经毒性物质,从而导致神经元死亡[17]。 Wang 等[18]实验证实,miR-34-73b 拮抗剂可以显著减弱大鼠脑组织缺血中促炎因子(iNOS、COX-2、TNF-α 和IL-6)和细胞因子信号传导抑制因子3(suppressors Of Cytokine Signaling 3,SOCS3)的表达,来保护神经元细胞,并且在体外实验中取得相同结果。 郭泉等[19]发现,miR-221 在脑缺血再灌注大鼠模型中,下调miR-221的表达后可以明显抑制炎症反应,从而达到神经保护的作用。 保护BBB 的完整性减弱其渗透性也是抑制炎症反应的重要途径之一。 Bernstein 等[20]研究表明,miR-98 减少了促炎因子Ly6C 的浸润,并降低了受影响区域内活化的M1 小胶质细胞的数量,进而减弱BBB 渗透性从而达到神经保护的作用。而来自外周白细胞的miR-29b 则可以通过肿瘤坏死因子(C1q tumor necrosis factor,C1QTNF)来增强BBB 完整性,从而减弱炎症反应[21]。 也有其他研究证实,来源于间充质干细胞(mesenchymal stem cells,MSC)的外泌体miRNA 对炎症反应具有抑制作用。例如Zhao 等[22]发现来自MSC 的外泌体miR-223-3p 抑制了M1 小胶质细胞极化引起的促炎反应,减轻了脑缺血再灌注损伤,从而改善了神经功能障碍,促进了学习和记忆能力。 来源于MSC 的外泌体miR-542-3p 通过抑制 Toll 样受体( toll-like receptor 4,TLR4)来抑制脑缺血后导致的神经胶质细胞炎症反应[23]。 此外,外泌体衍生的miR-146a-5p 通过抑制IRAK1/TRAF6 信号通路,降低NF-κB活化和M1 极化,最终减少脑缺血再灌注诱导的组织水肿、细胞死亡、缺血性梗死和功能性运动缺陷[24]。 大量证据强调了miRNA 在缺血性脑卒中炎症反应中的调节作用,并表明miRNA 在IS 的神经保护中的潜在作用。
2.2 miRNA 抑制细胞凋亡
IS 后会出现大量的细胞凋亡。 小胶质细胞在调节细胞凋亡和神经保护起着关键的作用,活化的小胶质细胞产生的外泌体,称为M2 表型小胶质细胞外泌体(bv2-exosome,BV2-Exo)。 有研究证明,BV2-Exo 衍生的miRNA 在体内外会被神经元吸收,从而减弱氧葡萄糖剥夺(oxygen glucose deprivation,OGD) 后的神经元凋亡[25-27]。 Zhang 等[25]发现Notch1 是miR-137 的直接靶标,miR-137 在BV2-Exo表达升高,miR-137 通过靶向Notch1 信号通路保护神经元免受OGD 引起的神经元凋亡。 Song 等[26]发现泛素特异性蛋白酶14(ubiquitin-specicprotease14,USP14)是miR-124 的直接下游靶标,BV2-Exo 可以通过miR-124 及其下游靶标USP14 减轻缺血性脑损伤和凋亡并促进神经元存活。 其他研究表明,miRNA 还可以通过抑制靶基因或信号通路来发挥抗凋亡作用。 FOXO1 被发现是miR-27a-3p 在HT22细胞中的直接靶基因,miR-27a-3p 拮抗剂可以显著减轻了I/R 大鼠模型的体内症状,而miR-27a-3p 可能是通过靶向FOXO1 抑制I/R 损伤[27]。 此外,来自MSC 的外泌体miR-26a-5p 是通过抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK6)来减少小胶质细胞凋亡,从而减轻小鼠的脑缺血再灌注损伤[28]。 源自内皮祖细胞的miR-126 也被证明可以抑制细胞凋亡,miR-126 水平与梗死体积和细胞凋亡呈负相关,与微血管密度呈正相关,上调miR-126 水平对缺氧诱导的神经元凋亡和轴突生长具有保护作用[29]。 而miR-29b-3p 的抗凋亡作用是通过调节PTEN/Akt 信号通路来减轻缺氧缺血性脑损伤的作用[30]。 值得一提的是,MSC 衍生的外泌体miR-145 可以显著抑制氧糖剥夺再灌注(oxygenglucose deprivation/reoxygenation,OGD/R)后小胶质细胞的凋亡,细胞周期停滞和氧化应激反应,这些是通过miR-145 从MSC 转移到小胶质细胞中,然后小胶质细胞极化转变为抗炎M2 表型来完成的[31]。
2.3 miRNA 抑制氧化应激反应
氧化应激反应与I/R 损伤的病理进展密切相关,它是由于ROS 的过量产生或降解不足引起的,在生理条件下,ROS 的产生和清除二者之间会保持平衡,I/R 后这种平衡就会被打破,会表现为ROS产量增加、抗氧化剂消耗增加,最后诱导蛋白质、脂质、DNA 和RNA 的氧化损伤。 因此,在脑缺血后,miRNA 可以通过内源性促氧化酶和抗氧化酶调控ROS 生成来减少这些有害作用[32]。 Chu 等[33]证实,Nrf2 是调节内源性抗氧化剂的重要转录因子,而miR-144 是I/R 损伤中Nrf2 的上游调节因子,抑制miR-144 活性可以在翻译后促进Nrf2/ARE 途径的抗氧化应激防御,从而缓解了I/R 后的氧化应激反应,促进神经元细胞的修复。 另外,在OGD 模型中,miR-31 的过表达和多囊肾病1 型致病基因(polystic kidney disease 1,PKD1)的沉默减轻了氧化应激诱导的神经元损伤,降低了ROS 水平,同时神经元活力升高。 所以说,miR-31 是通过下调PKD1和JAK/STAT3 途径来减轻IS 小鼠的炎症反应以及氧化应激诱导的神经元损伤[34]。 Shi 等[35]证实,肌细胞增强因子2D(myocyte enhancer factor 2D,MEF2D) 是miR-217 的直接靶标,miR-217 通过MEF2D 抑 制 NADH 脱 氢 酶 亚 基 6 ( NADH dehydrogenase subunit 6,ND6)的表达。 MEF2D 的过表达可以减少OGD 后神经元氧化应激反应和ROS的生成,减轻神经元损伤。 非编码RNA OIP5-AS1与缺血性脑卒中密切相关,上调lncRNA OIP5-AS1可以使miR-186-5p 激活TNF 相关蛋白3(tumor necrosis factor-related protein 3,CTRP3),保护神经元免受I/R 诱导的炎症和氧化应激反应[36]。 而且lncRNA OIP5-AS1 还可以通过调控miR-155-5p/IRF2BP2 轴来抑制氧化应激和炎症反应,减轻HMC3 和SH-SY5Y 细胞OGD/R 诱导引起的细胞损伤[37]。 综上所述,miRNA 可以有效抑制氧化应激反应并为缺血性脑卒中的神经保护提供新的靶向基因。
2.4 miRNA 促进血管新生
血管新生是目前公认的治疗IS 的一个潜在靶点,它有助于在IS 后脑组织的神经功能的恢复。 血管新生是通过刺激血管的生长来实现的,血管的生成可使脑灌注趋于稳定,继而促进神经元的生存,提高大脑可塑性及恢复神经功能[38]。 血管内皮生长因子( vascular endothelial cell growth factor,VEGF)是调控血管生成的关键分子之一。 miRNA在VEGF 及相关信号通路中发挥着直接或间接调控血管生成的作用。 Sun 等[39]认为miR-15a/16-1 簇的内皮靶向缺失会减轻卒中后脑梗死和萎缩,并改善缺血性卒中后长期感觉运动和认知障碍。 它通过上调VEGF,纤维细胞生长因子2(fibroblast growth factor receptor 2,FGFR2)及受体VEGFR2 和FGFR1的蛋白表达促进血管重塑和血管生成来增加同侧脑的血流量,有利于IS 后的神经恢复。 而miR-107模拟物是通过增强内皮VEGF165/164 的水平促进血管生成来减少缺血性脑梗死并增加半影区域的毛细血管数量。 Fan 等[40]研究证实,抑制miR-377的表达可以促进脑微血管内皮细胞(brain microvascular endothelial cells,BMEC)的毛细管样管形成和细胞增殖迁移,OGD 后miR-377 调节了早期生长应答因子2(early growth response protein 2,EGR2)的抗炎作用和VEGF 的血管生成作用,所以抑制miR-377 可减少MCAO 大鼠脑梗死体积并抑制炎症促进血管生成,从而达到神经保护的作用。除此之外,还有其他研究证明miRNA 有益于神经保护,例如miR-27b 转染增加了大脑中动脉闭塞后半影区的血管生成,从而促进了缺血后的恢复并改善了神经行为表现[41]。 另有研究发现抑制miR-155的过表达后,可以明显缓解大鼠脑组织的病理损伤,升高网络微血管密度(microvessel density,MVD)和VEGF 表达水平,并通过PI3K/AKT 信号通路降低炎症反应,促进血管新生,从而发挥神经元保护作用[42]。 总之,越来越多的研究致力于证实miRNA可以通过促进血管新生来发挥神经元保护作用。
2.5 miRNA 增强神经可塑性和神经发生
miRNA 与其他调控因子共同调控神经可塑性和神经发生的不同过程,并对神经发育有着至关重要的作用[43]。 而且它还可以通过促进神经发生、神经突重塑和存活发挥神经保护作用[44]。 例如来自MSC 的外泌体miRNA 在增强神经可塑性和神经发生有着关键的作用。 在体外,用来自MSC 的miR-133b 处理后的OGD 星形胶质细胞可显著促进胚胎皮质神经元的神经突分支和延长,提高了神经可塑性和功能恢复[45]。 在体内,用miR-133b 治疗缺血性脑卒中可显著改善缺血半暗带的功能和神经突重塑性[46]。 另外,在大脑中动脉闭塞的大鼠和小鼠模型中,MSC 外泌体miR-17-92 和miR-133b 以及内皮细胞外泌体miR-126 对神经元可塑性和神经恢复都有促进作用[47]。 此外,给予富含miR-17-92 簇的外泌体也可增强卒中后的神经发生和少突胶质发生,这表明miR-17-92 簇参与卒中后的神经可塑性和脑恢复[48]。 除此之外,miR-138 可以延长少突胶质细胞终末分化为髓鞘轴突的能力,它是通过调节NF-κB 活性来调节轴突再生,神经元发育和轴突存活[49]。 诸葛陆杰等[50]研究证明,补阳还五汤可上调miR-199a-5p 的水平,并在脑缺血后14 h 后增加VEGF 和脑源性神经营养因子(brain derived neurotrophic factor, BDNF) 的蛋白表达,来促进大鼠血管新生和神经发生。 (见表1)
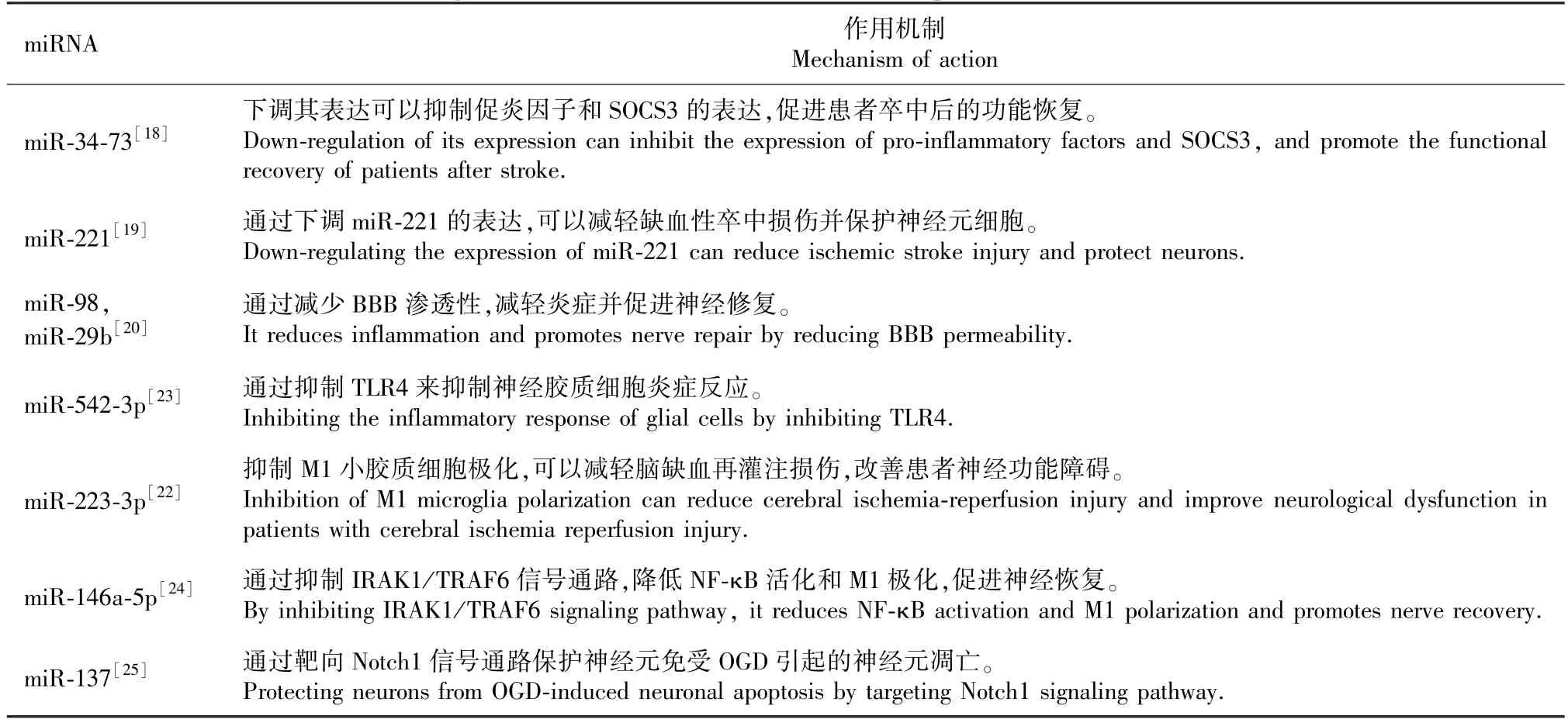
表1 miRNA 在缺血性脑卒中神经保护领域的意义Table 1 Significance of miRNA in the field of neuroprotection in ischemic stroke
3 miRNA 在IS 临床诊断及治疗作用
3.1 miRNA 可作为IS 生物标志物和临床诊断指标
miRNA 在血液中非常稳定,可以成为潜在的临床诊断和生物标志物[51]。 有研究表明,miRNA 可作为不同时期卒中患者的生物标志物,在卒中患者中,血浆细胞外的miRNA 和来自血细胞内的miRNA 两者水平存在差异,在IS 的亚急性和慢性期,血浆中miR-21,miR-221 和miR-145 增加,而miR-210 减少。 在急性卒中中,miR-143-3p、miR-125a-5p、miR-125b-5p 均增加[10]。 众所周知,引起IS 的发生发展有诸多危险因素,如高血压、糖尿病、动脉粥样硬化、年龄、性别和种族等。 所以,与这些危险因素的发病机制相关的几种miRNA,包括miR-155(高血压)、miR-33(高脂血症)、miR-144 和miR-223(糖尿病)以及miR-21、miR-126 和miR-320b(动脉粥样硬化)都已被提议作为IS 的潜在预测标志物[52]。 miRNA 还可作为缺血性脑卒中后运动和认知恢复的预测生物标志物和诊断指标。 有研究表明,我们可以通过调控miRNA 的表达为运动和认知恢复提供了预测信息[53]。 例如Burlacu 等[54]研究表明miR-132、miR-140-5p、miR-22 和miR-221-3p 在IS 后认知障碍患者中上调,miR-424、miR-100-5p 在预后不良的运动障碍患者中下调。 此外,袁芳等[55]证明,miR-233 与外周血TNF-α、IL-10 水平之间呈正相关,它参与了IS 的整个炎症过程,miR-233 相对表达量增高提示神经损伤严重,miR-233 可能会成为IS 临床诊断及疾病严重程度预测指标。
3.2 miRNA 与IS 治疗
目前IS 的急性期和慢性期的治疗策略都很有限,我们还需要探求更多的治疗方法。 近几年发现,特异性miRNA 表达的改变有助于缺血性脑卒中的病理生理机制,脑卒中后神经系统难以自我修复,而miRNA 可以促进神经修复,进而有利于IS 后患者预后发展,这说明它有望成为一种潜在的治疗方法。 来自小胶质细胞的miR-137 的过表达减少了缺血小鼠的梗死体积和行为缺陷[26]。 来自M2 小胶质细胞的miR-124 通过抑制信号转导器和转录激活因子(signal transducerand activatorof transcription 3,STAT3)的表达,减少了神经胶质细胞瘢痕的形成,促进了IS 的恢复,并缓解了星形胶质细胞的迁移和增殖[56],来源于脑内皮细胞的外泌体miR-126-3p 改变了脑可塑性,促进神经突生长[57]。 而miR-126 的过表达调节了脑损伤后内皮祖细胞(endothelial progenitor cell,EPC)的数量以及增殖、迁移和管形成能力,减少了脑缺血再灌注损伤[58]。这些都可以证明miRNA 可以通过各种机制和途径来改善神经损伤,促进神经修复,减少I/R 的损伤,这说明miRNA 有望成为IS 的治疗方法。
4 展望与总结
近几年的研究表明,miRNA 作为基因调控因子,可以靶向和调控细胞多个网络中的数百种蛋白质。 miRNA 的正常表达对大脑的正常发育和功能至关重要,而脑细胞或神经血管系统中miRNA 的失调会增加IS 和其他神经系统疾病的易感性。 脑缺血后,数百种miRNA 的表达在急性和慢性时间点发生显著改变,这些变化已被证明在IS 的临床诊断和生物标志物中有着预测的作用。 然而,miRNA 在参与缺血性脑卒中的诊断和治疗上仍有很多局限性。尽管miRNA 模拟物和抑制物的神经保护作用已经在体内和体外实验中得到验证,但如何使其应用于临床诊断及如何修饰miRNA 使其在缺血性脑卒中患者神经恢复治疗中发挥作用,目前尚不明确。 其次,miRNA 可在各种组织中进行表达,一种miRNA可调控多种基因,一种基因也可被多种miRNA 调控,良好准确的靶向性和安全性应该是未来研究的重点。 未来可针对不同miRNA 及其靶向不同信号通路在缺血性脑卒中的神经保护作用,建立信号通路网络,并通过基因组学、转录组学、蛋白组学、代谢组学等综合组学技术,去探索miRNA 参与神经保护作用的基因、蛋白质、代谢物和信号通路,从而为IS 提供更多的治疗选择和治疗新思路。 综上所述,miRNA 在调节缺血性脑卒中的神经保护方面发挥了重要作用。 并且miRNA 有着重要的生物学功能,与缺血性脑卒中预后进展紧密相关,miRNA 有望成为缺血性脑卒中的生物标志物和治疗靶点。

