基于UPLC-MS技术分析沙棘果肉成熟过程中生物活性成分差异
丁 健,阮成江,*,杨 红,关 莹,李 贺,陈 叶,唐 克,吴立仁
(1.大连民族大学资源植物研究所,辽宁 大连 116600;2.西藏农牧学院资源与环境学院,西藏 林芝 860000;3.黑龙江省农业科学院,黑龙江 哈尔滨 150059)
沙棘(HippophaeL.)属胡颓子科沙棘属植物,是水土保持和生态建设的重要经济树种[1]。沙棘果实、叶和茎中富含多种对人体有益、具较高营养和药用价值的生物活性成分,在食品、日化和医药等行业被广泛应用,其中,沙棘果汁酸甜可口,是市场认可度较高的产品之一[2-3]。发育期间的沙棘果肉从绿色经黄绿色,逐渐转变为黄色、橙黄色或橘红色,黄酮类化合物、VC、类胡萝卜素、5-羟色胺、γ-氨基丁酸、脂肪酸、多糖和有机酸等代谢物含量发生显著变化[4-5]。近年来,关于沙棘果汁、果油具有抗癌功能的报道越来越多,这与沙棘果肉中生物活性成分的高积累密切相关[6-7]。
沙棘是雌雄异株,有6 个种13 个亚种,蒙古沙棘(H.mongolia)和中国沙棘(H.sinensis)是中国北方分布最广泛的2 个亚种[8],不同沙棘种质果实之间的生物活性成分及含量均存在明显差异[1]。甘油三酯(triacylglycerol,TAG)是沙棘油脂的主要成分,其含量直接决定果肉含油率(约5.5%~24.3%)[9],而其结构则决定于脂肪酸组分[10]。沙棘是罕有的在非种子组织(果肉)中高积累棕榈油酸(C16:1)的植物[11],它具有抗溃疡、抗氧化、抗癌、降压和抑菌作用[12-13]。研究发现,C16:1含量与delta-9去饱和酶(delta-9 desaturase,Δ9D)基因的高表达及其与TAGsn-2位的亲和性密切相关[10,12]。除此之外,黄酮类化合物是沙棘果实中重要的次生代谢产物[14]。沙棘黄酮主要包括芦丁、槲皮素、异鼠李素、儿茶素、山柰酚和柚皮素等,果肉总黄酮含量约为102 μg/g[15]。沙棘黄酮具有抗氧化、抗炎、抗肿瘤和降血压等作用[16-17]。近年来,已有较多研究对沙棘油脂、脂肪酸、黄酮、5-羟色胺、维生素等生物活性成分和提取纯化工艺进行探究,但有关沙棘果肉(非种子组织)成熟期间主要生物活性成分的合成代谢机理仍不清楚。
为解析沙棘油脂、黄酮等生物活性成分的合成代谢规律,以2 个沙棘品系发育期间(绿色和橙色时期)的果肉为研究对象,采用超高效液相色谱-质谱(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS)技术对沙棘果肉生物活性成分进行全面解析,从非靶向代谢组学角度阐明沙棘果肉发育期间的差异代谢轮廓,筛选与沙棘果肉生物活性成分合成相关的关键代谢物,为揭示木本沙棘果肉中抗癌生物活性成分合成积累机理提供科学依据。
1 材料与方法
1.1 材料与试剂
以沙棘品系‘Za56’和‘TF2-36’的果实为实验材料,各品系选择6 株6 年龄植株为生物学重复,种植环境和田间管理方式相同。‘Za56’为中国沙棘亚种(♂)和蒙古沙棘亚种(♀)的杂交种,‘TF2-36’为蒙古沙棘亚种的实生子代。分别在2017年7月7日和8月10日,采摘两个品系的绿色(G)和橙色(O)果实,并命名为56G、56O、36G和36O,立即置于冻存管内用液氮速冻,运抵实验室后在-80 ℃保存备用。
乙醇、乙腈(均为色谱纯)美国Merck公司;乙酸铵(纯度≥98%)美国Sigma-Aldrich公司;所有分离用化学试剂均为国产分析纯。
1.2 仪器与设备
1290 Infinity LC超高压液相色谱仪 美国Agilent公司;Triple TOF 5600质谱仪(配电喷雾离子源(electron spray ionization,ESI))美国AB SCIEX公司。
1.3 方法
1.3.1 样品预处理
用液氮研磨去除种子后的沙棘果肉样品,果肉粉末经冷冻干燥后[18],称取20 mg,加入200 μL超纯水匀浆,再加入800 μL甲醇-乙腈(1∶1,V/V),旋涡混匀后于低温下超声破碎30 min,-20 ℃孵育1 h后再离心15 min(13 000 r/min,4 ℃),取上清液过0.22 μm微孔滤膜后,用于UPLC-MS分析。
1.3.2 色谱条件
色谱柱:Waters ACQUIT Y UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温:25 ℃;流动相:A为含25 mmol/L乙酸铵和25 mmol/L氨水的溶液,B为乙腈;梯度洗脱程序:0~1 min,5% A、95% B;1~14 min,5%~35% A、95%~65% B;14~16 min,35%~60% A、65%~40% B;16~18 min,60% A、40% B;18~18.1 min,60%~5% A、40%~95% B;18.1~23 min,5% A、95% B;流速:0.3 mL/min;进样量:2 μL。分析时样品一直置于4 ℃自动进样器中。
1.3.3 质谱条件
分别采用ESI正离子和负离子模式进行检测。离子源温度600 ℃;气帘气压力30 psi;质谱电压5 500 V(正负两种模式);质谱扫描范围60~1 000 Da;子离子扫描范围25~1 000 Da;去簇电压60 V(正负两种模式);碰撞能量(35±15)eV。
1.4 数据处理与分析
采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。代谢物鉴定采用精确质量数匹配和二级谱图匹配的方式,检索自建数据库。对XCMS提取得到的数据,删除组内缺失值>50%的离子峰。应用软件SIMCA-P 14.1(Umetrics,瑞典)进行模式识别,数据经Pareto-scaling预处理后,进行多维统计分析,包括无监督主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squaresdiscriminant analysis,OPLS-DA)。依据不同品系发育期样品组间变量投影重要度(variable importance in the projection,VIP)>1、t检验的P<0.05筛选组间的显著差异代谢物[19-20],利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)(http://www.genome.jp/kegg/pathway.html)数据库对显著差异代谢物的代谢通路进行分析。聚类热图和箱线图使用生信云平台分析(http://cloud.aptbiotech.com/#/ main-page)。
2 结果与分析
2.1 不同沙棘果肉样品的PCA
基于XCMS,在沙棘品系‘Za56’和‘TF2-36’发育期间的果肉样品(56G、56O、36G和36O)中共检测到3 385 个(ESI正离子模式)和2 837 个(ESI负离子模式)代谢特征离子信号。利用SIMCA软件构建无监督PCA模型,4 组样品的数据点在PCA得分图上区分明显(图1),在两两比较PCA得分图中也显著区分(图2),所有样本均落在95%置信区间内,说明代谢组组间的分析数据可信度较高[21]。

图1 沙棘品系‘Za56’和‘TF2-36’绿色(G)和橙色(O)果肉样品的PCA得分图Fig.1 PCA score plots of green (G) and orange (O) pulp samples from sea buckthorn strains ‘Za56’ and ‘TF2-36’

图2 4 组样品在正离子模式(A~D)和负离子模式(E~H)下的PCA得分图Fig.2 PCA score plots of the four pulp groups in positive(A,B,C and D) and negative ion modes (E,F,G and H)
2.2 不同沙棘果肉样品的OPLS-DA
为获得4 组样品间的差异信息,建立有监督OPLSDA模型。沙棘品系‘Za56’和‘TF2-36’的绿色和橙色果实样品点分布在不同区域并且明显分为不同簇(图3),表明4 组样品在代谢物种类、含量上存在差异。经7 次循环交互验证发现R2Y、Q2>0.9(越接近1表明模型越稳定可靠)(表1);然后,经200 次循环迭代置换验证发现(负值表明未发生过拟合),因此,建立的OPLS-DA模型稳定可靠,具有较高的预测能力[22]。
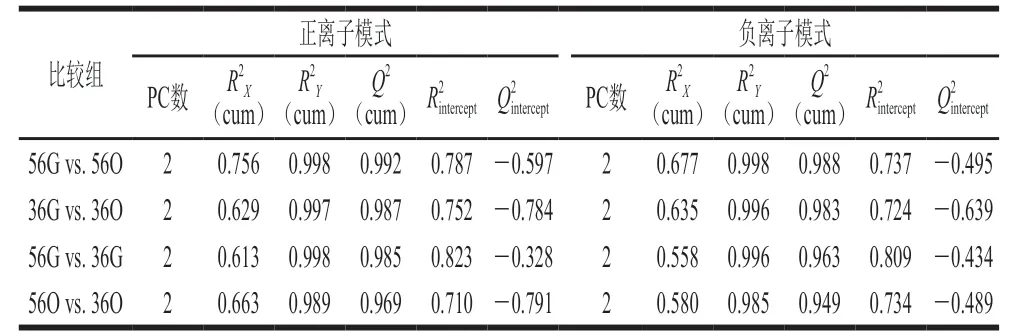
表1 OPLS-DA模型的评价参数Table 1 Evaluation parameters of OPLS-DA models

图3 4 组样品的正离子模式(A~D)和负离子模式(E~H)OPLS-DA得分图Fig.3 OPLS-DA score plots of the four groups in positive(A,B,C and D) and negative ion (E,F,G and H) modes
2.3 差异代谢物的筛选与识别
根据OPLS-DA获得的VIP>1和t检验的P<0.05筛选组间的显著差异代谢物。在56G vs.56O、36G vs.36O、56G vs.36G和56O vs.36O比较组中,分别有72、70、83 个和64 个显著差异代谢物(包括正、负离子模式),在各比较组中,呈下调趋势的差异代谢物较多(图4)。由于同一代谢物可在不同组间均表现差异显著性,因此,共筛选到124 个显著差异代谢物,其中正离子模式下有73 个,负离子模式下有51 个。基于实验室自建数据库和HMDB数据库,识别到上述差异代谢物主要包括有机酸、碳水化合物、脂类、黄酮类、次生代谢物等(图5),其中,脂类和黄酮是被称为“软黄金”沙棘油中最有价值的生物活性成分,在代谢组层面解析了沙棘果肉生物活性成分的代谢特征,为进一步开展转录组、蛋白质组关联分析沙棘关键成分的合成机制提供科学依据[2,4,23]。

图5 沙棘品系‘Za56’和‘TF2-36’绿色和橙色果实样品的显著差异代谢物热图Fig.5 Heatmap of significantly differential metabolites in green and orange berry pulps from ‘Za56’ and ‘TF2-36’ sea buckthorn
2.4 与脂类合成代谢相关的显著差异代谢物分析
基于4 组果实样品(56G、56O、36G和36O)间的124 个显著差异代谢物数据,进一步利用HMDB数据库和KEGG代谢通路功能分析,共识别到15 个显著差异代谢物参与脂类、脂肪酸合成积累(表2),它们在4 组样品中呈现出不同的含量差异(离子峰的相对丰度),根据箱形图可直观反映各差异代谢物在4 组样品中的丰度变化(图6)。在‘Za56’和‘TF2-36’果肉发育过程中,分别识别到8 个和7 个显著差异代谢物,棕榈油酸、PC(16:0/16:0)、甘油磷酰胆碱、二羟基丙酮、植物鞘氨醇、二氢鞘氨醇和油酸呈上调趋势,尤其,PC(16:0/16:0)、二羟基丙酮和植物鞘氨醇在两个品系中均显著上调(表2);另外,在两个品系的绿果和橙果时期分别发现9 个和10 个显著差异代谢物,PC(16:0/16:0)、甘油磷酰胆碱和二氢鞘氨醇呈上调趋势(图6),但只有甘油磷酰胆碱在两个比较组中均上调(表2)。

表2 沙棘果肉脂类、黄酮和5-羟色胺等合成代谢相关的显著差异代谢物Table 2 Significantly differential metabolites associated with the synthesis and metabolism of lipids,flavonoids and serotonin in sea buckthorn berry pulp





图6 56G、56O、36G和36O果肉的显著差异代谢物比较Fig.6 Comparison of significantly differential metabolites between the four groups
Omega-7脂肪酸通常在深海鱼类(如凤尾鱼、鲨鱼等)和少数植物种子(如澳洲坚果、猫爪草等)中积累,沙棘是自然界中罕有的在果肉(非种子组织)中高积累棕榈油酸(omega-7脂肪酸)的植物[12]。沙棘果肉棕榈油酸在‘Za56’发育期间显著上调,且在56O中显著高于36O(表2),这与‘Za56’果肉发育期间的C16:1含量显著上升,且‘Za56’发育期间的果肉含量(13.3%~41.30%)显著高于‘TF2-36’(12.57%~39.03%)的规律一致[24]。有研究认为沙棘果油中的生物活性成分多于沙棘籽油,尤其,特有的C16:1可降低人体胆固醇、防止心律失常和抑制肿瘤[25]。Yang Baoru等[26]发现沙棘C16:1等脂肪酸和脂类含量高低与其(亚)种、海拔、采摘时期等有关,而且C16:1含量及以其为主的单不饱和脂肪酸含量占总脂肪酸的比例是评价沙棘果油真伪及品质的关键指标[27]。
脂肪酸通常以酯的形式参与各种脂质的组成,TAG是植物油的主要成分,其含量与含油率高低密切相关[28]。脂肪酸的高积累则与其在TAG合成过程中被二酰甘油转移酶(diacylglycerol acyltransferasea,DGAT)和磷脂∶二酰甘油酰基转移酶(phospholipid∶diacylglycerol acyltransferase,PDAT)催化结合至TAG有关[29]。内质网上的3-磷酸甘油连续组装来自于细胞质的acyl-CoA脂肪酸形成DAG后,在DGAT催化下合成TAG,这被称为依赖acyl-CoA的Kennedy途径[30];此外,近年来在酵母、蓖麻和拟南芥TAG合成过程中发现的acyl-CoA独立途径也逐渐被重视[31],即利用磷脂(而非acyl-CoA)作为酰基供体,DAG为受体,在PDAT催化下,将磷脂酰胆碱(phosphatidylcholine,PC)sn-2位的酰基转移到DAG上,合成TAG[29,31]。研究发现,PC的合成代谢途径更复杂,在溶血磷脂酰基转移酶(lysophospholipid acyltransferase,LPCAT)的作用下,溶血磷脂酰胆碱(lysophosphatidylcholine,lysoPC)和游离acyl-CoA反应生成PC[32];而且有胆碱存在时,DAG又会被二酰基甘油胆碱磷酸转移酶催化形成PC[33]。在‘Za56’和‘TF2-36’果实成熟过程中,橙色果实样品(56O和36O)的PC(16:0/16:0)显著高于绿色果实(56G和36G),而且在36G中显著高于56G(表2),表明成熟沙棘果肉的PC(16:0/16:0)相对含量较高,这与‘Za56’和‘TF2-36’果肉发育期间C16:0含量(分别升高1.5 倍和1.4 倍)和含油率(分别升高1.7 和3.7 倍)逐渐增加的规律相符[24],因此,PC(16:0/16:0)可能是影响沙棘果肉C16:0含量和含油率的代谢标志物。另外,LysoPC(16:0)和LysoPC(18:1(9Z))的相对含量下调(表2),这可能与LPCAT优先以LysoPC(16:0)和LysoPC(18:1(9Z))为底物而反应生成PC有关[33],而且,胆碱在各比较组中也呈显著下调趋势,即为DAG向PC转化提供了大量供体[29]。可见LysoPC(16:0)、LysoPC(18:1(9Z))和胆碱的下调都与PC合成积累相关。除此之外,LysoPC还可被溶血磷脂酶I催化生成甘油磷酰胆碱,然后进一步被甘油磷酸二酯酶催化生成胆碱和甘油三磷酸(glycerol 3-phosphate,G3P)[34]。高油品系‘TF2-36’果肉中的甘油磷酰胆碱显著高于低油品系‘Za56’(表2),而且在果肉发育期间呈显著上调趋势(图6),这与PC(16:0/16:0)的变化模式相似,这可能与甘油磷酰胆碱被催化为胆碱和G3P后,分别为PC和TAG合成提供更多前体物质有关。因此,甘油磷酰胆碱也可能是影响沙棘果肉含油率高低的代谢标志物。
2.5 与黄酮合成代谢相关的显著差异代谢物分析
沙棘油之所以被誉为“软黄金”,还在于其富含多种黄酮类物质。根据HMDB数据库和KEGG代谢通路分析,在4 组果实样品(56G、56O、36G和36O)的代谢组比较中,共识别到7 个与黄酮合成相关的显著差异代谢物(表2),分别为异鼠李素、水仙碱/异鼠李素-3-O-芸香糖苷、山柰酚-3-O芸香糖苷、儿茶素、柚皮素、芦丁和原花青素B2,其中,只有异鼠李素在发育期间呈上调趋势,它们具有抗氧化、抗病毒等生物活性,在防治炎症、癌症和心脑血管疾病等方面作用明显[35-36]。沙棘不同品种、组织器官(果肉、种子、叶片等)和发育时期的黄酮类成分含量差异明显[37-39]。在沙棘果汁中异鼠李素含量最高(25.1~31.1 mg/100 g),其次为槲皮素(7.7~8.1 mg/100 g)和山柰酚(1.2~1.6 mg/100 g)[37];在沙棘全果实(含果肉和种子)中槲皮素(6.7~17.5 mg/100 g)和异鼠李素(4.5~10.6 mg/100 g)含量也较高[38]。在‘Za56’和‘TF2-36’果肉发育期间分别识别到4 个和5 个显著差异代谢物,其中显著上调的仅有异鼠李素(表2),差异倍数(fold change,FC)分别达3.76和2.50,其他显著差异代谢物均不同程度的下调(图6),这与沙棘果汁中异鼠李素含量较高的规律相符[37]。在56G vs.36G和56O vs.36O比较组中分别发现7 个和5 个显著差异代谢物,均显著上调(表2),即它们在‘TF2-36’果肉中的合成量一直高于‘Za56’(图6)。有研究发现沙棘总黄酮含量在果肉发育期间先下降后上升,而异鼠李素含量在沙棘果实发育期间呈显著上升趋势,这可能与儿茶素、山柰酚和芦丁含量显著下降有关[37,40],温秀凤等[41]发现沙棘叶游离总黄酮在7月中下旬急剧下降,其中,槲皮素、山柰酚和芦丁含量也均呈下降趋势。这与‘Za56’和‘TF2-36’果肉中异鼠李素上调和儿茶素下调的变化规律相似。因此,异鼠李素可能是影响沙棘果肉黄酮含量高低的代谢标志物。
2.6 5-羟色胺等生物活性成分分析
5-羟色胺是一种单胺类神经递质,具有广泛的生物学活性,参与调节神经活动、胃肠道功能、止凝血过程与机体免疫等多种生理过程[42]。有研究发现,沙棘茎和叶中富含5-羟色胺(分别为840~4 410 μg/g和12.5~213.8 μg/g),且其提取物具有抗癌、抗菌和清除自由基活性[43-44]。利用UPLC-MS技术在沙棘果肉中发现了5-羟色胺及其上下游代谢物,其中5-羟色胺及其前体色胺在各比较组中均呈下调趋势,而其代谢产物N-乙酰羟色氨在各比较组中均显著上调(表2),可见,二者之间的关键酶芳香基胺N-乙酰转移酶活性对5-羟色胺的合成积累具有重要影响[45],这可为解析沙棘5-羟色胺合成代谢机理提供科学依据,也为利用基因工程技术提高5-羟色胺含量提供了关键靶点。
许多研究表明,沙棘果实、叶片和茎提取物具有抗氧化、抗癌和抗肿瘤活性[46-48]。本实验组在沙棘果肉中首次发现卡培他滨,有研究表明,它通过抑制细胞分裂、干扰RNA和蛋白质合成抑制肿瘤生长,是一种对癌细胞具有高选择性的口服抗癌药物[49]。在‘Za56’和‘TF2-36’果肉变色成熟期间,卡培他滨均显著上调(FC分别为1.32和2.63)(表2)。此外,在沙棘果肉中还发现了γ-氨基丁酸(γ-aminobutyric acid,GABA)、白藜芦醇、甜菜碱、焦儿茶酚、VC和VB6等显著差异代谢物。尤其,‘TF2-36’成熟果肉(36O)中的GABA含量显著高于56O(FC=2.13)(表2),这与沙棘果肉的非靶向1H核磁共振代谢组研究结果相似[5]。GABA是哺乳动物中枢神经系统中一种重要的抑制性神经递质,具有镇定、抗癌、降脂、降压等功能[50]。发现并解析沙棘果肉的生物活性成分合成规律,为利用其为原料研发抗癌、抗抑郁,治疗心血管和精神类疾病等药物提供科学依据。
3 结论
采用UPLC-MS技术对2 个沙棘品系发育期间(绿色和橙色)的果肉进行了非靶向代谢组学研究。分析发现4 组样品间存在较大的代谢差异,并识别到124 个显著差异代谢物,包括有机酸、碳水化合物、脂类、黄酮类和次生代谢物等;根据KEGG代谢通路分析,分别识别到15、7 个和4 个显著差异代谢物与脂类、黄酮和5-羟色胺合成代谢相关,以及其他8 个与抗癌功能相关的显著差异代谢物。PC(16:0/16:0)和甘油磷酰胆碱在各比较组中均显著上调,它们是影响沙棘果肉含油率高低的代谢标志物。异鼠李素在各比较组中均显著上调,与沙棘果肉中富含黄酮密切相关。此外,N-乙酰羟色氨、卡培他滨和GABA等抗癌相关生物活性成分在‘Za56’和‘TF2-36’果肉发育期间也呈现出相对较高的含量。本研究采用非靶向代谢组学方法较为系统地阐明了不同沙棘品系果肉发育期间的代谢组差异,将为解析沙棘生物活性成分合成代谢机制以及相关功能产品开发提供科学依据。

