重组人凝血因子Ⅶ的表达、激活与功能鉴定
李倩卉,刘旭,王志军,路中枢,高雪寒,薛成峰,张子义,李齐
(庄亚(北京)生物科技有限公司,北京 100176)
活化的重组人凝血因子Ⅶ(Activated Recombinant Human Coagulation Factor Ⅶ,rhF Ⅶa)由于良好的安全性被广泛应用于出血性疾病的治疗,其适应症包括含有凝血因子Ⅷ(Coagulation Factor Ⅷ,F Ⅷ)/凝血因子Ⅸ(Coagulation Factor Ⅸ,F Ⅸ)抑制物的A型与B 型血友病(Hemophilia,HA)、获得型血友病、遗传性凝血因子Ⅶ缺乏症及血小板无力症等疾病。rhF Ⅶa 还可以用于治疗外科手术或严重创伤引发的大出血等其他出血性疾病[1]。目前,NovoSeven 与SevenFact 是全球仅有的两个重组产品,NovoSeven 是诺和诺德利用幼年仓鼠肾细胞(Baby Hamster Kidney)表达纯化而得,SevenFact 是法国LFB 公司利用转基因兔乳腺生产制得[2-3]。国产rhF Ⅶa 药品还未见批准上市。随着国内血友病等出血性疾病治疗市场的日益扩大,急需开发国产rhF Ⅶa。
杨剑锋等[4]曾经尝试利用CHO 表达rhF Ⅶ,但只获得了酶原形式的rhF Ⅶ。项目组利用中国仓鼠卵巢(Chinese Hamsterovary Ovary,CHO)细胞表达系统及成熟的蛋白表达工艺成功开发出了活化的重组人凝血因子Ⅶ(产品名称为NeoSeven)。国内目前尚未见国产rhF Ⅶa 与诺和诺德rhF Ⅶa 的对比报道。基于此,本文阐述了利用CHO-K1 宿主细胞表达/纯化rhF Ⅶ的方法,比较了NovoSeven 与NeoSeven 的生化及生物学活性,检测内容与方法包括SDS-PAGE、Western Blot、与组织因子结合的亲和力鉴定、对发色底物S-2288 的酶切活性、活化部分凝血活酶时间(Activated Partial Thromboplastin Time,APTT)/ 凝血酶原时间(Prothrombin Time,PT)及血栓弹力仪(Thrombelastography,TEG)等。
1 材料与方法
1.1 材料与仪器
UD-T5000 型血栓弹力图仪,深圳优迪生物技术有限公司;58230 型凝血仪,法国Stago 公司;10%SDS-PAGE 胶,实验室自制。
sTF-his/sTF-Fc,实验室构建表达;Novoseven,丹麦诺和诺德公司;Neoseven,实验室表达/激活;CHO-K1,欧洲认证细胞培养物收藏中心(ECACC);山羊抗凝血因子Ⅶ多克隆抗体、山羊抗凝血因子Ⅷ多抗,加拿大Haematologic Technologies 公司;Actipro 培养基、CD CHO AGT™培养基,美国Cytiva 公司;HT/GS,美国Thermo Fisher 公司;蛋氨酸磺酸盐(MSX),美国Sigma 公司;Cell boost 7a/Cell boost 7b:,美国Cytiva 公司;维生素K1,北京索莱宝科技有限公司;Hind Ⅲ-HF,EcoR Ⅰ-HF、 PVU Ⅰ-HF,美国NEB公司;S-2288,北京阿斯雷尔有限公司;APTT 试剂(STA-PTT Automate 5)、乏凝血因子Ⅶ血浆、STANeoplastine Cl Plus5 Prothrombin Time(PT)、通用定标血浆,法国Stago 公司。
1.2 实验方法
1.2.1 重组人凝血因子Ⅶ表达载体构建
含有406 个氨基酸的完整rhF Ⅶ读码框(ORF)基因序列[5],包括信号肽,由通用生物根据CHO 表达系统优化合成。该DNA 片段经PCR 加入Hind Ⅲ/EcoR Ⅰ酶切位点,插入经Hind Ⅲ/EcoR Ⅰ双酶切的HX1(自有表达GS 载体)中。经转化至DH5α 感受态细胞,然后挑取单菌落进行培养。细菌扩增后,抽提质粒DNA 进行酶切鉴定。
1.2.2 蛋白表达与纯化
将酶切鉴定后的rhF Ⅶ表达质粒进行单酶切以制备线性化质粒,然后使用Lonza 电转仪DT-133 程序将表达质粒转入CHO-K1 宿主细胞。转染后细胞置于含维生素K 与MSX 的CHO 培养基中培养加压筛选。最终的rhF Ⅶ高产细胞株通过分批补料式培养(fed-batch)确认,所表达并纯化激活的rhF Ⅶa命名为NeoSeven。NeoSeven 的纯化与激活采用经典的亲和与离子交换层析等蛋白纯化方法[6-9]。
1.2.3 SDS-PAGE 与Western Blot
rhF Ⅶa 由轻重链组成蛋白复合物,在还原的条件下,轻重链断开为20 kDa 与30 kDa 两条单链。为验证纯化后的样品为激活状态,将样品进行还原处理并与非还原样品同时进行SDS-PAGE 与Western Blot鉴定。
SDS-PAGE:将相同质量(1.5 μg)rhFⅦa(Neoseven和Novoseven)与还原剂二硫苏糖醇(DTT)上样缓冲液混合。另取相同质量(1.5 μg)rhF Ⅶa(Neoseven和Novoseven)样品上样缓冲液混合孵育作为对照。混合的样品分别于沸水浴中孵育10 min,高温变性后进行SDS-PAGE 电泳与考马斯亮蓝染色。
Western Blot:将相同质量(1.5 μg)rhF Ⅶa(Neoseven 和Novoseven)与DTT 上样缓冲液混合。另取相同质量(1.5 μg)rhF Ⅶa(Neoseven 和Novoseven)样品上样缓冲液混合孵育作为对照。混合的样品分别于沸水浴中孵育10 min,高温变性后进行SDS-PAGE 电泳,通过半干转仪器将SDS-PAGE中的蛋白转移至硝酸纤维膜上。用5%的脱脂奶粉封闭转移蛋白后的硝酸纤维膜,再用辣根过氧化物酶(HRP)标记的小鼠抗hF Ⅶ轻链的单抗对硝酸纤维膜进行孵育,使用二氨基联苯胺(DAB)显色液进行显色。
1.2.4 rhF Ⅶa 与sTF 结合的亲和力验证
rhF Ⅶa 与组织因子胞外区(soluble Tissue Factor,sTF)的结合亲和力通过生物膜干涉技术(Bio-Layer Interferometry,BLI)进行验证。按照仪器的操作方法[10],将组织因子胞外区-组氨酸融合蛋白(sTF-his)与组织因子胞外区-Fc融合蛋白(sTF-Fc)分别包被在氨基或蛋白A(protein A)探针上。阻断非特异性结合位点后,在含5 mmol/L CaCl2的缓冲液中准备不同浓度的(100 nmol/L、50 nmol/L、25 nmol/L)NovoSeven 与NeoSeven,然后与包被在探针上的sTF-his 或sTF-Fc 进行结合实验。rhF Ⅶa 与sTFhis 或sTF-Fc 的结合速率常数(Association)与解离速率常数(Dissociation)数据的采集时间分别为180 s与200 s。
1.2.5 rhF Ⅶa 活性鉴定
rhF Ⅶa 的活性鉴定通过其与sTF-his 结合后对发色底物S-2288 的酶切速率来验证[11-12]。S-2288是一种丝氨酸蛋白酶光谱发色底物,与F Ⅶa 作用于凝血因子Ⅹ的酶切位点氨基酸相同。rhF Ⅶa 可以酶切S-2288,rhF Ⅶa 在与sTF-his 结合后会提高对S-2288的酶切速率。在含5 mmol/L CaCL2的缓冲液中加入100 nmol/L 的rhF Ⅶa、200 nmol/L 的sTF-his 及1 mmol/L的S-2288,间隔5 min 用酶标仪持续读取405 nm 处的吸收值,直至吸收值达到平台期。
1.2.6 活化部分凝血活酶时间与凝血酶原时间
活化部分凝血活酶时间(APTT)的检测是将rhF Ⅶa 蛋白加入乏F Ⅷ因子血浆来检测其促凝血活性的STart 4 数据。简言之,将反应杯放在孵育孔中,并在每个孔中放入一个磁珠。应用反向移液法将50 μL 乏F Ⅷ因子血浆加入到每个反应杯的底部,静置30 ~45 s 以温热血浆,在每个孔中分别加入5 μL检测样品(NovoSeven 或NeoSeven)。简短孵育后在每个孔中加入50 μL APTT 试剂(试剂盒中自带),37 ℃条件下孵育240 s,最后加入50 μL 的20 mmol/L 的CaCl2启动凝血过程。血浆凝固时间与加入的hF Ⅶa浓度成正比[13]。
凝血酶原时间(PT)的检测是将hF Ⅶa 蛋白加入乏F Ⅶ因子的血浆来检测其促凝血活性。简言之,将反应杯放在孵育孔中,并在每个孔中放入一个磁珠。应用反向移液法将50 μL 乏F Ⅶ因子血浆加入到每个反应杯的底部,静置30 ~45 s 以温热血浆,在每个孔中分别加入5 μL 检测样品(NovoSeven 或NeoSeven)。简短孵育后在每个孔中加入100 μL 含CaCl2的PT 试剂启动凝血过程。血浆凝固时间与加入的hF Ⅶa 浓度成正比[13]。
1.2.7 血栓弹力图
血栓弹力图(Thrombelastography,TEG)能反映全血凝血过程中血小板与凝血因子的相互作用,展现凝血发生、发展的全过程。凝血反应时间(R)常用来检测止血药物的凝血活性。首先从健康人体中采集新鲜血液,将血液收集于抗凝管中。将9 mL 上述血液与终浓度0.1 mg/mL 的绵羊抗F Ⅷ多抗孵育(37 ℃,30 min)以制备A 型血友病样血液(HA)。然后向装有高岭土的试管中加入1 mL 上述抗凝血,颠倒混匀5 次,室温孵育≥1 min。再向血栓弹力仪样品检测杯中依次加入下列反应试剂:20 μL 待测样品(NovoSeven 或NeoSeven)+20 μL CaCl2(0.2 mol/L)+340 μL 血液。检测开始后,记录每份样品的凝血反应时间。
2 结果与分析
2.1 质粒酶切鉴定结果
将提取的质粒用Hind Ⅲ/EcoR Ⅰ进行双酶切鉴定(图1),酶切片段大小为1 413 bp,泳道1 为原始质粒,泳道2 为双酶切后的样品,在1 000 ~2 500 bp的DNA Marker 之间的条带即为目的条带,大小正确。

图1 琼脂糖凝胶电泳酶切鉴定结果图
2.2 细胞筛选结果
使用电击法将NeoSeven 线性化质粒转入CHO-K1 宿主细胞,经过96 孔板、24/48 孔板、6 孔板、T25 最终筛选出5 pools 于E125 摇瓶中进行fedbatch 评估。以1.0×106cells/mL 密度接种,培养基为Actipro+2% GS+1% HT+25μmol/L MSX+1 mg/L VK1,于37 ℃、5% CO2、100 r/min 条件下培养,密度达到9×106cells/mL 或10×106cells/mL 后(达不到则统一培养6 d)降温至31 ℃,降温后流加培养基7a+7b,流加策略为第3 d、5 d、7 d、9 d 分别流加3%、3%、5%、5% 的7a 与0.3%、0.3%、0.5%、0.5% 的7b。补糖策略为葡萄糖含量小于5 g/L 时补至5 g/L。存活率低于90%或11 d 收获上清。图2 为最终筛选得到的5 pools 筛选结果,从中筛选得到pool 细胞6B2,细胞密度可以达到18.5×106cells/mL,且细胞生长可以维持到11 d,产量可达50 mg/mL。

图2 细胞筛选结果图
2.3 纯化与激活样品SDS-PAGE 与Western Blot
使用SDS-PAGE 比较NeoSeven 与NovoSeven 分子量与激活(图3)。泳道1 与2 是非还原的NovoSeven与NeoSeven 样品,泳道3 与4 是还原的NovoSeven 与NeoSeven 样品。泳道1 与2 的样品由于hF Ⅶa 的轻重链之间的二硫键保持完整,因此呈单链状态,分子量一致(50 kDa)。泳道3 与4 的样品的轻重链之间的二硫键被打断,因此表现为一个重链(30 kDa)与一个轻链(20 kDa)。

图3 rhF Ⅶa 的SDS-PAGE 结果
Western Blot 显示(图4)还原与非还原的NeoSeven 与NovoSeven 均可以被HRP 标记的鼠抗hF Ⅶ单抗识别。rhF Ⅶa 的分子量为50 kDa 左右。在还原的状态下,rhF Ⅶa 被解离为30 kDa 与20 kDa两条带。由于实验中的抗体为只识别rhF Ⅶa 轻链的单克隆抗体,因此rhF Ⅶa 在非还原状态下,其Western Blot 结果显示为50 kDa 单条带。rhF Ⅶa 在还原状态下,只显示20 kDa 左右的rhF Ⅶa 轻链。上述分析显示NeoSeven 在蛋白纯度、分子量与激活等方面与NovoSeven 相似。

图4 rhF Ⅶa 的Western Blot 结果
2.4 rhF Ⅶa 与sTF-his 或sTF-Fc 的亲和力检测
BLI 分析显示(表1)NeoSeven 与组织因子胞外区(sTF-his 或sTF-Fc)的亲和力与NovoSeven 相似。诸多文献证实[14-15],组织因子的空间构象直接影响其与F Ⅶ的结合。将sTF-his 直接包被于探针,由于空间构象的不均一性,导致与F Ⅶa 的亲和力降低。然而,将sTF-Fc 包被于Protein A 探针,由于组织因子空间结构的一致性大大提高,从而与F Ⅶ的亲和力显著提高。

表1 组织因子(胞外区)与hF Ⅶa 亲和力
2.5 rhF Ⅶa 活性鉴定
根据NovoSeven、NeoSeven 与sTF 结合后对底物S-2288 的酶切速率分析(图5),在sTF 存在的情况下,NovoSeven 和NeoSeven 对底物S-2288 的酶切速率比无sTF 存在的情况下明显增强。相同浓度的NovoSeven、NeoSeven 对底物的酶切速率相同,耗尽底物S-2288 的时间相同。从NovoSeven、NeoSeven与sTF 结合后对底物S-2288 前10 min 的酶切线性斜率可以看出,NovoSeven 和NeoSeven 对底物S-2288的酶切速率接近一致。经过对比分析,两种rhF Ⅶ a的活性相似。
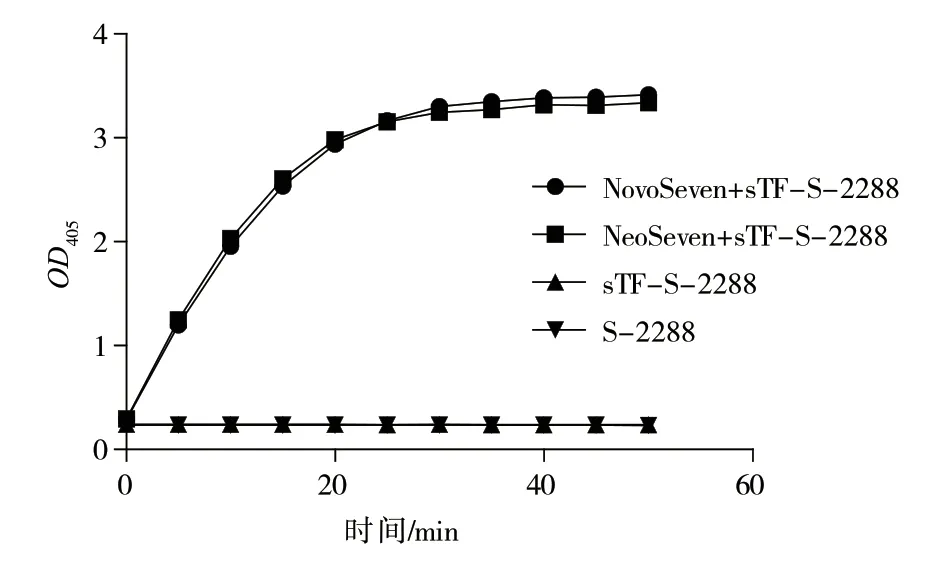
图5 rhF Ⅶa 对底物S-2288 酶切速率结果图
2.6 活化部分凝血活酶时间与凝血酶原时间
用活化部分凝血活酶时间(APTT)与凝血酶原时间(PT)实验检测NeoSeven 与NovoSeven 的凝血活性[13]。不同蛋白量的两种rhF Ⅶa 样品分别加入实验体系中,NovoSeven 与NeoSeven 相对应的APTT凝血活性和PT 凝血活性相似(图6)。

图6 凝血活性检测结果
2.7 血栓弹力图分析
应用血栓弹力仪比较NeoSeven 与NovoSeven 在全血中促凝血活性可以更加全面地对hF Ⅶ因子进行评估[16]。结果显示(图7),由抗F Ⅷ抗体制备的类A 型血友病全血样品(HA)的凝血反应时间为35 min左右。当对同一血样加入100 nmol/L 的NeoSeven(HA/NeoSeven)或NovoSeven(HA/NovoSeven)时,凝血反应时间均为10 min 左右,说明NeoSeven 的凝血活性等同于NovoSeven。对于中国人,凝血反应时间正常范围在4 ~9 min,也就是说,100 nmol/L 的F Ⅶa 基本可使血友病患者的凝血功能恢复至正常水平。
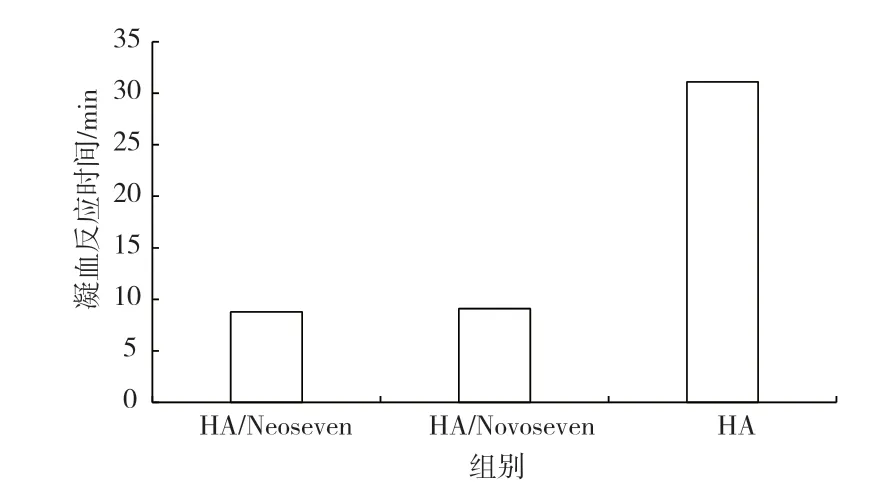
图7 产品在全血中的促凝血活性
3 讨论
本研究阐述的由CHO/GS 系统生产的rhF Ⅶ以及其在生物化学/凝血功能方面与NovoSeven 的比较分析在国内尚属首次。CHO 细胞表达的rhF Ⅶ由于其肝脏清除率低及AUC 高被认为是最适合于rhF Ⅶ表达的系统[1],项目组成功获得了rhF Ⅶ的高表达株(~50 mg/L)。
F Ⅶa 与TF 的高亲和力结合是启动外源性凝血系统的关键步骤。F Ⅶa 与TF 的亲和力分析常被用来鉴定F Ⅶ的结构与功能。常用的方法是分析F Ⅶ与置于磷脂中的TF 的亲和力[17]。直接包被没有磷脂的TF,由于蛋白包被位点不一,从而导致TF 与F Ⅶ结合部位的不一致,直接影响了TF 与F Ⅶ的结合,导致亲和力下降[18-20]。本实验中采用的TF 包括TF 胞外区(sTF-his)及sTF与Fc组成的融合蛋白(sTF-Fc)。sTF-his 可以直接被偶联至氨基探针上,而sTF-Fc 则可以利用其Fc 部分均一地偶联至Protein A 探针上,从而保证了所有sTF-Fc 分子中的sTF 部分的方向一致且游离,能有效与系统溶液中的F Ⅶa 结合。其较高的亲和力与较低的解离率与文献中的同类数据相似[21],因此认为本文描述的方法在维持TF 方向与空间构象方面较磷脂插入法更为优越。
TEG 是临床中使用的一种可反映全血功能全貌的监测实验[22-24]。F Ⅶ功能的发挥依赖于其Gla 结构域与全血中的血小板磷脂膜的结合。由于全血中含有血小板,因此TEG 实验与其他实验(APTT、PT、ELISA 等)相比更适合用来鉴定F Ⅶ的功能[25-27]。用抗F Ⅷ抗体人为制备了含有F Ⅷ抑制物的全血,其凝血时间与血友病人的血凝时间相似,表现为凝血时间的延长。在高岭土激活剂的启动下,分别加入的两种F Ⅶa 因子展现了一致的促凝血能力。
4 结论
本研究成功利用CHO/GS 系统表达/纯化了rhF Ⅶ,并通过离子交换层析与钙离子制备了具有活性的rhF Ⅶa。 通过SDS-PAGE、Western Blot、rhF Ⅶa 与组织因子结合实验、rhF Ⅶa 酶活实验、APTT/PT 以及血栓弹力仪等实验全面分析了制备产品(NeoSeven),并与NovoSeven 进行了比较。结果显示,NeoSeven 在生物化学与凝血活性等方面展现了与NovoSeven 相似的特性,为将来近一步对NeoSeven进行翻译后修饰的鉴定与临床前实验(PD、PK、毒理)奠定了基础。

