Lsd1对小鼠调节性T细胞发育及活化的影响
夏妙然 周 航 王达祎 陈 萍
(首都医科大学基础医学院免疫学系,北京 100069)
哺乳动物的免疫系统保护宿主免受病原微生物的侵害,但是过强的免疫反应,会导致自身免疫疾病,对宿主造成严重的损害。在哺乳动物体内,一些T细胞会积极抑制异常或过度的免疫反应,这类细胞称为调节性T细胞(regulatory T cell,Treg)。Treg根据来源可分为两类:①胸腺来源的Treg(thymus-derived Treg cells,tTreg),直接从胸腺CD4+T细胞分化而来[1];②外周来源的Treg(peripherally derived Treg cells,pTreg),由次级淋巴器官中的初始T细胞在TGF-β作用下经抗原刺激分化而来[2]。Treg在发育成熟后离开胸腺进入外周淋巴器官,成为静息状态的Treg(naive-like central Treg cell,cTreg),其特点为高表达归巢型受体L-选择素(CD62L)或CC趋化因子受体7(CC chemokine receptor 7, CCR7)。在抗原刺激下,cTreg可激活分化为活化状态的效应Treg(activated effector Treg cell,eTreg),其CD62L表达下调,高表达激活性标志物CD44分子[3-4]。与cTreg相比,eTreg表达更高水平的Treg效应分子,如细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)和诱导性协同共刺激分子(inducible co-stimulatory molecule,ICOS),有助于增强其免疫抑制功能,对维持体内免疫平衡和免疫耐受发挥着重要作用[5]。
Treg的发育及功能行使依赖于叉头框蛋白家族转录因子P3(forkhead box protein P3,Foxp3)的表达[6]。此外,已有报道揭示多种表观遗传调控分子在其谱系分化和维持中发挥重要作用,如NFAT[7]、NF-κB[8]和AML1[9]。Lsd1是第一个被发现的组蛋白去甲基化酶[10],其可以脱去组蛋白H3第4位赖氨酸(H3K4)或第9位赖氨酸(H3K9)上的一甲基或二甲基化修饰,从而发挥抑制或增强基因表达的作用。Lsd1在许多恶性肿瘤中异常表达,如前列腺癌[11]、乳腺癌[12]、非小细胞肺癌[13]等。Lsd1被认为是多种癌症的有效治疗靶点[14],并且能增强免疫检查点阻断剂的抗肿瘤效果。最近的研究[15]表明,Lsd1也调控T细胞的发育及功能。在小鼠早期未成熟T细胞中敲除Lsd1,会引起胸腺中双阳性T细胞(CD4+CD8+)及CD4单阳性T细胞减少。此外,在胸腺单阳性T细胞中敲除Lsd1,可以维持外周终末分化的杀伤性CD8+T细胞数量,从而促进结肠癌程序性细胞死亡蛋白1(programmed cell death protein-1,PD-1)抑制剂的免疫治疗效果[16]。而Lsd1对Treg的发育及分化是否有调控作用,目前尚无系统性的证据。
本文研究通过将Lck-Cre工具鼠与Lsd1fl/fl小鼠杂交,繁育出在早期未成熟T细胞中特异性敲除Lsd1的小鼠(Lsd1fl/flLck-Cre)。通过流式细胞术检测胸腺及外周免疫器官(脾、淋巴结)中Foxp3+Treg细胞的比例及数量,并分析其中eTreg/cTreg的比例,来探究Lsd1对Treg发育及活化的影响。
1 材料与方法
1.1 实验动物
Lsd1fl/fl小鼠和Lck-Cre小鼠由首都医科大学地坛医院传染病研究所王玺教授课题组惠赠。Lsd1fl/fl小鼠是在Lsd1基因5号和6号外显子两侧插入floxp序列的C57BL/6背景小鼠[17],Lck-Cre小鼠是Lck基因启动子驱动Cre酶表达的C57BL/6背景小鼠[18]。将成年Lsd1fl/fl小鼠和Lck-Cre小鼠连续杂交筛选,获得在早期CD4-CD8-T细胞中特异性敲除Lsd1的小鼠(Lsd1fl/flLck-Cre,KO),将同窝非敲除小鼠作为对照组小鼠(control,Ctrl),选取6~8周龄小鼠用于实验。小鼠饲养于首都医科大学实验动物部动物饲养室,所有操作均经过首都医科大学动物实验与实验动物管理委员会审查批准(批准文号:AEEI-2023-084)。实验动物使用许可证号: SYXK(京)2018-0003。
1.2 主要试剂
CD4 monoclonal antibody-Alexa Fluor700(56-0042-82)购自美国eBioscince公司,Ghost Dye Violet 510(13-0870-T100)、Purified anti-mouse CD16/CD32(70-0161-U500)、RBC lysis buffer(TNB-4300-L100)、Foxp3/Transcription factor staining buffer kit(TNB-0607)均购自美国Tonbo Biosciences公司,PerCP-Cy5.5 rat anti-mouse CD8a(551162)、FITC rat anti-mouse CD44(553133)购自美国BD Biosciences公司, Brilliant Violet 421 anti-mouse CD62L antibody(104436)、PE anti-mouse Foxp3 antibody(126404)购自美国Biolegend公司。Histone H3 antibody(9715)、LSD1 antibody(2139)购自美国CST公司。
1.3 实验方法
1.3.1 小鼠基因型鉴定
剪取3周龄新生鼠鼠尾(2~4 mm)加入75 μL碱液(25 mmol/L NaOH,0.2 mmol/L EDTA),99 ℃加热30 min裂解。每管加入75 μL酸液(40 mmol/L Tris-HCl)中和,混匀,即获得小鼠DNA。以此为模板,分别使用针对Lsd1基因floxp位点引物及针对Lck-Cre基因引物(表1)进行多重聚合酶链式反应 (polymerase chain reaction, PCR)扩增,扩增产物使用1.5%(质量分数)的琼脂糖凝胶进行电泳分析。

表1 引物序列Tab.1 Primer sequences
1.3.2 蛋白印迹(Western blotting)
分别取6~8周龄对照组和敲除组小鼠,处死后分离胸腺,在200目筛网研磨,制备成单细胞悬液,加入红细胞裂解液室温下裂解5 min,使用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,300g离心7 min。弃掉上清,用Buffer A[10 mmol/L HEPES pH 7.9,10 mmol/L KCl,1.5 mmol/L MgCl2,0.34 mol/L Sucrose,10% (体积分数)Glycerol,1 mmol/L DTT,0.1%(体积分数)Triton X-100]重悬,冰上放置5 min,然后4 ℃ 1300g离心4 min,沉淀为细胞核,用蛋白上样缓冲液重悬细胞核,超声至溶液不再黏稠,置于金属浴95 ℃煮5 min。配制12%(质量分数)的十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyac-rylamide gel electrophoresis, SDS-PAGE)凝胶,之后进行电泳、转膜、5%(质量分数)脱脂奶粉封闭。用H3和Lsd1一抗4 ℃孵育过夜,TBST缓冲液(tris-buffered saline tween-20)洗膜3次,兔二抗室温孵育1 h,TBST再次洗膜3次,使用Amersham Image Quant 800曝光分析。
1.3.3 淋巴器官指数测定
称量小鼠体质量,采取颈椎脱臼法处死小鼠。取腹股沟淋巴结及腋窝下淋巴结后,打开小鼠胸腔取出胸腺,打开腹腔取出脾,在PBS缓冲液中清洗,置于吸水纸上吸干水分,电子天平称质量。免疫器官指数按以下公式计算:脏器指数=脏器质量(mg)/动物体质量(g)。
1.3.4 流式细胞术
选取 6~8 周龄的对照组和敲除组小鼠各3只,分离胸腺、脾和淋巴结,在200目筛网研磨,分别制备成单细胞悬液,红细胞裂解液室温裂解5 min,PBS洗涤并计数。每只小鼠分别取2×106个细胞进行染色。先使用Ghost Dye Violet 510染料室温避光染色15 min,用以区分死细胞,洗涤后加入Anti-Mouse CD16/CD32封闭,4 ℃避光孵育5 min。随后加入抗体(anti-CD4、anti-CD8、anti-CD62L、anti-CD44),室温避光染色15 min,洗涤2次。用商品化试剂Foxp3/Transcription Factor Staining Buffer Kit进行固定及打孔,加入PE anti-mouse Foxp3抗体,室温避光孵育45 min,洗涤、重悬后使用BD Fortessa流式细胞仪进行分析,分析并统计每只小鼠的流式结果。
1.4 统计学方法
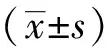
2 结果
2.1 小鼠基因型鉴定
每只小鼠分别用针对Lck-Cre基因和Lsd1基因的引物进行检测。对于Lck-Cre基因,在350 bp处出现明显条带的为阳性(图1A中2、3、4、5号)。带有floxp位点的等位基因扩增产物条带位于169 bp(Lsd1-fl),不带有floxp位点的等位基因扩增产物位于136 bp(Lsd1-wt);故图中1号、3号Lsd1基因型为Lsd1fl/wt,2号、4号为Lsd1wt/wt,5号为Lsd1fl/fl。综合两个基因鉴定结果,图1中5号小鼠为敲除组小鼠,基因型为Lsd1fl/flLck-Cre。Lck启动子诱导的Cre酶可在胸腺未成熟双阴性(CD4-CD8-)T细胞中特异性表达[18],切割带有floxp位点的Lsd1基因序列,从而获得在未成熟T细胞中特异性敲除Lsd1的小鼠。笔者利用Western blotting实验检测了对照组和敲除组小鼠胸腺细胞中Lsd1的表达量(图1B),在敲除组小鼠胸腺细胞中几乎检测不到Lsd1的表达。

图1 小鼠基因型鉴定及Lsd1表达水平检测Fig.1 Genotype identification of mice and detection of Lsd1 expression level
2.2 敲除T细胞中Lsd1使小鼠胸腺萎缩
取敲除组小鼠和同窝对照小鼠各三只,取每只小鼠的胸腺、脾及腹股沟和腋窝下淋巴结,称质量并拍照。与对照组相比,敲除组小鼠的胸腺明显萎缩(图2A),而其脾及淋巴结的大小(图2A)无明显区别。敲除组小鼠胸腺指数降低,但组间差异无统计学意义(P>0.05),胸腺细胞总数较对照组显著降低(图2B)。两组小鼠脾、淋巴结的质量及细胞数差异无统计学意义(图2C、2D)。以上结果说明在未成熟T细胞中特异性敲除Lsd1可导致小鼠胸腺萎缩,但不影响外周免疫器官(脾、淋巴结)的细胞总数。

图2 Lsd1敲除对胸腺、脾及淋巴结质量和细胞数的影响Fig.2 Effect of Lsd1 knockout on weight and cell numbers of thymus, spleen, and lymph nodes
2.3 敲除T细胞中Lsd1后小鼠胸腺中Treg的比例和数量明显增加
采用流式细胞术分析对照组及敲除组小鼠胸腺细胞亚群(图3A),结果显示,与对照组相比,CD8单阳性T细胞数量有轻微下降但差异无统计学意义(P>0.05),而CD4单阳性T细胞数量显著下降(P<0.05)(图3B)。但敲除组小鼠胸腺Foxp3+Treg占CD4单阳性T细胞亚群的比例明显上升(P<0.05)(图3C),且占总胸腺细胞数的比例及绝对数也显著增加(P<0.05)(图3D)。这提示在胸腺早期T细胞中特异性敲除Lsd1促进了CD4+T细胞向Treg方向的发育。
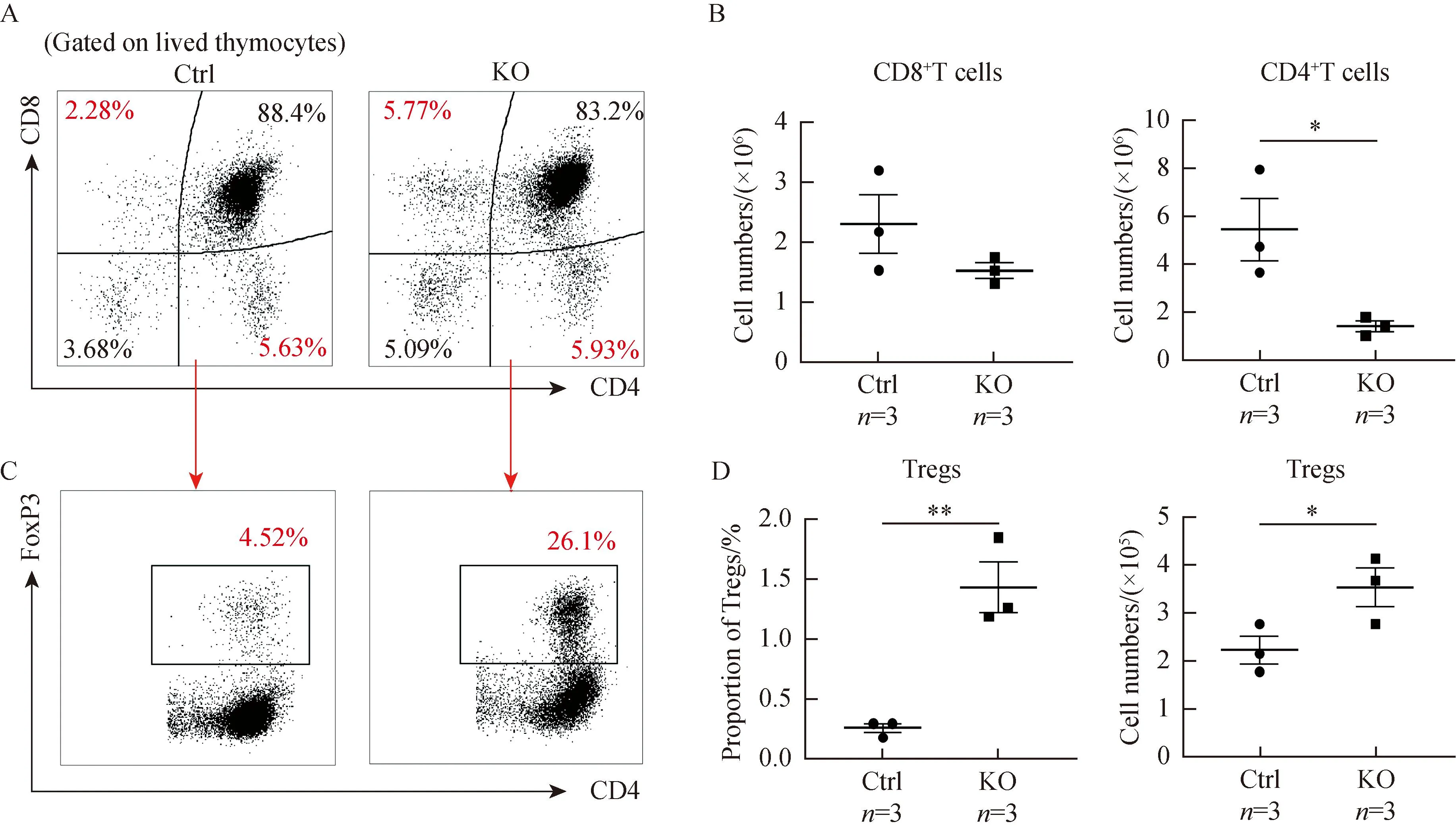
图3 小鼠胸腺T细胞亚群分析Fig.3 Analysis of thymic T cell subsets of mice
2.4 Lsd1敲除后小鼠外周eTreg的比例明显增加
提取敲除组和对照组小鼠脾和淋巴结中的淋巴细胞,通过流式细胞术检测,与对照组相比,敲除组脾(图4A)和淋巴结(图4B)CD4+T细胞的比例明显减少(P<0.05)。Treg占CD4+T细胞的比例仍然升高,但升高幅度不及胸腺Treg,绝对数差异无统计学意义(P>0.05)(图4C、4D)。以CD44及CD62L作为标志物,敲除组小鼠脾及淋巴结中eTreg(CD44+CD62Llo)的比例增加,cTreg(CD44loCD62L+)的比例降低,eTreg/cTreg比例显著上升(P<0.05)(图5A、5B)。不仅如此,对于脾及淋巴结中的cTreg亚群,其在Lsd1敲除后表达激活性分子CD44水平也显著升高(P<0.05),而表达CD62L水平显著降低(P<0.05)(图5C、5D)。以上结果提示敲除T细胞中的Lsd1能够促进小鼠脾和淋巴结中Treg的激活。

图4 小鼠脾和淋巴结中Treg分析Fig.4 Analysis of Treg in mouse spleen and lymph nodes

图5 小鼠脾和淋巴结中eTreg/cTreg分析Fig.5 Analysis of eTreg/cTreg in mouse spleen and lymph nodes
3 讨论
在本研究中,在早期胸腺T细胞中敲除组蛋白去甲基化酶Lsd1后,小鼠胸腺明显萎缩、细胞数显著减少。虽然外周免疫器官(脾脏、淋巴结)细胞数无明显差异,但其中T细胞比例及数量均显著降低。以上提示Lsd1在维持正常T细胞发育及数量的过程中发挥着至关重要的作用。在一项利用Cd2-Cre工具酶敲除Lsd1的研究[15]中,也发现了类似的胸腺及外周的Treg数量减少的现象。在本文研究中,虽然胸腺中CD4+T细胞数量下降明显,但Treg比例及细胞数却显著上升,这提示Lsd1的敲除促进了CD4+T细胞向Treg方向的分化。报道[15]显示,Lsd1敲除后,胸腺细胞中干扰素通路上调,外周淋巴结CD8+T细胞呈现天然记忆(innate-memory)状态,胸腺及外周的Treg表面免疫检查点受体(PD-1、CTLA-4、Nrp1等)表达升高。笔者推测,这种在未成熟阶段过早活化的状态,有可能导致T细胞反馈性上调抑制性分子的表达并促进抑制性Treg细胞的生成。但Lsd1如何调控这一通路并影响T细胞发育,还有待研究。
在敲除组小鼠的外周免疫器官,Treg占CD4+T细胞比例同样显著升高。但由于在胸腺萎缩的情况下,外周的Treg数量也显著减少,最终计算出外周脾及淋巴结Treg的绝对数差异无统计学意义。在生理状态下,Treg在抗原刺激后向eTreg方向分化[19]。本文研究中,敲除组小鼠的外周eTreg比例显著升高,cTreg的比例显著降低,且cTreg表面激活性受体CD44的表达水平也显著升高,提示其也正在向激活状态转化,这可能也与上文中提及的过早激活的干扰素信号有关。此外,eTreg的增殖及归巢能力均低于cTreg[3],且cTreg本身归巢受体CD62L表达水平显著降低,这也可能是外周免疫器官中Treg细胞数没有明显升高的原因之一。
在Treg细胞分化发育过程中,转录因子Foxp3是必不可少的。值得一提的是,有文献[20]报道,Foxp3能够招募CoREST复合体抑制Treg中IFN-γ及IL-2等靶基因的转录。CoREST复合体由核心组分Rcor1及组蛋白去乙酰化酶Hdac1/2和组蛋白去甲基化酶Lsd1共同构成[21]。在Treg中特异性敲除CoREST复合体核心组分Rcor1会损害Treg细胞功能,外周淋巴组织中Treg比例有微弱的数量减少,且Treg分泌IFN-γ及IL-2增多。在此报道[20]中,Rcor1敲除后胸腺Treg细胞比例不受影响,其外周Treg的激活也变化不大。虽然同样也是CoREST复合体的组成成分之一,在本文研究中,Lsd1条件性敲除对Treg的影响更大。一方面,这可能是由于该研究[20]中仅用Foxp3-Cre工具酶在Treg细胞中进行基因敲除,而本文实验中敲除Lsd1的阶段更早,因此对其分化发育影响更大。另一方面,这也提示Lsd1还参与调控其他的通路和靶基因。
Treg在建立并维持机体的免疫稳态过程中发挥着关键作用[22]。其主要通过直接接触或分泌TGF-β、IL-10等细胞因子的方式负调控免疫应答[22]。Treg的缺失及功能低下与多种自身免疫性疾病相关。本文研究表明抑制Lsd1有助于促进Treg的发育及活化。有研究[23]发现CD4+T细胞中敲除Lsd1能抑制细胞功能并改善类风湿性关节炎小鼠模型的严重程度。当前,Lsd1抑制剂在肿瘤治疗中的应用已有广泛研究[14],本文研究提示其在自身免疫病的治疗中也具有潜在的应用价值。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明夏妙然、周航:负责实验设计与操作,撰写与修改论文;王达祎:参与实验操作;陈萍:修改与审定论文。

