基于代谢组学分析郁李仁苷A 对小鼠粪便代谢物的影响
赵锦江,赵梓邯,张羽师,张晓冰,刘舒鹏,王笑雪,李卫东
(北京中医药大学 中药学院,北京 102488)
关键字:郁李仁苷A;代谢组学;粪便代谢物;泻下
便秘在全球都有较高的发病率[1],对人的精神、心理以及生活质量均会造成不良的影响[2]。临床上治疗便秘的药物以促分泌素类药物如利那洛肽,膳食纤维补充剂如粗纤维饮食,刺激性泻药如番泻叶苷,渗透性泻药如聚乙二醇,促运动药如莫沙必利等为代表,但是上述药物治疗效果不理想,且副作用较大[3-4]。
郁李仁是一味传统的润下类中药,具有两千多年的药用历史。课题组前期的研究表明,郁李仁泻下的特效成分为郁李仁苷A,该化合物是一种黄酮类成分[5-6],但其泻下机制仍不清楚,代谢组学可能是阐述其泻下机制的重要途径。代谢组学通过检测机体受到干扰后内源性代谢物的变化,从中找出与干扰相关的差异代谢物,同时结合生物信息学分析阐明代谢通路,继而解析生物代谢机制[7],可用于辅助疾病的早期诊断以及疾病机制、药物作用机制、靶点发现、毒效和毒理机制等方面的研究[8]。
本研究基于代谢组学技术方法,对给予郁李仁苷A 后的小鼠粪便代谢物进行分析,旨在探讨郁李仁苷A 对于小鼠代谢的影响,分析其参与泻下的可能机制,为后续相关研究提供参考和借鉴。
1 材料与方法
1.1 试剂与仪器
DW-HL528 型超低温冰箱(中国中科美菱低温科技有限公司);FD-2A 型冷冻干燥机(北京博医康实验仪器有限公司);UPLC 级色谱柱(美国Waters AQUITY UPLC HSS T3 色谱柱,2.1 mm × 100 mm, 1.8 μm );DIONEX Ultimate 3000 型UPLC 超高效液相色谱仪、UPLC-Q-Exactive Oribitrap MS 线性离子阱四极轨道质谱、Sorall ST 8R 型高速冷冻离心机,均购于美国赛默飞科技公司。
郁李仁苷A(纯度>95%)为实验室自制;乙腈、甲醇、甲酸均为质谱级,购自美国赛默飞科技公司;L-2-氯苯丙氨酸(分析标准品,HPLC ≥98%)购自上海源叶生物科技有限公司。
1.2 实验动物及分组
雄性ICR 小鼠,体质量为24 ~ 26 g,购自斯贝福(北京)生物科技有限公司。小鼠随机分3 组(n= 10),分别是空白对照组(C 组)、给药组(M 组)、恢复组(R 组)。实验前所有小鼠均于北京中医药大学实验动物中心适应性饲养1 周,期间自由饮水,并给予标准饮食。室温为(22±2)℃,湿度为(60±5)%,每日光照12 h。实验方案经北京中医药大学动物伦理委员会审核通过。适应性饲养待小鼠状态稳定后,M组和R 组连续3 d 经口灌胃给予受试物20 mg/kg,C组给予生理盐水,每日一次,首次给药前16 h 禁食不禁水,而后自由饮食,给药体积10 mL/kg。其中,R 组的小鼠连续3 d 给药结束继续正常饲养48 h 后取材,其他两组均在第三次给药后2 h 取材。
1.3 粪便样本预处理方法
处死小鼠后,取盲肠内容物500 mg 于干净的离心管中,液氮速冻,-80℃保存备用。将盲肠内容物冷冻干燥,充分混匀后,称取20 mg 盲肠内容物干燥粉末,加入400 μL 的80%甲醇水溶液(内含20 μg/mL 的L-2-氯苯丙氨酸作为内标),充分震荡提取,12 000 r/min 离心10 min,前后两次,移取上清液,用于LC-MS 检测。移取每个样品的上清液20 μL 合并,作为质量控制样品用于评价仪器和方法稳定性。
1.4 粪便代谢组学条件
柱温为35 ℃,样品室温度为4 ℃,流速为 0.25 mL/min,进样量为 3 μL。流动相A 为0.1%甲酸-水,流动相B 为乙腈。梯度洗脱:0 ~ 5 min ,8% →40%B;5 ~ 10 min,40%→ 60% B;10 ~ 15 min,60%→95%B;15 ~ 16 min,95% → 95%B。质谱条件为正、负离子模式,HESI 离子源,离子源温度为350 ℃,电离源电压为3.0 kV,毛细管电压为-35 V,管透镜电压为-110 V,鞘气和辅助气均为高纯氮气(纯度 >99.99%),鞘气流速为35 arb,辅助气流速为10 arb。一级全扫描(Full Scan,m/z60 ~ 1 000);数据依赖性二级质谱扫描ddMS2,碰撞能20 、40 、60 eV[9-10]。
1.5 数据预处理与分析
得到各样本的RAW 格式原始数据,借助Thermo Scientific Xcalibur 2.2、Compound Discoverer 3.0 和Mzmine 2.53 软件进行一级和二级质谱数据处理和分析。在所有QC 样本中,各特征峰的保留时间差不超过0.1 min,峰强的相对标准偏差(RSD)不超过20%。以内标物峰强为参考对各信号峰的峰强进行标准化处理,以进一步排除仪器及方法稳定性可能带来的数据误差。随后将含有质荷比(m/z)、保留时间(RT)和峰强度的数据导出进行下一步的分析。通过准确的质荷比(m/z)和二级质谱(ms/ms)信息,使用compound discover(v3.0)软件进行代谢物的鉴定,并通过HMDB 5.0(https://hmdb.ca/)进行进一步的验证。
将原始数据通过metaboanalyst 5.0(https://www.metaboanalyst.ca/)数据库进行处理。将处理得到的数据进行下一步的多元统计分析,包括主成分分析( PCA)和正交偏最小二乘判别分析 (OPLS-DA)。OPLS-DA 模式进一步评估空白对照组和给药组小鼠粪便的代谢差异,并筛选重要的差异代谢物。OPLSDA 的差异权重贡献值(VIP)评分识别主要的差异代谢物,并与t检验和FC 值进行相互验证,通过VIP >1、P<0.05 及|log2(FC)| >1 的 参 数 来 筛 选 重要的差异代谢物。将得到的重要差异代谢物通过metaboanalyst5.0(https://www.metaboanalyst.ca/)数据库进行代谢途径分析。
1.6 统计学方法
采用Graphpad Prism9.0 统计学软件进行处理。计量资料用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 郁李仁苷A 对正常小鼠的代谢模式的影响
首先,QC 样本在PCA 图中聚集集中,见图1,表明分析过程中仪器和方法具有良好的重复性、稳定性和可靠性,可用于代谢分析。基峰强度色谱图如图2 所示。在正、负离子模式下的PCA 图,M 组、R 组和C 组都有明显的分离,其中R 组的聚集相较于给药组更为集中,说明给药后不同小鼠代谢的个体差异较为显著,但是在恢复后各个小鼠的代谢水平又会变得较为一致,同时R组和C组之间的分离仍然明显。随后,通过OPLS-DA 进行进一步的分析,同时进行两组之间的t检验,筛选重要的差异代谢物,并进行鉴定。选择VIP >1、P<0.05 及|log2(FC)|>1 的代谢物进行通路富集分析。使用火山图显示差异代谢物的信息,见图3。

图1 小鼠粪便代谢物物的PCA 分析图Fig 1 PCA analysis of mouse fecal metabolites
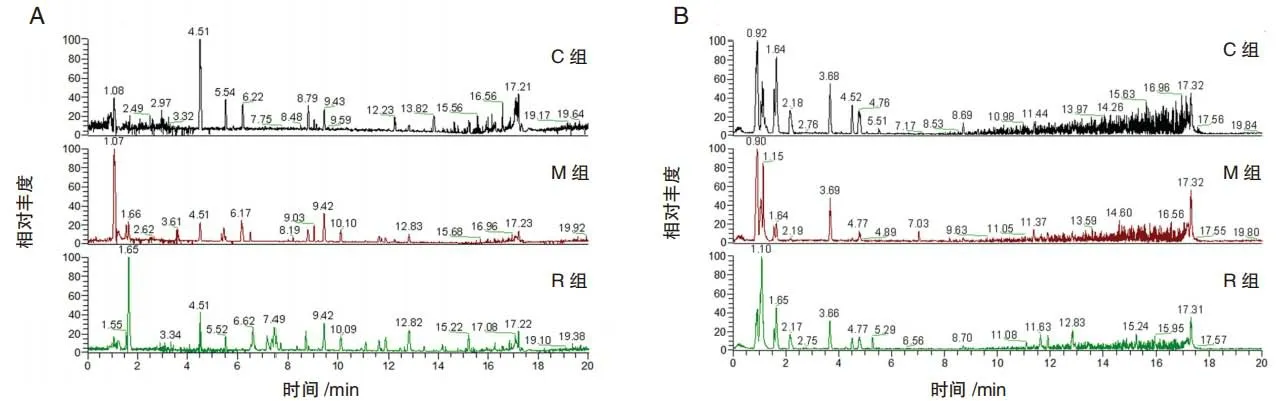
图2 小鼠粪便代谢物物的正、负离子模式下的基峰谱图Fig.2 Base peak spectra of mouse fecal metabolites in positive mode and negative mode

图3 小鼠粪便代谢模式的火山图Fig 3.Mouse fecal metabolic pattern volcano plot
2.2 郁李仁苷A 给药后小鼠粪便中的差异代谢物分析
通过上述代谢物的筛选标准,从R 组中共筛选到46 个差异代谢物(表1),在M 组中共筛选到38个差异代谢物(表2)。这些差异代谢物有脂肪酸、胆汁酸、氨基酸、牛磺酸、乳糖、磷酸类、嘧啶等,其中,影响较为明显的是氨基酸、脂肪酸、牛磺酸、胆汁酸和糖类。

表1 M 组与C 组的差异代谢物Tab 1.Differential metabolites between M group and C group

表2 R 组与C 组的差异代谢物Tab.2 Differential metabolites between the R group and C group
通过对上述差异代谢物的log2(FC)进行分析发现,在M 组中的差异代谢物以上调趋势较为明显(图4、5),主要有乳酸、尿氨酸、丙酸、草酸、甲羟戊酸、丙烯酸等。R 组则以下调居多,主要是胞嘧啶、肌苷、甾胆素、尿胆素原、肾上腺酸、5-羟基、乙酸、甲基琥珀酸、脱氧胆酸、尿苷等代谢物。上调差异代谢物大多属于短链脂肪酸(SCFAs),而SCFAs 具有较为显著的免疫调节潜能和促进肠道蠕动作用[11]。

图4 M 组差异代谢物的上调与下调图Fig 4 Upregulation and downregulation plot of differential metabolites in the administration group (M group)

图5 R 组差异代谢物的上调与下调图Fig 5.Upregulation and downregulation plot of differential metabolites in the recovery group (R group)
2.3 郁李仁苷A 给药后小鼠粪便中的代谢通路分析
通过进一步对上述差异代谢物进行KEGG 通路分析(图6)和KEGG 富集分析(图7),发现在M组中影响较为显著的通路有亚油酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、苯丙氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、半乳糖代谢、牛磺酸和次牛磺酸代谢、嘧啶代谢。而在R 组中仍然存在显著影响的通路主要是牛磺酸和次牛磺酸代谢。其他影响较低的代谢通路如淀粉和蔗糖代谢、胆汁酸生物合成等,在R 组和M 组均存在。

图6 M 组小鼠粪便代谢物通路分析图Fig.6 Analysis plot of fecal metabolite pathways in mice of M group

图7 小鼠粪便代谢物差异代谢物的富集分析图(M 组)Fig.7 Enrichment analysis plot of differential metabolites in mouse Fecal metabolites(M group)
3 讨论
本研究发现,郁李仁苷A 参与苯丙氨酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成,以及精氨酸和脯氨酸代谢等多条氨基酸代谢通路。肠道氨基酸代谢具有重要的生理和营养功能,可以为肠蠕动提供能量,为肠黏膜细胞和肠腔内微生物合成蛋白质、氨基酸、谷胱甘肽、多胺、嘌呤和嘧啶核苷供给氮源和碳骨架,还可以维持肠黏膜细胞的数量及其吸收、防御、细菌屏障和免疫功能,调节肠腔内微生物种群的多样性和活性等[12]。因此,郁李仁苷A 可以通过调控氨基酸代谢通路为肠道细胞提供营养、促进肠道黏液分泌、改善肠道屏障、调节肠道免疫、促进肠道吸收、保护肠道细胞,并为肠道蠕动提供能量来保证肠道发挥正常的生理功能,进而维持排便的正常。
同时,本研究还发现郁李仁苷A 可以参与到丙酮酸代谢、嘧啶代谢和牛磺酸和次牛磺酸代谢等多条代谢途径,通过影响上述代谢途径调节机体状态。其中,丙酮酸代谢是能量代谢的一个重要组成,肠道蠕动需要大量的能量供给,因此,提高肠道组织的能量代谢对于便秘的治疗具有重要的意义[13]。此外,嘧啶代谢对于炎症状态具有一定的指示作用,有研究表明便秘小鼠结肠组织嘧啶代谢相关的胸苷和脱氧胞苷均处于异常状态,提示小鼠结肠组织嘧啶代谢处于紊乱状态,这会引起便秘小鼠肠道炎症,导致肠道功能障碍[14]。因此郁李仁苷A 对嘧啶代谢通路的影响可能是缓解便秘引起的一系列肠道炎症的机制。大量的研究证实牛磺酸具有许多生理功能,如抗氧化、抗炎等[15-16]。同时,研究表明便秘产生的过量自由基会进加剧机体氧化损伤,影响肠道功能,故抗氧化在改善便秘相关疾病的治疗中发挥着重要作用[17]。而郁李仁苷A 影响牛磺酸代谢可能是其发挥抗氧化作用,从而保护肠道健康的一个机制。综上所述,郁李仁苷A 给药后可以调控上述代谢通路进而参与能量代谢、抗炎抗氧化、免疫调节等保障肠道正常生理功能。
4 结论
研究表明郁李仁苷A 对于小鼠肠道代谢的影响是多方面的,其作用可能有助于恢复肠道平衡和稳态,对于便秘引起的各种肠道功能紊乱可能具有调节功能。但作为对郁李仁苷A 作用机制的初步探索,代谢组学的研究还需要进一步的实验验证,后续将继续对郁李仁苷A 的相关机制作深入的研究。

