一株耐高氨氮好氧反硝化细菌的鉴定及脱氮性能研究
冯雨薇,苏新国,孙慧明,林浩澎,陈琼华,舒 琥
广州大学 生命科学学院,广东 广州 510006
近年来,我国工厂化养殖水产品产量持续上升,2021 年达679 908 t[1],随之而来的养殖污染也呈加剧趋势。富含蛋白质的商业饲料是水产养殖系统中的主要氮 (N) 源,但只有约25%的饲料可以转化为鱼类的生物量[2];氨氮 (NH4+-N)、硝态氮(NO3--N)、亚硝态氮 (NO2--N) 等含N 化合物成为工厂化养殖系统中的主要污染物。随着养殖密度的不断增大,饲料投喂量增加,残留饵料、残骸、鱼粪等含N 污染物也不断增加[3-4]。这些含N 污染物在微生物的作用下进行蛋白质脱氨作用产生NH+4-N,进而被氧化成NO2--N、NO3--N。在水产养殖系统中,3 种含氮化合物的含量不同,其中NH4+-N 的生成量最大,但这些N 污染对养殖水生动物均有不同程度的毒害作用,长时间暴露其中会破坏鱼体的鳃组织、干扰生物体氧化过程,导致生长减缓、肝组织恶化甚至死亡[5]。此外,NH4+-N 浓度过高还会导致水体富营养化,溶解氧含量下降,有毒物质增加,进而破坏水产养殖系统的生态平衡[4]。因此,亟须经济有效的方法清除水产养殖系统中的N 污染,避免水产养殖业遭受巨大的经济损失。
为了减少NH4+-N 及其他N 污染,人们通过充氧曝气、物理化学法、生物法等手段进行治理,实现工厂化养殖水体的循环再利用[6]。物理化学方法包括反渗透、电渗透析和离子交换,需要高昂的运营和维护成本,并会产生二次废物。与之相比,生物法省时高效且成本低,极具发展前景[7]。好氧反硝化细菌以生长周期快、脱氮周期短、降解能力强的优点常被运用于生物修复。目前已有研究发现的好氧反硝化细菌种类有芽孢杆菌属 (Bacillus)、假单胞菌属 (Pseudomonas)、产碱杆菌属 (Alcaligenes)、红球菌属 (Rhodococcus)等,能将水体中的含N 化合物还原为气态N 进而有效减少水中N 污染[8]。例如,刘方剑[9]筛选出的菌株WZ17 具有高效脱氮性能,对NH4+-N、NO2--N 和NO-3-N 的去除率分别为99.31%、91.82%和83.60%;Xia 等[10]从淡水中筛出菌株ND7 可在低浓度条件下 (约50 mg·L-1)分别去除约99.8%的NH4+-N、96.2%的NO2--N 和97.18%的NO3--N,表明好氧反硝化细菌具有较好的脱氮作用。但仅有少数研究者对反硝化菌株的生物安全性进行了研究[11],而未经生物安全性检验的菌株在投放使用后极可能对渔业造成危害。此外,现有研究的菌株存在生长缓慢、NH4+-N 耐受性差等问题,不能较好地适应高浓度NH4+-N 的极端环境,如高浓度NH4+-N 的工业和养殖废水等;缺乏能够兼用于处理农业、工业废水的菌株。本研究设计了高浓度NH4+-N 实验,探索了菌株对浓度范围较广 (100~1 000 mg·L-1) 的NH+4-N 的耐受性及去除能力。
为获得耐高NH4+-N 且安全高效脱氮的好氧反硝化细菌,本文基于一株从广东省佛山市某罗非鱼养殖池塘中分离纯化出来的好氧反硝化细菌WM28,对其进行菌株种属鉴定、抗生素药敏实验和毒性实验,研究了其异养硝化-好氧反硝化的能力及高NH4+-N 耐受性,以期为废水脱氮提供良好的菌种来源,并为未来该菌种在新型脱氮工艺中的开发利用奠定实验基础。
1 材料与方法
1.1 菌株
菌株WM28 筛选自广东省佛山市某罗非鱼养殖池塘采取的池水和底泥。用甘油冷冻保存法将菌株保存于实验室中,实验前进行富集培养。
1.2 培养基
牛肉膏蛋白胨琼脂培养基为:牛肉膏3 g·L-1,蛋白胨10 g·L-1,氯化钠 (NaCl) 5 g·L-1,琼脂17 g·L-1,双蒸水 (ddH2O) 1 L,pH 7.2~7.4;
单一氮源模拟废水:磷酸二氢钾 (KH2PO4) 1.5 g·L-1,七水硫酸镁 (MgSO4·7H2O) 0.2 g·L-1,磷酸氢二钠 (Na2HPO4) 7.9 g·L-1,柠檬酸钠 7.169 g·L-1,氯化铵 (NH4Cl) 0.764 g·L-1或硝酸钠(NaNO3) 1.214 g·L-1或亚硝酸钠 (NaNO2) 0.986 g·L-1,微量元素溶液 2 mL,H2O 1 L,pH 7.2;
高氨氮模拟废水培养基在单一氮源模拟废水(NH4Cl) 的基础上,改变NH4Cl 和柠檬酸钠的浓度:NH4+-N 初始质量浓度分别为100、200、500、700 和1 000 mg·L-1,分别加入0.382、0.764、1.911、2.675 和3.821 g·L-1的NH4Cl,分别加入3.584、7.169、17.912、25.090 和35.843 g·L-1的柠檬酸钠。
1.3 实验方法
1.3.1 形态学分析
将菌株接种至牛肉膏蛋白胨琼脂培养基中,28 ℃培养24 h,肉眼观察单菌落生长形态;再通过革兰氏染色在油镜下观察菌体的染色特性。用扫描电镜对分离菌株个体形态进行观察并拍照记录。菌株的生理生化特性鉴定根据《常见细菌系统鉴定手册》[12]及《Bergey's Manual of Systematic Bacteriology》[13]进行。
1.3.2 菌株16SrRNA基因序列分析
使用DNA 提取试剂盒提取菌株WM28 的DNA,并以之为模板扩增其16SrRNA基因。使用的引物为:上游引物 (27 F):5'-AGAGTTTGA TCCTGGCTCAG-3';下游引物 (1 492 R):5'-GGC TACCTTGTTACGACTT-3'。用琼脂糖凝胶电泳分析扩增结果,并将扩增产物送至上海生工有限公司进行测序。将测序结果先提交到NCBI,在Gen-Bank 中获得注册号。使用BLAST 进行序列比对,选取同源性较高的模式菌株,利用MEGA 6 软件构建系统发育树,分析菌株的种属关系。
1.3.3 常见抗生素纸片药敏实验
按照我国卫生行业标准WS/T 639—2018《抗菌药物敏感性试验的技术要求》中的“纸片扩散法”要求开展常见抗生素纸片药敏实验。菌株活化后,取150 μL 菌液于平板上,均匀涂布,待平板晾干后,使用无菌镊子将含有抗生素的纸片贴于平板中间,重复贴3 个,15 min 内倒置平板。于30 ℃恒温条件下培养18 h 后,使用游标卡尺测量抑菌圈直径并记录。
1.3.4 生态毒性评价—鱼类毒性实验
取出活化培养至16 h 的WM28 菌液,在5 000 r·min-1离心5 min,去上清液,用无菌PBS 缓冲液洗涤沉淀,重复2 次后,再用灭菌水重悬菌体,测定OD600,根据OD600与菌浓度的变化趋势得到实验标准曲线。参照Shu 等[14]的方法,选取体长为(3±1) cm 且健康的斑马鱼 (Daniorerio) 60 尾,随机分配到装有15 L 淡水的玻璃容器中,每缸10尾,设置3 个重复。实验组加入WM28 并根据标准曲线控制其菌量在1×106CFU·mL-1,对照组加入等体积无菌水。实验期间,正常饲养斑马鱼,每隔3 d 对水体进行更换,换水后按上述方法重新加入菌株,实验持续10 d,记录斑马鱼的成活率。
1.3.5 菌株在3 种单一氮源模拟废水下的生长情况与脱氮性能
实验设置3 种单一含氮模拟废水 (设置初始NH+4-N、NO-3-N 和NO-2-N 的质量浓度分别为197.06、211.70 和194.04 mg·L-1),其他变量保持一致,设置不添加菌液的空白对照组,每组实验设置3 个平行。将活化培养至第16 小时的菌株以体积比1%的接种量,分别接种到3 种高温灭菌后的单一含N 模拟废水中,在恒温摇床中培养48 h;前12 h 每4 h 取样,后36 h 每8 h 取样,测定发酵液中的生物量 (以光密度OD600为表征),再在5 000 r·min-1,5 min 条件下进行离心处理后取其上清液,检测其NH4+-N、NO3--N 和NO2--N 的浓度,以观察菌株的生长情况及氮源的动态变化情况。
1.3.6 菌株WM28 对高浓度NH4+-N 模拟废水的耐受性
为探究菌株是否具备处理养殖尾水、工业废水的潜力,分别使用NH4+-N 质量浓度为100、200、500、700 和1 000 mg·L-1的模拟废水对菌株WM28进行培养,其他变量保持一致,每组实验设置3 个平行。将活化培养至16 h 的菌株以体积分数1%接种量分别接种到不同浓度的NH4+-N 模拟废水中,在30 ℃恒温摇床中培养120 h,前72 h 每8 h 取样,后48 h每12 h 取样。测定发酵液中的OD600及其NH4+-N 浓度,验证菌株对高浓度NH4+-N模拟废水的耐受性。
1.3.7 N 检测方法及去除率计算
NH4+-N 采用纳氏试剂分光光度法 (HJ 535—2009) 测定;NO3--N 采用紫外分光光度法 (HJ/T 346—2007) 测定;NO2--N 采用N-(1-萘基)-乙二胺二盐酸盐分光光度法 (GB 7493—1987) 测定。去除率η的计算公式如下:
式中:C0表示第0 小时的相应氮源质量浓度(mg·L-1);C1表示发酵培养之后某时间测得的相应氮源质量浓度 (mg·L-1)。采用Origin 2018 软件对实验结果进行统计分析与绘图。
2 结果
2.1 菌株的形态、生理生化及16S rRNA 分子鉴定
菌株WM28 在牛肉膏蛋白胨琼脂培养基上形成米白色菌落,透明、表面光滑湿润、形状不规则(图1-a)。革兰氏染色结果呈阳性 (图1-b)。扫描电镜下,菌株WM28 为长约1.4 μm、宽约0.4 μm 的杆菌 (图1-c)。根据《常见细菌系统鉴定手册》[12]和《Bergey's Manual of Systematic Bacteriology》[13]进行菌株的生理生化鉴定,初步鉴定WM28 为赤红球菌 (表1)。
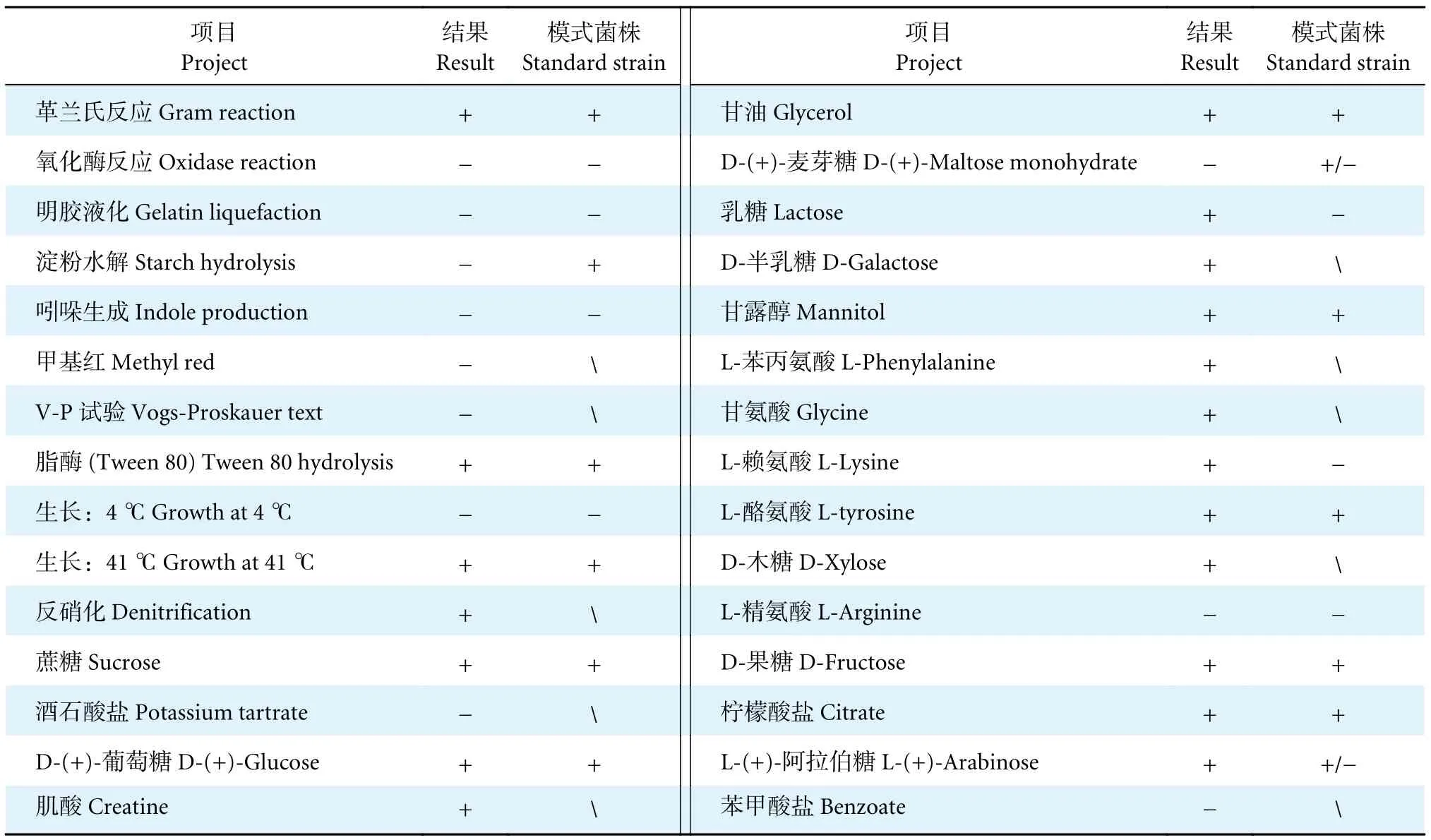
表1 菌株WM28 生理生化鉴定结果Table 1 Physiological and biochemical identification results of strain WM28
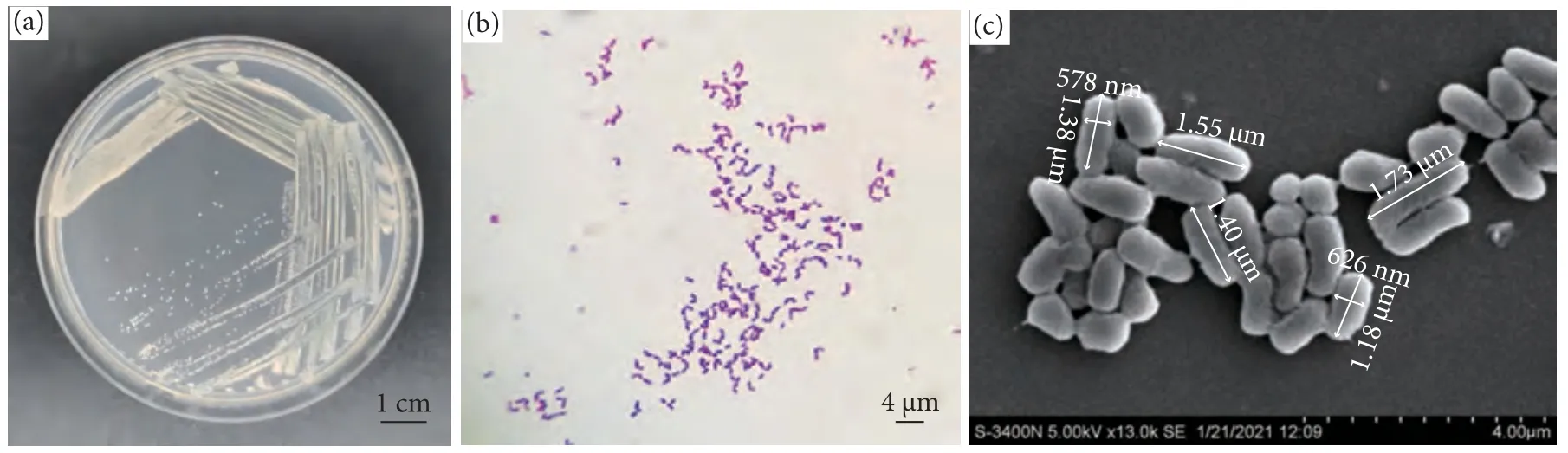
图1 WM28 菌落形态特征观察注:a.菌落特征;b.革兰氏染色镜检;c.菌株扫描电镜图。Fig.1 Observation on morphological characteristics of WM28 colonyNote: a.Colony characteristics; b.Gram stain microscopy; c.Scanning electron microscope of strain.
将菌株WM28 的16S rRNA 序列上传NCBI,在GenBank 中获得注册号MW578893.1。比对结果显示 (系统发育树见图2),菌株WM28 与Rhodococcus属Rhodococcussp.OUZC16 在同一个分支上,亲缘关系最近,序列比对一致度为99.64%,故鉴定为红球菌属。

图2 基于 16S rRNA 基因序列菌株WM28 的系统发育树Fig.2 Phylogenetic tree of strain WM28 based on 16S rRNA sequence
综合形态学、生理生化特征及16SrRNA基因序列和系统发育树分析结果,鉴定该菌株为红球菌属赤红球菌,命名为RhodococcusruberWM28。
2.2 常见抗生素纸片药敏实验及生态毒性实验
药敏实验结果 (表2) 显示,菌株WM28 对氯霉素、盐酸四环素、硫酸庆大霉素、左氧氟沙星等常见药品敏感;对诺氟沙星、环丙沙星呈中介状态;但对头孢他啶、链霉素等常见抗生素呈耐药性。这与抗生素的天然抗菌谱相关,实验菌WM28 为放线菌目、棒杆菌亚目、诺卡菌科、红球菌属,头孢他啶对革兰氏阳性菌的效果与第一代头孢菌素近似,作用较弱[15];链霉素产自放线菌目中的链霉菌[16],对菌株不敏感,在实际应用中应避开使用头孢他啶及链霉素等抗生素进行灭菌。因此,推断菌株WM28 对常见的抗生素具有较好的药物敏感性。
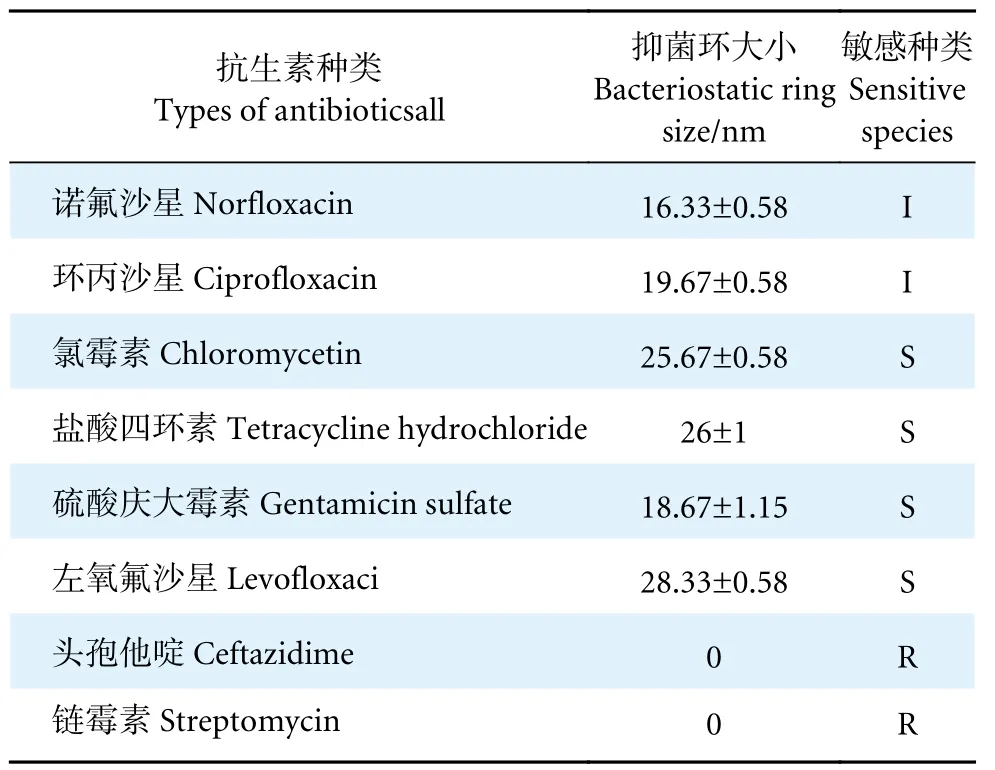
表2 抗生素耐药性实验结果表Table 2 Experimental results of antibiotic resistance
生态毒性实验中,正常饲养到第12 天时,菌株WM28 实验组和对照组的斑马鱼成活率均为100%。由于本实验加入的菌液浓度为1×106CFU·mL-1,高于病原微生物的致病剂量 (1×104CFU·mL-1),因此可以初步判断菌株WM28 具有较高的生物安全性。
2.3 菌株在3 种单一氮源模拟废水下的生长与脱氮性能
菌株WM28 分别在3 种单一氮源模拟废水中的生长与脱氮性能如图3 所示。异养硝化培养体系中 (图3-a),当NH4+-N 作为唯一的氮源被菌株利用时,菌株WM28 在第12 小时进入对数期,第24 小时达到最大生长OD600(1.004),培养至第36 小时NH4+-N 被完全去除,表明其具有良好的异养硝化NH4+-N 去除性能;在脱氮前期有6~7 mg·L-1NO3--N 少量生成后被去除,无NO2--N 积累。
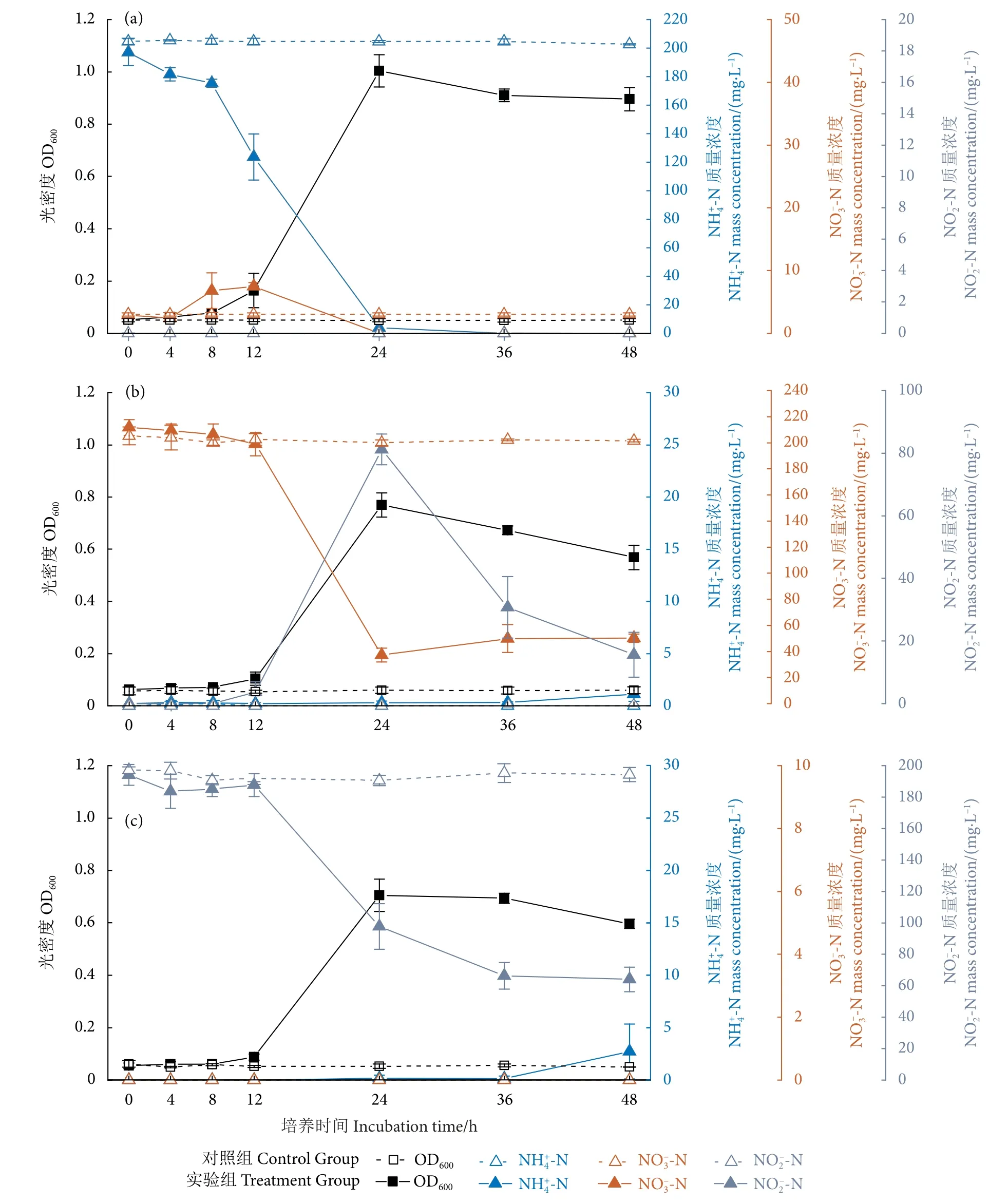
图3 菌株WM28 在单一NH4+-N (a)、NO3--N (b)、NO2--N (c)模拟废水中的生长及脱氮性能注:初始无机氮质量浓度 (C0,mg·L-1),NH+4-N 为197.06,NO-3-N 为211.70,NO2--N 为194.04。Fig.3 Growth and denitrification performance of strain WM28 under a single NH4+-N (a),NO3--N (b) and NO2--N (c) simulated wastewaterNote: Initial inorganic nitrogen mass concentration (C0,mg·L-1): NH4+-N 197.06; NO3--N 211.70; NO2--N 194.04.
在单一NO-3-N 的好氧反硝化体系中 (图3-b),观察到显著的NO3--N 去除,48 h 后去除率为76.3%。菌株WM28 在第24 小时达到最大生长OD600(0.762),后呈下降趋势,可能与此时高浓度的NO2--N 相关。在好氧反硝化过程中,NO-3-N 首先转化为NO-2-N,最大质量浓度为81.20 mg·L-1,最终降至15.61 mg·L-1。推测高浓度的NO2--N 会对菌株WM28 产生毒性,一定程度上抑制其生长和代谢。
在单一NO2--N 的好氧反硝化体系中 (图3-c),菌株WM28 培养至第24 小时后达到最大生长OD600(0.705),48 h 后NO2--N 去除率为66.99%,表明具有良好的好氧亚硝酸盐去除性能。单一NO3--N 和单一NO2--N 在36 h 后分别检测到0.909和2.734 mg·L-1的NH4+-N 生成,王田野等[17]认为,Acinetobactersp.SQ2 菌体在利用NO-3-N 或NO-2-N 为氮源生长合成细胞内源N 后,菌体进入内源期后部分内源N 通过氨化作用转化成为NH4+-N,从而导致水体中NH4+-N 的产生。
异养硝化和好氧反硝化是重要的能量代谢途径。比较3 种单一氮源的结果,菌株WM28 在反应体系中具有良好的氮源降解效果,异养硝化体系能够将NH4+-N 完全降解,在生长及脱氮性能上优于好氧反硝化体系。因此,推测该菌株用于去除NH4+-N 的能量高于NO3--N 或NO-2-N,但因能量供应导致的生长及脱氮性能的差异还需进一步的实验验证。
2.4 菌 株 WM28 对高浓度 NH4+-N 模拟废水的耐受性
菌株WM28 在不同浓度的NH4+-N 模拟废水中的耐受性结果 (图4,表3)显示,随着NH4+-N 质量浓度上升,菌株生长的对数期逐渐延后,OD600最大值逐渐增大。100、200 和500 mg·L-1初始NH4+-N 质量浓度中的NH4+-N 分别在第16、第24和第56 小时被完全去除;700 mg·L-1初始NH+4-N质量浓度中的NH4+-N 在第116 小时后可被去除88% 以上;在第120 小时,菌株WM28 对1 000 mg·L-1初始NH4+-N 质量浓度中的NH4+-N 去除率为74.38%,这说明菌株WM28 具有良好的耐受高浓度NH4+-N 的能力,在初始NH4+-N 质量浓度为1 000 mg·L-1时仍有脱氮能力。

表3 菌株WM28 在不同质量浓度NH4+-N 模拟废水中培养120 h 后的生长及去除情况Table 3 Growth and removal of strain WM28 in simulated wastewater with different concentrations of NH4+-N for 120 h

图4 菌株WM28 对高浓度NH4+-N 模拟废水的耐受性Fig.4 Tolerance of strain WM28 to high concentrations of NH4+-N simulated wastewater
3 讨论
3.1 赤红球菌WM28 的安全性评价
作为天然环保制剂,微生态制剂能有效净化水质,改善生态环境,提高动物的机体免疫力,故在水产养殖领域的应用较为广泛[18]。红球菌属是用于废水处理的常见微生物,除了能够有效降解苯酚、苯乙烯、邻苯二甲酸酯、芘等有机化合物外,在处理含N 废水上亦有较好效果[19-21]。例如,张智超等[19]从生猪养殖场筛出的红球菌菌株ZZC-14 对NH4+-N 的降解率达到94.4%;田雅洁等[20]筛出的玫瑰红红球菌XH2 的最高NH4+-N 去除率均在98.0%以上,均能体现红球菌属在处理含N 废水上的巨大潜能。但该属部分菌种导致生物患病的报道亦令人担忧,如马红球菌 (R.equi) 导致马驹(Equuscaballus) 患慢性化脓性支气管肺炎、棒状红球菌 (R.kroppenstedtii) 致新生儿菌血症和关节炎等[22-24]。基于水产健康养殖需要,微生态制剂研发筛选获得菌株后需要重点关注风险评价与安全性分析[25]。为确保微生物菌剂应用中的生态环境安全和污染防治,本研究对筛选出的赤红球菌WM28进行了生物安全性评估,证明其是一株具有安全性的好氧反硝化菌株,在工厂化水产养殖领域具有潜在的开发前景。但菌株对抗生素抗性是否具有转移性或耐药基因是否存在于菌株的DNA 上,仍需通过质粒提取进行更深入的实验研究[26]。
3.2 赤红球菌WM28 的异养硝化-好氧反硝化途径
有研究表明,红球菌属通过完全异养硝化-好氧反硝化途径除铵[27]。在已有的异养硝化-好氧反硝化细菌的研究中,发现两种不同的硝化途径:NH4+-N→NH2OH→NO2--N (↔NO3--N)→NO→N2O→N2和NH+4-N→NH2OH→N2O→N2。在菌株WM28 的异养硝化过程中,当以NH4+-N 为唯一氮源时,培养48 h 后脱氮去除率为100%,显著高于R.erythropolisATCC 4277 的47%[28],脱氮效果明显。异养硝化培养基中有NO3--N 少量积累,且无NO2--N 积累,这与Su 等[29]从对虾养殖池中筛出的菌株GZWN4 的研究一致。本实验中,菌株WM28 的异养硝化作用与菌株生长几乎同步进行。异养硝化途径可能为NH4+-N→NH2OH→NO2--N→NO3--N[30]。而实验过程中积累的NO3--N 被菌株通过反硝化途径去除。在菌株WM28 的好氧反硝化过程中,当以NO3--N 为单一氮源时,NO3--N 先转化为NO-2-N 后,再被去除;以NO-2-N 为单一氮源时,过程中无NO3--N 生成,推测反硝化途径为NO3--N→NO2--N →NO→N2O→N2。因此,推断菌株WM28能同时进行硝化和反硝化作用,能够快速高效进行N 降解,在处理含N 废水上有巨大的应用潜能。但要验证菌株的异养硝化-好氧反硝化途径,还需要克隆菌株硝化、反硝化基因,例如氨氮加氧酶基因 (amo)、羟胺氧化酶基因 (hao)、硝酸盐还原酶基因 (nap)、亚硝酸盐还原酶基因 (nir)、氧化亚氮还原酶基因 (nos) 等[31],以进一步完善N 转化途径及代谢机制研究。
3.3 赤 红球菌WM28 在高NH4+-N 废水处理中的潜力
在高NH4+-N 废水处理方面,虽已发现较多去除NH4+-N 的菌株,但红球菌属在NH4+-N 质量浓度超过200 mg·L-1的废水处理上的研究较少[32-34],且存在耐受力低、应用成本高等问题。以往研究中,Wang 等[33]通过紫外线-硫酸二乙酯复合诱变得到了红球菌ΔCPZ 24 对100 mg·L-1NH4+-N 的去除率为81.99%,但并未有更高浓度的进一步实验,且诱变工程菌处理水环境在安全性上存在一定隐患;而张卫艺等[34]使用红平红球菌 (R.erythropolis) 处理猪场废水的NH4+-N 去除率仅为59.35%。本研究的目的是筛选出一株能安全、高效处理工厂化养殖废水的耐高NH4+-N 环境的新型好氧反硝化细菌。本研究从池塘环境中获得的赤红球菌WM28 能在100~500 mg·L-1NH4+-N 质量浓度模拟废水中完全将其去除,700 mg·L-1NH4+-N 在116 h 后被去除88%以上,在第120 小时对初始NH4+-N 质量浓度为1 000 mg·L-1的废水仍有脱氮能力,去除率为74.38%。相较于同属其他降NH4+-N 菌株,WM28在较宽的N 浓度范围内表现出良好的脱氮能力,扩大了其在废水处理中的应用。总之,赤红球菌WM28 在处理高NH4+-N 废水的微生态制剂开发中极具潜力。
4 结论
赤红球菌WM28 是一株抗生素敏感性高、生物安全性强的天然菌株;在3 种单一氮源模拟废水条件下培养48 h,NH4+-N 、NO3--N、NO2--N 的去除率分别为100%、76.3%、66.9%;在高质量浓度100~1 000 mg·L-1模拟NH4+-N 废水条件下的耐受力强,120 h 内NH4+-N 去除率可达74.38%~100%。综上所述,该菌株对N 浓度适应范围广,是一株安全高效的异养硝化-好氧反硝化菌,在处理养殖尾水、工业废水领域具有较好的应用前景。但开发新型的微生物制剂还需要考虑菌株的稳定性,今后可以对菌株继续进行固定化研究,使其能以一定比例在渔业生产尾水中持续存在,实现稳定高效且可循环利用的绿色生产。

