CDK4基因在骨肉瘤细胞中的表达及功能研究
李健雄,韩雨辰,杜祎萌,薛春源,郑亚男,亢小峰,房廖鑫,许 猛,徐小洁,毕文志
1 解放军医学院,北京 100853;2 解放军总医院第四医学中心骨科医学部,北京 100048;3 军事科学院军事医学研究院生物工程研究所,北京 100850;4 解放军总医院京南医疗区,北京 100850
骨肉瘤是一种好发于儿童和青少年骨骼肌肉系统的高度恶性肿瘤,年发病率(2 ~ 4)/1 000 000,致残率和致死率均较高[1-3]。目前初诊无转移的骨肉瘤患者5年总体生存率为65% ~ 75%,由于骨肉瘤异质性较高,对传统化疗药物的反应性不同,有20% ~ 30%的骨肉瘤患者最终会出现复发或转移,因此研究免疫治疗或分子靶向治疗等新治疗方案尤为重要[1-2,4-9]。细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)属于丝氨酸/苏氨酸激酶家族,基因定位于人类染色体12q13,是一种能够调控细胞周期的关键激酶,在G1 ~S期中发挥作用[10]。CDK4可以与细胞周期蛋白D(CyclinD)结合,形成复合物CyclinD-CDK4,促使视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)磷酸化,阻止其与转录因子E2F结合,最终结果是E2F不能充分发挥生长抑制功能,促使细胞周期从G1期转换到S期[11-14]。CDK4促进细胞增殖的作用使其可作为抗癌治疗的靶标[15]。本研究利用GEO数据库中检索得到的基因表达谱数据集,分析CDK4基因在人骨肉瘤MG63细胞系与正常成骨HOB细胞系中的表达水平差异。通过构建CDK4真核表达载体,探索其对骨肉瘤细胞增殖和迁移的影响,为进一步研究CDK4在骨肉瘤中的作用奠定基础。
材料与方法
1 材料 人骨肉瘤细胞系(MG63细胞)、pEGFPC1载体和人乳腺文库由军事医学研究院生物工程研究所细胞工程研究室保存提供;CDK4相关引物(北京博迈德公司);金牌MIX(擎科生物公司);限制性内切酶(EcoRⅠ和BamHⅠ)、T4 DNA连接酶等试剂(TaKaRa公司);质粒提取试剂盒和PCR胶回收试剂盒(Thermo Fisher Scientific公司);转染试剂VigoFect(威格拉斯生物技术有限公司);高糖DMEM细胞培养基(Thermo Fisher Scientific公司);胎牛血清(Biological Industries公司)。
2 数据集的获取和分析 选择GEO数据库(http://www.ncbi.nlm.nih.gov/geo)进行生信分析,在数据库中搜索与骨肉瘤相关的基因表达谱芯片数据。以“osteosarcoma”为关键检索词,限制种属为“homo sapiens”,检索骨肉瘤相关基因表达谱,下载基因表达谱芯片数据集GSE45275,在其中利用R语言分析工具GE02R,以校正后P<0.05为阈值,对比数据集内所包含的两组样品,找出两组之间差异表达的基因。
3 构建pEGFP-CDK4重组质粒并测序 在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网站找到CDK4的基因序列,按照其CDS区序列设计上游引物:5'-CGGAATTCTATGGCTACCTCTCGATATGAG-3';下游引物:5'-CGGGATCCTCACTCCGGATT ACCTTCATC-3'。通过聚合酶链反应(polymerase chain reaction,PCR)扩增CDK4基因。此扩增实验使用人乳腺文库作为模板。将所得产物进行1%琼脂糖凝胶电泳,观察条带是否与预期位置相符。回收产物后用EcoRⅠ和BamHⅠ将其与pEGFPC1空载体进行酶切,用T4连接酶将所得产物进行4 h以上(16℃)的酶连,再将所得产物加入大肠埃希菌感受态细菌DH5α中转化涂板,使用无菌移液枪头移取单克隆菌群,扩增此单克隆菌群。使用菌液PCR实验鉴定所扩增的菌群。将鉴定阳性的克隆继续进行扩增,从中提取质粒并鉴定。
4 蛋白质免疫印迹实验测定CDK4蛋白的表达在6 cm皿中接种骨肉瘤MG63细胞,当密度达到70%左右时,将pEGFP-CDK4与pEGFP-C1质粒分别进行转染。Vigofect (4 µL)转染试剂与0.9%氯化钠注射液(200 µL)加至EP管中混匀,静置5 min,将10 µg的两种质粒分别混匀在0.9%氯化钠注射液中,并补齐至200 µL,而后分别加入静置后的转染试剂溶液并混匀,静置15 min后加入皿中。孵育6 h后更换培养基,孵育24 h后消化细胞收于EP管中,3 000 r/min离心5 min弃掉上清液,加入约沉淀体积3倍量的RIPA裂解液并混匀,置于冰上裂解30 min,加入与RIPA裂解液等体积的2 × SDS溶液并混匀,开始SDS-PAGE电泳。电泳完成后进行转膜。使用5%脱脂奶粉封闭1 h。使用GFP-αm抗体孵育,使用1 × TBST洗膜3次。加入二抗(鼠抗)继续孵育,使用TBST洗膜后显影。
5 免疫荧光实验检测CDK4蛋白在细胞中的定位骨肉瘤MG63细胞接种于6 cm皿中,培养至密度约70%,将pEGFP-CDK4与pEGFP-C1质粒分别转染其中,4 ~ 6 h后更换培养基,常规培养24 h。用胰酶消化细胞,并将其铺于12孔板中,调整细胞密度为30%,贴壁后用1 mL PBS洗涤1次,用4%多聚甲醛于常温下固定30 min,用PBS洗后,将10 µL Triton X-100 + 20 µL NGS溶液混于2 mL PBS溶液中,加入细胞培养皿中,将细胞培养皿置于冰上,将细胞透化10 min。用DAPI染料将细胞核染色,最后用荧光显微镜观察蛋白的表达。
6 CCK-8实验测定CDK4蛋白对细胞增殖的作用 转染pEGFP-CDK4与pEGFP-C1质粒于骨肉瘤MG63细胞中,4 ~ 6 h后更换培养基,常规培养24 h后接种于96孔板,细胞密度3 000/孔,每组样品设3复孔,待细胞贴壁后,于每孔加入DMEM∶CCK-8(9∶1) 100 µL混合液,放于细胞培养箱中孵育1 h,取上清液,检测样品OD450值。转染后的4 d,每天都在同一个时间点对细胞进行检测,记录检测数值。
7 克隆形成实验检测CDK4蛋白对细胞增殖的作用 将已表达CDK4蛋白的MG63细胞和转染pEGFP-C1质粒的MG63细胞以2 000/孔的细胞密度接种于6孔板中。每组样品重复设置3个平行孔。细胞培养14 d后,用4%多聚甲醛溶液固定细胞,结晶紫染色,观察染色后细胞克隆的大小及数目。
8 划痕实验检测CDK4蛋白对细胞迁移的作用将稳定转染pEGFP-CDK4与pEGFP-C1质粒的骨肉瘤MG63细胞接种于6孔板中,当细胞密度增至90%左右时,用200 µL无菌枪头垂直于孔板快速划出一条直线,PBS洗涤去除悬浮细胞后,用不含胎牛血清的培养基继续培养,于划线后0 h和24 h在固定的点拍照观察细胞迁移情况,并用Image J软件进行测量。
9 统计学分析 采用SPSS 23.0软件进行统计学分析。pEGFP-CDK4对骨肉瘤MG63细胞增殖能力的影响采用双因素方差分析并用Bonferroni法进行多重比较,采用独立样本t检验比较两组其他数据。P<0.05为差异有统计学意义。
结 果
1 CDK4基因在骨肉瘤细胞中表达水平高于正常成骨细胞 基因表达谱芯片数据集 GSE45275由Hospital for Sick Children采用GPL16814芯片平台完成,采用的数据样本为骨肉瘤MG63细胞系及成骨细胞HOB细胞系(各7个重复)。使用GE02R工具进行差异基因的筛选,以Padj<0.05为条件,从GSE45275芯片中筛选出共17个差异基因。其中在骨肉瘤中显著上调表达的有15个(CDC5L、MYC、CDK4、RB1、FOS、SPARC、WWOX、PTEN、MT-ATP6、CDKN1C、HMBS、MT-CO1、RECQL4、MDM2、BCL2L1),下调表达的有2个(CDKN1A、RUNX2_P1),见图1。其中CDK4在骨肉瘤MG63细胞系样本中表达平均值(1480.1)显著高于在正常成骨细胞HOB细胞系的表达平均值(342.9),见图2。
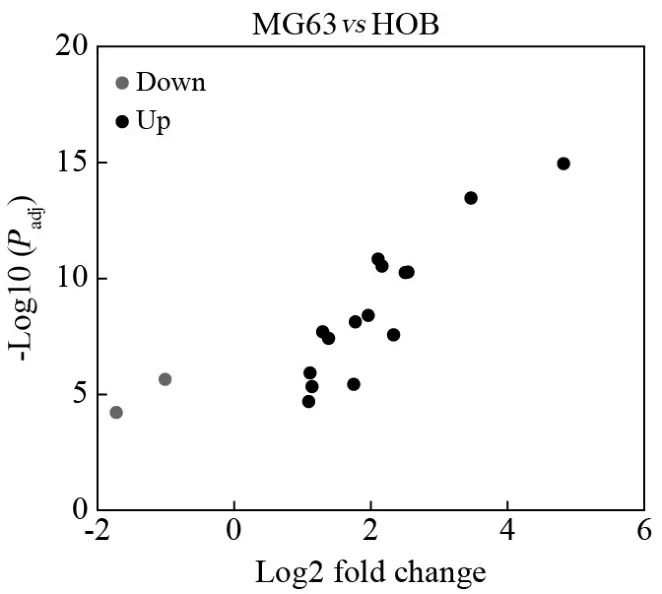
图1 MG63细胞和HOB细胞间的基因差异表达情况Fig.1 The differentially expressed genes between osteosarcoma cell line MG63 and osteoblast cell line HOB
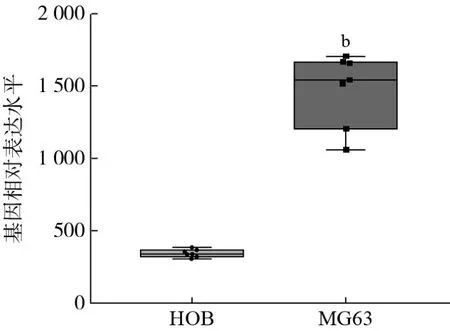
图2 CDK4基因在HOB细胞与MG63细胞间表达水平的对比(bP<0.01,vs HOB)Fig.2 Comparison of CDK4 gene expression between HOB and MG63 cell line (bP<0.01, vs HOB)
2 pEGFP-CDK4重组质粒的构建与鉴定 用PCR技术对CDK4进行扩增,电泳后,于约912 bp的位置出现明亮条带(图3)。经过回收PCR产物、酶切、酶连、菌液PCR(图4)、双酶切,产物进行电泳后可以显示两个条带,分别在约5 000 bp和约912 bp处(图5),与载体和目的基因的大小位置相吻合。所提取的质粒检测其碱基序列,结果显示其碱基序列为正确序列,因此可以得出重组质粒构建成功的结论。

图3 PCR扩增人CDK4基因Fig.3 PCR amplification of CDK4 gene
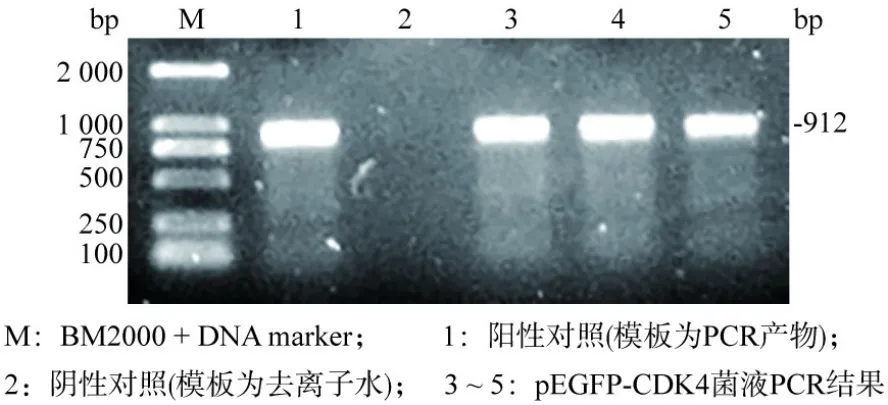
图4 对重组质粒pEGFP-CDK4进行菌液PCR后鉴定结果Fig.4 PCR identification of recombinant plasmid pEGFP-CDK4 in bacterial liquid

图5 对重组质粒pEGFP-CDK4进行双酶切电泳的结果图Fig.5 The result of double enzyme digestion for recombinant plasmid pEGFP-CDK4 by gel electrophoresis
3 Western blot检测pEGFP-CDK4蛋白表达 于MG63细胞中转染pEGFP-CDK4和pEGFP-C1质粒,24 h后裂解收集蛋白,用蛋白质免疫印迹检测CDK4蛋白表达情况。结果显示,转染pEGFPC1质粒的样品表达的条带出现在相对分子质量约27 × 103kU处;转染pEGFP-CDK4质粒的样品表达的条带出现在相对分子质量约61 × 103kU处,说明构建出的质粒可表达pEGFP-CDK4蛋白(图6)。
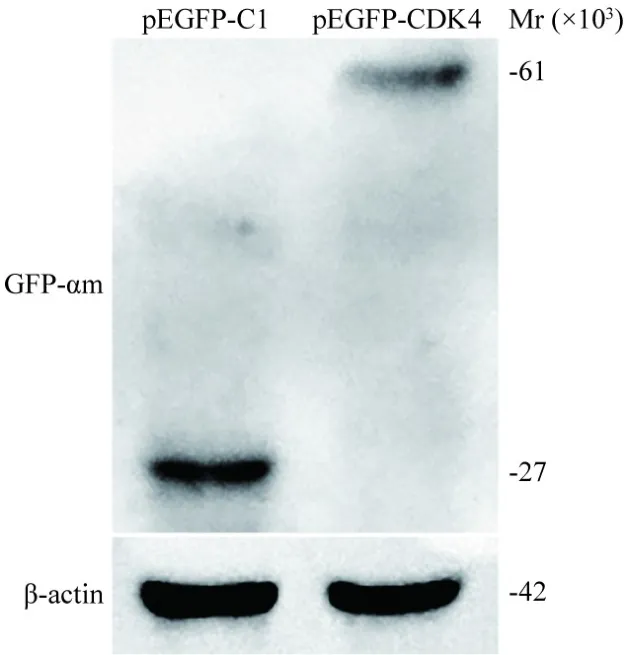
图6 蛋白质免疫印迹验证pEGFP-CDK4的蛋白表达Fig.6 The identification of pEGFP-CDK4 using western blot analysis
4 CDK4定位于MG63细胞的细胞核 转染pEGFP-CDK4重组质粒进入MG63细胞中,待表达后,用荧光显微镜观察pEGFP-CDK4在细胞内的荧光定位。结果显示,在荧光显微镜下pEGFPCDK4分子表达的绿色荧光与DAPI染色细胞核的蓝色荧光呈现显著的重合,并且在细胞质中无明显可见的绿色荧光。综上所述,CDK4定位于MG63细胞的细胞核中(图7)。
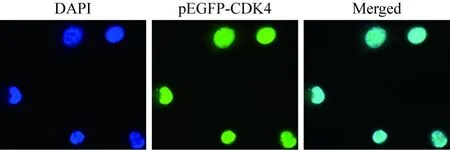
图7 CDK4蛋白在MG63细胞内定位的荧光显微镜图片(400×)Fig.7 Fluorescence images of CDK4 in MG63 cells (400×)
5 CDK4基因促进骨肉瘤细胞增殖 在96孔板中接种转染pEGFP-CDK4质粒的骨肉瘤MG63细胞,并以转染pEGFP-C1质粒的MG63细胞作为对照组。每天检测两组细胞的OD450值并计算存活率,根据4 d内的细胞存活率数值绘制细胞生长曲线。生长曲线显示,从第2天开始,转染pEGFPCDK4质粒的MG63细胞的OD450值显著高于转染pEGFP-C1质粒细胞的OD450值。CCK-8实验证明,CDK4基因可促进骨肉瘤细胞的增殖(图8)。
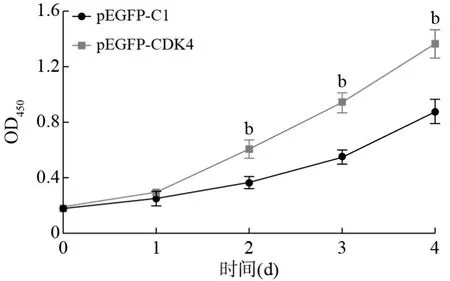
图8 转染pEGFP-CDK4及pEGFP-C1质粒后细胞0 ~ 4 d的生长曲线(bP<0.01,vs pEGFP-C1)Fig.8 CCK-8 results of cells transfected with pEGFP-CDK4 and pEGFP-C1 plasmids within four days (bP<0.01, vs pEGFP-C1)
6 CDK4基因增强骨肉瘤细胞的克隆形成 将pEGFP-CDK4和pEGFP-C1质粒转染于MG63细胞中,转染完成后对细胞进行计数,以3 000/孔的细胞密度接种于35 mm的培养皿中,2周后观察克隆形成的数目。结果显示,转染pEGFP-CDK4的细胞形成的平均克隆数显著高于转染pEGFPC1的细胞形成的平均克隆数(图9)。
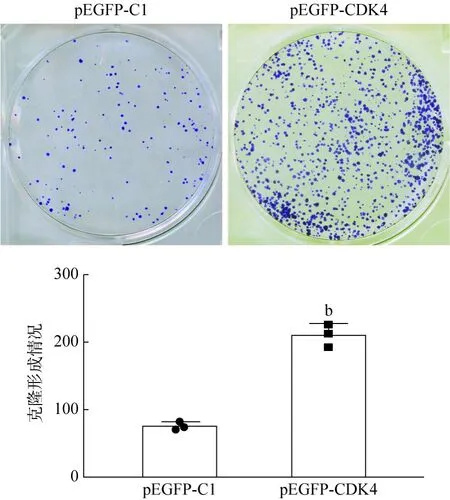
图9 转染pEGFP-CDK4及pEGFP-C1质粒后细胞平板克隆形成情况(bP<0.01,vs pEGFP-C1)Fig.9 Colony formation assay of cells transfected with pEGFPCDK4 and pEGFP-C1 plasmids (bP<0.01, vs pEGFP-C1)
7 CDK4基因增强骨肉瘤细胞的迁移能力 将pEGFP-CDK4和pEGFP-C1质粒转染于MG63细胞中,划痕后观察24 h后细胞的迁移情况。结果显示,转染pEGFP-CDK4后骨肉瘤MG63细胞的迁移能力显著增强(图10)。

图10 转染pEGFP-CDK4及pEGFP-C1质粒后细胞迁移能力变化(bP<0.01,vs pEGFP-C1)Fig.10 Cell migration ability of cells transfected with pEGFPCDK4 and pEGFP-C1 plasmids by scratch assay (bP<0.01,vs pEGFP-C1)
讨 论
CyclinD-CDK4-Rb信号通路是最重要的细胞周期调节通路之一,在细胞增殖过程中发挥了重要作用[14,16-17]。CDK4作为细胞分裂的正向调节因子,已被确定为乳腺癌、脂肪肉瘤、黑色素瘤和胶质母细胞瘤等的潜在治疗靶标,由此研发出的CDK4抑制剂或特异性小干扰RNA已成为治疗多种恶性肿瘤的候选药物[11,15,17-19]。有研究报道证实,CDK4在骨肉瘤组织样本和细胞系中高表达,主要表达在细胞核中,并且已经在骨肉瘤细胞系U2OS和KHOS中进行了验证[18]。在前期研究的基础上,我们利用GEO数据库中与骨肉瘤相关的基因表达谱芯片数据,对比数据集内两组样品骨肉瘤MG63细胞系及正常成骨细胞HOB细胞系的差异基因表达情况,发现CDK4在MG63细胞系中的表达水平显著高于HOB细胞系。我们通过荧光显微镜观察到,CDK4定位于MG63细胞的细胞核中,进一步证实和扩展了前期研究成果,提示我们CDK4可能在骨肉瘤的进展中发挥着关键作用。于是我们通过构建稳定转染pEGFP-CDK4和pEGFP-C1质粒的骨肉瘤MG63细胞证实,CDK4过表达可能促进骨肉瘤MG63细胞的增殖和迁移。骨肉瘤患者死亡的主要原因是肿瘤的远处转移和局部复发,增殖和迁移是骨肉瘤细胞恶性生物学行为的重要基础,鉴于CDK4对骨肉瘤细胞增殖和迁移的重要作用,CDK4可作为骨肉瘤治疗的潜在新靶点。
目前,CDK4抑制剂联合内分泌治疗已经广泛应用于乳腺癌的抗肿瘤治疗[12,20]。美国食品与药品监督管理局已经批准的CDK4抑制剂包括Palbociclib、Ribociclib和Abemaciclib等,均可以用于雌激素受体阳性/人表皮生长因子受体2阴性的进展期乳腺癌患者的治疗[17,19,21-23]。一些研究表明,CDK4抑制剂联合雌激素受体拮抗剂可以显著延长此类乳腺癌患者的无进展生存期[24-27]。此外,Palbociclib等CDK4抑制剂也被应用于脂肪肉瘤等肉瘤的临床治疗中。二期临床试验结果表明,Palbociclib在低不良反应程度的剂量下,能够延长分化好/去分化脂肪肉瘤患者的无进展生存期,中位无进展生存期可达17.9周[28]。
CDK4抑制剂在骨肉瘤等肉瘤治疗中的探索仍处于初期阶段[10,29-32],目前关于骨肉瘤和CDK4基因的研究关注的是CDK4基因和MDM2基因在骨肉瘤中的表达和临床意义。研究表明,在高级别骨肉瘤或低级别骨肉瘤的去分化区域,CDK4和MDM2共同高表达,在骨膜骨肉瘤、皮质旁骨肉瘤等低级别骨肉瘤中也可特异性表达,用于辅助影像学/临床表现不典型或样本量有限病例的病理诊断。此外,CDK4在转移性骨肉瘤组织中的表达水平显著高于非转移性骨肉瘤组织,且在转移灶中的表达水平显著高于原发灶。以上研究表明CDK4高表达与骨肉瘤患者预后不良相关[18,33-35]。本实验通过构建pEGFP-CDK4重组质粒,从CDK4的功能出发,验证了CDK4对骨肉瘤增殖和迁移的关键作用。以上结果表明CDK4在骨肉瘤的发生发展中起着重要作用,值得进一步研究。
因此,本研究成功构建出pEGFP-CDK4重组质粒,将pEGFP-CDK4质粒转染至骨肉瘤MG63细胞中。蛋白质免疫印迹结果表明pEGFP-CDK4成功转染至骨肉瘤细胞中并表达,免疫荧光验证CDK4定位在MG63细胞的细胞核中。CCK-8实验、克隆形成实验及划痕实验的结果,都证明了过表达CDK4可以增强MG63细胞的增殖和迁移能力。本研究内容验证了CDK4基因在骨肉瘤中的关键作用,为今后进一步研究CDK4抑制剂在增强骨肉瘤治疗效果中的作用奠定了重要的研究基础。
作者贡献李健雄、韩雨辰:文献调研,实验实施,文章撰写;杜祎萌:协助文献调研,实验实施;薛春源、郑亚男、亢小峰、房廖鑫:协助实验实施;毕文志、徐小洁、许猛:论文选题,实验指导,文章审阅及修改。
利益冲突所有作者声明无利益冲突。
数据共享声明本论文相关数据可依据合理理由从作者处获取,Email:ljianxiong301@163.com。

