西妥昔单抗对A-431细胞系增殖和凋亡的影响
殷祥烨,姜伟乾,韩愚弟,韩 岩
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心整形修复科,北京 100853
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)是由表皮角质形成细胞恶性增殖引起的一种皮肤恶性肿瘤[1]。在所有皮肤癌中,其发病率仅次于基底细胞癌,病死率仅次于黑色素瘤[2]。近年来,cSCC的发病率呈显著上升趋势,高龄、日光照射等常见因素均可诱发cSCC,给人们的健康带来了极大的威胁[3-4]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议,对于无法接受手术治疗的晚期cSCC患者,其治疗方案首选为放疗联合顺铂的整体治疗方案,不能接受放疗者可采用帕博利珠单抗或西米普利单抗进行免疫治疗。靶向治疗方案虽具有良好的安全性和有效性,但因缺乏临床试验结果,目前仍未被列入cSCC的指南和共识[5]。表皮生长因子受体(epidermal growth factor receptor,EGFR)在多种恶性肿瘤中处于高表达状态,对肿瘤细胞的增殖、分化起重要作用[6]。西妥昔单抗(cetuximab,Cet)是一种单克隆抗体药物,对EGFR具有高特异性。鉴于其优秀的抗肿瘤效果和出色的安全性,已被用于转移性结直肠癌、晚期头颈部鳞状细胞癌的治疗[7-8]。有研究表明,EGFR在cSCC中为高表达状态,通过下调EGFR的表达可抑制cSCC细胞的增殖、迁移和侵袭,从而发挥抗肿瘤效应[9]。据此,本研究拟探讨Cet对高表达EGFR的皮肤鳞状细胞癌细胞A-431增殖和凋亡的影响,以期为临床中无法接受手术治疗的cSCC患者提供一种安全有效的治疗可能。
材料与方法
1 细胞系及细胞培养 皮肤鳞状细胞癌细胞A-431购自武汉普诺赛公司,人永生化表皮细胞Ha-Cat购自湖南丰晖生物科技有限公司。A-431细胞在添加10%(V/V)胎牛血清、100 µg/mL青霉素和100 µg/mL链霉素的DMEM高糖(4.5 g/L葡萄糖)培养基中培养,HaCat细胞在添加10%(V/V)胎牛血清、100 µg/mL青霉素和100 µg/mL链霉素的DMEM低糖(1.0 g/L葡萄糖)培养基中培养。所有细胞均在37℃,5% (V/V) CO2条件下培养。当细胞融合度达到80%时,用0.25%胰蛋白酶消化细胞,传代培养或接种于细胞板中进行后续实验。
2 主要试剂 Cet购自德国默克公司。Annexin V-FITC和碘化丙啶(PI)检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司。3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)、Dimethyl sulfoxide (DMSO)购自上海阿拉丁生化科技股份有限公司。DMEM高糖培养基(4.5 g/L葡萄糖)、DMEM低糖培养基(1.0 g/L葡萄糖)购自美国Corning公司。青霉素-链霉素、胰蛋白酶、胎牛血清(fetal calf serum,FBS)购自美国Gibco公司。抗EGFR抗体购自武汉赛维尔生物科技有限公司,抗GAPDH抗体购自美国CST公司。RIPA裂解缓冲液及BCA蛋白检测试剂盒购自上海碧云天生物技术有限公司。
3 主要仪器 CO2恒温细胞培养箱(美国Thermo Scientific),超净工作台(天津泰斯特公司),Spectra Max M8酶标仪(美国MD公司),凝胶电泳仪(美国Bio-Rad公司),Tanon 4800 全自动化学发光图像分析系统(上海天能生命科学有限公司),Cytomics FC 500流式细胞仪(美国Beckman公司)。
4 细胞EGFR表达量筛查分析 运用人类蛋白质图谱数据库(https://www.proteinatlas.org),筛查并分析其所收录的41种正常组织和肿瘤细胞系中EGFR的表达情况。
5 Western blot检测EGFR蛋白表达 向A-431细胞和HaCat细胞中加入RIPA裂解缓冲液,冰上裂解30 min。12 000 r/min离心15 min,提取A-431细胞和HaCat细胞蛋白,应用BCA蛋白检测试剂盒检测蛋白浓度。在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上分离等量的蛋白质,并通过凝胶电泳仪转移到PVDF膜上。应用含5%脱脂牛奶的TBS-T溶液封闭PVDF膜1 h,随后与EGFR一抗及GADPH一抗孵育过夜。最后,将PVDF膜洗涤3次,并与辣根过氧化物酶偶联抗体在室温下孵育2 h。Western blot图像采用Gel成像系统,在膜顶部添加200 µL ECL化学发光试剂,检测目的蛋白条带。
6 细胞毒性实验 将A-431细胞以8 × 103/孔的细胞密度接种于96孔板中,培养12 h。实验组用Cet以0.025 µg/mL ~ 200 µg/mL的浓度处理细胞48 h,对照组加入同等体积的PBS溶液。在每孔中加入10 µL的MTT (5 mg/mL),继续培养细胞4 h,吸弃上清液体,每孔中加入200 µL的DMSO溶液,37℃恒温条件下中低速震荡10 min,使甲瓒结晶充分溶解,应用酶标仪于490 nm和570 nm波长处测量各孔的吸光度值,并计算各药物浓度下的细胞存活率。细胞存活率=[(实验孔-对照孔)/(对照孔-空白孔)] × 100%[10]。
7 细胞凋亡检测 将A-431细胞接种于12孔板上(3 × 105/孔)。孵育12 h后,分别用PBS、Cet(150µg/mL)处理细胞24 h。消化、收集各组细胞,离心去除上清液,以PBS洗涤细胞,应用1 ×binding buffer重悬细胞,先后加入Annexin V-FITC和PI,在37℃条件下避光孵育15 min。即刻用流式细胞术检测细胞凋亡情况。
8 统计分析方法 本研究的每个实验均重复3次,计量资料以表示。数据通过Graphpad Prism 8软件进行分析处理。组间比较采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
结 果
1 EGFR在A-431细胞中的表达情况 A-431细胞来源于1例85岁的老年女性cSCC患者,是目前应用最广泛、最具代表性的商品化cSCC细胞系[11]。为研究A-431细胞中EGFR的表达情况,我们对人类蛋白质图谱数据库中收录的41种正常组织及肿瘤细胞系的EGFR表达情况进行了筛查分析。结果表明,在所有正常及肿瘤组织细胞中,A-431细胞的EGFR表达量排名第1,且远高于其余各种细胞(图1A)。随后,我们通过Western blot实验对培养的A-431细胞及对照组HaCat细胞进行了EGFR表达情况的对比。结果表明,A-431细胞中EGFR的表达量远高于HaCat细胞(图1B)。以上实验结果均表明,皮肤鳞状细胞癌细胞A-431的EGFR呈高表达状态,且表达量远高于正常表皮及器官组织细胞,是研究Cet靶向治疗皮肤鳞状细胞癌的最优选择。
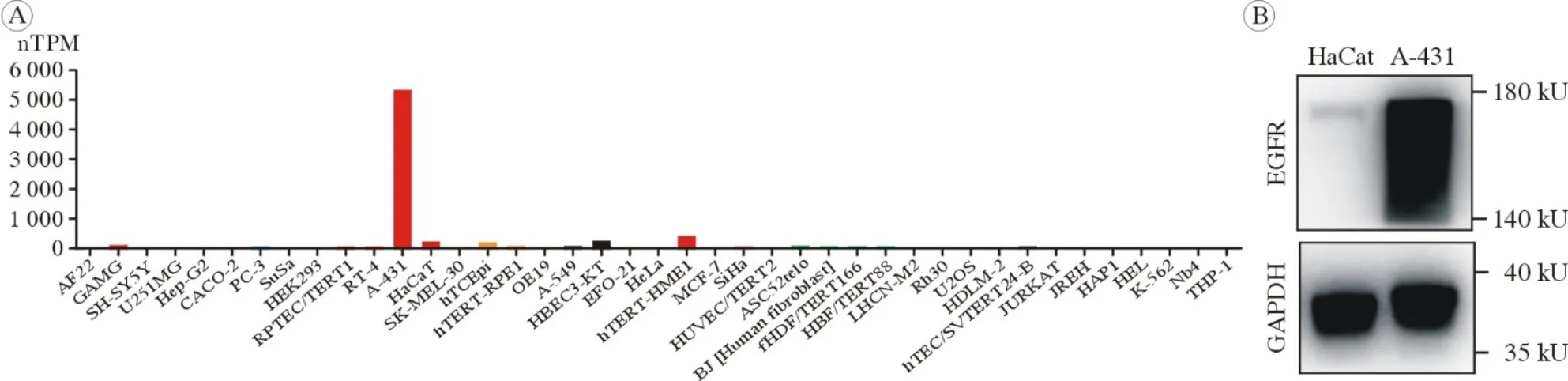
图1 EGFR在各种细胞中的表达情况 A:人类蛋白质图谱数据库中收录的41种正常组织及肿瘤细胞系的EGFR表达鉴定;B:Western blot检测A-431细胞及HaCat细胞EGFR表达情况Fig.1 Expression of EGFR in cells A: Identification of EGFR expression in 41 normal tissues and tumor cell lines included in human protein map database; B: Expression of EGFR in A-431 and Hacat cells detected by Western blot
2 MTT法检测Cet对A-431细胞增殖的影响MTT结果显示,用Cet (0.025 µg/mL、0.25 µg/mL、2.5 µg/mL、25 µg/mL、50 µg/mL、100 µg/mL、200 µg/mL)处理A-431细胞48 h,A-431的细胞生存率随Cet浓度的增加而降低。在200 µg/mL Cet浓度下,A-431的细胞生存率仅为38.65%(P<0.01;图2)。这表明与对照组相比,Cet可显著抑制A-431细胞增殖,充分发挥单药抗肿瘤作用。

图2 Cet对皮肤鳞状细胞癌细胞A-431增殖的影响Fig.2 Effect of Cet on the proliferation of A-431 cells detected by MTT assay
3 流式细胞术检测Cet对A-431细胞凋亡的影响我们通过Annexin V-FITC和碘化丙啶(PI)双染法在A-431细胞中对不同组别的细胞凋亡情况进行了分析。结果表明,Cet组在150 µg/mL浓度下,细胞凋亡率达29.85%,而空白对照组的细胞凋亡率为10.44%(P<0.01;图3A、图3B)。实验结果表明,Cet可通过影响细胞凋亡相关蛋白发挥其抗肿瘤效应。

图3 Cet对皮肤鳞状细胞癌细胞A-431凋亡的影响A:流式细胞术检测Cet及对照组处理后A-431细胞的凋亡情况;B:A-431细胞凋亡率统计Fig.3 Effect of Cet on apoptosis of A-431 cellsA: Apoptosis of A-431 cells detected by flow cytometry; B: Statistics of apoptosis rate of A-431 cells
讨 论
cSCC是发病率最高的皮肤恶性肿瘤之一,男性发病率为9% ~ 14%,女性发病率为4% ~ 9%[12]。由于人口寿命延长以及多种因素(如日光照射等常见致癌)的影响,近些年cSCC患病率显著增加[13]。虽然大部分cSCC患者可通过切除肿瘤或局部放疗的方式获得良好预后,但也有一部分患者表现出局部浸润和转移的倾向[14]。美国明尼苏达州的一项研究表明,cSCC的局部复发通常发生在初次诊断后的2年内。手术切除后,具有高风险特征的患者有13% ~ 41%的局部区域复发率和7% ~ 16%的远处转移率,而涉及淋巴结转移的cSCC患者10年生存率低于20%[15]。
考虑到种种不良预后,人们单独提出了晚期cSCC的概念[16]。晚期cSCC包括局部晚期cSCC(lacSCC)和(或)转移性cSCC (mcSCC)。lacSCC定义为局部晚期进展(肿瘤已深入到皮下组织、肌肉或神经)且不再适合行手术或放射治疗的cSCC。mcSCC是指已经扩散到原始位置外的相邻皮肤、淋巴结或其他器官的肿瘤类型[17-18]。NCCN指南指出,手术治疗是目前根治cSCC的首选方法[5],但部分晚期cSCC患者无法通过手术得到有效治疗[17]。随着cSCC发病率的不断提高,疑难、晚期的病例愈发多见,晚期cSCC患者治疗方式的选择在过去10年中发生了重大变化。
考虑到疾病严重程度、肿瘤位置和患者合并症等因素,目前晚期cSCC患者大多采用基于顺铂的化学疗法或姑息性治疗方案。不过这类治疗方法持续时间长、不良反应程度重,严重影响了患者的依从性,从而限制了治疗效果[5,19]。随着免疫治疗、靶向治疗等新兴治疗方式的出现,晚期cSCC患者的治疗有了新的选择。与传统化疗药物相比,这些药物具有程度更轻的不良反应,在晚期疾病患者中可能具有更好的治疗有效性和耐受性[20]。
EGFR是一种致癌受体蛋白酪氨酸激酶,可启动多种细胞内信号通路。EGFR过表达与肿瘤细胞存活、增殖、侵袭和转移密切相关,已在多种类型的恶性肿瘤中观察到了EGFR的高表达[21]。目前,基于抗EGFR的靶向治疗方案已成为结直肠癌等诸多高表达EGFR实体瘤的一线治疗选择[22]。为探究EGFR在cSCC中的表达情况,有研究者通过免疫组织化学染色的方式对cSCC组织样本进行研究,结果表明EGFR在85.7%的cSCC细胞中过度表达[16]。此外,据文献报道,EGFR的表达在cSCC增殖、侵袭和转移中发挥重要作用,与cSCC患者的不良预后密切相关[23-24]。目前已有多项实验研究表明,抑制EGFR的表达可作为cSCC的有效治疗策略[9,25-26]。
Cet是一种嵌合免疫球蛋白G1单克隆抗体,与EGFR的外部域结合后可诱导EGFR内化和降解,阻断细胞内信号转导途径,从而抑制肿瘤细胞的增殖,诱导癌细胞的凋亡[27]。鉴于其优异的安全性和抗肿瘤作用,已被批准用于RAS基因野生型转移性结直肠癌(2005年)以及晚期头颈部鳞状细胞癌(2020年)的治疗中。虽然Cet的疗效和安全性已在结直肠癌和头颈部鳞状细胞癌的治疗中得到证实,但目前有关Cet治疗cSCC的研究还相对缺乏,其对cSCC细胞增殖和凋亡的影响尚不明确。
本研究通过人类蛋白质图谱数据库筛查分析发现,EGFR在A-431细胞中的表达远超其余各种细胞,是EGFR表达量最高的细胞。我们通过Western blot实验,对比了A-431细胞和HaCat细胞中EGFR的表达情况。结果显示, 与HaCat相比,A-431细胞中EGFR确实为高表达状态。这一结果也与文献报道的cSCC中EGFR表达情况高度一致,符合Cet靶向治疗的基本条件,为后续实验的开展奠定了基础。
抑制肿瘤细胞增殖和诱导细胞凋亡是Cet抗肿瘤的主要作用方式。在我们的研究中,MTT结果显示随着Cet浓度的提高,A-431细胞的生存率逐渐降低,200 µg/mL的Cet浓度处理48 h后,A-431的细胞生存率仅为38.65%(P<0.01)。该结果充分表明,Cet单药可对A-431细胞的增殖造成影响,且药物对肿瘤细胞杀伤能力呈浓度依赖性。我们在应用流式细胞术分析Cet诱导A-431细胞凋亡的研究中发现,150 µg/mL的Cet浓度处理24 h后,有29.85%的A-431细胞凋亡,是对照组细胞凋亡率的2.86倍(P<0.01)。这说明Cet单药使用时,可通过影响细胞凋亡途径相关通路,诱导A-431细胞凋亡,从而起到抗肿瘤作用。
综上,我们证明了Cet对EGFR高表达的皮肤鳞状细胞癌细胞A-431有较强的增殖抑制作用,并可诱导A-431细胞凋亡,有望成为晚期cSCC治疗的新选择。但Cet治疗cSCC的具体作用机制仍需进一步探究,并且需临床试验进一步验证其安全性和药物疗效。
作者贡献殷祥烨:完成实验,论文撰写;姜伟乾、韩愚弟:论文修改;韩岩:论文的选题、审阅及修改。
利益冲突所有作者声明无利益冲突。
数据共享声明本论文相关数据可依据合理理由从作者处获取,Email:xiangyeyin301@163.com。

