DEB-TACE与cTACE治疗中晚期原发性肝癌的肿瘤缓解率、肝功能及不良反应比较
庞义红,王晶晶,崔晓静
(河南大学第一附属医院感染疾病科,河南 开封 475000)
原发性肝癌(hepatocellular carcinoma,HCC),其总体生存率比乳腺癌、结直肠癌、肺癌相比较差很多,尤其绝大多数患者确诊时肝癌已处于癌症中晚期阶段,且此类患者5年内生存率极低[1-2]。肝动脉化疗栓塞(cTACE)作为一种广泛的抗肿瘤介入疗法,对于肝脏外科手术不具耐受性的患者,是一种理想的替代治疗措施[3]。载药微球肝动脉化疗栓塞(DEB-TACE),通过以聚乙烯醇为主材,利用载药微球及化疗药物分子结构中的阴阳离子相互作用搭载药物,形成具有一定变型性质的蓝色球体,与cTACE两者载药机制相同,载药规格相同,但DEB-TACE载药能力增加,因而其理论上可实现对肿瘤部位的持久化疗[4-5]。因其造价昂贵,且临床实际效果研究资料缺乏,故而无法在患者群体中广泛普及。基于上述两种不同的化疗方式,本研究将通过回顾性分析我院收治的92例中晚期HCC患者展开研究探讨,现将结果报道如下。
1 一般资料与方法
1.1 一般资料
回顾性分析河南大学第一附属医院2019年6月至2022年10月期间收治的92例原发性中晚期肝癌患者,依据不同治疗方法分为DEB-TACE组(44例),cTACE组(48例)。两组患者性别(男/女)分别为(28/16)例和(28/20)例,χ2=0.271,P>0.05;两组患者平均年龄分别为65~80(76.85±1.25)岁和66~81(76.55±1.35)岁,t=1.103,P>0.05;两组患者ECOG评分(2/3/4)分别为(12/16/16)例和(16/20/12)例,χ2=1.416,P>0.05[6];两组患者和Child-Pugh分级(A级/B级)分别为(22/22)例和(26/22)例,χ2=0.159,P>0.05;两组患者肿瘤最大径(≤10 cm/>10 cm)分别为(20/24)例和(21/27)例,χ2=0.027,P>0.05;两组患者一般资料均衡可比。
1.2 纳入与排除标准
纳入标准:(1)所有HCC患者均符合中华人民共和国国家卫生健康委员会医政医管局制定的《原发性肝癌诊疗指南(2022年版)》诊断标准,诊断为HCC中晚期患者[7];(2)Child-Pugh A或B级患者[8];(3)既往均未接受过外科手术治疗;(4)经CT扫描判断肿瘤最大径大于5 cm。排除标准:(1)因存在过敏史等禁忌症而无法耐受抗肿瘤药物治疗者;(2)合并肝肾功能严重不足者;(3)合并存在血液系统疾病者;(4)实验期间因毒副作用导致停药且停药时间超过研究周期或改用其他药物者;(5)放弃治疗或失访者。
1.3 治疗方法
1.3.1 DEB-TACE疗法
DEB-TACE组患者行DEB-TACE术。患者均采用仰卧位,术中予以心电监护。载药微球选择100~300 μm国产CalliSpheres,用20 mL注射器抽取约6 mL,吸出后静置30 min;将上清液推出,余量约占5 mL;用5 mL注射器抽吸葡萄糖溶液等比例混合稀释注射用盐酸表柔比星(商品名:法玛新,辉瑞制药有限公司,国药准字H20000496)50 mg,充分混合,每5 min摇匀1次,再按等比例注入碘佛醇,摇晃均匀备用。于股动脉通过塞尔丁格法穿刺,至肝动脉附近行远端造影[8],通过影像检查HCC病灶部位与血管流向分布后,将抽吸混合均匀的载药微球用1 mL注射器缓慢匀速从供血动脉注入,以1 mL/min的速度注射药液,通过观察造影情况,当造影剂流速出现减缓或停滞时停止注射。5 min后再次进行血管造影,观察肿瘤供血血管是否栓塞完全,确认栓塞妥当后拔除套管,同时对穿刺点位进行加压包扎止血,并嘱患者卧床尽量保持6 h内静止,同时术后12 h密切检测生命体征,无明显导演后可活动,同时对患者行保肝、护胃治疗。
1.3.2 cTACE疗法
cTACE组造影方法步骤同DEB-TACE组。将表柔比星50 mg与等比例罂粟乙碘油充分混合乳化,加入非离子型对比剂,透视下缓慢推入肿瘤供血动脉,直至造影中观察到对应靶血管出现血流中断或肿瘤染色消失,若仍可见肿瘤供血血管,则肿瘤供血动脉填入明胶海绵颗粒,颗粒直径为(300~500 μm),观察是否栓塞完全,待栓塞完全后,将血管鞘、导管撤出,其余方法同DEB-TACE组。
1.4 观察指标
(1)于术后3个月对两组患者走访,根据改良实体瘤疗效评价标准(mRECIST)对肝癌患者的疗效进行评价。按照mRECIST标准,疗效可分为完全缓解(complete remission,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100 %,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%;(2)于术前、术后7 d采取两组患者肘静脉血5 mL,通过血液生化检查等项目检测患者肝功能[谷草转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(tTBIL)、间接胆红素(IBIL)、白蛋白(ALB)]水平;(3)于术前、术后7 d、术后3个月3个时间点分别采取患者肘静脉血3 mL,采用放射免疫分析法检测并记录两组患者甲胎蛋白(AFP)变化情况;(4)记录两组患者术后治疗期间内存在的毒副作用发生率,包括术后康复期间出现的贫血、恶心呕吐、发热、消化道反应现象。
1.5 统计学方法
所有数据应用SPSS 21.0软件进行统计学分析。所有数据以均数±标准差表示,治疗前后组内比较采用自身配对t检验,治疗前后组间比较采用差值进行独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术后肿瘤缓解率比较
术后3个月,DEB-TACE组患者ORR为75.00%,cTACE组ORR为50.00%,两组患者ORR差异存在统计学意义(P<0.05);DEB-TACE组患者DCR为86.36%,cTACE组DCR为81.25%,两组患者DCR差异无统计学意义(P>0.05),见表1。
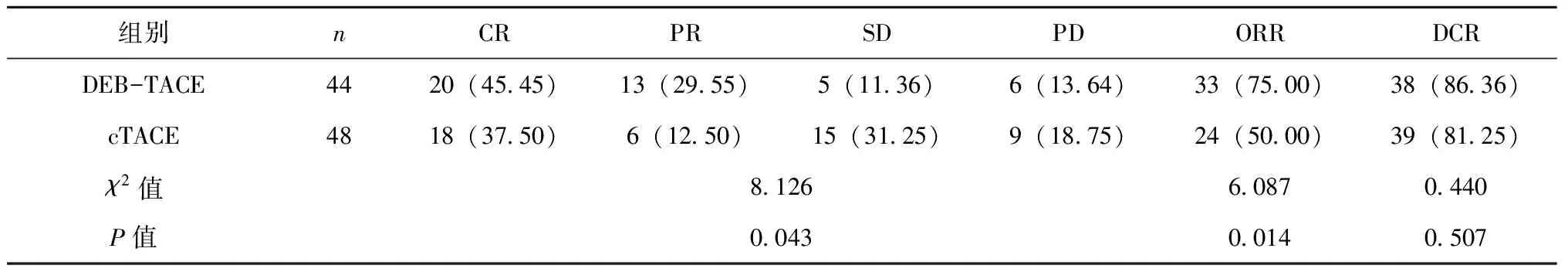
表1 两组患者疗效对比[n(%)]
2.2 两组患者术前术后肿瘤标志物比较
术前,两组患者组间AFP水平差异无统计学意义(P>0.05),术后7 d、3个月两组患者AFP水平均有下降,且DEB-TACE组患者术后7 d、3个月两时间点AFP水平均明显低于cTACE组患者,差异有统计学意义(P<0.05),见表2。
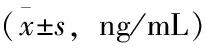
表2 两组患者AFP比较
2.3 两组患者肝功能比较
术前,两组患者肝功能各项指标差异无统计学意义(P>0.05);术后7 d,两组患者肝功能各项指标较术前均有下降,DEB-TACE组患者肝功能呢各项指标均低于cTACE组患者明显下降,差异均具有统计学意义(P<0.05),见表3、表4。
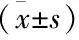
表3 两组患者肝功能转氨酶水平比较
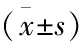
表4 两组患者肝功能胆红素与白蛋白水平比较
2.4 两组患者毒副作用比较
治疗观察期间,两组患者术后毒副作用发生率差异均无统计学意义(P>0.05),见表5。
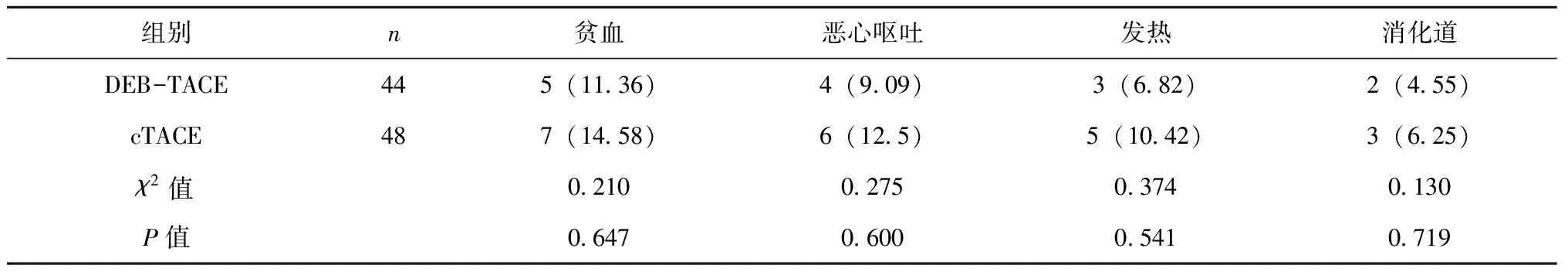
表5 两组患者毒副作用比较[n(%)]
3 讨 论
HCC作为我国临床常见的恶性肿瘤疾病之一,其发病率在我国与肺癌的胃癌等恶性肿瘤发病率均较高,对患者生存质量影响极大。且由于HCC发病具有隐匿性,在疾病早期难以发现,诊断发现时多数已经进入中晚期,错失临床最佳手术时机。随着科学技术的深入发展,临床上通过血管造影技术可以实现肿瘤染色判断肿瘤区间,进而方便患者进行TACE手术介入治疗[9]。TACE作为常规治疗方法,可通过对血管进行栓塞,从而达到阻断肿瘤供血,促使肿瘤细胞无法持续获得供血支持,便于对患者肿瘤部位进行控制[10-11]。且相对于HCC患者,采用传统的cTACE术,患者临床上获得明显疗效,临床生存情况得到明显提升。
对于HCC患者,有研究显示,虽然cTACE临床疗效已获得广泛肯定,但是存在术后安全性问题,包括肝脓肿、恶心、疼痛等情况未能解决,且部分患者术后肝功能情况并无明显好转,部分患者进行栓塞术后出现肝功能甚至持续恶化情况[12]。这是因为cTACE术常使用阿霉素或其他与碘化油混合乳化制剂进行栓塞,这会导致患者肝脏内部长期存在混合乳剂,肝脏无法及时代谢掉,且混合乳剂无法长久维持药物浓度,故而在疗效提升上存在一定限制;但也正是由于乳剂长期存在,导致部分乳剂药物进入患者体内循环系统,患者机体可随之出现毒副作用。而DEB-TACE术则可对cTACE术中所存在的缺陷进行弥补,作为一种新型栓塞剂,较传统cTACE术可以更长久且稳定的释放化疗药物。同时,DEB-TACE术中选择的CalliSpheres国产微球,采用的是带静电荷的磺酸酯基集团作为药物的搭载体,通过可逆结合极性药物分子,以一种可控且定量的方式缓慢释放抗肿瘤药物,保证药物在体内位置长时间高浓度状态;且该种载药微球具有表面光滑、大小均一的特性,能够更好的对药物分子起到靶向制定的作用,为其准确选择对应血管;此外,球形的载体形式,也证明其具有良好的可塑性,保证载药微球在血管中的栓塞稳定,使得肿瘤供血血管堵塞彻底,肿瘤组织坏死更为迅速。通过本次回顾性研究,实验数据表明,DEB-TACE组中晚期HCC患者经过术后治疗,其疗效显著,术后3个月,DEB-TACE组患者ORR为75.00%,cTACE组ORR为50.00%,明显高于cTACE组患者,同时在进入病情稳定期患者人数也存在明显差异。这从客观层面肯定DEB-TACE术较cTACE术好。但目前临床上关于DEB-TACE与cTACE术短期疗效相比仍存在一定争议,有的研究表示两种方法均提高肿瘤缓解率与生存率,在短期疗效上二者并无明显差异。结合本文研究结果,与谢璇丞、李梅等[13-14]学者研究结论一致。推测其原因可能与患者个人因素、纳入样本量、化疗药物及随访时间有关。但总体上,DEB-TACE载药微球法其临床效果更好,在通过后期的走访过程中还发现,DEB-TACE组患者AFP指标水平有明显下降,也佐证DEB-TACE术对HCC患者具有肿瘤细胞生物学行为抑制作用。但因本次研究总周期仅为3个月,DEB-TACE术在HCC患者后续生存状况及远期疗效是否明显无法具体体现,后续有机会将开展进行更长时间的研究。
栓塞综合征是HCC患者接受临床TACE手术后最常见的毒副作用,其主要表现为肝功能异常、黄疸、发热、消化道指征等[15]。肝功能是本次研究中对于疗法安全性进行评判的重要因素,同时也能通过肝功能指标变化判断两组患者抗肿瘤的同时是否有实现正常肝脏组织的自修复活动。本次研究中获取两组患者术前的肝功能及术后7 d数据进行比对,发现在本此研究过程中两组患者经过术后治疗,其肝功能各项转氨酶较治疗前均有下降,且DEB-TACE组患者AST、γ-GT较cTACE组患者下降明显,表明DEB-TACE术在短期上与传统cTACE术相比对患者肝功能有明显修复作用,并且对比两组患者在术后7 d血清情况,DEB-TACE组患者TBIL、IBIL、ALB较cTACE组患者明显下降,也证实DEB-TACE术对于中晚期HCC患者有明显控制作用,利于改善患者肝功能情况。针对两组患者术后不良情况,在本次研究观察期间,两组患者术后均存在各类毒副作用情况,但在发生率上差异并无统计学意义。这表明,在安全性方面,两种手术风险相当。相关文献指出,两种化疗方式安全风险均较低,患者不良情况发生率接近,但DEB-TACE术后患者不良状况发生情况稍低,与本研究结果一致,考虑可能因素为选用载药微球尺寸和化疗药物剂量的选择不同,加之观察时间较短,故而应在后续研究中加以验证[16]。
综上所述,本次研究中发现DEB-TACE术较cTACE术短期疗效好,客观缓解率高,对中晚期HCC患者肝功能有一定纠正作用,但两者安全性无差异。见于此次研究为回顾性研究且因患者状况可能存在标准差异,后续仍需扩大标准量,对标准进行更细致的规划,以证明确两种疗法优劣。

