水稻幼苗期低温胁迫的生理响应及转录组分析
郭 慧,李树杏,甘 雨,张宏伟,郝留根,杨占烈,向关伦,王珍珍,易崇粉
(贵州省水稻研究所,贵阳 550006)
【研究意义】水稻(OryzasativaL.)是起源于热带、亚热带的喜温性作物,低温冷害严重影响水稻的地理分布、生长发育和产量形成。低温对水稻的影响主要发生在苗期和生殖生长期。水稻苗期遭遇低温容易造成叶片光合作用减弱、电解质渗漏增加、鲜重和干物质重显著下降,物质积累亏缺。低温冷害在生产上常导致播种后不出芽或出芽后烂秧等现象,不利于早稻高产稳产[1]。水稻低温逆境下的生理及代谢变化、耐逆相关功能基因研究一直是水稻研究的核心内容,开展低温胁迫下相关生理变化及基因动态研究,有助于了解水稻应对低温胁迫的生理基础与分子机制,进而为耐低温水稻品种与资源的筛选、耐冷新基因的挖掘与利用以及耐冷性状的遗传改良奠定基础,在农业和社会经济发展方面均具有深远意义。【前人研究进展】低温冷害不仅会对水稻造成明显的外部伤害,还会引起一系列生理变化。叶绿素含量通常被作为判断植物逆境胁迫耐受性的重要指标[2]。水稻细胞膜是最先感知温度变化的部位,在低温胁迫下其结构容易发生变化,导致胞内电解质渗漏,因此电介质渗漏率常作为植物耐受低温的重要指标[3]。水稻耐冷性是由多基因控制的复杂数量性状,近年来随着生物技术的快速发展,特别是二代测序技术的广泛应用,已经定位250余个与低温有关的数量性状基因座(QTL),但其中大部分仅为初步定位,精细定位的约有12个,而被克隆的仅有7个,与苗期耐冷性相关的仅有3个:COLD1、GSTZ2和qCTS-9[4]。COLD1编码1个G蛋白信号调节因子,过表达COLD1能显著提高水稻的耐冷性[5]。蛋白OsGSTZ2中从Ile99到Val99的单个氨基酸替换会导致其与已知底物的催化活性显著降低,相应的SNP与水稻亚种内和亚种间的幼苗对寒冷的敏感性高度相关[6]。水稻苗期耐低温QTLqCTS-9是通过耐寒品种丽江新团黑谷和冷敏品种三黄占2号构建的重组自交系群体获得,过表达qCTS-9水稻在苗期表现耐寒性增强[7]。Wan等[8]研究发现,OsCNGC9作为1个钙离子通道蛋白,积极调控低温胁迫相关的基因表达,其与水稻低温信号转导关键蛋白激酶OsSAPK8互作,将OsCNGC9或OsSAPK8基因过表达均可显著提高水稻对低温的耐受性。朱琳等[9]对水稻品种中花11苗期进行低温处理,经过高通量测序分析光合作用通路和苯丙氨酸代谢通路中的差异表达基因发现,低温胁迫对水稻的影响主要表现在光合作用、次生代谢的生物合成和苯丙氨酸代谢等方面。【本研究切入点】目前,关于水稻耐低温研究主要集中在低温表型鉴定与评价方面。近年来,在耐冷相关基因挖掘方面虽已开展了大量研究,且已获得很多基因(或QTL),但能够用于鉴定耐冷资源材料或改良水稻品种,辅助育种实践的功能基因尚不多见。【拟解决的关键问题】本试验以P427(强耐冷型)、日本晴(耐冷型)和9311(冷敏感型)3个耐冷性不同的水稻品种为材料,通过测定生理、生化指标,以及转录组测序(RNA-Seq)分析,研究幼苗期水稻响应低温胁迫的生理生化及低温诱导下不同耐冷性水稻品种的基因表达变化规律,挖掘水稻耐冷相关新基因,并进一步解析水稻应对低温胁迫的生理基础与分子机制,以期为水稻耐冷性遗传改良奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 水稻品种 P427(强耐冷型)、日本晴(Nip,耐冷型)和9311(冷敏感型)由贵州省水稻研究所提供。
1.1.2 主要仪器设备 E.N.2Z.A Plant Total RNA KitI(R6834)RNA提取试剂盒由OMEGA公司生产;721型分光光度计(AC0911035)由上海第三分析仪器厂生产;振荡式摇床器(Vibramax 100)产自德国;恒温水浴锅(SYG-1230)由美国精骐生产;超低温冰箱SANYO产自日本。
1.2 方法
1.2.1 材料预处理 (1)幼苗培养。选取P427、日本晴和9311各200粒饱满种子进行发芽,分别选取50粒发芽一致的芽谷,播于塑料钵中,置于光照培养箱中,经过21 d、28 ℃/14 h 和25 ℃/10 h光暗交替培养,生长至三叶期(苗龄21 d)时备用。CP:低温处理前(0 h)的P427;CR:低温处理前的日本晴(Nip);CJ:低温处理前的9311;TMP:低温处理1 d的P427;TMR:低温处理1 d的日本晴;TMJ:低温处理1 d 的9311;TEP:低温处理3 d 的P427;TER:低温处理3 d的日本晴;TEJ:低温处理3 d 的9311,各3次重复。
(2)RNA提取。分别选取P427、日本晴和9311各50株备用幼苗,从中分别选取5株生长一致的幼苗,剪取其基部、茎中部和叶片的少许组织用锡箔纸包裹,于液氮中速冻,置于-80 ℃超低温冰箱保存备用。将剩余秧苗(45株)转移至3~4 ℃低温光照培养室内低温处理,分别在处理1和3 d时采用上述方法进行取样,每次5株,然后采用RNA提取试剂盒参照使用说明书提取低温处理前(0 h)、低温处理1 d及低温处理3 d样品的RNA,3次重复。
1.2.2 试验设计 (1)水稻幼苗期耐冷性鉴定。将生长21 d的P427、日本晴和9311备用幼苗各20株转移至3~4 ℃低温光照培养室内冷处理3 d,再移至常温条件(28 ℃/14 h 和25 ℃/10 h光暗环境)下进行恢复生长2周。调查叶片卷曲度、叶片赤枯程度(叶片褪绿程度)和死亡率等指标,将不同基因型的水稻材料按耐冷性好、耐冷性中和耐冷性差进行耐冷性初步鉴定分级。
(2)叶绿素含量测定。植物在低温胁迫下叶绿素合成会受到抑制。将生长21 d的P427、日本晴和9311幼苗各30株暗适应1 h后,在低温处理前测定第1次叶绿素含量,然后分别在低温胁迫3 d和常温恢复生长3 d后测定叶绿素含量。每个品种每次各测定10株幼苗的测定值,3次重复。
(3)电导率测定。细胞膜是植物最先感知低温的部位,遭遇低温胁迫后,其理化性质发生变化,细胞膜结构受到破坏,导致细胞内电解质渗漏,因此电解质渗漏率可作为鉴定植物耐低温性的指标之一[3]。电解质渗漏程度一般用相对电导率来表征。选取培养21 d生长一致的P427、日本晴和9311幼苗各5株,分别在低温处理前、低温胁迫3 d和低温胁迫5 d后测定电导率。参照略有改动的赵世杰等[10]的方法测定相对电导率。用去离子水冲洗叶片2次,用滤纸吸干表面水分,用直径6~8 mm的打孔器,打取稻叶圆片10片,放入洁净试管中,加15 mL去离子水,真空泵抽气10 min,振荡1 h,室温平衡2 h,摇匀后用电导仪测定初电导;置沸水浴中10 min,冷却至室温后测定终电导,3次重复。
相对电导率=(初电导-空白)/(终电导-空白)×100%
(4)差异表达基因分析。聚类分析可用于研究差异基因在不同试验条件下的表达模式,而表达模式类似的基因可能具有相同的功能,共同参与同一代谢过程或细胞通路。将表达模式相同或相近的基因聚类,可用于推测未知基因的功能或已知基因的新功能。采用readcount数据通过DESeq(1.12.0)标准化后进行基因差异表达分析(P<0.05),用火山图推断差异基因的整体分布情况,根据低温处理前后差异基因的FPKM(Fragments Per Kilobase Million)值为表达水平,做层次聚类图分析。
(5)差异表达基因的GO和KEGG富集分析。为进一步分析低温胁迫下不同品种基因的表达水平及调控网络,采用GOSeq进行GO富集分析(P<0.05),差异表达基因的筛选条件标定为log2FC≥1或log2FC≤0.25,P-value≤0.01;为进一步分析低温胁迫过程中低温胁迫响应基因参与的代谢过程,基于KEGG数据库,采用KOBAS(V2.0)进行KEGG分析,检测特异KEGG通路中差异表达基因的富集情况,找出差异表达基因显著富集的Pathway。
1.3 数据统计与分析
采用Excel 2016进行数据整理,应用DPS 2.0进行数据分析。
2 结果与分析
2.1 水稻幼苗期耐冷性鉴定
从图1看出,品种P427表现较强的耐冷性,经低温处理后,叶色无明显变化,没出现失水萎蔫等症状,只是在恢复生长期间叶尖出现叶片枯黄或幼苗死亡等症状;日本晴和9311在低温胁迫后叶片便出现不同程度的卷曲、萎蔫以及幼苗死亡等症状。2周后统计其存活率(图2),P427的存活率达49.3%,极显著高于日本晴(23.3%)和9311(9.3%);日本晴与9311也呈极显著差异。该结果证实P427苗期具有较强的耐冷性,且耐冷性明显优于日本晴和9311。

图1 P427、日本晴和9311苗期低温胁迫前、后及恢复生长后的表型Fig.1 Phenotypes before low-temperature stress, after low temperature stress and recovery growth of P427,Nipponbare and 9311
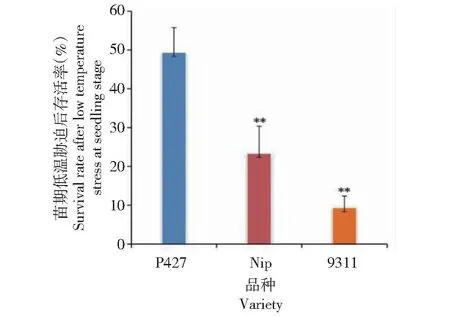
*和**分别表示P<0.05和P<0.01水平差异显著和极显著(t-test)。下同。* and ** indicate significant difference and extremely significant difference at P<0.05 and P<0.01 level (t-test),respectively. The same as below. 图2 P427、日本晴和9311苗期低温胁迫处理恢复生长后的存活率Fig.2 The survival rate of P427, Nipponbare and 9311 after low temperature stress at seedling stage
2.2 水稻幼苗期低温胁迫后的叶绿素含量
从图3看出,低温胁迫3 d后,P427的叶绿素含量由29.64 μg/g降至29.30 μg/g,仅下降1.15%;而日本晴的叶绿素含量由26.10 μg/g降至23.26 μg/g,下降10.88%;9311的叶绿素含量由26.8 μg/g降至22.84 μg/g,下降14.77%。恢复生长3 d后,P427和9311的叶绿素含量均明显下降,P427和9311分别降至27.96和21.24 μg/g,而日本晴没有太大变化。说明,品种P427对低温不敏感,耐冷性明显优于日本晴和9311。
新安北堤、障水埝及四门堤的复堤土料场勘探点间距较大,一般2~4km,取土深度(按2.0m考虑)氛围内未见地下水,土料开采不受地下水影响。

同一品种低温处理前与低温处理后、恢复生长后分别相互比较。The same varieties are compared before low temperature treatment,after low temperature treatment and after recovery.图3 P427、日本晴、9311苗期低温胁迫处理前、后及恢复生长后的叶绿素含量Fig.3 Chlorophyll content of P427, Nipponbare and 9311 before low temperature stress,after low temperature treatment and after recovery at seedling stage
2.3 水稻幼苗期低温胁迫后相对电导率变化
从图4看出,P427、日本晴和9311经过3~4 ℃低温处理3 d后,3个品种的相对电导率均较自身处理前显著或极显著增大,其中,9311的变幅最大,极显著增长10.79%;P427和日本晴的变幅相对较小,分别显著增长2.69%和1.41%。表明,低温对9311的膜系统造成的损伤最大,即3个材料中9311的耐低温性最差。低温处理持续至5 d时,3个品种的相对电导率均再次升高,说明持续低温再次加重对膜系统的伤害程度。其中,此阶段日本晴的变幅最大,较处理前极显著增长5.97%,表明持续低温对日本晴的膜系统也造成了较严重的伤害。说明,低温处理对9311的膜系统伤害最严重,对P427的膜系统伤害最轻,3个品种中P427对低温的耐受性最强。
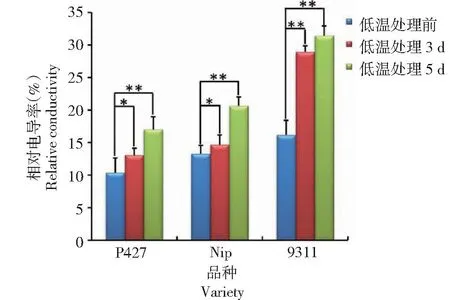
同一品种低温处理前与低温处理3 d、低温处理5 d分别相互比较。The same varieties are compared before low temperature treatment, low temperature treatment for 3 days and low temperature treatment for 5 days.图4 不同水稻品种低温处理前后相对电导率的变化Fig.4 Changes of relative electri-conductivity of different rice varieties before and after low temperature treatment
2.4 低温胁迫下差异表达基因的鉴定
从图5可知,在低温处理前(0 h)P427(CP)和日本晴(CR)呈相似的聚类结果,差异基因表达模式相近,但随着低温处理时间延长,逐渐表现不同聚类形式;而9311(CJ)则表现出不同于P427和日本晴的聚类结果,9311差异基因的表达模式与P427和日本晴相差较大。
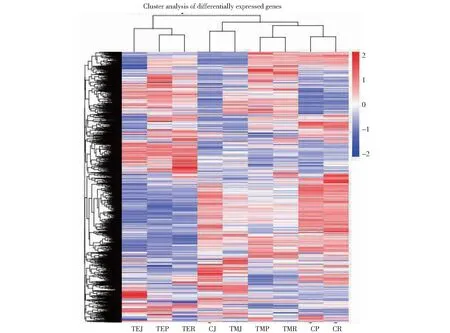
红色表示高表达基因,蓝色表示低表达基因,颜色从红到蓝,表示log10(FPKM+1)从大到小。CP、CR和CJ分别表示低温处理前的P427、日本晴和9311;TMP、TMR和 TMJ分别表示低温处理1 d的P427、日本晴和9311;TEP、TER和 TEJ分别表示低温处理3 d的P427、日本晴和9311,下同。Red indicates high-expressed gene, and blue indicates low-expressed gene. The color from red to blue means that log10(FPKM+1) is big to small. CP,CR and CJ represent P427,Nipponbare and 9311 before low temperature treatment;TMP,TMR and TMJ represent P427,Nipponbare and 9311 after 1 days of low temperature treatment;TEP,TER and TEJ respectively represent P427,Nipponbare and 9311 after 3 days of low temperature treatment. The same as below. 图5 基于FPKM值的基因表达聚类图谱Fig.5 Gene expression clustering diagram based on FPKM value
从图6看出,基于RNA-Seq进行差异基因分析,低温处理1 d后,P427获得9190个差异表达基因(DEGs),日本晴获得8476个DEGs,9311获得6138个DEGs;低温处理3 d后,P427获得15 040个DEGs,日本晴获得16 253个DEGs,9311获得14 863个DEGs。随着低温处理时间的延长,3个品种启动的耐冷相关基因均明显增加,其中,共有DEGs由3196个增至9352个,增加6156个;特有DEGs在日本晴和9311中也不同程度地增加,分别增加911和940个,而P427的特有DEGs则下降691个。此外,P427从低温处理1~3 d只有576个特有基因一直在差异表达。
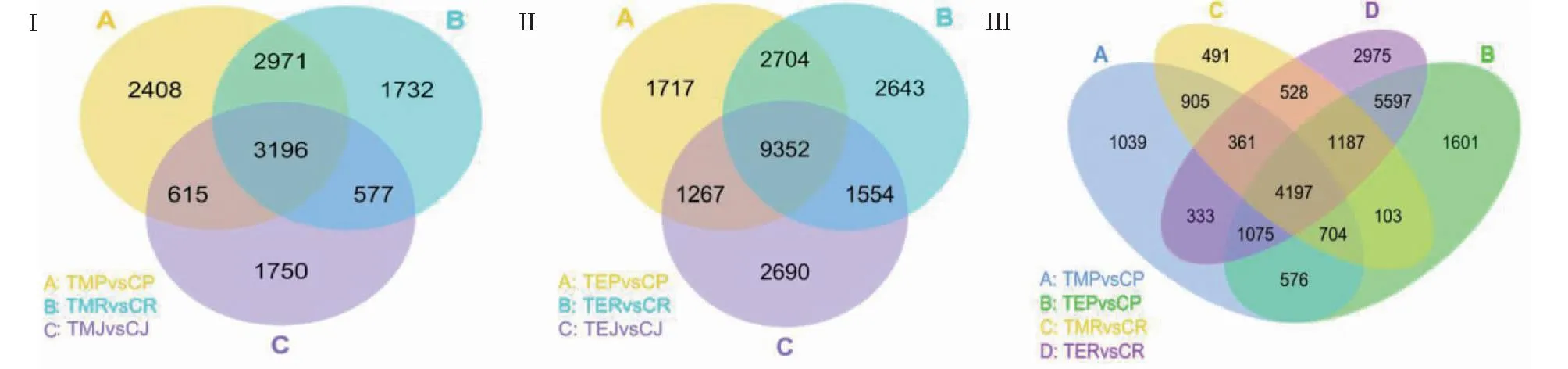
Ⅰ.低温处理1 d后,P427、日本晴和9311差异变化基因韦恩图;Ⅱ.低温处理3 d后,P427、日本晴和9311差异变化基因韦恩图;Ⅲ.低温处理1和3 d后,P427和日本晴差异变化基因的韦恩图(P<0.05)。 Ⅰ.Venn diagram of differentially expressed genes in P427,Nipponbare and 9311 after 1 days of low temperature treatment; Ⅱ.Venn diagram of differentially expressed genes in P427,Nipponbare and 9311 after 3 days of low temperature treatment; Ⅲ.Venn diagram of differential changes in P427 and Nipponbare after 1 days and 3 days of low temperature treatment (P<0.05).图6 低温处理P427、日本晴和9311差异变化基因的韦恩图Fig.6 Venn diagram of differentially expressed genes P427,Nipponbare and 9311
2.5 低温胁迫下差异表达基因的GO富集
从图7可知,在低温处理3 d时,P427单独拥有1654个DEGs,将其进行GO富集分析的结果显示,1654个DEGs被富集在3326个GO功能条目中,图中展示出富集的前30个功能条目。其中,生物学过程(BP)占62.39%,细胞组分(CC)占 12.99%,分子功能(MF)占24.62%,多数差异基因与生物学功能显著相关。细胞成分的组织或生物发生、细胞内组分、大分子复合物结合等分别是生物学过程、细胞组分、分子功能富集最多的功能类别。
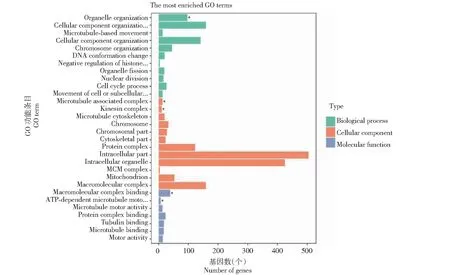
*表示显著富集的GO term。* indicates significantly enriched GO term.图7 低温处理3 d后P427特有DEGs的GO富集Fig.7 GO enrichment of specific DEGs in P427 after 3 days of low temperature treatment
2.6 低温胁迫下差异表达基因的KEGG富集
将P427特有的1654个DEGs进行KGEE富集分析结果显示,1654个DEGs富集在98条代谢通路上,显著富集的有20条Pathway,主要集中在次生代谢产物的生物合成(PATH:01110)、植物激素信号转导(PATH:04075)、泛素介导的蛋白水解(PATH:04120)、嘌呤代谢(PATH:00230)、苯丙烷生物合成(PATH:00940)和苯丙氨酸代谢(PATH:00360)等通路(图8)。KEGG注释通路图显示,植物激素信号转导和苯丙氨酸代谢对苗期水稻低温胁迫影响较大。

图8 低温处理3 d后P427特有DEGs的KEGG富集Fig.8 KEGG enrichment of specific DEGs in P427 after 3 days of low temperature treatment
通过KGEE富集分析,在植物激素信号转导途径富集到18个差异表达基因,其中10个基因上调表达,8个基因下调表达。生长素介导的通路富集到4个基因,其中OsARF7和OsARF11是生长素响应因子;富集到2个尚未见报道的生长素响应SAUR家族基因,细胞分裂素途径富集到OsRR4[11]、OsRR9和OsRR10[12]共3个水稻细胞分裂素响应的A型响应调节子基因,ABA信号途径富集到OsSAPK1、OsSAPK3和OsSAPK4共3个基因;此外,在油菜素内酯途径富集到OsGSK3和OsBRI1共2个基因,水杨酸途径富集到OsNPR5和OsbZIP41共2个基因(图9)。苯丙氨酸代谢途径是植物最重要的次生代谢之一。从图10可知,差异表达基因在苯丙氨酸代谢途径中共富集11个基因,其中上调表达基因4个,下调表达基因7个,其中已有报道的OsPAL4和OsPAL6是控制抗性的关键基因,也是提高水稻广谱抗性的潜在育种靶标基因[13]。

图9 差异表达基因参与的植物激素信号转导途径Fig.9 Plant hormone signal transduction pathways involved in differentially expressed genes

图10 差异表达基因参与苯丙氨酸代谢通路Fig.10 Differentially expressed genes involved in phenylalanine metabolism pathway
3 讨 论
3.1 水稻幼苗期低温胁迫的生理反应
水稻受逆境胁迫的影响程度与逆境种类、逆境强度和持续时间等多种因素紧密相关[14]。低温胁迫对水稻的形态特征和生理指标均会产生影响[15],低温胁迫后表型变化可直接反映出水稻的损伤程度[16-17]。相对于形态学指标而言,生理学指标可进一步反映植物在逆境条件下体内各代谢过程的变化[18-19]。有研究者根据苗期耐冷形态指标建立了苗期耐冷性鉴定评价标准,戴陆园等[20]根据水稻苗期耐冷形态变化将苗期耐冷性分为1~9级。韩龙植等[21]将3~4叶龄幼苗置于冷水中处理后,对幼苗叶片的赤枯程度进行调查,并将其作为幼苗期水稻耐冷性的鉴定指标。本研究选用叶片卷曲度、叶枯度及死亡率等形态学指标结合叶绿素含量和电导率等生理指标作为水稻苗期耐寒性的评价指标判断苗期水稻耐低温能力。低温胁迫容易使水稻功能叶受到伤害,叶绿素的正常代谢出现紊乱,叶绿素合成下降。刘次桃等[4]研究认为,水稻在低温下会减少叶绿素合成及叶绿体形成。本试验结果显示,低温胁迫后P427、日本晴和9311的叶绿素含量均不同程度下降,但强耐冷品种P427的叶绿素含量下降较少,而冷敏感品种9311的叶绿素含量下降最多;耐冷水稻品种对低温胁迫表现较强的适应能力,叶片受伤害程度小,能保持较高的叶绿素含量;可能是低温胁迫使不同水稻幼苗的细胞结构发生了变化,不同品种生理功能恢复能力不同,因而植株叶绿素合成受到不同程度的抑制。Bertin等[22]研究发现,低温处理后的秧苗存活率与其电解质渗漏关系密切。陈善娜等[23]研究认为,电解质渗漏可用于评价水稻耐冷性。本试验结果显示,低温胁迫后P427、日本晴和9311的相对电导率均不同程度增大,其中9311的增幅最大,P427和日本晴的变幅相对较小,低温胁迫对P427的膜系统伤害最轻,对9311的膜系统伤害最严重。品种耐冷性是一个复杂的综合性状,不同品种可能具有不同的耐冷机制,即使同一品种在不同的生长发育时期耐冷机制也可能存在差异。
3.2 水稻苗期低温诱导差异表达基因分析
基于RNA-Seq技术对植物低温胁迫应答及网络调控研究,已经获得大量候选基因、新转录本及SNPs等。本研究通过对3个不同耐冷性的水稻品种进行转录组测序分析,获得大量差异表达基因,包括已经被报道的耐冷相关基因COLD1和bZIP73;同时也发现大量参与激素代谢通路、淀粉糖类合成代谢的差异表达基因及水通道蛋白基因,如OsARF11、OsPYL/RCAR1、OsPAL6、OsAPL4、OsRR4、SUS6及OsPIP13等。
生长素响应因子(Auxin response factor,ARF)是一类特异性结合到TGTCTC序列上的一类转录因子,调节生长素表达的响应基因。ARF基因在植物中大多数由多基因家族组成。Wang等[24]研究显示,水稻中25个ARFs成员中除OsARF20外的其他24个OsARFs基因均具有表达活性,其中一些表达量受生长素处理或者光暗培养的影响。本研究结果表明,生长素响应因子OsARF11在耐冷品种P427中上调表达,暗示OsARF11基因可能通过生长素信号途径响应水稻低温诱导。
水稻细胞分裂素响应的A型响应调节子基因(A-type response regulator gene,OsRR)受细胞分裂素的诱导。OsRR6响应不同的环境刺激而诱导表达,水稻处于高盐、脱水或低温胁迫下OsRR6表达量会增强,显示其在非生物胁迫和细胞分裂素信号之间的交互中发挥作用[11]。本研究结果表明,细胞分裂素响应的A型响应调节子基因为OsRR4、OsRR9和OsRR10,其在耐冷品种P427低温处理前后均发生差异表达,与Yukihiro等[11]的研究结果一致。
蔗糖非发酵相关蛋白激酶2(Sucrose non-fermenting 1-related protein kinase 2,SnRK2)激酶家族,是众多应答渗透压胁迫的蛋白激酶家族之一,SnRK蛋白家族成员参与ABA诱导的信号转导途径、耐盐、营养胁迫应答、病害及碳代谢调控等[25]。水稻SnRK2基因家族的OsSAPK3、OsSAPK5、OsSAPK7和OsSAPK9在应答细菌性条斑病菌侵染后表达显著上调,其在细胞质和细胞核中均有定位,但聚集在不同的组中,说明其参与不同的抗性信号转导途径[26]。本研究中水稻SnRK2基因家族OsSAPK3显示下调表达,暗示其参与水稻苗期低温诱导。
蔗糖合酶(Sucrose synthase,SuS)是植物体中广泛存在的一种糖基转移酶[27],在生长发育过程中起重要作用,是蔗糖合成分解的重要催化酶,也是叶片光合产物蔗糖进入各种代谢途径所必需的关键酶之一[28]。此外,蔗糖合酶在库器官的生长发育及代谢过程中发挥重要功能,且在植物缺氧、低温等非生物胁迫环境适应中也具有十分重要的作用[29]。本研究发现,蔗糖合酶家族SUS6受低温诱导下调表达,与Albrecht等[30]和Maraa等[31]的研究结果相吻合,表明蔗糖合酶在植物低温胁迫调控中发挥重要作用。
本研究结果提示RNA-seq获得的大量差异表达基因中包含水稻响应低温胁迫的候选基因,对于深入研究耐低温调控机制具有潜在的作用,同时也为进一步挖掘低温诱导基因提供了大量的靶基因和潜在方向。
4 结 论
不同耐冷型品种其耐冷响应基因及调控机制可能存在差异,强耐冷品种P427存在有别于日本晴和9311的低温胁迫响应基因。苗期水稻低温胁迫对植物激素信号转导和苯丙氨酸代谢影响较大,P427可能通过次生代谢产物的生物合成、植物激素信号转导等代谢通路及苯丙烷类生物合成通路上的基因响应苗期水稻的耐冷性。

