VCAM-1、MCP-1、IL-17、IL-6在桥本甲状腺炎患者不同甲状腺抗体水平下的作用
卢亚敏, 邢晨皓, 陈芳, 刘光霞, 侯瞻, 张溢文
(1.河北省人民医院 核医学科; 2.河北北方学院 研究生学院, 河北 石家庄市 050051)
血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)是内皮功能障碍的生物标志物,在炎症期间参与白细胞黏附和迁移到间质,介导一些免疫细胞的功能作用,与各种免疫疾病的进展密切相关,已被提议作为自身免疫疾病、癌症等的生物标志物[1]。研究表明血清VCAM-1在类风湿关节炎中升高,与疾病活动、氧化应激和炎症因子密切相关[2]。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)在基于甲状腺激素的反馈中发挥作用[3],依赖甲状腺激素增加分泌,它也随着脂肪细胞组织的增大而增加,通过各种刺激机制在桥本甲状腺炎(hashimoto thyroiditis,HT)中起作用。 IL-17参与HT的发病机制[4],特别是通过促进炎症反应对HT等自身免疫性疾病起到破坏甲状腺组织作用,可用作 HT 疾病诊断、预后和随访的潜在生物标志物。
HT是典型的自身免疫性疾病,以甲状腺特异性自身抗体增加为特征,常见细胞炎症浸润。遗传因素、环境因素、细胞因子对HT发生发展等均起重要作用[5]。 目前尚无确切机制阐明HT与甲状腺抗体相关疾病的严重程度和差异的关系,为探究此问题,本研究回顾性分析了HT患者的VCAM-1、MCP-1、IL-17、IL-6和糖脂代谢生化指标的变化,分析了与甲状腺功能相关抗体水平的相关性和影响甲状腺功能相关抗体水平的因子,为进一步研究桥本甲状腺炎的发病机制提供理论基础。
1 资料与方法
1.1 研究对象
选取2022年1月至2022年12月在河北省人民医院门诊及住院的HT患者241例,纳入标准:①血清自身甲状腺抗体检测中,甲状腺过氧化物酶抗体(TPOAb)或甲状腺球蛋白抗体(TGAb)呈阳性;②超声检测显示甲状腺肿大,也可肿大不明显,甲状腺腺体内部呈弥漫性改变、回声减弱等,或伴有结节等。排除标准:①合并其他急慢性炎症疾病;②肝肾功能不全;③严重呼吸系统疾病;④肿瘤放射治疗及化疗;⑤严重心血管疾病;⑥妊娠期或哺乳期;⑦严重精神疾病和传染病等。按照TPOAb和TGAb的水平,TPOAb<34 IU/mL,TGAb<115 IU/mL为正常对照组(90例),TPOAb<34 IU/mL,TGAb>115 IU/mL为TGAb阳性组(79例),TPOAb>34 IU/mL,TGAb<115 IU/mL为TPOAb阳性组(72例),TPOAb>34 IU/mL,TGAb>115 IU/mL为双阳性组(90例)。组间性别及年龄相比较,差异均无统计学意义。
本研究已取得河北省人民医院伦理委员会的同意(审批号:2020科研伦审第204号),所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 仪器与试剂
生化分析仪及配套生化试剂(美国贝克曼公司, AU5800);生化试剂(美国贝克曼公司,血糖:OSR6121;HDL-C:OSR6287;LDL-C:OSR6183;TC:OSR6116;TG:OSR61118);电化学发光分析仪(罗氏公司,cobas e602);甲状腺激素及其抗体试剂(罗氏公司,T3:11731360122,T4:12017709122,TSH:08429324190, FT3:06437206190,FT4:07976836190,TPOAb:06368590190,TGAb:06368697190);酶免仪(赛默飞世尔科技有限公司,Multiskan Fc),VCAM-1、MCP-1试剂(四正柏生物有限公司,CHE0110-96;CHE0103-96);流式细胞仪(美国BD公司,FACS Canto);IL-6、IL-17试剂盒(江西赛基生物有限公司,P010002)。
1.2.2 实验方法
所有受试者均清晨空腹取静脉血5 mL,生化分析仪测定血脂、血糖等指标,GPO-POD法测定胆固醇(TC)和甘油三酯(TG)水平,己糖激酶法测定血糖;罗氏公司cobas e602电化学发光分析仪检测甲状腺激素及其抗体;ELISA法检测VCAM-1、MCP-1指标;流式细胞仪检测血清中的细胞因子IL-6、IL-17的水平。
1.3 统计学分析
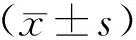
2 结果
2.1 各组年龄、甲状腺激素和抗体及血脂、血糖指标的比较
各组年龄及女性占比无差异(P<0.05),抗体阳性组TSH、TC、TG、LDL-C、FPG与对照组比较有显著差异(P<0.05),双阳组升高明显;FT3、FT4、HDL-C水平紊乱,各组比较也存在显著差异(P<0.05),见表1。

表1 一般资料比较Table 1 Comparison of general data among study groups and control group
2.2 各组炎症因子水平比较
抗体阳性组VCAM-1、MCP-1、IL-17、IL-6与对照组比较有显著差异(P<0.05),双阳组升高明显。各组炎症因子表达水平比较见图1。

1)P<0.01。图1 流式细胞仪分析各组炎症因子表达水平Figure 1 Expression level of inflammatory factors in each group by FACS
2.3 相关性分析
VCAM-1、MCP-1、IL-17、IL-6之间相关性用Pearson相关分析,VCAM-1、MCP-1、IL-17、IL-6与TPOAb、TGAb之间相关性用Spearman相关分析。
VCAM-1与TPOAb、TGAb、MCP-1、IL-17,IL-6均呈显著正相关(r=0.37、0.427、0.322、0.311、0.258,P<0.01);MCP-1与TPOAb、TGAb、IL-17、IL-16均呈显著正相关(r=0.364、0.176、0.416、0.328,P<0.01);IL-17与TPOAb、TGAb、IL-6均呈显著正相关(r=0.245、0.224、0.422,P<0.01);IL-6与TPOAb、TGAb均呈显著正相关(r=0.294,0.323,P<0.01)。
2.4 VCAM-1、MCP-1、IL-17、IL-6的Logistic多因素回归分析
控制影响甲状腺功能的因素后,以正常对照组作参照,纳入年龄、性别、VCAM1、MCP1、IL17、IL6、TC、TG、HDL、LDL、FPG作为自变量,不同甲状腺功能抗体异常为因变量进行Logistic多因素回归分析。分析VCAM-1、MCP-1、IL-17、IL-6 4种炎症因子对不同甲状腺功能相关抗体水平的影响。结果显示,VCAM-1、MCP-1、IL-17是不同甲状腺功能抗体水平异常的危险因素,见表3。
3 讨论
HT以甲状腺特异性自身抗体TPOAb、TGAb升高为特征,本研究发现抗体阳性组尤其是双阳组中VCAM-1、MCP-1、IL-17和IL-6水平较对照组明显升高,表明VCAM-1、MCP-1、IL-17、IL-6可能通过刺激TPOAb、TGAb表达水平升高促进甲状腺激素紊乱,导致HT的发生发展。
VCAM-1是一种跨膜唾液酸糖蛋白,广泛表达在活化内皮细胞,平滑肌细胞、巨噬细胞、树突状细胞、集成纤维细胞等表面。其生物学作用有:调节细胞和组织的分化、发育,参与淋巴细胞归巢、炎症细胞黏附和迁移到受损组织中等免疫应答过程[6]。研究表明HT患者的自身免疫过程包括自身抗体和T细胞激活,激活的淋巴细胞产生细胞因子,增加内皮细胞中VCAM-1的表达和抗原提呈细胞中ICAM-1的表达,导致慢性淋巴细胞浸润和破坏[7]。VCAM-1与甲状腺激素密切相关:在评估毒性弥漫性甲状腺肿Graves病患者的踝臂指数(ABI)时,观察到VCAM-1和游离T4对ABI降低的协同作用[8]。
VCAM-1在炎症性疾病中发挥调节作用,刺激IL-6、IL-17等炎症因子释放从而加重变应性反应[9]。慢性肾脏病通过NF-κB信号通路启动VCAM-1和MCP-1基因表达,二者协同发挥炎症作用[10]。IL-17通过蛋白激酶C-α(PKC-α)和c-Jun N-末端激酶(JNK)信号级联降低miR-5701的表达,从而影响 VCAM-1 依赖性单核细胞黏附[11]。IL-17可以通过激活Act1/TRAF6/TAK1级联来刺激MCP-1的表达,促进自身免疫性疾病组织中炎性浸润[12]。IL-17还通过 MCP 依赖性机制诱导特定亚型巨噬细胞浸润以加重纤维化[13]。以上研究均表明,各炎症细胞因子之间发挥协同作用。
VCAM-1、IL-6在HT和乳头状甲状腺癌中升高[14],调控细胞增殖和血管再塑发育,与肿瘤侵袭密切相关。HT发病时,甲状腺组织中MCP-1蛋白水平增加,甲状腺自身抗体升高,MCP-1/CCR2信号轴能促进巨噬细胞、单核细胞和杀伤T淋巴细胞等多种炎症细胞趋化至炎症病灶进而发挥免疫作用[15]。细胞实验诱导的HT模型中,miR-155通过调控JAK2/STAT3信号通路促进IL-17mRNA表达增加,影响变应原免疫疗法(allergen immunotheropy,AIT)免疫失常状态。Th17细胞及其分泌的IL-17能调节T淋巴细胞免疫功能,通过增强患者机体抗氧化功能降低TPOAb滴度[16]。本课题组前期研究表明自身免疫性甲状腺疾病患者IL-17蛋白及其mRNA的表达水平增高[17],与TPOAb、TGAb等自身抗体显著相关,协同其他炎症因子作用不同的甲状腺致病表型。
MCP-1及TPOAb水平与HT的发生率呈正相关,此为自身免疫性甲状腺炎发病机制的一部分[18]。此外,MCP-1、IL-17、IL-23A、IL-6等细胞因子在甲状腺眼病患者眼眶结缔组织中高度表达,与血清TSH-R刺激抗体浓度显著相关并影响临床活动评分[19]。
IL-17也称为IL-17A,具有多种生物学功能[20],它通过促进中性粒细胞募集和巨噬细胞炎症因子产生等介导保护性免疫和增强屏障功能,驱动的炎症通常由调节性 T 细胞、IL-6和IL-10等调控。如果失调,IL-17 可以在感染或自身免疫的情况下促进免疫病理学变化。IL-17在全身和局部都介导免疫反应,并且与甲状腺眼病的临床活性相关[21]。前期研究表明[17],IL-17 可激活 NF-κB 信号通路,刺激 TNF-α、IL-6 和 IFN-γ 等炎症因子的产生和释放,并参与自身免疫性甲状腺损伤。IL-17驱动了炎症的级联放大效应,激活的炎症因子破坏了甲状腺滤泡细胞和组织,导致甲状腺激素水平紊乱和抗体不断产生。自身免疫过程本身可能对组织重塑产生重大影响[7],部分患者机体对甲状腺激素的敏感性降低[22],造成血脂和血糖水平等代谢紊乱,并且与性别特定关联,女性多于男性[23],与本研究结果一致。
在本研究中无论TPOAb阳性组还是TGAb阳性组VCAM-1、MCP-1、IL-17、IL-6与TPOAb及TGAb均呈显著正相关,表明在HT中各炎症因子间相互促进分化调节过程,诱导炎症程度越强,刺激机体应激反应产生的抗体越多,生物学效应越紊乱。TPOAb阳性组和TGAb阳性组中VCAM-1、MCP-1、IL-17、IL-6水平没有显著性差异,双阳组中这4种因子较单抗体阳性组显著升高,考虑由于HT患者TPOAb的升高与炎症有关,随着炎性细胞大量浸润,甲状腺组织被逐渐破坏,导致TG逐渐释放,TGAb与TG结合后,再通过NK细胞破坏甲状腺细胞[24]。因此,认为TPOAb与TGAb双阳性时,对甲状腺组织的破坏性更强,更容易加重炎症程度。虽然目前没有明确的证据能证明TGAb可直接破坏甲状腺组织,但高滴度的TGAb对本病的诊断有重要意义[25]。本研究结果表明,TGAb阳性组炎性因子水平较正常对照组显著升高,甲状腺激素水平紊乱,推测TGAb诱导炎症水平升高间接破坏甲状腺组织。
本研究两两比较结果发现,甲状腺自身抗体单阳组和双阳组4种炎症因子的表达水平高于正常组,双阳组又高于单阳组。经多因素分析结果显示,VCAM-1、MCP-1、IL-17是不同甲状腺功能抗体异常的危险因素。TPOAb可介导NK细胞活化和增强靶抗原表达细胞杀伤,介导免疫细胞募集和攻击正常组织;恶化炎症状态,产生更多的炎症因子直接损害甲状腺细胞[26]。因此,VCAM-1、MCP-1、IL-17可以作为预测HT炎症破坏程度和评估病情变化的有效指标,也为免疫治疗桥本甲状腺炎提供理论基础。
本研究的不足之处:缺乏对甲状腺功能抗体水平纠正后VCAM-1、MCP-1、IL-17、IL-6的水平变化的分析。
作者贡献声明
卢亚敏:提出研究思路,设计实验,统计分析,撰写及修改论文;邢晨皓,陈芳,刘光霞,侯瞻,张溢文:数据收集,统计分析,数据评估,撰写论文。
利益冲突声明
本研究未受到任何第三方资助,不存在潜在利益冲突。

