瑞马唑仑全麻诱导对股骨骨折切开复位内固定手术患者的镇静效果*
丁后友 杨 芳
(安徽卫生健康职业学院附属医院麻醉科 安徽池州 247000)
切开复位内固定手术是临床常见的术式之一,是一种通过手术的方式显露骨折部位,对骨折端进行修正与复位,并根据骨折情况使用合适的内固定物,使复位后位置保持一致的治疗方案。切开复位内固定可将影响骨折愈合的不利条件转为有利条件[1],还可避免外固定利于术后锻炼,促进患者康复。研究表明[2],在极度疼痛与肌肉痉挛的影响下,骨折复位的难度较高,因此切开复位术时对麻醉镇静的要求较高,需要在完全无痛与肌肉松弛的状态下完成操作。丙泊酚是临床常用的短效静脉麻醉药物,主要用于全身麻醉诱导与维持。瑞马唑仑是新上市的镇静药物,使用于无痛诊疗镇静、全身麻醉以及局麻镇静等多种领域中。该研究使用瑞马唑仑与丙泊酚用于股骨骨折切开复位内固定手术患者全麻诱导中,分析两种药物对患者的镇静作用以及对认知功能的影响,为临床用药提供参考。现报道如下:
1临床资料与方法
1.1一般资料
2020年8月~2021年3月安徽卫生健康职业学院附属医院行股骨骨折切开复位内固定手术患者80例,根据样本量计算公式以及相关参数[3],计算得出对照组与观察组样本,每组均40例。纳入标准:①所有患者均行切开复位内固定手术治疗;②年龄<60岁;③病例资料信息齐全;④无手术禁忌症;⑤家属知晓研究内容,并签署知情同意书。排除标准:①长期服用镇静或镇痛药物者;②合并严重心、肝、肾器官疾病者;③镇痛药物或麻醉药物敏感史;④合并颅脑损伤与颅内高压者本研究符合赫尔辛基宣言关于医学伦理研究建议。两组患者性别、年龄、体重指数、美国麻醉师协会(american society of anesthesiologists,ASA)分级等一般资料差异无统计学意义(p<0.05),见表1。
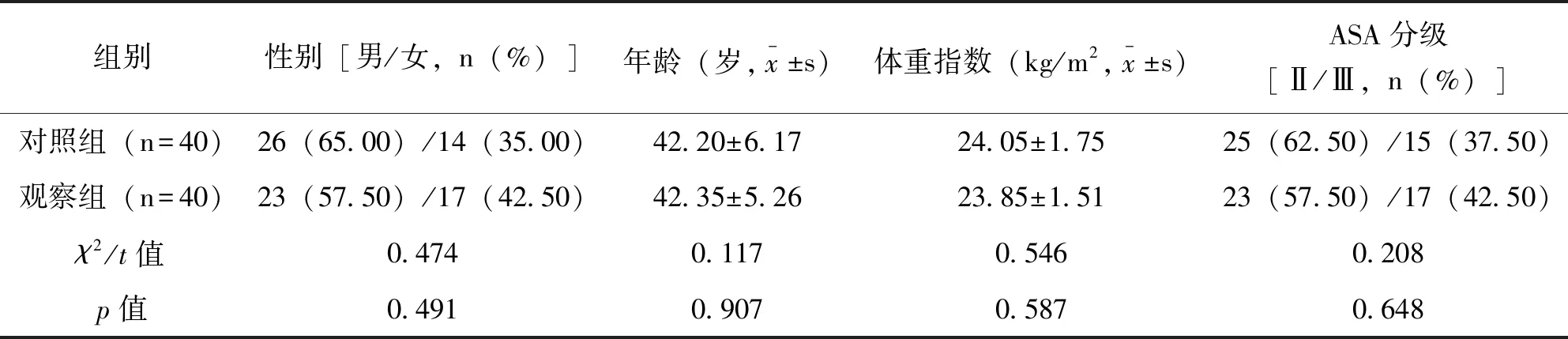
表1 两组一般资料比较
1.2实验设计
采用随机、双盲对照研究,对照组行丙泊酚(广东嘉博制药有限公司,国药准字H20051842)麻醉诱导,观察组行瑞马唑仑(江苏恒瑞医药股份有限公司,国药准字H20190034)麻醉诱导,两组均采用0.2 mg/kg阿曲库铵(江苏恒瑞医药股份有限公司,国药准字H20174008)、4 μg/kg芬太尼(河南羚锐制药股份有限公司,国药准字H20163277)维持麻醉。所有药品均统一制作包装,确保外观相同,按照随机表编号区分。
1.3麻醉方法
两组患者均行股骨骨折切开复位内固定手术治疗,入室后仰卧位,建立外周静脉通路,输注乳酸钠林格液,监测患者心率(heart rate,HR)、心电图(electrocardiogram,EGG)、脑电双频指数(bispectral index,BIS)、血氧饱和度(blood oxygen saturation,SpO2),有创动脉穿刺置管术监测平均动脉压(mean arterial pressure,MAP)、心指数(cardiac index,CI)与每搏输出量指数(stroke volume index,SVI)。气管插管全麻诱导:对照组30 s注射1.5 mg/kg丙泊酚,静脉注射0.2 mg/kg阿曲库铵、4 μg/kg芬太尼,待达到气管插管条件时行气管插管。麻醉诱导过程中若BIS持续>60,则注射0.5 mg/(kg·次)丙泊酚补救镇静。观察组30 s静注瑞马唑仑0.3 mg/kg,静脉注射0.2 mg/kg阿曲库铵、4 μg/kg芬太尼,行气管插管。麻醉诱导过程中若BIS持续>60时,静注瑞马唑仑0.05 mg/(kg·次)补救镇静,直至BIS≤60,间隔给药时间>1 min。
1.4观察指标
1.4.1麻醉指标及镇静效果评价 记录起效时间(注射丙泊酚与瑞马唑仑开始至BIS≤60的时间)、停药后拔管时间、补救镇静率,以及麻醉诱导过程中高血压、低血压、心动过缓、低氧血症发生情况;记录患者麻醉诱导前(T0)、气管插管时(T1)、拔管时(T2)、拔管后15 min(T3)时的HR、舒张压(diastolic blood pressure,DBP)、收缩压(systolic blood pressure,SBP)水平、血氧饱和度(oxygen saturation,SpO2)、呼气末二氧化碳(end tidal carbon dioxide tension,PETCO2)水平。
1.4.2认知功能评价 采用简易智力状况检查法(mini-mental state examination,MMSE)[4]量表评估并记录术前、术后3 d、5 d的认知功能,主要包括时间、地点定向力、即刻记忆、注意力与计算力、延迟记忆、语言、视空间,共30项题目,分值0~30分,得分越高,患者认知功能越好,低于27分为认知功能受损,其中<10分为重度认知功能受损;10~20分为中度认知功能受损;21~26分为轻度认知功能受损。
1.4.3实验室指标 采集术前、术后3 d两组患者空腹静脉血,分离血清后采用印迹法测定血清中Tau蛋白、p-Tau蛋白以及载脂蛋白E(apolipoprotein,ApoE)的表达。
1.4.4 Ramsay镇静评分[5]标准 1分:烦躁、焦虑不安;2分:安静清醒;3分:嗜睡、依从性较强;4分:入睡速度快、可唤醒;5分:入睡状态时对可唤醒有轻微反应;6分:深睡不醒。视觉模拟评分(visual analogue scale,VAS)[6]:分值0~10分,得分越高,疼痛感越强烈。
1.5统计分析

2结果
2.1 两组Ramsay镇静评分、VAS评分比较
两组麻醉诱导起效时间、VAS接近,差异无统计学意义(p<0.05);观察组术后1 h、术后4 h的Ramsay评分低于对照组(p<0.05),见表2。
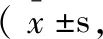
表2 两组Ramsay镇静评分、VAS评分比较分)
2.2 手术前后MMSE评分与认知障碍发生率
术前,两组患者MMSE评分相当,术后3 d、5 d时观察组高于对照组(p<0.05),两组认知功能障碍发生率相当(p>0.05),见表3。

表3 两组手术前后MMSE评分与认知障碍发生率比较
2.3 认知功能血清指标比较
与术前相比,两组患者Tau蛋白、p-Tau蛋白以及ApoE水平均升高,观察组上升幅度低于对照组(p<0.05),见表4。

表4 两组认知功能血清指标比较
2.4 不同时相血流动力学指标比较
T0时,两组HR、SBP、DBP、SpO2、PETCO2水平相当(p>0.05);T1、T2、T3时观察组HR、SBP、DBP、SpO2、PETCO2水平均低于对照组(p<0.05),见表5、6。

表5 两组不同时相血流动力学指标比较
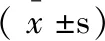
表6 两组血氧指标比较
2.5 不良反应比较
观察组低血压、低氧血症、注射痛不良反应发生率低于对照组(p<0.05),见表7。

表7 不良反应发生率分析[n(%)]
3讨论
股骨骨折切开复位内固定手术是临床治疗骨折患者常用手段之一,具有较好的临床优势,可使骨折端达到解剖复位,且有效的内固定可使患者较快的恢复运动功能,尽早下床活动,促进康复。但股骨骨折切开复位也存在一定的缺陷,如手术创伤较大,术后感染风险较大,且对于股骨近端骨质疏松者而言手术失败率较高,因此实行该手术时应加强抗感染治疗,积极避免术后感染发生;同时符合手术适应症,杜绝股骨骨折切开复位手术禁忌症患者,以期提高手术成功率。切开复位内固定术在骨折局部出血与疼痛的强烈刺激之下,患者极易发生休克,并发症发生率高[7],因此对麻醉的要求极高,需要完全无痛与肌肉松弛的情况下完成复位。目前临床上麻醉诱导药物选择较多,如咪达唑仑与异丙酚各有优缺点,仍存在呼吸抑制、血压下降、注射痛、药物蓄积等缺陷[8],难以兼具有效且安全的要求,合理选择麻醉诱导药物对手术成功率以及患者预后具有重要影响。
该研究结果显示,观察组术后1 h、术后4 h的Ramsay评分均低于对照组,提示瑞马唑仑具有良好的镇静镇痛效果,对患者血流动力学的影响较小。瑞马唑仑是近年来新上市的镇静药物,打破了国内外镇静药物领域近30年无创性药上市的局面,具有重要的现实意义。瑞马唑仑是一种强速效的γ-氨基丁酸A型受体(γ-Aminobutyric acid type A,GABAa)激动剂[9],主要作用于GABAa受体,抑制神经元的兴奋性,还可通过氟马西尼逆转,用于全麻诱导时,兼具丙泊酚的有效性与咪达唑仑的安全性。瑞马唑仑在无痛诊疗镇静、全身麻醉、ICU镇静以及局麻镇静等诸多领域中均有所使用,且取得满意的镇静效果。
研究结果显示,观察组术后MMSE评分高于对照组,且Tau蛋白、p-Tau蛋白、ApoE水平低于对照组,提示瑞马唑仑对患者认知功能的影响较小,但两组患者认知功能障碍发生率相当,并差异无统计学意义。其原因考虑与瑞马唑仑作为超短效药特有的代谢方式以及特性有关[10],瑞马唑仑经非特异性血浆酯酶快速代谢,在机体内蓄积时间较短,同时代谢物活性较低,代谢物经肾脏排出,麻醉镇静残留较小,麻醉恢复较快,对患者认知功能的影响较小。由于切开复位内固定手术创伤性较大,疼痛刺激感较强,患者交感神经兴奋,极易造成血压升高、心动过速,刺激突触功能,致使血流动力学不稳定,影响患者的脑血流,进而术后出现认知紊乱现象[11]。而瑞马唑仑则可改善这一现象,降低对认知功能的影响。Tau蛋白是机体的生理性蛋白,通常在人脑中Tau蛋白、p-Tau蛋白含量极低,认知功能障碍发生时Tau蛋白、p-Tau蛋白磷酸化后含量显著增加[12]。ApoE在认知功能障碍的发病机制中发挥重要作用,神经细胞破坏后会诱导ApoE水平过量表达[13],进一步使Tau蛋白磷酸化增加,损伤突触功能与线粒体功能,从而加重对认知功能的损伤。研究证实[14],瑞马唑仑通过上调ApoE的表达,降低Tau蛋白的磷酸化程度,以降低对患者认知功能的损伤。MMSE是临床常见的评估认知功能的量表指标,对评估患者认知功能具有重要的指导作用。近年来临床对血清Tau蛋白、p-Tau蛋白、ApoE指标的研究不断深入,部分学者认为上述血清指标可作为评估认知功能的客观量化指标,对评估患者的认知功能具有重要的指导意义。钱焕丽等[15]研究中将瑞马唑仑用于全麻腹腔镜胆囊切除手术麻醉诱导中,结果显示对患者认知功能影响较少,安全性较好。这一结论与该研究观点一致。
观察组气管插管时、拔管时、拔管后15 min时观察组HR、DBP、SBP、PETCO2水平均低于对照组。分析其原因,可能是瑞马唑仑作为一种新型的水溶性短效苯二氮类药物,其作用机制与咪达唑仑类似,通过作用于GABAa受体,促使GABAa受体活性增强,由于细胞外氯离子浓度高于细胞内,促使氯离子顺浓度梯度进入细胞内[16],进而使细胞内膜电位增加,引起超极化,致使兴奋性降低,从而抑制神经元电活动,产生镇静作用。研究指出[17],瑞马唑仑静脉注射后,可在体内快速被非特异性酯酶水解成唑仑丙酸,该物质对GABAa受体的亲和力较低,几乎不具备药理活性,因此患者术后恢复较快。HR、DBP、SBP、PETCO2水平是临床评估患者围术期血流动力学的常见指标,血流动力学指标稳定是评估镇静镇痛药物效果的重要指标。相关研究证实[18],瑞马唑仑可延长起效时间,且对患者HR、血压的影响较小,血流动力学趋于稳定;并具有较好的镇静效果。与该研究观点一致。
该研究结果显示,观察组几乎未发生低血压、低氧血症、心动过缓、注射痛等不良反应,具有较好的安全性。研究证实[19],瑞马唑仑在体内代谢迅速,几乎不会蓄积,且无注射痛,安全性较好,与咪达唑仑类似。由于股骨骨折切开复位手术难度较高,对麻醉的要求较为严格,瑞马唑仑避免了丙泊酚与咪达唑仑两种药物的缺点,与咪达唑仑相比,1 min可达血药浓度峰值,在患者体内滞留时间仅为咪达唑仑的1/7,且半衰期为1 h,起效快速,可达到较好的镇静效果,且具有良好的可控性,通过抑制神经元的兴奋性,减少机体活动,同时对循环系统影响较少,对血流动力学影响较小,利于手术的进行与完成。使用瑞马唑仑镇静期间应密切关注血压,若出现低血压现象,应立即予以处理,必要时可根据实际情况予以升压药物处理。BIS可通过具体的数值直观反映患者镇静深度,便于手术期间调控给药。大量实验证实[20],瑞马唑仑在0.075~0.300 mg/kg的范围内递增给药可促使镇静加深,BIS值为40~65时处于麻醉状态。目前临床中关于瑞马唑仑用于切开复位内固定手术麻醉诱导的相关研究极少,该研究创新性地运用瑞马唑仑于股骨骨折切开复位内固定手术患者麻醉管理中,取得较好的麻醉、镇静效果,且对患者的认知功能与血流动力学影响较小,具有较好的安全性。瑞马唑仑具有丙泊酚的有效性以及咪达唑仑的安全性,起效快、可控性好、代谢产物无活性、术后恢复快等诸多优势,几乎不会产生低血氧症、注射痛等不良反应,具有较好的运用前景。但研究仍存在不足,关于瑞马唑仑对患者认知功能影响的作用机制仍需进一步、深入研究。
综上所述,瑞马唑仑作为一种超短效GABAa受体激动剂,用于股骨骨折切开复位内固定手术时具有较好的镇静作用,对患者心率、血压以及认知功能的影响较小,起效时间延长,镇静效果满意;且代谢迅速,药效不蓄积,兼具安全性与有效性,具有良好的运用前景。

