生长抑素联合艾司奥美拉唑对重症急性胰腺炎患者炎症指标及肠道黏膜屏障功能的影响研究*
钟金金,高 天
江西省上犹县人民医院感染科,江西 赣州 341200
急性胰腺炎(AP)属于急性消化系统疾病,主要以血清淀粉酶升高、上腹痛及恶心、呕吐等表现为主。依据AP的严重程度,可分为轻症AP 及重症AP(SAP),SAP 不仅具有AP 常见临床症状,还会出现胰腺囊肿、胰腺出血及其他器官功能障碍[1]。抗感染、禁食解痉及纠正水、电解质紊乱为治疗SAP 的常规方法,除此以外,可加入抑制胃酸分泌的质子泵抑制剂艾司奥美拉唑(ESOM),使患者的胃黏膜血液循环得以改善,减轻胃肠道组织的损伤[2]。生长抑素(SS)作为治疗SAP 的重要药物,是胰酶分泌的抑制剂,可增强患者免疫功能,抑制胃肠道消化酶的分泌,保护胰腺细胞[3]。鉴于此,本研究将探讨SS 联合ESOM 治疗SAP患者的临床效果,现将结果报告如下。
1 资料与方法
1.1 一般资料
选择2020 年1 月—2021 年12 月江西省上犹县人民医院治疗的62 例SAP 患者作为研究对象,按随机数表法分为对照组和观察组,每组各31 例。观察组:男17 例,女14 例;年龄25~67 岁,平均年龄(43.87±5.20)岁;体质量指数(BMI)18.20~27.90 kg/m2,平均BMI(22.87±1.20)kg/m2;病因为暴饮暴食SAP 8 例,酗酒SAP 10 例,胆源性SAP13例。对照组:男20例,女11例;年龄22~68岁,平均年龄(44.17±5.16) 岁; BMI 18.10~27.70 kg/m2, 平均BMI(22.80±1.24)kg/m2;病因为暴饮暴食SAP 8例,酗酒SAP 9例,胆源性SAP 14 例。两组患者一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准通过。
1.2 入选标准
(1)纳入标准:①签署知情同意书。②SAP 诊断标准[4]。③能够耐受SS、ESOM 治疗。(2)排除标准:①精神行为异常,依从性较低,无法积极配合临床诊治。②合并恶性肿瘤。③存在其他胰腺疾病。④妊娠、哺乳期女性。
1.3 方法
两组患者均进行禁食、预防感染及控制酸碱平衡等常规治疗。对照组采用ESOM(瑞阳制药股份有限公司,国药准字H20193353)治疗,静脉滴注40 mg 的ESOM+生理盐水100 mL,2 次/d。观察组采用SS(江苏海岸药业有限公司,国药准字H20066708)与ESOM 联合治疗,ESOM 使用方法同对照组;静脉注射3 mg的SS+生理盐水100 mL,1次/d。两组患者均连续治疗7 d。
1.4 观察指标
(1)临床疗效:治疗7 d后评估疗效,实验室指标恢复正常水平,临床症状基本消失为显效;实验室各项指标明显改善,临床症状好转为有效;实验室各项指标及临床症状均未改善或恶化为无效。显效率+有效率=总有效率(RR)。(2)临床症状缓解时间:统计两组患者腹胀、发热、腹痛及恶心呕吐等临床症状缓解时间。(3)病情改善情况:治疗前、治疗7 d 后采用Ranson 评分系统评估,该系统包括入院时5 项指标(年龄>55 岁、白细胞计数>16×109/L、血糖>11.1 mmol/L、AST>250 U/L、乳酸脱氢酶>350 U/L)及48 h 的6 项指标(血钙浓度<2 mmol/L、红细胞压积减少>10%、动脉氧分压<60 mmHg、碱缺失>4 mmol/L、体液丢失量>6 L、血尿素氮上升>1 mmol/L),总分0~11分,评分越高,病情越严重。(4)健康状况:治疗前、治疗7 d 后采用急性生理与慢性健康状况Ⅱ(APACHEⅡ)评分标准评估,包括慢性健康状况评分、年龄评分及急性生理性评分,最高分71 分,评分越高,患者病情越严重,健康状况越差。(5)炎症指标及肠道黏膜屏障功能:于上述相同时间点采集两组患者空腹静脉血,采用酶联免疫吸附法测定C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)及内皮素(ET)、二胺氧化酶(DAO)、D-乳酸(D-LA)水平。(6)统计两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效情况
观察组患者治疗RR 高于对照组,差异有统计学意义(P<0.05),见表1。
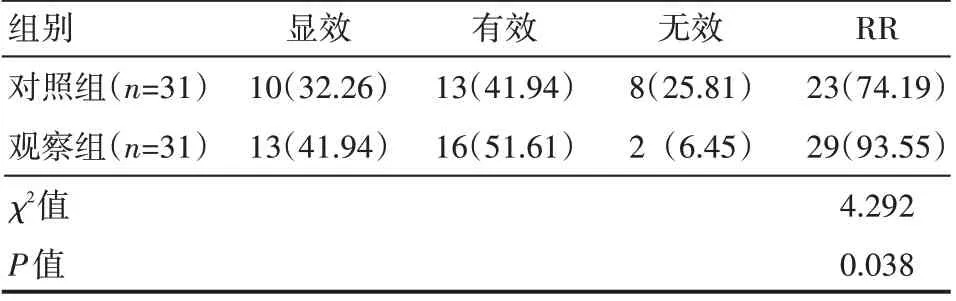
表1 两组患者临床疗效情况例(%)
2.2 两组患者临床症状缓解时间情况
观察组患者腹胀缓解时间、发热缓解时间、腹痛缓解时间及恶心呕吐缓解时间均短于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者临床症状缓解时间情况(±s)d

表2 两组患者临床症状缓解时间情况(±s)d
组别对照组(n=31)观察组(n=31)t值P值腹胀缓解时间6.85±2.11 5.53±1.98 2.540 0.014发热缓解时间4.71±1.63 3.83±1.35 2.315 0.024腹痛缓解时间5.93±2.04 4.79±1.86 2.299 0.025恶心呕吐缓解时间3.78±1.15 3.05±0.97 2.702 0.009
2.3 两组患者治疗前后Ranson 评分及APACHEⅡ评分情况
治疗前,两组患者Ranson 评分及APACHEⅡ评分比较,差异无统计学意义(P>0.05);治疗后,观察组Ranson 评分及APACHEⅡ评分均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后Ranson评分及APACHEⅡ评分情况(±s)分

表3 两组患者治疗前后Ranson评分及APACHEⅡ评分情况(±s)分
组别对照组(n=31)观察组(n=31)t值P值Ranson评分治疗前4.68±1.40 4.83±1.35 0.429 0.669治疗后2.37±1.03 1.55±0.69 3.683 0.001 APACHEⅡ评分治疗前14.55±3.08 14.19±3.21 0.451 0.634治疗后8.13±2.24 6.71±1.95 2.662 0.010
2.4 两组患者CRP及TNF-α水平情况
治疗前,两组患者CRP 及TNF-α水平比较,差异无统计学意义(P>0.05);治疗后,观察组CRP 及TNF-α水平均低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者CRP及TNF-α水平情况(±s)
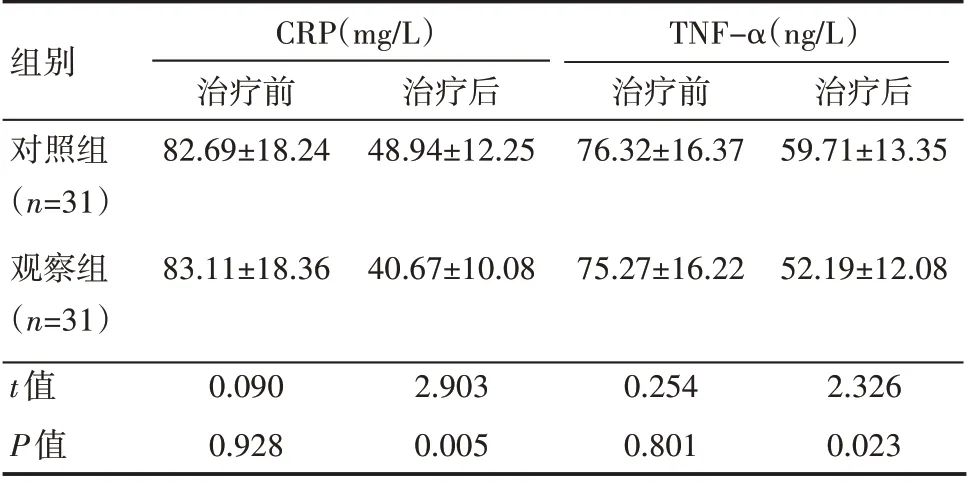
表4 两组患者CRP及TNF-α水平情况(±s)
组别对照组(n=31)观察组(n=31)t值P值CRP(mg/L)治疗前82.69±18.24治疗后48.94±12.25 TNF-α(ng/L)治疗前76.32±16.37治疗后59.71±13.35 83.11±18.36 40.67±10.08 75.27±16.22 52.19±12.08 0.090 0.928 2.903 0.005 0.254 0.801 2.326 0.023
2.5 两组患者治疗前后ET、DAO及D-LA水平情况
治疗前,两组患者ET、DAO 及D-LA 水平比较,差异无统计学意义(P>0.05);治疗后,观察组ET、DAO 及D-LA 水平均低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后ET、DAO及D-LA水平情况(±s)
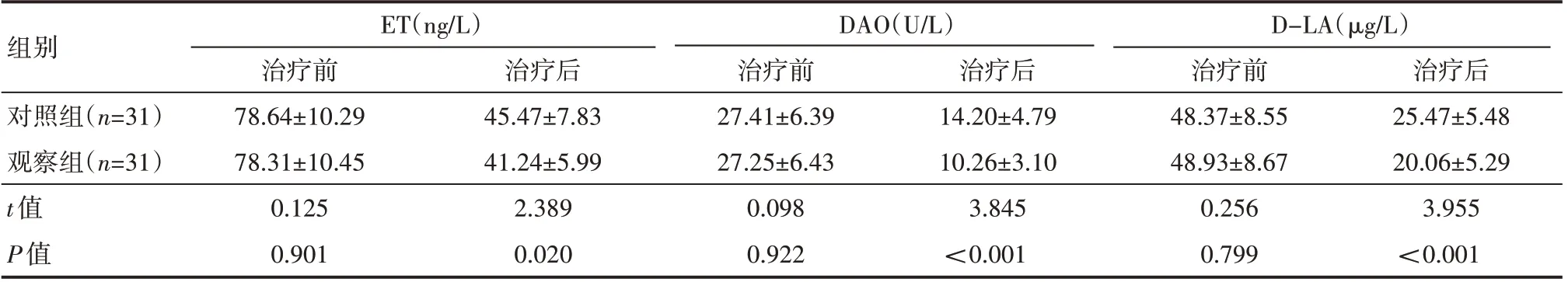
表5 两组患者治疗前后ET、DAO及D-LA水平情况(±s)
组别对照组(n=31)观察组(n=31)t值P值ET(ng/L)治疗前78.64±10.29 78.31±10.45 0.125 0.901治疗后45.47±7.83 41.24±5.99 2.389 0.020 DAO(U/L)治疗前27.41±6.39 27.25±6.43 0.098 0.922治疗后14.20±4.79 10.26±3.10 3.845<0.001 D-LA(μg/L)治疗前48.37±8.55 48.93±8.67 0.256 0.799治疗后25.47±5.48 20.06±5.29 3.955<0.001
2.6 两组患者不良反应发生情况
观察组不良反应发生率为16.13%(5/31,呕吐3例,腹泻2 例),对照组不良反应发生率为9.68%(3/31,呕吐2例,腹泻1 例)。两组患者不良反应发生率比较,差异无统计学意义(χ2=0.144,P>0.05)。
3 讨论
SAP 属于急腹症,病情复杂凶险且发展快速,发病早期即可出现感染、全身炎症反应综合征等症状,更为严重者会出现多器官功能衰竭,患者预后较差。目前,SAP 发病机制尚未明晰,但SAP 的发生与胆道疾病、暴饮暴食及酗酒等情况具有密切联系[5]。SAP 以药物治疗为主,ESOM属于质子泵抑制剂,可抑制胃酸及胃蛋白酶分泌,促进胃黏膜修复[6]。单独采用ESOM 可延缓SAP 患者病情进展,但少数患者采用ESOM治疗后,病情仍不断严重,甚至休克。
SS 可作用于胃肠道、下丘脑等组织脏器中,对胃酸及胃蛋白酶的产生进行抑制,抑制胰腺分泌胰酶,促进胰腺胆汁外排。外源性加入SS 可降低迷走神经兴奋性,改善氧化应激反应,减轻或消除炎症反应[7]。目前,用于SAP 严重程度的评分系统主要包括Ranson 评分及APACHEⅡ评分,其中,Ranson 评分是预测SAP 患者结局最为关键因素,包含患者入院时5 项临床指标及入院后48 h 的6 项指标,在SAP 的诊治过程中发挥了重要作用;APACHEⅡ评分已被广泛用于SAP、严重脓毒症及急性冠脉综合征等危重疾病的严重程度及预后评估中,是目前判断重症患者死亡情况的常用指标[8]。本研究结果表明,SS 联合ESOM 治疗SAP 患者效果更佳,有利于缓解患者临床症状,控制其病情,改善其健康状况。研究[9]发现,炎症反应是导致SAP 患者病情进展的重要原因,CRP 作为敏感的炎症标志物,在炎症反应早期即可大量合成并释放入血,CRP 水平与机体炎症严重程度呈正相关。TNF-α可诱导炎性因子的生成,TNF-α水平上升,会介导破坏血脑屏障,造成脑水肿,通过测定TNF-α水平,可反映患者病情[10]。本研究结果表明,SS 联合ESOM 治疗SAP 患者有利于抑制机体炎症反应,降低CRP 及TNF-α水平。SAP 患者的肠黏膜屏障受损,肠道中微生物进入血液,其中,ET 由肠道病原菌产生,在肠黏膜功能受损时,ET 可大量进入循环血。DAO 是一种活性度较高的细胞内酶,肠黏膜细胞损伤后,可随坏死脱落肠黏膜细胞进入肠腔,导致循环血中DAO 增加。D-LA 是细菌发酵产物,SAP 患者肠道黏膜通透性增加,D-LA 由此进入血液循环[11]。本研究结果表明,SS 联合ESOM 治疗对SAP 患者的肠道黏膜屏障功能改善效果更佳,且不良反应并未增加。SS 可加速营养物质转换,促使体内蛋白质的生成,降低血管阻力,减轻胰腺水肿及肠黏膜屏障损伤,并可抑制迷走神经兴奋性及炎性细胞因子释放,减少胰腺、胰酶分泌,促进胰腺组织的修复[12]。ESOM 可对肠道黏膜进行保护,对胃壁细胞分泌胃酸进行抑制,减轻肠道损伤,进而促进胰腺修复,改善肠黏膜屏障功能,两种药物联合使用可发挥协同作用,延缓SAP 炎症进展,改善肠道黏膜屏障功能[13]。本研究仍存在一定的不足,如样本量少,有待今后临床扩大样本量,进行深入分析研究。
综上所述,SS 联合ESOM 治疗可降低SAP 患者CRP、TNF-α、ET、DAO、D-LA 水平,改善患者治疗效果,减轻其临床症状,加快其病情恢复,且不良反应发生率并未增加。

