Omega-3多不饱和脂肪酸改善奥硝唑致少弱精子症雄性小鼠精子发生的作用机制
0 引 言
近年来,婴儿出生率的降低成为社会上日益关注的问题,不孕不育是其中一个主要原因。根据WHO调查结果显示,约15%的育龄夫妇存在生育问题,而由男性所致不孕不育高达50%[1]。在男性不育的因素中,少弱精子症约占50%[2],少弱精子症病因复杂,许多影响生殖内分泌轴完整性、生殖器官发育和精子生成的因素都可能导致少弱精子症,例如精索静脉曲张、生殖道感染、睾丸损伤、服用药物和理化因素、氧化应激等[3],具有难治性和易复发性[4]。Omega-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)作为必需脂肪酸须通过饮食摄入,不能由哺乳动物机体内源性合成[5]。Omega-3家族包括二十碳五烯酸(EPA,20:5 n-3)和二十二碳六烯酸(DHA,22:6 n-3)等,已被证明是哺乳动物细胞膜结构和功能的重要组成部分[6],通过其抗炎抗氧化的作用[7]可用来治疗阿尔兹海默症[8]和心血管疾病[9]等。已有临床数据证实,与正常生育的男性相比,不育男性的血液和精浆中Omega-3 PUFAs的水平显著降低[10],而且在饮食中补充Omega-3 PUFAs可以有效地提高精子质量,保护男性的生育能力[11]。因此,Omega-3 PUFAs对少弱精子症的治疗具有良好的应用前景。奥硝唑[1-(3-氯-2-羟丙基)-2-甲基-5-硝基咪唑]是第三代硝基咪唑类衍生物,主要用于预防和治疗术后感染和生殖道感染,但是它也具有一定的毒性,是国内外公认的具有可逆性的雄性生殖毒性的药物[12]。有研究表明,使用800 mg/kg浓度的奥硝唑灌胃处理30 d可建立少弱精子症模型,并且在停药30 d、60 d以及90 d之后精液质量仍没有完全恢复[13]。因此,为探讨Omega-3 PUFAs对少弱精子症模型鼠的治疗效果及机制,本研究利用奥硝唑造少弱精子症模型鼠,在此基础上再用Omega-3 PUFAs进行挽救,初步探讨Omega-3 PUFAs改善精子发生的潜在靶点及其作用机制,为相关少弱精子症治疗药物的研究奠定理论基础。
1 材料与方法
1.1 动物与试剂18只6周龄SPF级C57BL/6J雄性小鼠由东部战区总医院比较医学中心提供,动物使用许可证:SYXK[军]2017-0037。标准饲料由江苏省捷通生物有限公司提供。所有动物的饲养均在清洁动物房内,环境温度控制在22~26 ℃、湿度50%~70%,光照∶黑暗周期12∶12 h。将18只小鼠按照随机数表法分为3组(每组6只):①对照组:予1%的羧甲基纤维素钠溶液灌胃,每2天1次,连续4周,再予玉米油(2 g/kg)灌胃,每2天1次,连续4周;②少弱精子症组:予奥硝唑(800 mg/kg,溶于1%的羧甲基纤维素钠溶液)灌胃,每2天1次,连续4周,再予玉米油(2 g/kg)灌胃,每2天1次,连续4周;③Omega-3 PUFAs挽救组:予奥硝唑(800 mg/kg,溶于1%的羧甲基纤维素钠溶液)灌胃,每2天1次,连续4周,再予Omega-3 PUFAs(2 g/kg)灌胃,每2天1次,连续4周。奥硝唑(O5879-5G)和羧甲基纤维素钠(C5678)均购自Sigma,Omega-3 PUFAs购自上海欧淬恩生物科技有限公司。SYCP3抗体(23024-1-AP,1∶200)、HO-1抗体(10701-1-AP,1∶2000)和β-actin抗体(66009-1-Ig,1∶50000)均购自Proteintech,γH2AX抗体(ab26350,1∶200)和DDX4抗体(ab13840,1∶100)均购自Abcam,Nrf2抗体(12721S,1∶1000)购自Cell Signaling Technology,罗丹明标记羊抗小鼠二抗(ZF-0313,1∶100)和异硫氰酸荧光素标记羊抗兔二抗(ZF-0311,1∶100)均购自中杉金桥,羊抗兔二抗(RS0002,1∶5000)和羊抗小鼠二抗(RS0001,1∶5000)均购自Immunoway。聚丙烯酰胺凝胶制备试剂盒(E303-01)购自Vazyme,二喹啉甲酸(BCA)法蛋白定量试剂盒(23227)购自Thermo,RNA提取试剂盒(082001)购自贝贝生物科技有限公司,RNA逆转录试剂盒(RR036A)购自Takara,实时定量PCR仪(LightcyclerR96)购自罗氏,促卵泡生成激素(follicle stimulating hormone,FSH)检测试剂盒(ml001910)、促黄体生成素(luteinixing hormone,LH)试剂盒(ml001984)、抑制素B(inhibin B,INHB)试剂盒(ml301823)和睾酮(testosterone,T)试剂盒(ml001948)均购自上海酶联生物科技有限公司。CO2培养箱(Mco-5AC)购自三洋公司,普通光学显微镜(SZX9)购自Olympus,蛋白质免疫印迹电泳仪(EPS 300)购自Tanon,快速湿转仪(L00686C)购自南京金斯瑞生物科技有限公司,激光共聚焦显微镜(LSM 800)购自德国卡尔蔡司公司。
1.2方法
1.2.1 样本采集小鼠造模并治疗结束后,眼球取血法收集小鼠血液,室温放置1 h,然后2100×g离心10 min,吸取上层血清于-80 ℃保存。将小鼠麻醉后,颈椎脱臼法安乐死,尽快解剖并取出小鼠双侧睾丸与附睾并称重。
1.2.2附睾尾精子计数和活动率检测将小鼠附睾按解剖结构定位取出附睾尾部分,立即置于400 μL人输卵管培养液中,用剪刀将附睾尾剪碎使精子游离出,37℃水浴10 min使精子充分释放到溶液中,取10 μL滴在血细胞计数板上,分别计数活动精子和不活动精子数量,计算公式:
精子数量(个/mL)=(A+B+C)/3×104×25(稀释倍数)
精子活动率(%)=活动精子数量/(活动精子数量+不活动精子数量)
A、B、C分别为显微镜下血细胞计数板上的3个区域内的精子计数。
1.2.3睾丸和附睾组织结构观察将新鲜的小鼠睾丸用改良波氏固定液固定24 h后换4%多聚甲醛,附睾组织直接固定在4%多聚甲醛中。石蜡包埋,常规石蜡切片,HE染色,光学显微镜下观察睾丸和附睾结构。
1.2.4小鼠血清中生殖激素水平检测采用ELISA方法按试剂盒说明书检测血清生殖激素水平(FSH、LH、INHB、T)。
1.2.5逆转录-荧光定量PCR(RT-qPCR)检测睾丸中生精细胞Marker基因表达水平取适量的小鼠睾丸组织,按照RNA提取试剂盒说明书提取组织总RNA,使用酶标仪检测总RNA浓度,按照RNA逆转录试剂盒说明书进行逆转录,得到的cDNA用于后续qPCR反应(95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共40个循环)。引物用Primer-Blast设计,由上海捷瑞生物工程有限公司合成,引物序列见表1。以GAPDH为内参,结果用2-△△Ct法进行分析,计算目的基因的相对表达量。

表 1 引物名称和序列Table 1 Primer names and sequences
1.2.6组织免疫荧光石蜡切片脱蜡至水,将组织切片置于盛满柠檬酸抗原修复液中于微波炉内(中火8 min,停火8 min,中低火7 min)进行抗原修复,用组化笔在组织周围画阻水圈,用0.1% Tween-20打孔20 min,用3%的BSA封闭30 min,孵育一抗DDX4,4 ℃冰箱内过夜,孵育异硫氰酸荧光素标记的羊抗兔二抗,室温2 h,Hochest复染细胞核,树脂封片,在显微镜下观察。
1.2.7精母细胞染色质铺展和免疫荧光将小鼠麻醉,颈椎脱臼法安乐死,解剖出睾丸,去除白膜后放入10 mL低渗液(50 mmol/L蔗糖,17 mmol/L柠檬酸三钠,30 mmol/L Tris,0.5 mmol/L二硫苏糖醇,0.1 mmol/L苯甲基磺酰氟和5 mmol/L乙二胺四乙酸,pH 8.2~8.4)中,冰浴60 min。然后将生精小管分散为大约3 mm直径的小块。加23 μL蔗糖溶液(100 mmol/L,pH 8.2)至玻片的组化圈中,将一块生精小管置于液滴中,使用刀片切碎,直至液体混浊。移开生精小管,再加入23 μL蔗糖溶液(100 mmol/L,pH 8.2),用枪头轻轻吹打,制备成均匀的细胞悬液。将一张新的玻片从固定液(含0.15% Triton X-100的1%多聚甲醛溶液,pH 9.2)中取出,倾斜玻片,仅保留角落的一滴液滴。吸取20 μL细胞悬液与那一滴固定液混合,缓慢倾斜玻片,使得细胞均匀地铺展。立刻将玻片放入湿盒中,静置2.5 h,使得染色质充分地分散。打开盒盖,室温自然晾干。将玻片放入含0.4% Photo-Flo 200的PBS中洗5 min,2次。自然晾干后即可进行免疫荧光实验:用3%的BSA室温封闭2 h,PBST洗3次,用PBST稀释一抗SYCP3和γH2AX,4 ℃孵育8~12 h,用PBST洗3次,孵育罗丹明标记的羊抗小鼠二抗和异硫氰酸荧光素标记的羊抗兔二抗,室温2 h。Hochest染色,室温15 min,PBST洗3次。加入抗淬灭剂封片,在激光共聚焦显微镜下观察。
1.2.8睾丸组织蛋白质提取和蛋白质免疫印迹取适量睾丸组织放入200 μL含1 mmol/L蛋白酶抑制剂和1 mmol/L苯甲基磺酰氟的RIPA裂解液中,用组织破碎仪充分研磨,4 ℃、13 000×g离心20 min后取上清,使用BCA试剂盒检测蛋白浓度。剩余上清加入5 X上样缓冲液后100 ℃水浴10 min使蛋白变性,于-20 ℃保存。取20 μg蛋白样品进行聚丙烯酰胺凝胶电泳,然后将蛋白转移到PVDF膜上,用TBST配置的5% BSA溶液室温封闭1 h,孵育一抗Nrf2、HO-1和β-actin,4 ℃冰箱内过夜。用TBST洗3次,Nrf2和HO-1孵育羊抗兔二抗、β-actin孵育羊抗小鼠二抗,室温1 h,用TBST洗3次,使用化学发光图像分析系统曝光显色并统计灰度值。
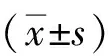
2 结 果
2.1 Omega-3 PUFAs对小鼠精子浓度、活动率的改善作用与对照组比较,少弱精子症组小鼠表现为少动、反应迟缓,体重增长缓慢(P<0.01),精子浓度与精子活动率也都显著降低(P<0.01)。与少弱精子症组比较,Omega-3 PUFAs挽救组小鼠的状态显著恢复,四处活动并且反应灵敏,体重没有恢复,但是精子浓度与精子活动率有显著提高(P<0.01)。说明Omega-3 PUFAs对小鼠精子浓度、活动率具有改善作用。见图1。

a:小鼠体重;b:小鼠精子浓度;c:小鼠精子活动率少弱精子症组与对照组比较,*P<0.05、**P<0.01与少弱精子症组比较,**P<0.01
2.2Omega-3 PUFAs对小鼠生殖激素水平的影响与对照组比较,少弱精子症组血清中FSH、LH、INHB和T均没有显著变化(P>0.05)。与少弱精子症组比较,Omega-3 PUFAs挽救组血清中FSH、LH、INHB和T也都没有显著变化(P>0.05)。说明Omega-3 PUFAs对小鼠生殖激素水平没有改善作用。见表2。
2.3Omega-3 PUFAs对小鼠睾丸和附睾组织结构的改善作用HE染色结果显示:与对照组比较,少弱精子症组的睾丸间质松散,生精细胞数量减少,排列紊乱,生精小管内精子数量减少,附睾间质轻度增宽,管腔内成熟精子数量减少。与少弱精子症组比较,Omega-3 PUFAs挽救组的睾丸结构则有所恢复,睾丸间质紧密,生精细胞数量增加,排列整齐,生精小管内精子数量变多,附睾间质变薄,管腔内成熟精子数量增加。说明Omega-3 PUFAs对小鼠睾丸和附睾组织结构具有保护作用。见图2。

表 2 Omega-3 PUFAs对小鼠生殖激素水平的影响Table 2 Effect of Omega-3 PUFAs on hormone levels in

与少弱精子症组比较,Omega-3 PUFAs挽救组睾丸睾丸间质紧密,生精细胞数量增加,排列整齐,管腔内精子数量变多;附睾间质变薄,精子数量增加;黄色箭头示典型的正常结构,红色箭头示典型的损伤结构
2.4Omega-3 PUFAs对小鼠生精细胞的改善作用组织免疫荧光结果显示:与少弱精子症组比较,Omega-3 PUFAs挽救组的睾丸中DDX4+阳性生精细胞数量显著增加。RT-qPCR结果显示:与少弱精子症组比较,Omega-3 PUFAs挽救组小鼠未分化精原细胞Marker基因Lin28、分化精原细胞Marker基因C-Kit的mRNA表达水平显著下降(P<0.01),精母细胞Marker基因SYCP3、圆形精子细胞Marker基因Tex21以及长形精子Marker基因Tnp1的mRNA表达水平显著上升(P<0.01)。说明Omega-3 PUFAs对小鼠包括精母细胞阶段以后的睾丸生精细胞具有改善作用。见图3。

a:免疫组织荧光检测小鼠睾丸组织生殖细胞中DDX4蛋白;b:RT-qPCR检测小鼠生精细胞Marker基因mRNA表达水平与少弱精子症组比较,**P<0.01
2.5Omega-3 PUFAs对小鼠精母细胞减数分裂的改善作用染色质铺展实验结果显示:与对照组比较,少弱精子症组的细线期(P≤0.05)和偶线期(P<0.01)的精母细胞比例增加,粗线期(P<0.01)的精母细胞比例降低,双线期的精母细胞数量没有显著变化,说明精母细胞的减数分裂过程受到影响。与少弱精子症组比较,Omega-3 PUFAs挽救组的细线期(P<0.01)和偶线期(P≤0.05)的精母细胞比例降低,粗线期(P≤0.05)的精母细胞比例增加,减数分裂过程恢复正常,说明Omega-3 PUFAs可以改善精母细胞减数分裂过程。见图4。
2.6Omega-3 PUFAs对小鼠睾丸氧化应激的改善作用RT-qPCR结果显示:与对照组比较,少弱精子症组的抗氧化应激基因NQO1(P≤0.05)的mRNA表达水平下降,HO-1、SOD3和CAT的mRNA表达水平有下降的趋势,但差异不明显(P>0.05)。与少弱精子症组比较,Omega-3 PUFAs挽救组的抗氧化基因HO-1(P>0.05)的mRNA表达水平有上升的趋势,NQO1(P<0.01)、SOD3(P<0.01)和CAT(P<0.01)的mRNA表达水平均上升。蛋白质免疫印迹结果显示,少弱精子症组较对照组抗氧化应激基因Nrf2和HO-1的蛋白表达水平下降,Omega-3 PUFAs挽救组显著提高了抗氧化应激基因Nrf2和HO-1的蛋白表达水平。说明Omega-3 PUFAs可以提高睾丸的抗氧化应激水平。见图5。

a:染色质铺展结果显示精母细胞第一次减数分裂前期的细线期、偶线期、粗线期和双线期(SYCP3:绿色荧光,γH2AX:红色荧光);b:精母细胞减数分裂各时期统计与对照组比较,*P<0.05、**P<0.01;与少弱精子症组比较,*P<0.05、**P<0.01
3 讨 论
不孕不育是世界卫生组织公认的全球性公共健康问题[14],其中男性因素占比高达50%,而少弱精子症是男性不育的一个重要因素。临床上发现不育男性的血液和精浆中Omega-3 PUFAs的水平较正常男性显著降低[10],在饮食中补充Omega-3 PUFAs可增加啮齿动物睾丸中的DHA浓度[15]和人类精子膜中的DHA含量[16],另外,精子膜中DHA含量与更高的精子活力、正常形态和浓度呈正相关[17]。在本研究中,与少弱精子症组比较,Omega-3 PUFAs挽救组小鼠的精子浓度与活动率显著提高,这与Afeiche等[18]和Attaman等[19]报道的Omega-3 PUFAs摄入量与精液质量之间存在正相关关系是一致的,表明Omega-3 PUFAs对精液质量具有改善作用。
文献报道,精子发生受多种激素的调节,例如FSH、LH、INHB、T[20]、胰岛素[21]和甲状腺激素[22]等都参与精子发生的调节,也与睾丸生精功能密切相关,出现一种或几种激素失衡均导致生精功能障碍[23]。FSH和LH由垂体合成释放,FSH主要调节精原细胞的自我更新以及减数分裂的起始[20],LH通过作用于睾丸间质细胞促进睾酮的合成[23],INHB由睾丸间质细胞和支持细胞产生,其水平可以反映睾丸的生精功能[24],T由睾丸间质细胞分泌,可以促进雄性生殖器官发育和精子的发生[25],并主要负责调节减数分裂的完成和精子变形[20]。有研究报道,400mg/kg的奥硝唑能够降低大鼠血清中INHB水平,但是FSH、LH和T水平没有显著变化,800 mg/kg的奥硝唑可以降低大鼠血清中T和INHB的水平,增加FSH和LH水平[26],人参糖蛋白可提高血清中催乳素、FSH以及T水平来改善少弱精子症小鼠生精障碍[27]。但是本研究结果表明,与对照组比较,少弱精子症组血清中FSH、LH、INHB、T激素水平没有显著差异,与少弱精子症组比较,Omega-3 PUFAs组血清中FSH、LH、INHB、T激素的水平也没有显著差异,提示Omega-3 PUFAs并不是通过调节生殖激素水平改善精子发生。
睾丸是精子生成的重要器官,附睾是精子贮存和成熟的器官,在健康状态下,睾丸中的生精小管排列整齐,管腔内有大量成熟精子,附睾间质厚度正常,具有大量精子。本研究结果显示,少弱精子症组的睾丸间质松散,生精细胞数量减少,排列紊乱,生精小管内精子数量减少,附睾间质厚度轻度增加,成熟精子数量减少,这与熊芬等[12]报道的研究结果一致,而Omega-3 PUFAs挽救组的睾丸间质紧密,生精细胞数量增加,排列整齐,生精小管内精子数量变多,附睾间质厚度变薄,成熟精子数量增加,提示Omega-3 PUFAs可以改善睾丸和附睾组织结构,提高精液质量。
DDX4是生殖细胞的Marker,文献报道,线粒体融合蛋白2敲除之后会导致减数分裂阻滞进而引起精子发生失败,同时DDX4+阳性细胞数量减少[28]。本研究结果表明,与对照组比较,少弱精子症组DDX4+阳性细胞数量减少,而Omega-3 PUFAs组DDX4+阳性细胞数量增加,提示Omega-3 PUFAs能够增加生殖细胞的数量。精子发生是一个复杂的过程,包括精原细胞的自我更新和分化、精母细胞减数分裂和精子细胞的变形[29],并将精子释放到睾丸的生精小管中[30]。文献报道,Omega-3 PUFAs能够显著地促进M1和M2巨噬细胞的分化和功能[31],Omega-3 PUFAs,尤其是其主要成分DHA可以促进神经干细胞的分化[32],说明Omega-3 PUFAs具有促进细胞分化的功能。Lin28、C-Kit、SYCP3、Tex21和Tnp1分别是未分化精原细胞、分化精原细胞、精母细胞、圆形精子细胞和长形精子的Marker基因,本研究结果表明,Omega-3 PUFAs可以降低Lin28、C-Kit基因mRNA表达水平,提高SYCP3、Tex21、Tnp1基因mRNA表达水平,说明Omega-3 PUFAs可减少未分化精原细胞和分化精原细胞的数量,增加精母细胞、圆形精子细胞和长形精子的数量,提示Omega-3 PUFAs促进了精原细胞向精母细胞的分化,进而促进精子发生。精母细胞负责进行减数分裂产生圆形精子细胞,减数分裂是所有有性生殖生物配子形成的重要阶段,约占整个精子生成过程的四分之一,其中减数分裂前期约占减数分裂过程的90%,通常可分为四个阶段:细线期、偶线期、粗线期、双线期[33]。在减数分裂过程中,DNA双链断裂的诱导和修复介导了同源染色体的联会、重组和交叉互换,以确保减数分裂中期染色体正确的排列在赤道板上,SYCP3是联会复合体的一部分,γH2AX是DNA双链断裂形成的标志,因此,通过SYCP3和γH2AX的染色可以区分精母细胞第一次减数分裂前期的细线期、偶线期、粗线期和双线期[34]。在细线期,联会复合体开始组装、DNA双链断裂,因此,SYCP3呈现不连续信号,γH2AX信号开始逐渐积累并弥漫在整个核中;在偶线期,随着联会复合体组装完成,同源染色体开始联会,DNA双链断裂被修复,因此,SYCP3呈现连续信号,γH2AX信号开始逐渐降低;在粗线期,同源染色体完全联会,因此,SYCP3呈现短棒状信号,常染色体处的γH2AX信号消失,但是由于XY染色体大小不一,无法完全联会,γH2AX信号仅出现在性染色体处;在双线期,同源染色体开始分离,SYCP3信号较粗线期变细,γH2AX信号仍然仅出现在性染色体处[35-37]。本研究结果显示,少弱精子症组减数分裂过程中细线期和偶线期精母细胞比例上升,粗线期精母细胞比例下降,双线期精母细胞比例没有显著差异变化,提示少弱精子症组中减数分裂在偶线期向粗线期的转化过程中发生了阻碍,这与Vendrell等[38]和叶楠等[39]报道的男性不育患者睾丸中精母细胞减数分裂进程存在异常一致,而Omega-3 PUFAs能够恢复减数分裂过程中细线期、偶线期、粗线期精母细胞的比例,提示Omega-3 PUFAs可以通过保护精母细胞的减数分裂过程进而促进精子发生。
氧化应激是导致男性不育的一个重要原因[40]。奥硝唑的生殖毒性主要包括:作用于附睾产生大量的丙二醛,抑制能量转换酶等使精子受损、成熟受阻;通过其分子中的硝基产生氨基或自由基,使附睾发生氧化应激,导致精子细胞结构损伤;抑制精子获能以及精卵结合等[12, 41-42],奥硝唑对睾丸也具有明显的损伤[12],但是对睾丸的损伤机制鲜有报道。Omega-3 PUFAs具有抗炎抗氧化的功能[43],可以保护睾丸避免氧化应激损伤[44],在饮食中补充抗氧化剂,特别是硒、锌、辅酶Q10和肉碱,以及某些富含这些补充剂的食物可以有益地调节精子质量参数并影响男性生育能力[11]。环境污染物短链氯化石蜡可以导致小鼠精液质量下降,降低睾丸抗氧化应激基因HO-1、NQO1的mRNA表达水平以及抗氧化酶SOD3、CAT活性,用白藜芦醇体外处理小鼠精母细胞系可以提高抗氧化应激基因Nrf2、HO-1的蛋白表达水平[45],Omega-3 PUFAs也可以通过激活3T3-L1脂肪细胞内的Nrf2来诱导HO-1的表达降低氧化应激压力[46]。本研究结果表明,与对照组比较,少弱精子症组睾丸中抗氧化应激基因mRNA及蛋白表达水平显著下降,与少弱精子症组比较,Omega-3 PUFAs挽救组睾丸中抗氧化应激水平显著提高,与Saw等[47]和Jones等[48]报道的Omega-3 PUFAs能够促进HO-1、NQO1、SOD3、CAT的mRNA表达是一致的,提示Omega-3 PUFAs可以减少睾丸中的氧化应激反应,进而改善精子发生与成熟。文献报道,褪黑素可以通过降低小鼠精母细胞系中的ROS水平保护线粒体功能[49],而线粒体功能受损会导致减数分裂过程阻滞[32],因此推测Omega-3 PUFAs是否通过提高睾丸抗氧化应激水平改善精母细胞线粒体功能,进而改善减数分裂过程,这是未来需要继续探索的问题。
综上所述,Omega-3 PUFAs对少弱精子症小鼠的生精障碍具有显著的改善作用,其作用机制可能与提高睾丸的抗氧化应激水平、改善精母细胞减数分裂过程有关,进而维持精子发生的正常进程,但Omega-3 PUFAs对精母细胞减数分裂过程的具体调控机制仍有待深入研究。

