Caveolin-2通过Hippo信号通路调控LPS诱导的小鼠肺泡巨噬细胞凋亡
廖浩宇,高 霏,陈 娟,丁伟超,陈 迁,任 艺,张 炜,孙兆瑞,聂时南
0 引 言
肺是人体进行气体交换的重要器官。由于持续的气体交换功能,肺部很容易成为空气中病原体、过敏原或其他有毒物质损伤的靶器官,在败血症、肺炎感染期间导致肺损伤[1]。每年,全球有超过2亿人死于各种肺损伤疾病[2]。肺损伤可分为急性和慢性,而急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)会在短时间内引起肺部大量炎性改变。不可逆的肺损伤是导致ALI/ARDS患者高死亡率的主要原因之一[2-4]。ALI的特点是白细胞聚集、上皮损伤、肺水肿以及弥漫性肺泡损伤,而ARDS是由多种致病因素导致的急性、进行性低氧血症,最终导致致死性呼吸衰竭[5]。此外,近年来由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新型冠状病毒肺炎疫情造成与肺炎相关的ARDS发病率大幅增加,大量患者因此死亡[6]。肺泡巨噬细胞占肺部免疫细胞的55%,在肺损伤炎症反应期间,通过吞噬吸入颗粒物和外来病原体并诱导细胞因子产生和抗原呈递来维持体内稳态[7-8]。有证据表明,肺泡巨噬细胞凋亡可以在肺损伤发生时维持肺部结构的稳定性,抑制过度的炎症反应,从而调控肺损伤的发展[9]。ARDS晚期患者预后极差,目前没有药物治疗显示出对改善患者生存有确切好处,影响肺泡巨噬细胞凋亡可能成为ALI/ARDS的治疗策略。
Hippo信号通路是一种进化保守的网络,可以被激素、炎症因子和微环境细胞类型等激活,通过调节细胞增殖和凋亡,在控制组织稳态、发育和再生方面发挥着核心作用[10-12]。越来越多的研究表明,Hippo信号通路与呼吸系统疾病密切相关,如肺炎、特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)、ALI、哮喘等[13-15]。如Hippo信号通路关键蛋白YAP的激活促进肺动脉血管平滑肌细胞增殖,从而导致肺血管重塑,加重了肺动脉高压;过表达的YAP促进肺成纤维细胞的增殖和胶原沉积,从而促进IPF[14]。此外,Hippo信号通路可能通过促进肺上皮祖细胞的增殖和分化以及干预肺毛细血管内皮的修复,从而参与ALI的修复过程[10]。
小窝(Caveolae)是位于大多数细胞质膜表面约50~100纳米的内凹陷样结构,小窝蛋白(Caveolin,Cav)是形成内陷质膜结构所必需的蛋白质,其参与信号传导、血管生成、细胞极性、胞吞作用、脂质代谢、膜结构稳定和炎症反应的调节,是生命活动的重要调节者[16-18]。大量研究证据表明,小窝和Hippo信号通路能够相互影响,例如小窝通过调节细胞表面积与体积的比率,通过改变机械应力激活Hippo信号通路[17];YAP/TAZ转录诱导编码Cav-1的重要基因,在YAP/TAZ缺陷细胞中,Cav-1的表达水平降低超过85%[19]。而另一些研究表明,肺是Cav-2表达最高的组织之一,Cav-2在没有Cav-1的情况下也在肺中特别表达,这表明Cav-2可能对肺有显著影响[18]。在本课题组的前期研究中发现,使用LPS刺激体外培养的小鼠肺泡巨噬细胞,与对照组相比,LPS组肺泡巨噬细胞凋亡比例增加,Cav-2的表达水平明显升高,YAP的表达水平明显上调。因此,我们推测Cav-2的表达可能通过Hippo信号通路调节肺泡巨噬细胞凋亡。综上所述,本研究旨在探究Cav-2/Hippo信号通路对肺泡巨噬细胞炎症和凋亡的影响,为肺部炎性疾病的治疗提供新的靶标。
1 材料与方法
1.1 主要试剂FBS血清(上海碧云天),RPMI-1640培养基(上海赛默飞),LPS脂多糖(上海赛默飞),SDS裂解液(上海碧云天),电泳缓冲液(美国Biorad公司),电转缓冲液(北京索莱宝),SYBR(上海科创达),Lipofectamine 2000,(上海赛默飞),BCA蛋白测定试剂盒(上海碧云天),总RNA提取试剂盒(武汉伊莱瑞特),逆转录试剂盒(武汉伊莱瑞特),TNF-αELISA检测试剂盒(ab208348,美国Abcam),IL-1βELISA检测试剂盒(ab197742,美国Abcam),IL-6ELISA检测试剂盒(ab100713,美国Abcam),CCK-8检测试剂盒(上海碧云天),ROS检测试剂盒(上海碧云天),Cav-2-shRNA(R208255547,美国Abcam),Cav-2+DNA(R208255548,美国Abcam),HRP标记的羊抗兔二抗(146270,美国Jackson immune research),荧光标记的羊抗兔二抗Alexa FluorTM488 donkey anti-rabbit IgG H+L (2156521,上海赛默飞),Bax(1∶1000,2772S,CST),Bcl-2(1∶2000,ab182858,Abcam),Bak(1∶1000,12105S,CST),cleaved-Caspase-3(1∶1000,9661S,CST),Caspase-3(1∶1000,9662S,CST),GAPDH(1∶10000,AB0037,Abways technology),YAP(1∶1000,8418T,CST),p-YAP(1∶1000,13008T,CST),Caveolin-2(1∶1000,Ab133484,Abcam)。
1.2实验方法
1.2.1 细胞培养小鼠肺泡巨噬细胞系MH-S购自美国ATCC细胞库。用含10% FBS和1%青霉素-链霉素的RPMI-1640培养基,于37℃含5%CO2的孵箱中培养。待MH-S细胞生长至80%密度左右进行传代,接种于不同培养皿中,取对数生长期的细胞进行实验。
1.2.2细胞转染细胞转染前,将125 μL的RPMI-1640培养基与5 μL的Lipofectamine 2000混合,再将125 μL的RPMI-1640培养基分别和10 μL的Cav2-shRNA与3.6 μL的Cav-2+DNA混合,室温下静置5 min,之后将Lipofectamine 2000与RPMI-1640培养基的混合物与含有Cav2-shRNA或Cav-2+DNA的RPMI-1640培养基混合,吹打混匀并室温下静置20 min。6孔板中MH-S细胞生长至60%~70%密度后,向每孔加入1 mL无血清无抗生素的RPMI-1640培养基和250 μL的混合物,在温箱中静置8 h后弃液,加入2 mL含10% FBS和1%青霉素-链霉素的RPMI-1640培养基继续培养。采用qRT-PCR和Western blot检测转染效率。
1.2.3实验分组将生长状态良好的MH-S细胞随机分为4组。①Control组:用于对照研究,正常培养;②LPS组:予不同浓度的LPS(0、0.1、1、5、10、20 μg/mL)处理24 h;固定浓度的LPS(10 μg/mL)处理不同时间(0、3、6、12、18、24 h);③sh-Cav-2组:使用Cav-2-shRNA转染细胞,后使用10 μg/mL LPS处理24 h;④OE-Cav-2组:使用Cav-2+DNA转染细胞,后使用10 μg/mL LPS处理24 h。
1.2.4CCK-8检测细胞活力将处理后的各组细胞接种于96孔板中,细胞密度为5×103/孔。培养24 h后,向每孔细胞中加入10 μL CCK-8溶液,37 ℃孵育2 h后,使用多功能酶标仪测定在450 nm处的吸光度,使用比值法计算细胞活力。该实验独立重复3次。
1.2.5ROS检测细胞活性氧水平将处理后的各组细胞均匀接种于孔板中,培养24 h后,吸净培养基,PBS洗涤1~2次,加入100 μL的DCFH-DA工作液,置于温箱中避光孵育30 min。吸除DCFH-DA工作液,用PBS洗涤2~3次,最后用PBS覆盖细胞,孔板内标记好的细胞直接置于共聚焦显微镜观察。
1.2.6细胞免疫荧光将处理后的各组细胞均匀接种于小皿,培养24 h。吸掉培养基,向每小皿加入2 mL 4%多聚甲醛室温固定10 min,PBS润洗,加入2 mL 0.2%Triton-100室温5 min,PBS润洗,加入100 μL封闭液室温封闭1h,PBS润洗。加入一抗,湿盒4 ℃孵育过夜,PBS润洗,加入二抗,湿盒室温孵育2 h,PBS润洗,加入DAPI聚核5 min,PBS润洗,甘油淬灭封片,将切片置于荧光显微镜下拍片。
1.2.7逆转录定量PCR(qRT-PCR)用RNA提取试剂盒进行总RNA提取,按试剂盒说明书进行操作,通过基因扩增仪进行逆转录。取PCR反应板,配制如下反应体系:SYBR10.0 μL,Forward Primer(10 μmol/L)和Reverse Primer(10 μmol/L)各0.4 μL,DEPC水7.2 μL,cDNA2.0 μL(Total 20 μL),每个样本做4个复孔。通过实时荧光定量PCR仪进行基因扩增,结束后导出实验数据,以GAPDH为内参进行归一化处理,用2-ΔΔCT法处理结果。实验独立重复3次。目的基因的引物序列见表1。

表 1 PCR引物序列信息Table 1 PCRprimer sequence information
1.2.8蛋白质免疫印迹收集MH-S细胞,加入RIPA裂解液充分裂解,离心30 min收集上清,使用BCA试剂盒测定蛋白浓度。加入SDS-PAGE上样缓冲液,100 ℃金属浴12 min,震荡混匀离心。上样,80 V 30 min,120 V 90 min恒压电泳,400 mA 30 min恒流转膜。5%脱脂奶粉封闭,一抗4 ℃孵育过夜,TBST缓冲液3次×5 min,二抗室温孵育100 min,TBST缓冲液3次×5 min,ECL发光液进行曝光,保存条带。实验重复进行3次。
1.2.9酶联免疫吸附试验将处于对数生长期的MH-S细胞接种于24孔板中,收集各组细胞上清,根据ELISA试剂盒说明,检测MH-S细胞中TNF-α、IL-1β和IL-6的表达水平,然后使用多功能酶标仪测定450 nm波长处的A值。实验重复进行3次。
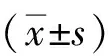
2 结 果
2.1 LPS对MH-S细胞凋亡及活力的影响CCK-8结果显示,与对照组相比,10 μg/mL LPS浓度组细胞存活率下降至(74.26±2.6)%(P<0.01),10 μg/mL及更高浓度组能够明显降低细胞活力,差异有统计学意义(P<0.01)。Western blot结果显示,随着LPS作用浓度的升高,促凋亡蛋白Bak、Bax、cleaved-Caspase-3/Caspase-3表达水平升高,抗凋亡蛋白Bcl-2表达水平降低(P<0.05),提示LPS浓度与MH-S细胞凋亡呈正相关。见图1。
2.2LPS对YAP及Cav-2的影响Western blot检测结果显示,Hippo信号通路关键蛋白YAP的表达水平随着LPS的作用浓度增加而升高,p-YAP的表达水平降低(P<0.05)。细胞免疫荧光检测结果显示,与Control组相比,10 μg/mL LPS组YAP蛋白的荧光表达水平升高(P<0.05),提示在MH-S细胞中,Hippo信号通路关键蛋白YAP的表达水平与LPS处理浓度呈正相关。此外,随着LPS的作用浓度逐渐升高,Cav-2表达水平亦升高(P<0.05),提示在MH-S细胞中,Cav-2的表达水平与LPS作用浓度呈正相关。随着LPS作用时间的增加,YAP蛋白的表达水平升高,p-YAP蛋白的表达水平降低(P<0.05)。此外,Cav-2的表达水平也随着LPS作用时间的增加而升高(P<0.01),其变化趋势与YAP蛋白的表达水平变化趋势相一致。见图2。

a:蛋白质免疫印迹检测凋亡蛋白代表条带;b:凋亡蛋白表达水平1:Control组; 2:0.1 μg/mL; 3:1 μg/mL; 4:5 μg/mL; 5:10 μg/mL; 6:20 μg/mL与Control组相比,*P<0.05、**P<0.01

a、e:蛋白质免疫印迹检测YAP、p-YAP、Cav-2蛋白条带;b、f:YAP蛋白表达水平;c、g:p-YAP蛋白表达水平;d、h:Cav-2蛋白表达水平1:Control组;2:0.1 μg/mL;3:1 μg/mL;4:5 μg/mL;5:10 μg/mL;6:20 μg/mL;7:Control;8:3 h;9:6 h;10:12 h;11:18 h;12:24 h与Control组相比,*P<0.05、**P<0.01
2.3Cav-2对炎症因子及活性氧表达水平的影响采用Cav-2-shRNA及Cav-2+DNA转染MH-S细胞构建Cav-2低表达和过表达载体,qRT-PCR检测结果表明细胞均转染成功(P<0.01)。qRT-PCR检测结果显示,与LPS组相比,sh-Cav-2组TNF-α、IL-1β和IL-6的mRNA表达水平显著降低(P<0.01);OE-Cav-2组上述炎症因子的mRNA表达水平显著升高(P<0.01)。ELISA检测结果也表明,与LPS组相比,sh-Cav-2组MH-S细胞培养上清液炎症因子TNF-α、IL-1β和IL-6的蛋白表达水平降低(P<0.05);OE-Cav-2组上述蛋白表达水平升高(P<0.05)。提示抑制Cav-2的表达可抑制LPS诱导的炎性反应。ROS检测结果显示,与LPS组相比,sh-Cav-2组细胞活性氧水平降低(P<0.05);OE-Cav-2组细胞活性氧水平升高(P<0.05),提示Cav-2能够调节细胞ROS生成等氧化应激过程。见图3。
2.4Cav-2对YAP的表达影响qRT-PCR检测结果显示,与LPS组相比,sh-Cav-2组YAP的mRNA表达水平下调(P<0.05);OE-Cav-2组YAP的mRNA表达水平升高(P<0.05)。Western blot检测结果表明,与LPS组相比,sh-Cav-2组YAP蛋白表达水平降低(P<0.05),p-YAP蛋白表达水平升高(P<0.01);OE-Cav-2组YAP蛋白表达水平升高(P<0.05),p-YAP蛋白表达水平降低(P<0.01)。细胞免疫荧光检测结果显示,与LPS组相比,sh-Cav-2组YAP蛋白的荧光表达水平显著降低(P<0.01);OE-Cav-2组YAP蛋白的荧光表达水平显著升高(P<0.01)。见图4。
2.5Cav-2对细胞凋亡的表达影响Western blot检测结果显示,与LPS组相比,sh-Cav-2组促凋亡蛋白Bak、Bax、cleaved-Caspase-3/Caspase-3的表达水平降低,抗凋亡蛋白Bcl-2的表达水平升高(P<0.05);OE-Cav-2组促凋亡蛋白的表达水平升高,抗凋亡蛋白的表达水平降低(P<0.05)。上述结果表明,抑制Cav-2的表达可以抑制LPS诱导的MH-S细胞凋亡。见图5。

a:qRT-PCR检测Cav-2的mRNA表达水平;b、c、d:qRT-PCR检测TNF-α、IL-1β和IL-6的mRNA表达水平;e、f、g:ELISA检测TNF-α、IL-1β和IL-6的蛋白表达水平;h:ROS检测细胞活性氧水平与Control组相比,*P<0.05、**P<0.01;与LPS组相比,*P<0.05、**P<0.011:Control;2:LPS;3:sh-Cav-2;4:OE-Cav-2

a:qRT-PCR检测YAP的mRNA表达水平;b:YAP蛋白荧光表达水平;c:蛋白质免疫印迹检测YAP、p-YAP蛋白条带;d:YAP蛋白表达水平;e:p-YAP蛋白表达水平;f:细胞免疫荧光检测YAP蛋白1:Control组;2:LPS;3:sh-Cav-2;4:OE-Cav-2与Control组相比,**P<0.01;与LPS组相比,#P<0.05、##P<0.01

a:蛋白质免疫印迹检测凋亡蛋白条带;b:cleaved-Caspase-3/Caspase-3表达水平;c:Bak蛋白表达水平;d:Bax蛋白表达水平;e:Bcl-2蛋白表达水平1:Control组;2:LPS;3:sh-Cav-2;4:OE-Cav-2与Control组相比,*P<0.05、**P<0.01;与LPS组相比,#P<0.05、##P<0.01
3 讨 论
肺部疾病是世界范围内常见的健康问题,为医疗系统带来沉重负担[1]。在肺部疾病的发生发展过程中,免疫炎症反应是重要的病理生理机制,肺泡巨噬细胞(AMs)是最易受到影响的细胞[20]。已有研究表明AMs和其他免疫细胞在调节肺部炎症中协同工作,过度的肺部炎症和肺泡上皮细胞凋亡是ALI发病的关键因素[21]。
小窝是富含胆固醇和糖鞘脂的烧瓶状质膜内陷,在血管内皮中特别丰富,在血管平滑肌细胞、巨噬细胞、心肌细胞和成纤维细胞中也广泛存在[22]。小窝蛋白是小窝的主要蛋白质成分,以Cav-1分布最为广泛,而Cav-2同样是小窝的重要组成部分,辅助Cav-1或独立发挥生物学功能[16]。已有研究报道在不同的组织细胞内Cav-1参与炎症及Hippo信号通路的调控,Cav-1与toll样受体(TLR)结合,减少了促炎细胞因子的产生,并部分增强了抗炎细胞因子的生成[23]。对Cav-2的作用研究远少于对Cav-1的研究,但是与Cav-1相比,Cav-2通常表现出相反的活性。例如,有研究发现在LPS诱导的ALI小鼠模型中,miR-1443p通过调节Cav-2的表达,以增强ALI的炎症反应和细胞凋亡[24]。在本研究中,对Cav-2的检测表明,随LPS的刺激强度和时间增加,Cav-2的表达水平升高,呈时间浓度梯度依赖性。抑制Cav-2的表达可以抑制炎症因子TNF-α、IL-1β和IL-6的释放,抑制肺泡巨噬细胞凋亡;而过表达Cav-2可以促进炎症因子的释放,促进肺泡巨噬细胞凋亡。
Hippo信号通路发挥调控细胞增殖、凋亡及组织再生的作用,转录共刺激因子YAP/TAZ是Hippo信号通路的效应蛋白,当Hippo信号通路激活,YAP/TAZ被磷酸化修饰,抑制其与转录因子TEAD结合调控下游靶基因的表达[25]。既往许多研究显示Hippo信号通路参与免疫炎症的调控,如肺康颗粒可以使COPD大鼠的MST1/2表达升高,通过抑制Th17细胞分化,调控DC的迁移及黏附来抑制趋化因子和促炎细胞因子产生[26];YAP缺乏导致机械通气诱导的肺水肿、出血和炎症细胞浸润减少[27]。Hippo信号通路和小窝之间的相互作用是这些疾病状态的基础。尽管小窝调节Hippo信号通路的确切机制尚不完整,但仍存在一些可能的机制,例如在成肌细胞中,拉伸诱导的小窝分解直接激活YAP的磷酸化,导致SRC激活。低渗透应激使小窝内陷变平,通过NLK激酶介导YAP的Ser128磷酸化刺激YAP的瞬时核定位[13]。在本研究中我们通过Cav-2-shRNA稳定转染低表达Cav-2基因,通过Cav-2+DNA稳定转染过表达Cav-2基因,获得定向低表达和过表达Cav-2的MH-S细胞模型,我们的研究结果显示,相比于LPS组,定向抑制Cav-2的表达可以使Hippo信号通路中YAP的mRNA和蛋白表达水平下降,p-YAP蛋白表达水平升高,促凋亡相关蛋白指标下降。而过表达Cav-2可以使Hippo信号通路中YAP的mRNA和表达水平升高,p-YAP表达水平降低,促凋亡相关蛋白指标升高。结果表明在LPS诱导的肺泡巨噬细胞模型中,Cav-2可以促进YAP的基因及蛋白表达,抑制Hippo信号通路,促进炎症因子的释放,加重巨噬细胞损伤、凋亡。
综上所述,本研究揭示了在LPS诱导的肺泡巨噬细胞凋亡中,Cav-2可以加重LPS诱导的巨噬细胞损伤、凋亡,定向抑制Cav-2的表达可以通过减少YAP入核,激活Hippo信号通路,阻止炎症因子的释放,减轻LPS诱导的巨噬细胞损伤、凋亡。因此,Cav-2可能作为干预肺部炎性疾病的潜在治疗靶标。而本研究仅在细胞水平上对Cav-2在肺泡巨噬细胞凋亡过程中的作用和机制进行了研究,后期将进一步对其在动物及临床上进行深入探究。

