甲状腺癌中含伴侣蛋白的TCP1亚基3表达与生物学行为及免疫微环境的关系研究
白云峰, 施晓辉, 白银宝, 塔拉
甲状腺癌是成人最常见的内分泌恶性肿瘤,其中甲状腺乳头状癌(papillary thyroid cancer, PTC)是甲状腺癌中最常见的亚型[1],约占全部甲状腺癌的85%~90%,且其发病率逐年增加,已成为头颈外科最常见的恶性肿瘤之一[2]。尽管大多数PTC患者可通过外科手术和放射性碘131辅助治疗后治愈,但仍有部分PTC进展为难治性的癌症,易复发、转移[3-5]。因此,需要从发生发展机制及预后等方面对其进行深入研究,其中导致丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇-3激酶(PI3K/AKT)信号通路激活的突变至关重要[6]。甲状腺癌中最常见的突变是抗鼠科肉瘤病毒癌基因同源物B1(BRAF)突变、端粒酶逆转录酶(TERT)启动子突变、RAS和RET重排等[6-7]。TCP1复合物伴侣蛋白(chaperonin containing TCP1complex,CCT)是真核细胞胞质中唯一的伴侣素分子,参与约10%的蛋白质折叠,由2个异寡聚体堆叠环组成,每个环由8个不同的亚基(CCT1~CCT8)构成[8]。含有TCP1伴侣蛋白亚基3(Chaperonin containing TCP1,subunit 3,CCT3)是CCT家族中的一个重要亚基,有研究表明其在一些肿瘤中高表达,并且与肿瘤的发生发展和预后关系密切[9-13]。CCT3参与肿瘤发病近几年被广为报道[14]。Liu等[10]认为CCT3与甲胎蛋白(AFP)联合可以增加肝癌诊断的阳性率,尤其对于AFP阴性肝癌和早期肝癌时,CCT3还可以在YAP和TFCP2的上游起作用,靶向CCT3可能治疗YAP相关肝癌。在肺腺癌中,CCT3通过激活JAK2/STAT3通路促进肺腺癌细胞对顺铂的耐药性[13]。但关于CCT3在甲状腺癌中的报道甚少。本研究通过TCGA数据库分析CCT3与甲状腺癌的关系,通过临床样本和体外实验验证其生物学行为,然后通过GSEA富集分析和CIBERSORT分析可能相关信号通路、肿瘤微环境免疫相关及机制,探讨其可能成为新的分子标志物及治疗靶点的价值。
1 资料与方法
1.1 TCGA数据库 从UCSC xena癌症基因组图谱库(https://xenabrowser.net/)下载获取33种肿瘤的癌组织(9184例)和癌旁组织(8260例)的CCT3表达数据,利用R.4.3.1软件分析CCT3在泛癌中的表达差异。使用R软件利用“TCGAbiolinks”R包从TCGA数据库(https://portal.gdc.cancer.gov/)下载甲状腺癌数据,进行数据整理,采用“Limma”R包进行差异分析,采用“ggplot”R包进行可视化。
1.2 临床样本 纳入2022年3—5月内蒙古自治区人民医院收治的30例PTC患者,手术时患者的年龄44(26~65)岁。取其癌组织,以及距肿瘤边缘>2 cm处的癌旁正常组织。本研究经内蒙古自治区人民医院伦理委员会批准。
1.3 免疫组织化学染色法(IHC)检测PTC组织及癌旁组织中CCT3的表达 将30对PTC组织及癌旁组织用甲醛固定、石蜡包埋,4~5 μm切片,通过烘干、在二甲苯中脱蜡和酒精递减中复水,在枸橼酸缓冲液中抗原修复20 min;将切片冷却至室温后,在双蒸水中孵育10 min,加入10%山羊血清继续孵育30 min。加入CCT3抗体(1∶50),4 ℃冰箱孵育过夜。1×TBS缓冲液漂洗3次,加入1∶200稀释的辣根过氧化物酶(二抗抗体),室温孵育1 h。再次洗涤,固红显色试剂盒显色,室温孵育15 min,显色,阅片。标本免疫组织化学染色结果以CCT3染色强度和阳性率来评判,染色强度分为4个等级:0为阴性表达,无色;1为低表达,淡黄色;2为中等表达,棕黄色;3为高表达,褐色。阳性率:0分为阴性;1分为1%~25%;2分为26%~50%;3分为51%~75%;4分为76%~100%。将两个评分的乘积作为每个标本的染色评分结果。此部分由两名病理学医师独立评估,其对临床数据均不知情。
1.4 细胞培养 K1细胞系是一种PTC细胞混合细胞系,来源于欧洲标准细胞收藏中心(European Collection of Authenticated Cell Cultures,ECACC)。B-CPAP细胞来自中国科学院细胞库。K1细胞系和B-CPAP均培养在DMEM-F12培养基中,其中添加10%胎牛血清以及1%青霉素(终浓度:100 U/mL),链霉素(终浓度:100 U/mL),培养在5% CO2、37℃恒温、恒湿的细胞培养箱中。取对数生长期细胞接种于6孔板中6×105个/孔,培养至75%的密度左右时进行转染。
1.5 实时荧光定量PCR(RT-qPCR)检测PTC细胞中CCT3 mRNA的表达 为研究CCT3在PTC发生发展中的作用,本研究在PTC细胞中敲低CCT3,并研究CCT3的细胞功能。比较两种细胞株(K1细胞系和B-CPAP细胞系)中CCT3 mRNA的表达水平。使用TRIzol试剂(美国Thermo Fisher Scientific公司)提取细胞中的总RNA,并检测其纯度。使用M-MLV逆转录酶(北京Promega生物技术有限公司)将总RNA反转录为cDNA。以GAPDH作为内参。RT-qPCR扩增参数参照SYBR Advantage qPCR Premix试剂盒(日本TaKaRa公司)说明书操作,以cDNA为模板进行RT-qPCR。参数:95 ℃预变性30 s;95 ℃ 5 s、60 ℃ 30 s、45次循环;60 ℃终延伸30 s。使用2-ΔΔCt方法计算CCT3 mRNA的相对表达量。CCT3引物:正向5′-TCA GTC GGT GGT CAT CTT TGG-3′。反向5′-CCT CCA GGT ATC TTT TCC ACT CT-3′,GAPDH引物:正向5′-TGACTTCAACAGCGACACCCA-3′,反向5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.6 慢病毒感染 将K1细胞用CCT3为靶点的慢病毒感染,分为对照组(正常培养,shCtrl)和干扰组(转染CCT3特异性shRNA,shCCT3)。通过荧光显微镜观察感染慢病毒72 h后K1细胞表达绿色荧光蛋白(GFP)的感染效果,将细胞分为对照组(正常培养,shCtrl)和干扰组(转染CCT3特异性shRNA,shCCT3)。CCT3shRNA慢病毒购于上海吉凯基因医学科技股份有限公司。CCT3 shRNA的靶序列:5′-CAAGTCCATGATCGAAAT T-3′;非沉默对照的靶序列:5′-GCGTCCTCATACCAGGATAAA-3′。
1.7 蛋白免疫印记(Western Blot)检测PTC细胞中CCT3蛋白的表达 收集shCtrl组和shCCT3组的K1细胞,用细胞裂解液裂解后,提取细胞中总蛋白。使用PierceTMBCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司)测定蛋白浓度,按每孔上样量60 μg进行SDS-PAGE,稳压冰浴电转至PVDF膜上,5%牛血清白蛋白封闭2 h,加入一抗后[CCT3一抗为兔抗人多克隆抗体(英国Abcam公司),稀释度为1∶500;内参GAPDH一抗为兔抗人单克隆抗体(美国CST公司),稀释度为1∶2000],4 ℃孵育过夜。再加入二抗[辣根过氧化物酶标记的鼠抗兔IgG(武汉博士德生物工程有限公司),稀释度为1∶2000],使用PierceTMECL试剂盒(美国Thermo Fisher Scientific公司)发光并采集图片数据,计算蛋白相对表达量。
1.8 高含量筛选(HCS)和MTT法检测细胞增殖 为研究沉默CCT3对PTC细胞生长的影响,将shCCT3组和shCtrl组的PTCK1细胞以等密度接种到96孔板中。培养5 d,每天测定细胞数量。将干扰组和对照组细胞在37 ℃、5%CO2的培养箱中培养。取对数生长期细胞,按每孔100 μl接种于96孔培养板中。铺板后24 h,使用Array ScanTMHCS 2.0软件(美国Thermo Fisher Scientific公司)采集并量化细胞图像,连续5 d。然后加入20 μL MTT溶液(5 g/L),继续培养4 h,吸弃孔中细胞上清。每孔加入100 μl二甲基亚砜,使用振荡器振荡10 min,在酶标仪上于490 nm波长处测量各孔的光密度(OD)值。
1.9 流式细胞技术检测细胞凋亡 采用Annexin V-Allophycocyanin (APC)凋亡检测试剂盒(美国Thermo Fisher Scientific公司)分析细胞凋亡情况:取处于对数生长期的两组细胞。消化、收集,用预冷的PBS洗细胞2次。将细胞密度调整为(1×106~1×107)/mL。然后加入5 μL APC荧光标记的Annexin V试剂,室温孵育15 min。在流式细胞仪上检测细胞凋亡率。
1.10 流式细胞技术检测细胞周期 为研究沉默CCT3抑制PTC细胞增殖的机制,检测了敲低CCT3后K1的细胞周期分布。shCCT 3和shCtrl慢病毒感染96 h后,用碘化丙啶(propidium iodide, PI)染色并通过流式细胞术分析。取对数生长期的两组细胞,在6孔板中培养。孵育96 h,细胞生长至覆盖率约80%,吸弃上清,用70%乙醇固定,于4%CO2、37 ℃恒温箱中过夜。PBS洗涤2次,并用10 mg/mL RNA酶溶液在37 ℃下行细胞PI染色。最后使用流式细胞仪和BD FACStationTM6.1软件进行数据分析。
1.11 GSEA富集分析 为确定CCT3在甲状腺癌中可能参与的信号通路,将CCT3分为高表达组和低表达组进行GSEA富集分析,使用TCGA数据库,以MsigDB中的H(h.all.v7.0.symbols.gmt)和C7(c7.all.v7.0.symbols.gmt)数据集作为功能基因集。利用GSEA分析,随机组合次数设置为1000次,以P<0.05为基因集显著富集。
1.12 CIBERSORT免疫细胞浸润差异和相关性分析 将下载的基因表达矩阵进行归一化和整理,采用CIBERSORT法分析甲状腺癌中22种免疫细胞的丰度,再将CCT3以中位数分高、低表达组,分析在甲状腺癌中与22种免疫细胞的差异,最后将每个免疫细胞与CCT3进行相关性分析。22种免疫细胞包括:未成熟的B细胞(B cells naive);记忆B细胞(B cells memory);浆细胞(plasma cells);CD8+T细胞(T cells CD8);未成熟的CD4+T细胞(T cells CD4 naive);静息记忆CD4+T细胞(T cells CD4 memory resting);活化记忆CD4+T细胞(T cells CD4 memory activated);滤泡辅助性T细胞(T cells follicular helper);滤泡调节性T细胞(T cells regulatory Tregs);γδT细胞(T cells gamma delta);静息NK细胞(NK cells resting);活化NK细胞(NK cells activated);单核细胞(moncytes);巨噬细胞M0(macrophages M0);巨噬细胞M1(macrophages M1);巨噬细胞M2(macrophages M2);静息树突细胞(dendritic cells resting);活化树突细胞(dendritic cells activated);静息肥大细胞(mast cells resting);活化肥大细胞(mast cells activated);嗜酸性粒细胞(eosinophils);中性粒细胞(neutrophils)。
1.13 统计学方法 使用SPSS 22.0和R软件4.3.1版本进行统计分析。实验指标以均值±标准差表示,两组间的差异比较采用t检验,多组间差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CCT3在人PTC中高表达 UCSC xena癌症基因组图谱库结果显示,CCT3在28种癌症中高表达,即卵巢癌(OV)、子宫癌肉瘤(UCS)、子宫内膜样癌(UCEC)、乳腺浸润癌(BRCA)、多形成性胶质细胞瘤(GBM)、脑低级别胶质瘤(LGG)、肾上腺皮质癌(ACC)、甲状腺癌(THCA)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、胰腺癌(PAAD)、食管癌(ESCA)、胃癌(STAD)、皮肤黑色素瘤(SKCM)、结肠癌(COAD)、直肠癌(READ)、前列腺癌(PRAD)、睾丸癌(TGCT)、胸腺瘤(THYM)、弥漫性大B细胞淋巴瘤(DLBC)、肝癌(LIHC)、肾乳头状细胞癌(KIRP)、膀胱尿路上皮癌(BLCA)、宫颈鳞癌和腺癌(CESC)、肉瘤(SARC)、胆管癌(CHOL)、头颈癌(HNSC)、嗜铬细胞瘤和副神经节瘤(PCPG)。在肾嫌色细胞癌(KICH)中低表达,见图1A。选择TCGA数据库中500例甲状腺癌组织与57例癌旁正常组织样本对比,发现CCT3在甲状腺癌肿瘤组织中的表达量明显高于癌旁正常组织,见图1B。
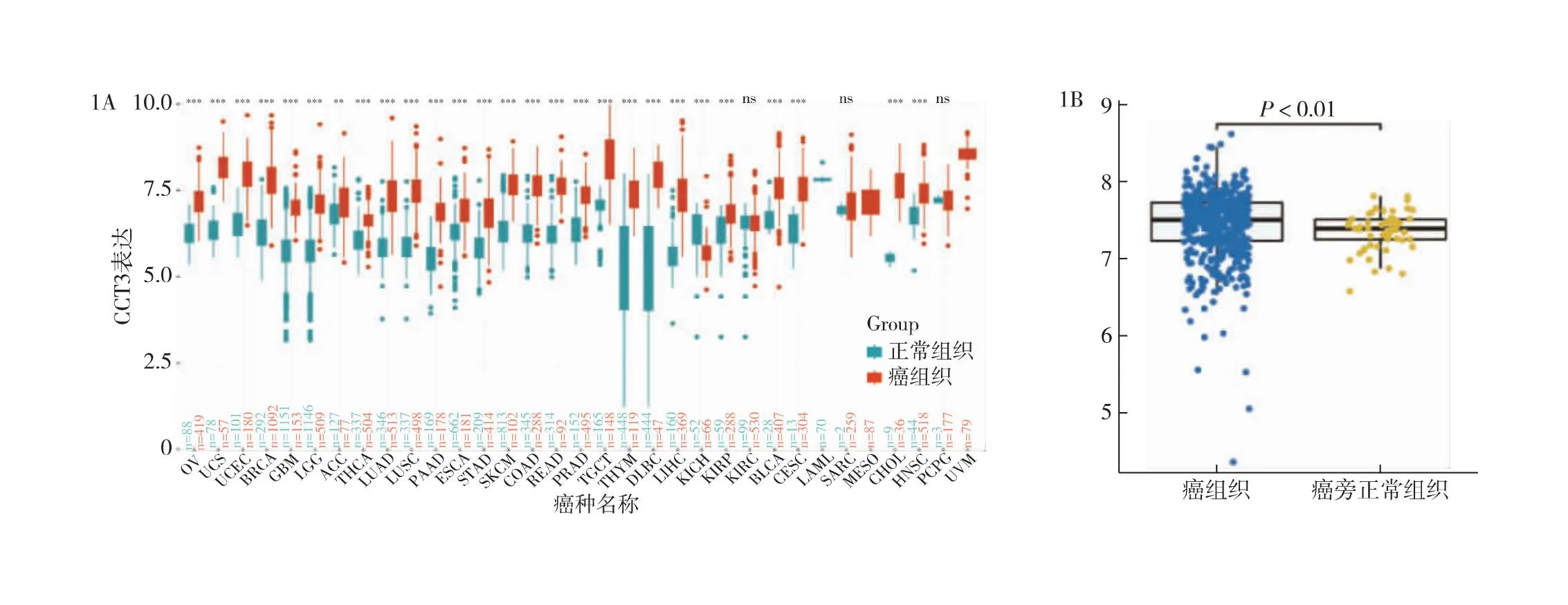
图1 CCT3在泛癌及甲状腺癌中的表达情况 1A:UCSCxena数据库分析CCT3在泛癌中的表达差异;1B:TCGA数据库中CCT3在甲状腺癌组织与癌旁正常组织中的表达差异
2.2 CCT3在PTC中高表达 CCT3在癌旁正常组织中染色很少,而在PTC的细胞核及胞质中染色较多(图2A)。CCT3在癌组织中的染色评分明显高于癌旁正常组织(图2B)。

图2 CCT3在人甲状腺乳头状癌中过表达 2A:IHC染色检测癌旁正常组织和PTC组织中CCT3表达情况;2B:癌旁正常组织与PTC组织中CCT3表达评分比较(n=30,***P<0.001)
2.3 CCT3在PTC中被有效沉默 CCT3 mRNA在两种细胞系中表达量均较高,其中K1细胞中CCT3 mRNA水平相对高于B-CPAP细胞(图3A)。因此,本研究对K1细胞进行CCT3的敲减,进行下游实验发现,shCCT3组和shCtrl组中80%以上的K1细胞被成功感染(图3B)。RT-qPCR结果表明,shCCT3组的CCT3 mRNA表达量约为shCtrl组的10%(图3C)。Western Blot结果显示,shCCT3慢病毒感染后,K1细胞中CCT3蛋白表达水平低于shCtrl组(图3D)。表明在K1细胞中使用慢病毒成功敲低了CCT3。
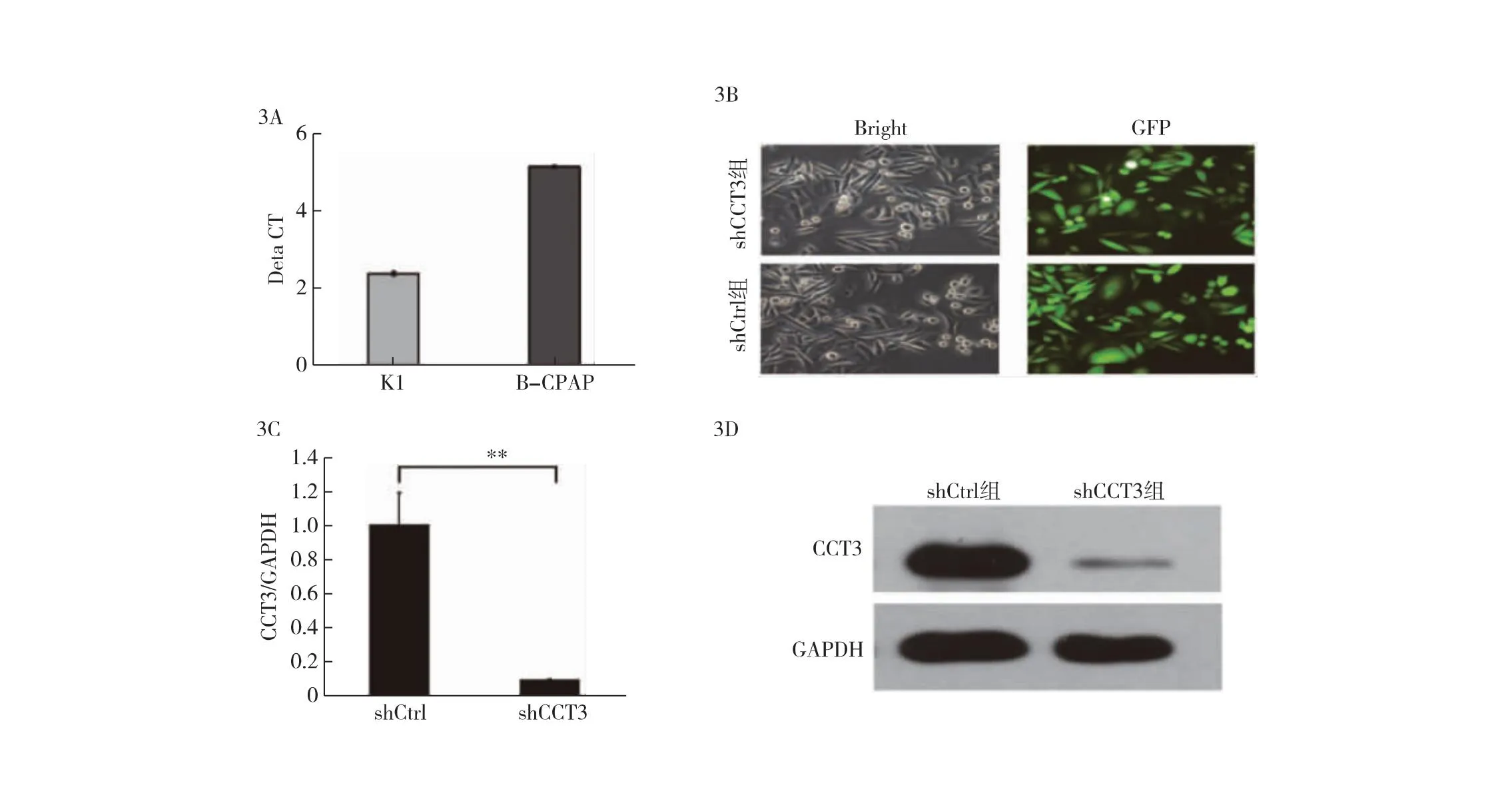
图3 人PTC中CCT3的敲低 3A:K1和B-CPAP细胞中的CCT3表达水平比较;3B:慢病毒感染K1细胞后72 h的感染效率(×200);3C:shCtrl与shCCT3组K1细胞中的CCT3 mRNA水平比较(n=3,**P<0.01);3D:shCtrl组和shCCT3组K1细胞CCT3蛋白表达
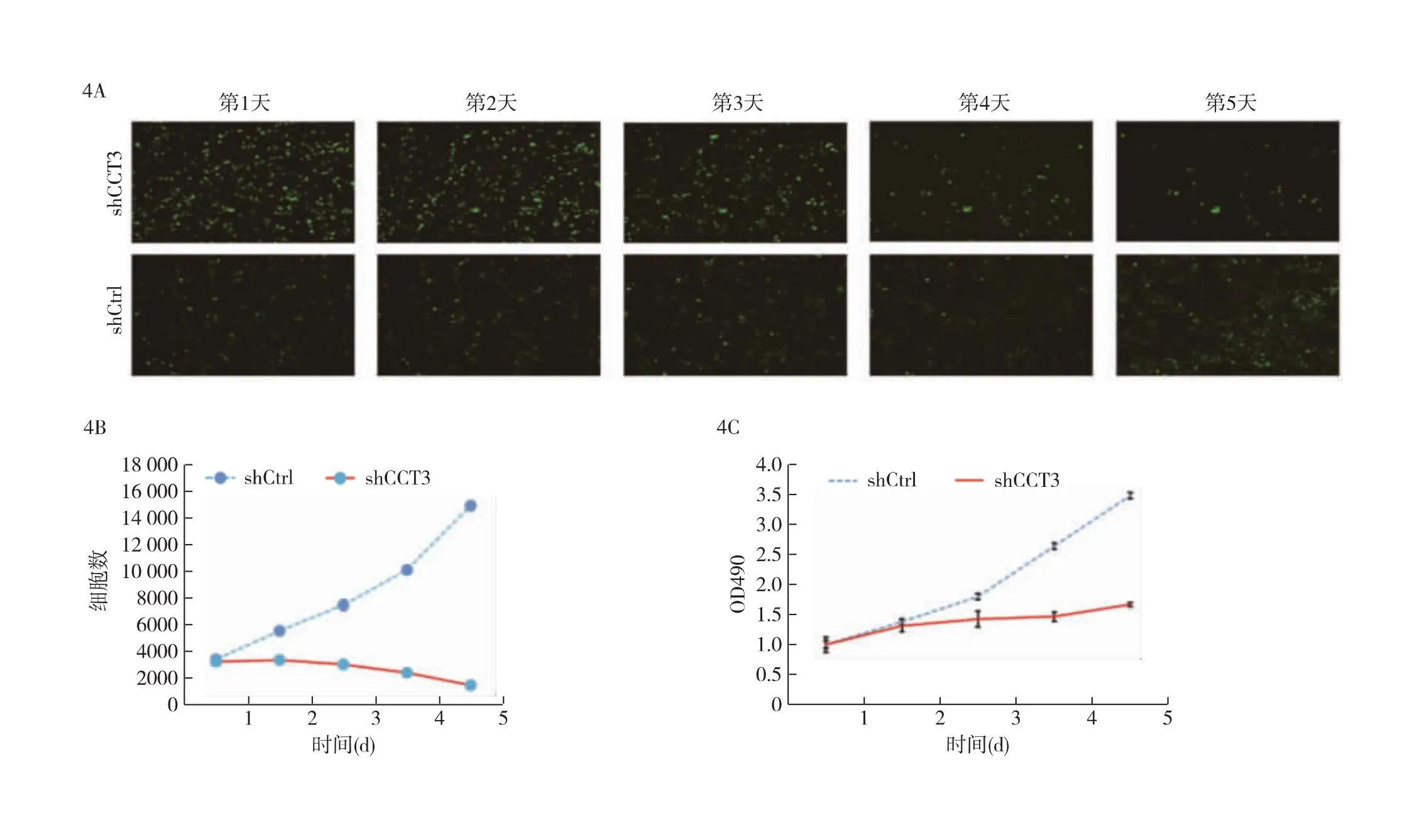
图4 敲低CCT3可抑制PTC细胞的增殖 4A:慢病毒感染后细胞生长的代表性荧光显微镜图像;4B:感染后shCtrl和shCCT3组细胞计数比较(n=3);4C:MTT试验测定shCtrl和shCCT3组细胞活性,*P<0.01。
2.4 沉默CCT3抑制PTC细胞的增殖 荧光显微镜观察到shCCT3组和shCtrl组细胞在前2天的绿色荧光蛋白(GFP)表达细胞相当。从第3天开始,shCCT3组细胞的GFP密度低于shCtrl组细胞(图4A)。细胞计数结果证实,培养第5天时,shCtrl组的细胞逐渐增多,而shCCT3的细胞逐渐减少(图4B)。MTT结果显示,shCtrl组的细胞在5天内稳定生长;前2天shCCT3组的细胞存活数与shCtrl组相似,但此后shCCT3组的细胞生长率显著降低(图4C)。
2.5 沉默CCT3影响细胞周期进程 shCCT3组中G1期和S期细胞比例低于shCtrl K1组,而shCCT3 K1细胞中G2/M期细胞比例高于shCtrlK1细胞(图5)。

图5 沉默CCT3基因影响细胞周期检测结果 5A:流式细胞仪分析每组K1细胞的细胞周期分布;5B:shCtrl与shCCT3组K1细胞的细胞周期分布情况; **P<0.01
2.6 沉默CCT3可诱导细胞凋亡 与shCtrl K1细胞相比,shCCT3 K1细胞的凋亡细胞比例增加了近4倍(图6)。
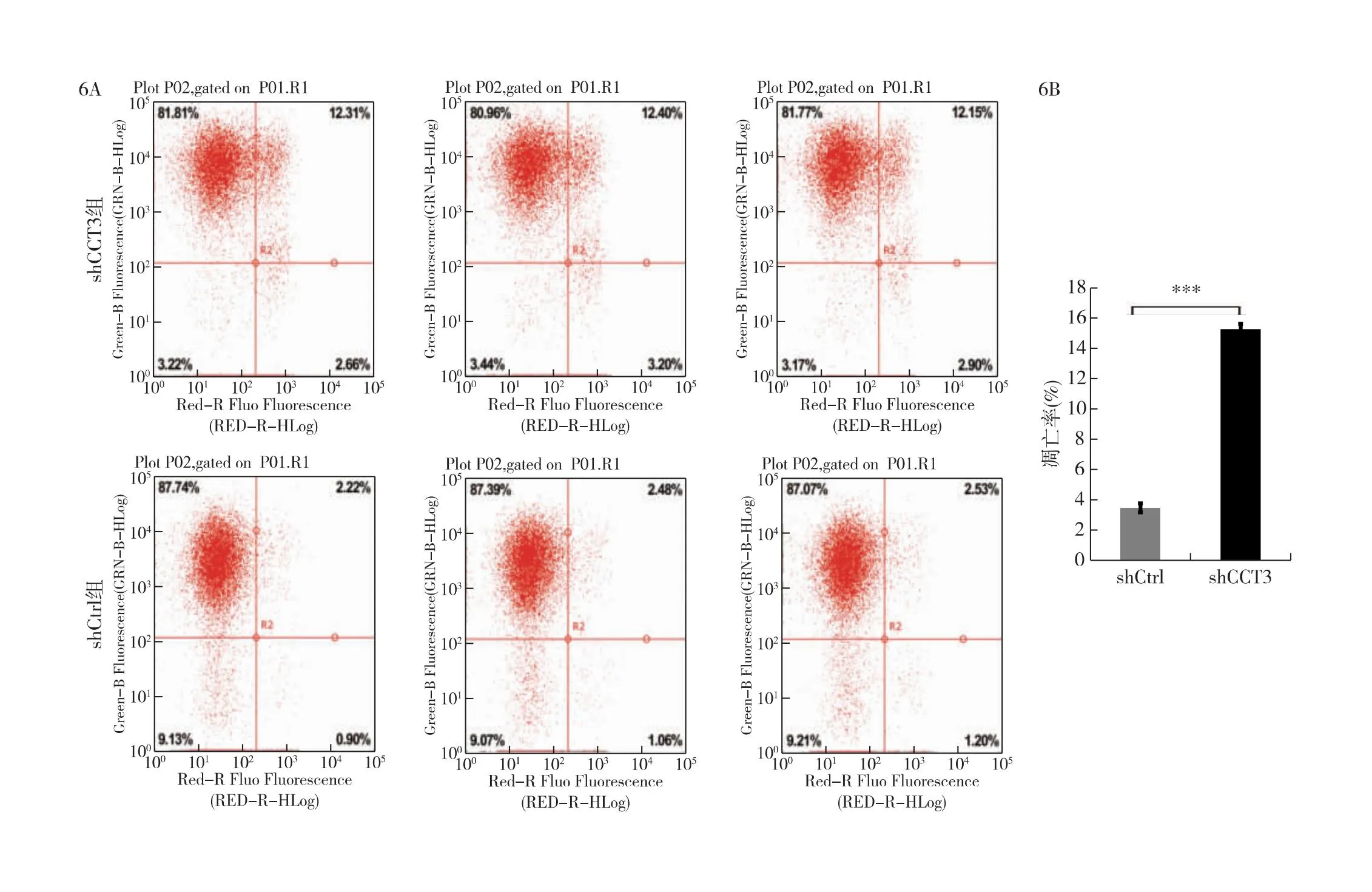
图6 沉默CCT3可诱导细胞凋亡 6A:Annexin V染色显示细胞凋亡情况;6B:shCtrl与shCCT3组细胞凋亡率比较(n=3,***P<0.001)
2.7 GSEA基因富集分析结果 CCT3主要参与了11条信号通路,包括:同种异体移植物排斥、γ干扰素应答、炎性反应、补体、IL-6-JAK-STAT3信号、α干扰素应答、KRAS信号、IL-2-STATS信号、氧化磷酸化通路、通过NF-κB的TNFA信号、凝血等免疫相关通路,见图7。

图7 GSEA富集分析CCT3在甲状腺癌中参与的通路 7A:“H” 基因集(多个已知的基因集构成的超基因集);7B:“C7”基因集(免疫系统功能相关的基因集合)
2.8 CIBERSORT法分析免疫细胞浸润相关性 为进一步分析免疫机制在甲状腺癌微环境中的影响,利用CIBERSORT法推断甲状腺癌和正常甲状腺中22种免疫细胞的表达丰度,见图8A。然后将CCT3分为高、低表达组,采用CIBERSORT法分析甲状腺癌中22种免疫细胞的表达差异,结果显示7种免疫细胞在CCT3基因高表达组与低表达组中具有统计学差异,分别是记忆B细胞、浆细胞、活化记忆CD4+T细胞、巨噬细胞M1、巨噬细胞M2、静息肥大细胞和嗜酸性粒细胞,见图8B。在每个免疫细胞与CCT3的相关性分析中,记忆B细胞、静息NK细胞、巨噬细胞M2、静息肥大细胞、中性粒细胞与CCT3呈正相关。浆细胞、活化记忆CD4+T细胞、巨噬细胞M1与CCT3呈负相关,见图8C。
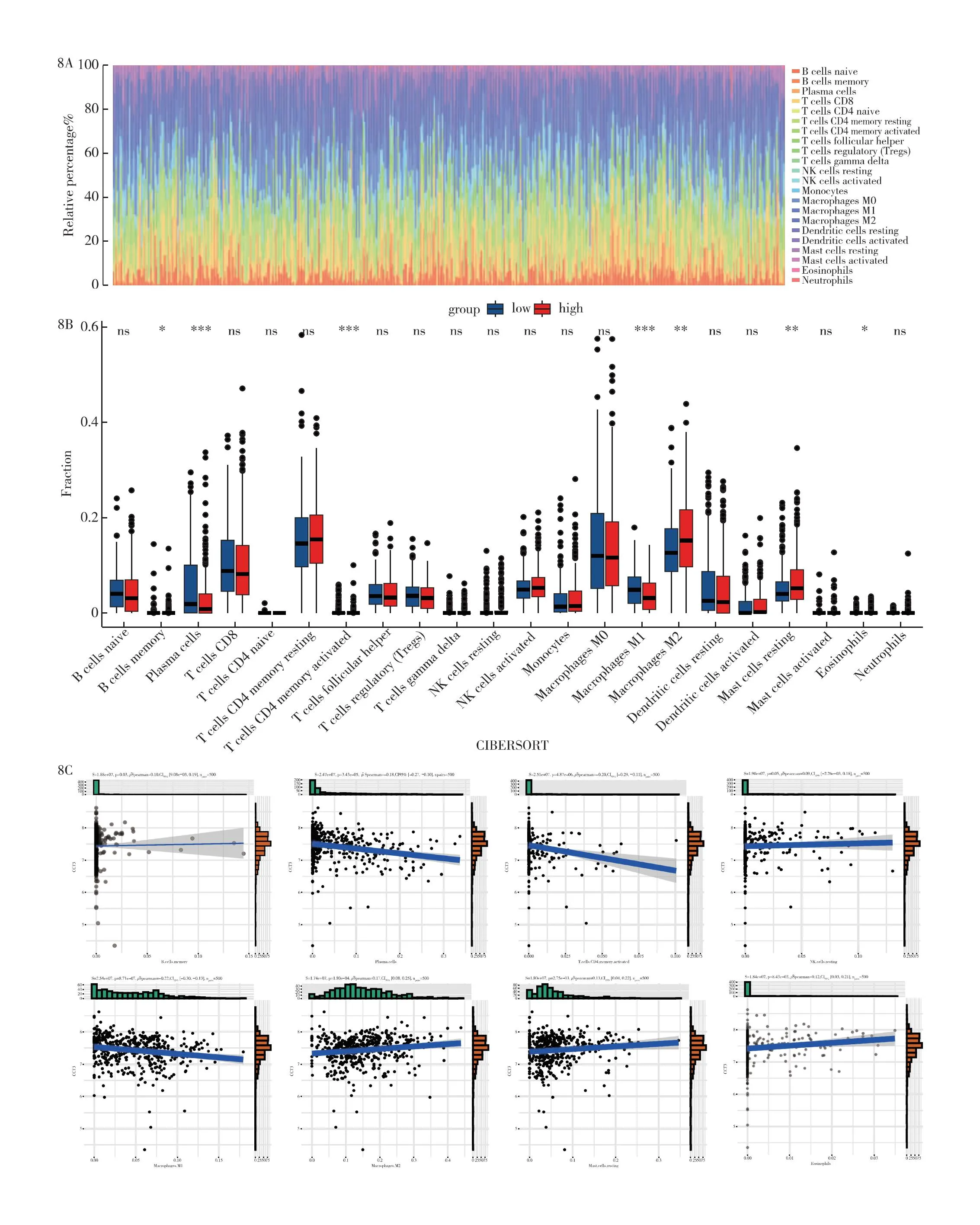
图8 CIBERSORT免疫细胞相关性分析 8A:甲状腺癌中22种免疫细胞丰度柱状图;8B:甲状腺中CCT3与22种免疫细胞的差异箱线图;8C:甲状腺癌中CCT3与每个免疫细胞的相关性散点图;*P<0.05,**P<0.01,***P<0.001
3 讨论
目前用于治疗复发的、转移的、难治性甲状腺癌的药物有索拉非尼[15]和Lenvatinib[16]等,这两种药物为多靶点抑制剂,不良反应特别强,对于难治性PTC缺乏特异性强的治疗靶点[17]。其发病机制、分子靶点、预后评估是目前研究的重点。本研究发现,CCT3在PTC组织中的表达显著高于癌旁正常组织。此外,沉默CCT3可降低K1细胞的增殖和细胞周期进程,并诱导细胞凋亡。并且CCT3在甲状腺癌中可能通过参与IL-6-JAK-STAT3信号通路、NF-κB信号通路、KRAS信号通路和免疫相关信号通路。
CCT3是CCT家族的重要亚基之一。CCT属于Ⅱ型伴侣素,作为一种伴侣蛋白复合物,参与细胞中10%的蛋白质折叠,调节许多肿瘤相关蛋白质的表达和细胞周期[18]。除了包括肌动蛋白和微管蛋白在内的细胞骨架蛋白,一些细胞周期调节蛋白,如细胞周期因子20(Cdc20p)、钙黏蛋白1(Cdh1p)、马球象激酶1(Plk1)和细胞周期蛋白E(cyclin E)、细胞周期蛋白B(cyclin B)、VHL肿瘤抑制蛋白、肌球蛋白、P53、KRAS、p21ras、转录激活因子3(STAT3)、转导蛋白和含有WD重复序列的蛋白质家族成员等,也是CCT的底物[19-21]。CCT表达异常影响细胞的侵袭和转移[18]。有研究表明CCT3在肝癌、胃癌、结直肠癌、卵巢癌等多种肿瘤中高表达,并且与增殖、侵袭、转移及复发等相关[9-11,22]。本研究采用生物信息学分析对TCGA数据库进行挖掘,发现CCT3在多种癌中均高表达,并且在甲状腺癌中的表达显著上调,与上述报道结果一致。本研究成功地在K1细胞中沉默了CCT3,发现沉默CCT3能明显降低K1细胞的增殖和细胞周期进展。在CCT3沉默的K1细胞中观察到细胞周期阻滞在G2/M期,并伴有G1期和S期分布的减少。已知DNA损伤检查点是G2/M期阻滞的显著因素,这表明沉默CCT3可导致DNA功能失调,从而阻止有丝分裂。有研究证明敲低CCT3可以提高肝细胞癌对长春新碱治疗的敏感性[23]。本研究观察到沉默CCT3可诱导K1细胞凋亡。此外,沉默CCT3后G2/M周期阻滞增强也可导致细胞凋亡增加。因此,CCT3可能对PTC细胞存活和增殖至关重要。最新研究称CCT3联合AFP可增加早期肝癌及AFP阴性时的肝癌诊断率,且靶向CCT3干扰可能治疗YAP相关肝癌[10]。还有报道称,CCT3可能成为肺腺癌产生顺铂耐药性的治疗靶点[13]。本研究发现,CCT3表达增加与PTC的肿瘤面积有关。沉默CCT3降低了PTC细胞的增殖。利用GSEA富集分析发现,CCT3通过多种基因集参与甲状腺癌的发生发展,如同种异体移植物排斥、γ干扰素应答、炎症反应、补体、IL-6-JAK-STAT3信号通路、α干扰素应答、KRAS信号-上调、IL-2-STATS信号、氧化磷酸化通路、通过NF-κB的TNFA信号、凝血等免疫相关通路。有报道表明,RAS、JAK-STAT3、NF-κB与甲状腺癌的发生、发展密切相关[24-26],在其他癌中CCT3通过JAK-STAT3信号通路促进多发性骨髓瘤的进展[27],在一项挽救实验中NF-κB-p65的过表达挽救了乳腺癌细胞中受CCT3影响的细胞增殖和迁移[12]。并且免疫细胞在PTC肿瘤的微环境中起促进或抗肿瘤作用[28]。以上结果提示,CCT3可能是一种有价值的用于诊断PTC的生物标志物和潜在分子治疗靶点。
综上所述,CCT3在PTC组织中高表达,CCT3参与了PTC的发病机制,CCT3是PTC的致癌基因,CCT3可能通过调节免疫细胞在甲状腺癌微环境中发挥作用,其机制还需进一步研究。CCT3可能成为PTC分子诊断和治疗的潜在候选基因。本研究仍存在不足之处,数据分析未联合多个数据库进行联合验证,另外关于CCT3如何通过上述信号通路及免疫反应通路影响甲状腺癌的发生发展尚需深入研究。

