三阴性乳腺癌的转移情况对阿替利珠单抗联合化疗疗效影响的Meta分析
马雨欣, 施玥, 石鑫红, 姜莹莹, 刘怡伶, 卢麟, 昌雨婷, 周飞, 王晓华, 陈诚, 冯继锋
乳腺癌是女性最常见的恶性肿瘤,也是全球女性癌症死亡的主要原因。根据全球癌症统计数据,2023年美国预计新增乳腺癌病例高达297 790例,成为美国女性发病率第一的癌症,约占31%,预计有43 170例患者死亡,死亡率第二,仅次于肺癌,约为15%[1]。2023年国家癌症中心公布的数据表明,2016年乳腺癌已成为我国女性发病率第一,死亡率第五的恶性肿瘤,为 7.17/万人[2]。
乳腺癌根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达状态可分为4种亚型。其中,三阴性乳腺癌(triple-negative breast crancer,TNBC)约占所有乳腺癌的15%~20%[3-5],与其他亚型相比,TNBC具有分化程度低,恶性程度高,异质性强,转移发生率高等特点[6]。且TNBC的高免疫原性导致了肿瘤的快速增长以及高肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte,TIL)水平,促进了肿瘤复发,及肺、肝、脑等远处部位转移,从而降低了生存率[5-7]。约50%的早期TNBC患者会发生远处转移,远处转移发生率高于其他亚型[3-4]。
TNBC因ER、PR及HER2阴性表达而无法在内分泌治疗及抗HER2靶向治疗中获益,目前治疗方式仍以化疗为主[8]。根据CSCO指南推荐,早期TNBC术后辅助治疗首选蒽环类、环磷酰胺及紫杉类药物联合治疗,晚期一线治疗首选单药或联合化疗。对于既往在新辅助治疗或术后辅助治疗中接受过蒽环类药物治疗失败的患者,晚期一线通常选择紫衫类药物治疗。由于目前指南中TNBC的新辅助及晚期一线治疗策略推荐仅限于化疗药物,mTNBC患者的中位生存时间仅10~13个月,与此形成鲜明对比的是,晚期非TNBC患者经历化疗,抗HER2或者内分泌综合治疗后,其中位生存时间可长达48~60个月[9-10]。因此TNBC需要探索新的治疗方式,来改善mTNBC患者的生存和预后。一项研究表明,程序性死亡受体配体-1(programmed death receptor-ligand 1,PD-L1)在乳腺肿瘤细胞和肿瘤相关炎性细胞(如免疫细胞、TIL和CD8+T细胞)中均表达。尤其是,TNBC的PD-L1表达率高于其他亚型的乳腺癌[11-13]。这些特征表明免疫检查点抑制剂(immune checkpoint inhibitor,ICI)是一种可行的TNBC的治疗药物[14]。ICI作为一类新型的抗肿瘤药物,尤其是PD-1/PD-L1抑制剂,已应用于多种癌症,免疫联合化疗的方案目前已在临床上得到了广泛的应用。
因此在这项研究中,我们对已经公布结果使用PD-1/PD-L1抑制剂治疗晚期TNBC的随机对照试验结果进行Meta分析,评估在转移部位不同的患者中免疫联合治疗的疗效是否有所不同。
1 研究方法
1.1 搜索策略 本研究根据系统评价和Meta分析(PRISMA)的首选报告项目指南进行。通过PubMed、EMBASE和Cochrane Central Register of Controlled Trials数据库检索了转移性三阴性乳腺癌(metastatic triple-negative breast crancer,mTNBC)免疫治疗的随机对照试验(RCT)的原始文献。两位研究人员独立的检索了文献,并最终进行了交叉核对,以达成一致。我们在PROSPERO中进行了注册:CRD42023423916。
1.2 纳入和排除标准 纳入标准如下:① 受试者为mTNBC患者;② 实验组接受免疫联合治疗;③ 研究为随机对照研究(RCT);④ 每项研究有足够的数据,如危险比(HR)和相应的95%置信区间(CI);⑤ 以无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)为主要研究终点;⑥ 公开不同转移部位的生存数据。排除标准包括:① 病例报告、综述、Meta分析;② 患者数量低于40例;③研究对象为细胞及动物类研究;④数据缺失或不明确。另外,如果一个研究发表了多份结果,我们将采用最全的研究结果。
1.3 数据提取 研究严格按照入组和排除标准进行筛选,然后由两位研究人员独立提取数据。从原始文献中提取以下信息:发表年份、研究阶段、中位随访时间、PFS、OS、HR和95%CI。
1.4 质量评价 使用Cochrane偏倚风险工具评估每项随机对照试验的质量。Cochrane偏倚风险工具将偏倚风险表示为低、高或不明确的风险,包括选择、表现、检测、流失、报告和其他偏倚方面。两名评审员进行了评估,不同意见的部分由第3名评审员进行评估。最后对所有随机对照试验进行评分和记录。
1.5 数据分析HR、95%CI使用Review Manager[5.4版;Cochrane协作(http://www.cochrane.org)]中的固定效应模型进行Meta分析。HR<1的表明免疫联合治疗有生存益处,P<0.05被认为差异具有统计学意义。通过q检验评估研究之间的异质性,如P<0.05,或I2≥50%,则纳入的研究之间存在异质性,此时采用随机效应模型。
2 结果
2.1 文献检索和纳入研究的特征 通过检索PubMed、EMBASE和Cochrane电子数据库(截至2023年5月),并阅读了33篇研究全文,最终确定入组2项相关研究,IMpassion130和Alice研究(表1,图1)。这2项研究发表于2018—2022年,样本量分别为902和68例。总计纳入970例患者进行分析,有491例(50.62%)参与者接受PD-1或PD-L1抑制剂联合化疗。而其余的患者(49.38%)则是单独接受化疗的。

图1 文献筛选流程及结果
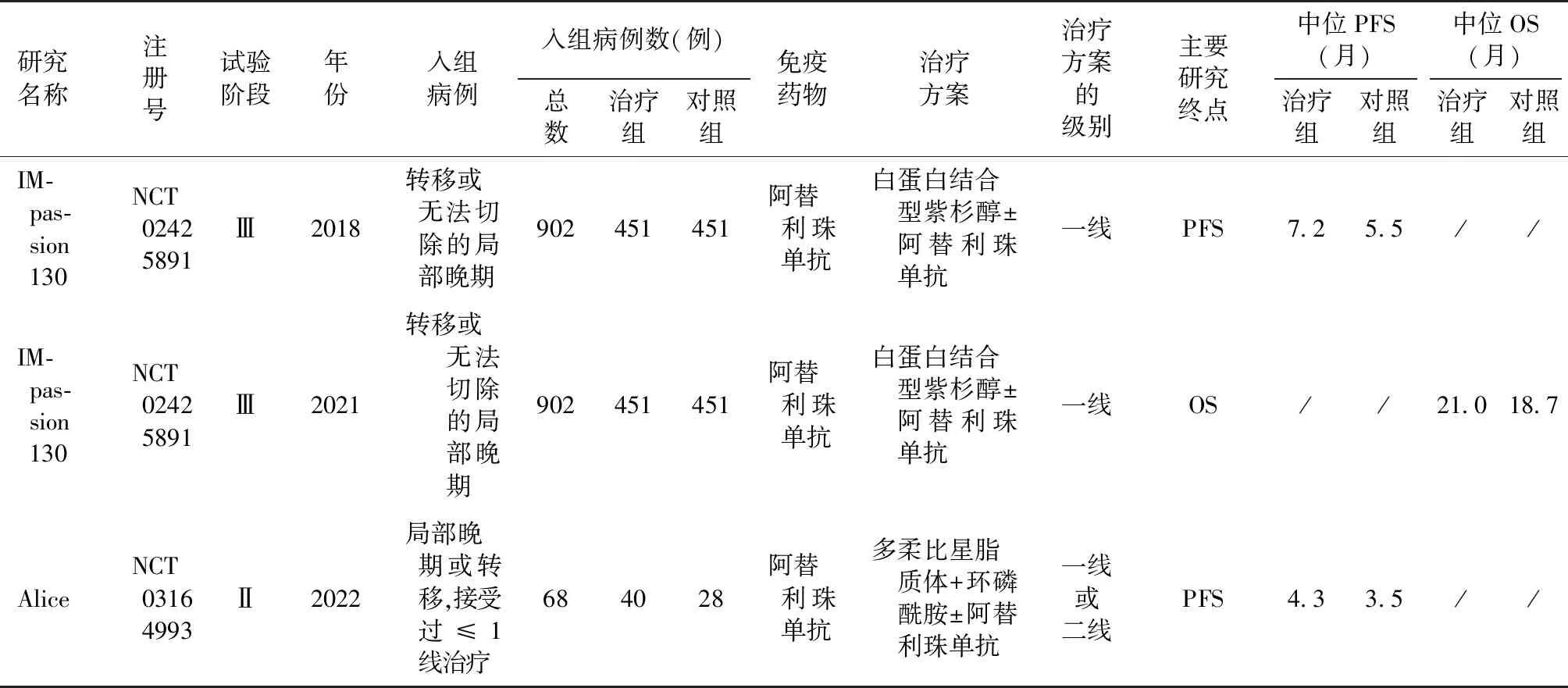
表1 纳入研究的基本特征
2.2 质量评价 偏倚评估结果如偏倚风险图(图2A)和偏倚风险汇总(图2B)所示。2项随机对照试验均为双盲设计,研究质量较高,总体被评估为低偏倚风险。

图2 文献质量评价结果 2A:偏倚风险图;2B:偏倚风险汇总
2.3 IMpassion130研究中各转移组PFS和OS的变化 我们对IMpassion130研究结果中2018年公开的中期PFS数据进行了分析,发现在任何一个分组中,免疫联合治疗均延长了患者的PFS。接受免疫联合治疗后,肺转移组与骨转移组的患者中位PFS均为5.7个月,仅有淋巴结转移的患者中位PFS较对照组延长了7.2个月(12.7个月vs.5.5个月,HR=0.44,95%CI: 0.24~0.83)。肝转移组中位PFS延长了1.6个月(5.3个月vs.3.7个月,HR=0.80,95%CI: 0.62~1.04),仅次于仅有淋巴结转移组,其次是骨转移组(5.7个月vs.5.2个月,HR=1.02,95%CI: 0.79~1.31)和脑转移组(4.9个月vs.4.4个月,HR=0.86,95%CI: 0.50~1.49),均延长了0.5月。而肺转移组PFS仅延长了0.2个月(5.7个月vs.5.5个月,HR=0.87,95%CI: 0.72~1.07),为联合治疗组中PFS延长最短的组别。而没有肺转移的患者接受免疫联合治疗后的中位PFS为8.2个个月,较对照组延长了2.7个月(8.2个月vs.5.5个月,HR=0.74,95%CI: 0.60~0.91),无肝转移的患者延长了1.9个月(7.5个月vs.5.6个月,HR=0.79,95%CI: 0.66~0.94),无骨转移(7.2个月vs.5.5个月,HR=0.73,95%CI: 0.61~0.87)、无脑转移(7.2个月vs.5.5个月,HR=0.80,95%CI: 0.69~0.93)的患者均延长1.7个月。而有除淋巴结以外部位转移的患者PFS延长最少,仅延长了0.9个月(6.4个月vs.5.5个月,HR=0.84,95%CI: 0.73~0.98)。转移器官数量≤3的患者PFS延长了2.6个月(8.2个月vs.5.6个月,HR=0.76,95%CI: 0.64~0.91),转移器官数量>3的患者PFS仅延长了0.3个月(4.0个月vs.3.7个月,HR=0.89,95%CI: 0.67~1.17)。
IMpassion130在2021年公布了的最终的OS研究结果中,对有明确转移部位的患者进行了分组分析。骨转移的患者接受免疫联合治疗的OS较对照组延长2.2个月(17.1个月vs.14.9个月,HR:0.86,95%CI: 0.67~1.11);肝转移组(14.0个月vs.12.1个月,HR:0.82,95%CI: 0.62~1.07)OS延长时间相近为1.9个月;肺转移组较对照组OS仅延长0.4个月(17.8个月vs.17.4个月,HR:0.95,95%CI: 0.77~1.17);脑转移组相较于对照组(14.3个月vs.16.2个月,HR:1.16,95%CI: 0.66~2.04)及仅有淋巴结转移组相较于对照组(34.3个月vs.34.7个月,HR:0.77,95%CI: 0.39~1.51)的患者中,并未观察到中位OS的延长。在没有分组部位转移的患者中,无肺转移的患者的中位OS相较于对照组在免疫联合治疗中延长了3.7个月(23.7个月vs.20.0个月,HR:0.83,95%CI: 0.66~1.04),是OS延长最多的组别;与无肺转移组相反,无肝转移组的OS延长时间最短,仅约1.7个月(23.7个月vs.22.0个月,HR:0.89,95%CI: 0.74~1.07)。转移器官数量≤3的患者接受免疫联合治疗后相较于对照组OS的延长时间(24.1个月vs.21.1个月,HR:0.85,95%CI: 0.71~1.02)。转移器官数量>3的患者OS延长了0.6个月(12.7个月vs.12.1个月,HR:0.94,95%CI: 0.71~1.25)。且与有肺、骨、脑、肝这些转移部位的患者的OS延长时间相比,接受免疫联合治疗的无转移者OS延长时间均更长。然而IMpassion130并未对各个组内OS延长的差异进行统计分析,我们难以从IMpassion130 的结果中判断,OS延长时间的差异是否能为临床诊疗中判断能从免疫联合治疗中获益的患者提供证据支持。
2.4 转移部位对免疫联合治疗疗效的影响 为了探究转移部位对免疫联合治疗疗效的影响,进一步对无肺、骨、肝、淋巴结转移组的患者进行了Meta分析。如图3所示,在无肺转移及无肝转移的队列里,免疫治疗联合化疗可改善患者的PFS。无肺转移的患者中,有21%的患者的PFS获益(HR=0.79,95%CI:0.69~0.91),差异有统计学意义(P=0.001),且异质性差异无统计学意义(I2=30%,P=0.23)(图3)。与接受单独化疗相比,有23%的无肝转移患者接受免疫治疗联合化疗后PFS获益(HR=0.77,95%CI:0.65~0.92,P=0.004),异质性差异无统计学意义(I2=0%,P=0.41)(图3)。尽管有31%的无骨转移患者在免疫联合治疗中获益,但差异无统计学意义(HR=0.69,95%CI:0.43~1.10,P=0.12)(图3)。在无淋巴结转移组中,两个研究间存在异质性(I2=79%,P=0.03),采取随机效应模型进行分析,发现高达41%的患者的PFS在免疫联合治疗中获益,但差异无统计学意义(HR=0.59,95%CI:0.26~1.37,P=0.22)(图3)。

图3 不同转移部位的PD-1/PD-1免疫检查点抑制剂加化疗联合疗法和化疗单一疗法的无进展生存期(PFS)合并风险比森林图
根据上述结果,进一步对转移数量进行Meta分析。 我们将Alice研究中转移器官数量≤2的患者及Impassion130研究中转移器官数量≤3的患者归入转移数量有限组,将Alice研究中转移器官数量>2以及Impassion130研究中转移器官数量>3的患者定义为转移广泛组。分析结果表明,有限组有27%患者的PFS在免疫联合治疗中获益,且差异具有统计学意义(HR=0.73,95%CI:0.62~0.91,P=0.000 3)。而广泛转移的组别中,免疫联合治疗与单独化疗对PFS的影响,差异无统计学意义(HR=0.92,95%CI:0.71~1.21,P=0.57)。亚组间差异比较结果显示I2=50.9%,差异具有统计学意义(P<0.05),表明转移累计范围可直接影响免疫联合治疗在mTNBC患者中的疗效(图4)。
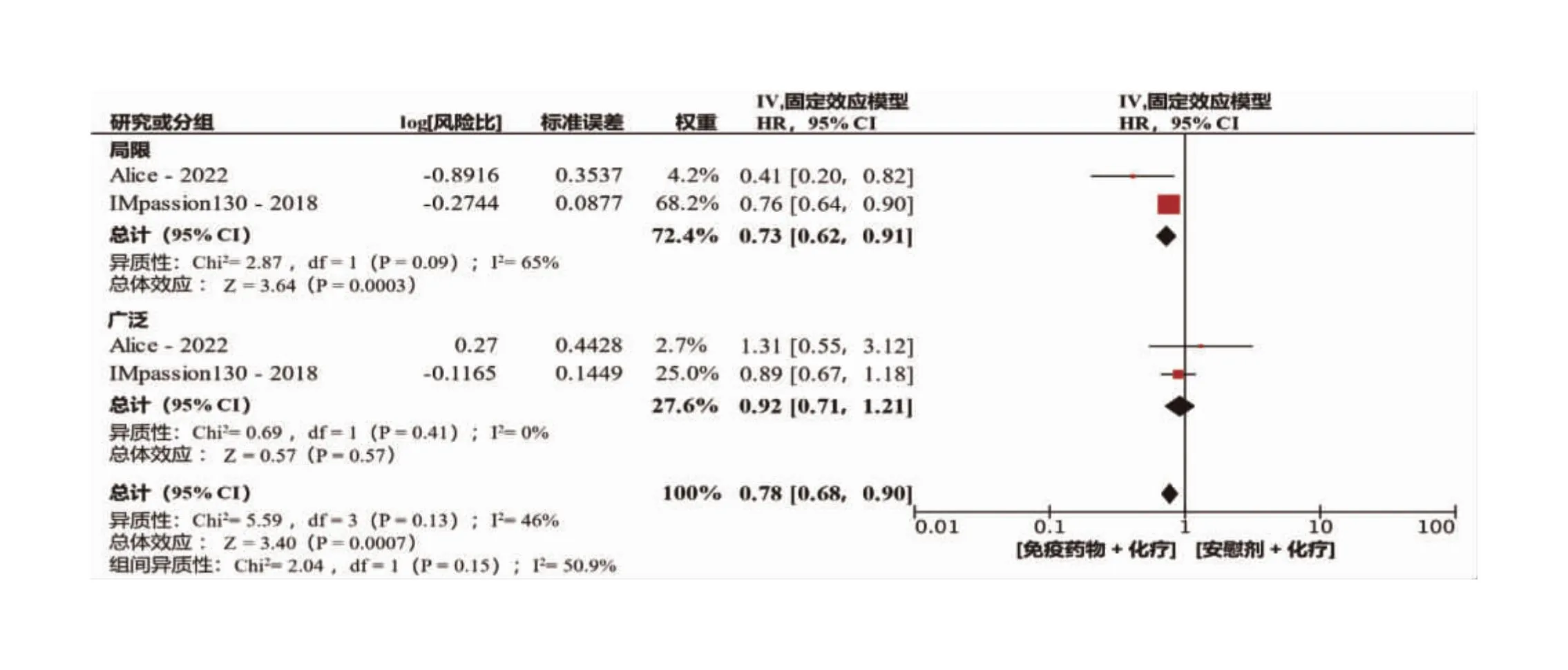
图4 不同转移部位数量的PD-1/PD-1免疫检查点抑制剂加化疗联合疗法和化疗单一疗法的无进展生存期合并风险比森林图
3 讨论
在当前的临床治疗中,TNBC的治疗方式十分有限,主要是化疗,如紫杉醇、蒽环类。与其他分子亚型相比,TNBC具有最高的PD-L1表达(约20%)。PD-L1在肿瘤细胞表面表达,可以逃避免疫监测。多个研究也报告了PD-L1的表达与免疫药物在各种实体肿瘤(包括乳腺癌症)中的疗效相关[15]。当PD1与PD-L1结合时,它可以通过抑制T细胞功能和诱导T细胞凋亡来调节免疫系统并预防自身免疫性疾病[16-17]。因此,PD1/PD-L1抑制剂一直是目前免疫治疗领域的研究重点,一些抑制剂已被确定可改善多种癌症晚期患者的生存[18],如转移性的非小细胞肺癌[19]、肾癌[20]、恶性黑色素瘤等[21]。免疫治疗目前在乳腺癌中的作用也得到了初步探索[22-23]。
在免疫单药治疗时代,KEYNOTE-012、KEYNOTE-086 A和B试验等多项随机对照试验表明,免疫单药治疗的生存获益优于单独化疗[24]。然而,KEYNOTE-119 Ⅲ期临床试验报告发现[25],帕博利珠单抗单药治疗与化疗相比未能改善OS,但化疗联合免疫药物治疗是一种潜在的治疗方案。
有研究发现,免疫检查点抑制剂如PD1/PD-L1抑制剂与化疗可能在人体内具有协同作用[19, 26]。在化疗联合免疫治疗时代,接受免疫药物联合标准化疗的患者获得了更高的OS以及可控的发生不良事件风险[27-28]。
2018年公布的Ⅲ期随机临床试验IMpassion130的试验结果表明mTNBC患者接受阿替利珠单抗与白蛋白结合型紫杉醇联合治疗比单用白蛋白结合紫杉醇治疗,PFS得到了延长(7.2个月vs.5.5个月,HR=0.81,95%CI:0.70~0.93,P=0.002 5)。因此,2019年3月美国食品药品监督管理局(FDA)批准阿替利珠单抗与白蛋白结合型紫杉醇联合治疗PD-L1表达阳性的mTNBC。这是第一个获批用于治疗mTNBC的ICI。KEYNOTE-355试验也显示与Impassion130相同生存益处。然而,在IMpassion131试验中,与安慰剂加紫杉醇相比,阿替利珠单抗联合紫杉醇治疗并没有改善PFS或OS,甚至获得了更差的OS[27]。尽管IMpassion130和IMpassion131试验均使用阿替利珠单抗联合化疗,但这些研究的结果不同。专家们认为,可能与两者药理学机制不同[29-30]、白蛋白结合型紫杉醇疗效更好[31-32]、地塞米松预处理、实验设计不同等因素有关。Impassion130与131相矛盾的试验结果导致FDA撤回了阿替利珠单抗在mTNBC患者中获批的适应证。
由于这些研究的结果未能取得一致性结论,我们考虑除了研究设计的原因,TNBC的异质性可能也是影响因素之一。我们进行了这项Meta分析,研究在转移情况不同的mTNBC患者中,化疗联合免疫治疗的益处。由于Alice试验中尚未报道各远处转移组的OS,因此,目前尚不清楚联合治疗对各转移组mTNBC患者OS的影响,我们选择PFS作为本Meta分析的终点,对不同的转移部位进行了研究分析。从IMpassion130的结果中,我们观察到无分组部位转移的患者疗效好于有该部位转移的患者。于是我们对两个研究中无分组部位转移的患者进行Meta分析,我们发现21%的无肺转移患者及23%的无肝转移患者在免疫治疗联合化疗中获益。而在无骨转移及无淋巴结转移的患者中,免疫联合治疗对PFS的延长并未观察到统计学差异。在无淋巴结转移的队列中,入组研究间异质性(P=0.03,I2=79%)。这可能是由于两个研究淋巴结转移组的入组条件不同。Alice研究中淋巴结转移组的患者只需有淋巴结转移,而IMpassion130研究中需要有淋巴结转移同时没有其他部位转移才可归入仅有淋巴结转移组。
在本研究中,这些患者分组部位以外的转移情况难以知晓,我们默认分组因素以外的转移情况是相仿的,并对这部分转移情况按照默认方式处理。综合考虑可以推断,在mTNBC的患者中,累及范围相对局限的患者在免疫联合治疗中获益更大。于是我们将Alice研究中转移数量≤2的患者及IMpassion130研究中转移数量≤3的患者归于转移局限组,其余患者归为转移广泛组。Meta分析结果显示,局限组的患者在免疫治疗中获益,而广泛组的患者的获益并未观察到统计学意义。这也验证了我们的推测。既往多项meta研究表明,化疗联合免疫治疗可能会增加不良反应发生的风险,不过均在可耐受范围内[33-34]。
我们的研究结果表明,与单纯化疗相比,联合阿替利珠单抗改善了肿瘤累及范围有限的mTNBC患者的PFS,这可能有利于阿替利珠单抗在mTNBC患者的临床应用,为mTNBC患者提供了一种新的选择。
与早期TNBC相比,mTNBC的肿瘤细胞免疫特征发生了的改变。转移瘤具有更高的免疫完整性,更少的免疫细胞,包括TIL、CD8+T细胞,并有更低的免疫相关基因的表达[35-38]。相反,转移瘤中巨噬细胞的数量更多[38-39],并保留了参与各种免疫逃逸机制的基因的表达,且不同的转移部位之间免疫情况也有不同[39]。例如,肝转移具有明显的免疫耗竭状态,与其他转移部位相比具有更少的TIL以及更高的PD-L1阴性的可能[40-41]。总之,这些观察结果表明,转移过程中发生了肿瘤-免疫协同进化,导致癌症细胞的免疫侵袭性表型增加,这与免疫重编辑假设一致[42]。原发性肿瘤和转移性病灶之间的差异可能解释了早期和晚期疾病环境中免疫治疗效果的不同,并提高了针对特定疾病阶段制定治疗策略的可能性。
转移瘤与原发灶以及转移瘤之间的免疫状态的不同,部分患者分子分型也不同,可能导致了不同阶段的TNBC以及转移情况不同的TNBC对免疫治疗的反应不同。这也为我们的研究结果提供了理论支持,可能是免疫状态的不同导致了不同的结局:病灶累及相对局限的患者免疫联合治疗疗效好于累及范围广泛的患者。因此,需要更加深入地研究探讨不同情况下的晚期TNBC患者的最优治疗方案,探寻加用免疫治疗的最佳时机。
本研究的优势在于,首次Meta分析了免疫药物联合治疗不同部位转移的晚期TNBC患者的疗效。创新点在于,本文分析统计了转移情况对免疫治疗疗效的影响,这对于识别和筛选能在免疫治疗中受益的患者人群至关重要。入组试验均为研究转移性的TNBC的免疫联合治疗的国际正式注册的随机对照试验,从而最大限度地减少选择偏差。
然而,本研究也有一些局限性。首先,这些免疫疗法的随机对照试验数量有限,公布转移部位生存情况的研究仅有两个,这可能导致我们低估这一分析的有效性。其次,一些亚组中存在异质性,但因研究数量有限,我们难以进行敏感性分析,排除导致异质性的因素。第三,我们研究中包括的临床试验因随访时间不同,可能会导致最终结果的一定偏差。第四,病例报告的患者结局未知,无法获得准确的PFS及OS。
综上所述,我们通过Meta分析发现,阿替利珠单抗联合化疗可改善部分mTNBC患者的PFS,对于病灶累及范围相对局限的患者,生存获益更大。本研究结果可能为mTNBC患者的治疗提供更多选择。

