黑米花青素对食源性肥胖小鼠脂代谢紊乱及肠道菌群的影响
王蕾,孙汉巨,刘淑芸,高玲艳,顾荥荧
(合肥工业大学食品与生物工程学院,安徽合肥 230000)
作为一种全球性的流行病,肥胖与健康并发症的风险增加有关,包括高脂血症、2 型糖尿病、心血管疾病和某些癌症[1]。流行病学证据表明,高脂肪饮食(HFD)会促进肥胖和相关代谢紊乱的发展,并且饮食中的脂肪含量与肥胖程度之间存在直接关系[2]。
脂代谢与肥胖症关系密切,脂代谢紊乱是其发病机制之一。脂代谢紊乱会引起诸如肥胖、高血脂症、非酒精性脂肪肝等多种疾病[3]。而肥胖症自身又可导致脂类代谢紊乱,从而形成一种恶性循环。此外,肥胖会导致参与脂质代谢的酶和激素的异常表达。肥胖患者脂肪组织中的脂肪酸水解酶及对激素敏感性的脂肪酸酯酶活力下降,使脂肪组织中的脂肪分解能力下降[4]。肥胖会造成脂肪细胞激素分泌异常,血浆中甘油三酯和胆固醇的水平升高,脂蛋白代谢异常,从而使脂质转运异常的激素(如瘦素、脂联素等)的水平降低,导致脂代谢异常[5]。脂质代谢异常还与诱导游离脂肪酸的释放有关,游离脂肪酸释放会增加空腹血浆TAG 浓度,降低高密度脂蛋白和胆固醇,并改变低密度脂蛋白[6]。天然植物提取物由于其各种生物活性和无副作用,已被证明在预防和临床管理肥胖及其合并症方面是安全有效的[7]。
花青素是一类广泛存在于水果和蔬菜中的水溶性黄酮类化合物,通常母体以2-苯基苯并吡喃阳离子的形式呈现,稳定性较差[8]。花青素具有多种生物活性,如抗氧化性、抗炎、抑菌性、抗肿瘤等[9,10]。近年来花青素被确定为脂质代谢的调节剂,是降低代谢综合征风险的潜在候选者[11]。大部分花青素不能在上消化道被吸收,从而到达大肠,在那里它们被肠道微生物群生物转化为其代谢物,然后被吸收[12]。花青素也被认为是具有益生元活性的物质。它们可促进益生菌的生长,抑制有害细菌的生长,改善肠道微生态[13]。有充分证据表明,肠道菌群在维持能量平衡和正常物质代谢的过程中也发挥着重要作用[14]。因此,也有学者认为肠道菌群不仅与脂代谢有密切关系,也和肥胖的发生有潜在联系。目前已有研究比较了超重和体脂偏低个体的拟杆菌门和厚壁菌门的丰度[15],结果表明超重受试者和体脂偏低受试者之间肠道微生物群有显著差异,与超重组相比,体脂偏低个体的长双歧杆菌和厚壁菌门丰度更高。厚壁菌门与拟杆菌门的比例越增加,肥胖发生的机率越大。有研究表明黑加仑花青素缓解了HFD 诱导的肥胖、高脂血症和肝脂肪变性。此外,黑加仑花青素补充剂通过调节与脂质和胆固醇的合成和降解相关的基因的表达来改善肝脂代谢。微生物分析表明,补充黑加仑花青素显著改变了肠道微生物群的整体结构和组成[16]。因此花青素可能通过影响肠道菌群的组成来调节脂质代谢。本研究旨在研究黑米花青素(BRE)对HFD 喂养小鼠脂代谢紊乱的调节机制及肠道菌群组成的影响。
1 材料与方法
1.1 原料
黑米花青素粗提物(矢车菊素-3-O-葡萄糖苷的质量分数>35%),购于天津康友生物有限公司。茶多酚购于山东思扬生物科技有限公司。
1.2 主要仪器设备
全波长扫描酶标仪,美国Thermo 公司;高速冷冻离心机,上海卢湘仪离心机仪器有限公司;数显恒温水浴锅,金坛市荣华仪器制造有限公司。
1.3 试验方法
1.3.1 黑米花青素的鉴定
黑米提取物中花青素的鉴定采用安捷伦1260 UPLC 系统(安捷伦,美国)和LC-ESI-MS/MS 电喷雾电离串联质谱(安捷伦,美国)进行鉴定。二极管阵列检测器为520 nm。花青素使用Agilent Eclipse Plus C18(2.1 mm×50 mm)分离,流速为0.2 mL/min。流动相由A(水:甲酸=90:10,V/V)和B(乙腈)组成。0~5 min,95%~90% A;5~10 min,90% A;10~17 min,90%~76% A;17~27 min,76%~10% A;27~30 min,10% A;30~35 min,10%~95% A;35~40 min,95% A。质量分析在Agilent 6430 三重四极杆LC/MS 系统进行,扫描间隔为200~1 000m/z。温度为310 ℃,N2流速为11.0 psi。毛细管电压为4 kV,干燥气体流速为5 L/min。数据用Agilent MassHunter 软件进行处理。
1.3.2 动物实验设计
雄性C57BL/6J 小鼠50 只,6 周龄,平均质量为(19.34±0.84)g,自由饮食饮水1 周后随机分为五组,每组10 只。五组分别命名为高脂膳食组(HFD)、低剂量BRE 处理组(LBRE)、中剂量BRE 组(MBRE)、高剂量BRE 组(HBRE)及阳性对照茶多酚组(TP),每组10只。高脂饲料由质量分数为34.89%脂肪、26.23%蛋白质、31.50%碳水化合物、5.81%矿物质、1.57%的维生素组成(每100 g 饲料中能量为2 192.42 kJ)。低、中、高剂量黑米花青素组小鼠分别喂食含有200、400及600 mg/kg 黑米花青素的高脂膳食。阳性对照茶多酚组小鼠给予含有240 mg/kg 茶多酚(质量分数>90%)的高脂膳食。总试验周期8 周,并将体质量变化每周记录在册。
1.3.3 血清生化指标检测
将小鼠禁食12 h,CO2窒息后立即从眼眶取血并收集。将取得的血液迅速在4 000 r/min、4 ℃条件下离心15 min,分离出上层血清,4 ℃下保存。通过使用全自动生化分析仪测定各组小鼠血清中甘油三酯(TG)、总胆固醇(TC)、低密度值蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平[17]。
1.3.4 肝脏组织病理形态观察
用灭菌后的工具剪取肝脏组织,经质量分数4%多聚甲醛溶液进行浸泡固定,再依次进行包埋、切片、脱蜡、HE 染色等操作,完成肝脏组织切片的制作,在400 倍光学显微镜下进行观察并拍照记录[18]。
1.3.5 肝脏组织中脂代谢相关基因表达水平分析
取新鲜的小鼠肝脏组织,用消毒后的刀片将肝脏组织切割成绿豆大小,所切组织块的长宽高≤0.5 cm,然后用预冷的RNase-free 水快速冲洗肝脏组织[19]。将处理后的肝脏组织迅速放入RNase-free的螺纹冻存管中并标记,全部操作过程在冰浴下进行。将螺旋管置于液氮迅速冷却1 h 后,于-80 ℃保存,避免反复冻融。本研究样品送至苏州帕诺米克生物医药科技有限公司作宏基因组分析。通过分析各组小鼠肝脏脂代谢相关基因的mRNA 表达水平,并以此为依据推测黑米花青素改善高脂膳食饲喂小鼠脂代谢紊乱的途径[20,21]。
1.3.6 肠道内容物肠道菌群差异性分析
将各组小鼠麻醉后处死,分别取小鼠肠道内容物2 g 并标记,随即将样品放入冻存管中,液氮冷冻1 h后,放入-80 ℃保存,在干冰保存条件下寄送至苏州帕诺米克生物医药科技有限公司。处死小鼠后取出盲肠,在超净台中用干净的镊子取盲肠内容物于1.5 mL管中,密封后迅速放入液氮中冻存。并从中提取细菌DNA,将DNA 样品在Illumina 平台上进行扩增、纯化和测序。对测序后得到的原始数据进行过滤筛选,确认其有效性和准确性后再进行分析[22]。将各组小鼠肠道菌群进行对比,筛选出差异菌群。最后总结分析黑米花青素对小鼠肠道菌群的丰度、结构、功能等产生的影响。
(1)OTU 分析
使用QIIME2 软件,将相似性大于97%的序列进行OTU 聚类分析,再通过RDP 数据库(Release 11.1http://rdp.cme.msu.edu/)注释。
(2)组间相似性分析
基于主坐标分析(PCoA)评估组间物种的β-多样性及肠道微生物差异性。
(3)肠道群落组成分析
通过QIIME 2 软件,对肠道微生物进行物种分类学注释,并在门、属水平上进行分析,明确黑米花青素对高脂膳食小鼠肠道微生物组成和结构的影响。
1.3.7 肠道内容物短链脂肪酸含量检测
取禁食12 h后的小鼠粪便200 mg于5 mL离心管中,加入2 mL 磷酸充分混匀。再将样本在4 ℃、10 000 r/min下离心15 min,吸取0.3 mL 上清液移入离心管中,加入0.1 mL 质量分数为50%的H2SO4和0.8 mL 内标2-乙基丁酸,涡旋振荡10 min 后离心15 min(4 ℃,10 000 r/min)。最后,将上清液转移至-20 ℃保存,以备后续检测[23]。Agilent 7890 气相色谱质谱联用仪配备Agilent HP-5 毛细管柱(30 m×0.25 mm ID×0.25 μm)检测样品中短链脂肪酸含量。进样口温度为220 ℃,溶剂延迟6 min,进样量1 μL,离子源温度230 ℃,传输线温度280 ℃;程序升温起始温度80 ℃,保持1 min,然后以40 ℃/min 的速率升温至100 ℃,保持5 min,再以20 ℃/min 的速率升温至210 ℃,保持30 min;载气为氦气,载气流速1.0 mL/min。质谱条件:电子撞击模式,电子能量为70 eV。小鼠粪便中短链脂肪酸含量通过公式1 计算。
式中:
Ccon——样本中目标化合物的含量,mg/kg;
Cs——提取液中目标物质量浓度,mg/L;
V1——加入内标溶液体积,mL;
V2——取出纯水上清液体积,mL;
V3——加入纯水体积,mL;
M——称样量,mg。
1.3.8 数据分析
使用Origin Pro 2021 软件对取得数据进行作图,实验重复至少3 次,数值以平均值±SD 表示。当P<0.05 时为显著,P<0.01 为极显著。
2 结果与讨论
2.1 黑米提取物中花青素的组成
如图1 所示,黑米提取物中花青素所占比例为88.24%,共有5 个峰,其中峰2 为主要花青素单体。然后,通过HPLC-ESI-MS/MS 对各峰进行表征,花青素的质谱和化学结构如图2 所示。
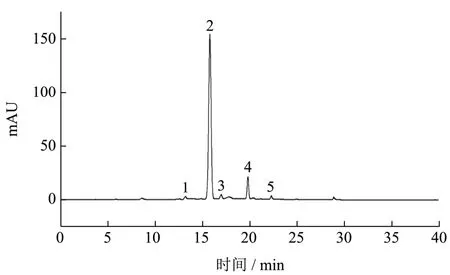
图1 黑米提取物在520 nm 处的HPLC 色谱图Fig.1 HPLC chromatogram of the black rice extract detected at 520 nm
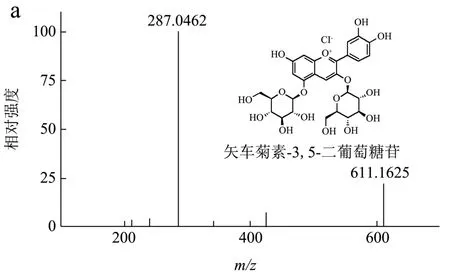
图2 黑米提取物在520 nm 处的质谱图Fig.2 Mass spectrum of black rice extract at 520 nm
如图2a 所示,峰1 在m/z611 处有一个分子离子[M]+,在m/z287 处有一个片段离子。由于花青素-3,5-二葡萄糖苷的理论数据为m/z611,分子离子损失162 个,表明在峰的结构中存在葡萄糖部分,峰1 的m/z数据(m/z611)为矢车菊素-3,5-二葡萄糖苷。如图2b 所示,观察到m/z449 处的分子离子[M]+,并且分子离子可以在m/z287 处碎裂成一个离子[M-162]+,表明一个葡萄糖部分的损失。因此,峰2 为矢车菊素-3-O-葡萄糖苷。在m/z595 处存在分子离子[M]+,在m/z287[M-308]处显示初级碎片离子+,对应一个芸香苷部分的分子离子损失。因此,峰3(图2c)可以鉴定为矢车菊素-3-O-芸香糖苷。由于m/z463 的分子离子和m/z301[M-162]+的分子离子的特征碎裂模式,峰4 中(图2d)成分为芍药素-3-O-葡萄糖苷。峰5的MS 图谱(图2e)在m/z609 处存在分子离子[M]+,在m/z301[M-308]处显示初级碎片离子,对应一个芸香苷部分的分子离子损失。因此,峰5 为芍药素-3-O-芸香糖苷。
2.2 黑米花青素对高脂小鼠体质量的影响
小鼠每周体质量变化随时间增长逐渐增大,符合小鼠生长发育的一般规律。8 周试验周期结束后,HFD组小鼠平均体质量为28.24 g,LBRE、MBRE 及HBRE组小鼠平均体质量分别为26.22、25.94 及24.72 g。而阳性对照组(TP 组)小鼠体质量为25.23 g(图3)。显然,与HFD 组相比,黑米花青素和茶多酚干预后的小鼠体质量显著降低,且具有剂量效应。随着黑米花青素的添加量越多,体质量降低的趋势也越显著。

图3 黑米花青素对小鼠体质量增长的影响Fig.3 Effect of black rice anthocyanins on body weight gain in mice
2.3 黑米花青素对高脂小鼠血清生化指标的影响
当TP 及不同剂量黑米花青素干预8 周后,五组小鼠血脂水平发生不同变化。采用生化分析仪对小鼠血清中总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和甘油三酯(TG)的含量进行检测,结果如图4 所示。与HFD 组相比,HBRE 组血清TG、TC 和LDL 水平显著降低,与阳性对照组(TP 组)变化趋势相似。

图4 黑米花青素对小鼠血脂异常的影响Fig.4 Effect of black rice anthocyanin on dyslipidemia in mice
如图4 所示,HFD 喂养小鼠的TG、TC、LDL-C水平显著高于其他组(P<0.05),而添加黑米花青素显著降低了上述升高参数的水平。与HFD 组相比,LBRE 组的TG、LDL 及TC 水平分别降低了14.30%、12.75%及3.73%,而HDL水平则提高了16.28%。HBRE组血清中TG、LDL 及TC 水平分别降低了42.33%、22.28%及11.13%,而HDL 水平则提高了30.86%。这表明高剂量的黑米花青素干预降血脂效果更显著。结果表明,与TP 效果相似,黑米花青素能够有效降低HFD 小鼠血清TC、TG 和LDL-C 水平,增加血清HDL-C 水平,其降脂作用明显,并呈量效关系。
2.4 黑米花青素对高脂小鼠肝脏组织形态的影响
小鼠肝脏组织的病理学变化如图5 所示。HFD 组小鼠肝脏有明显的脂肪泡,部分细胞形态出现肿大,并伴有炎性浸润。不同剂量黑米花青素组分别不同程度的改善了肝脏组织的病理学结构变化,随着黑米花青素剂量的增加,改善作用越大。与HFD 组相比,HBRE 及TP 组的小鼠肝组织细胞结构完整、清晰、没有明显变性,以中央静脉为中心,周围呈放射状分布,肝小叶结构正常。研究发现,黑米花青素对高脂饲料诱导的小鼠肝内脂质沉积有明显的抑制作用,且在8 周内,BRE 对高脂饲料诱导的小鼠肝内脂肪的含量明显降低,炎症细胞的浸润减少。经不同剂量黑米花青素干预8 周,肝组织细胞界限更加清楚,无明显退行性改变,脂肪空泡减少。这些现象不仅表明黑米花青素可以有效预防高脂膳食小鼠肝脏中脂质沉积,同时可以缓解小鼠肝脏组织炎症。

图5 BRE 及TP 摄入对小鼠肝脏的影响Fig.5 The effects of BRE and TP intake on mouse liver
2.5 肝脏中基因表达差异分析
在图6 中,以FC≥1 且P<0.05 为标准筛选显著差异表达基因。显著差异的基因中上调基因被显示为红色,下调基因则为蓝色。由图6 可知,通过LBRE/HFD 比较,发现了422 个上调和225 个下调的显著差异表达基因。而MBRE 组与HFD 组相比,发现419 个上调基因,286 个基因显著下调。而HBRE组中显著差异基因中上调了770 个,下调了296 个。与HFD 组相比,TP 组中被上调的显著差异基因数目为504 个,下调的基因为322 个。随着黑米花青素剂量增大,显著差异基因中上调和下调的基因数目也增多,这表明摄入黑米花青素对高脂膳食小鼠的基因转录图谱产生了较大影响,且与剂量呈现正相关的关系。

图6 不同剂量黑米花青素对HFD 小鼠肝脏的显著差异基因的影响Fig.6 The effect of different doses of black rice anthocyanins on significantly different genes in the liver of HFD mice
2.6 黑米花青素对高脂小鼠肝脏脂代谢相关基因表达的影响
肝脏是代谢过程的主要场所,如脂质的合成、组装、重塑和分解。因此,肝脏是研究肥胖模型的一个重要目标。人体胆固醇的主要来源是甲羟戊酸的生物合成。3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGCR)作为从头合成胆固醇的限速酶,同时也是内源性胆固醇合成的关键调节酶[24]。Cyp7a1可以催化胆固醇向胆汁酸生物转化,促进体内胆固醇的分解代谢[25]。Ldlr是LDL-c 的受体,参与胆固醇从血浆到细胞质的转运与胆固醇的分解过程[26]。PPARs是一类过氧化物酶体增殖激活受体,包括三种亚型:PPARα、PPARβ/δ和PPARγ[27]。其中,PPARγ参与脂肪生成、能量平衡和脂质生物合成等脂代谢途径。已有研究表明,PPAR-γ失调与肥胖、2 型糖尿病、动脉粥样硬化和其他疾病的发展有关,而PPARγ表达下调已被证明具有抗肥胖作用[28]。由图7 可知,BRE 干预对高脂膳食饲喂小鼠肝脏脂代谢相关基因的mRNA 表达水平有较显著的影响,与HFD 组相比,PPARγ、HMGCR的表达量分别下调了46.82%和41.92%,Cyp7a1、LdIr、PPARα的表达量分别上调了189.41%、102.42%和197.80%。说明黑米花青素可减少机体因高脂膳食机体肝脏胆固醇的合成,降低脂肪酸从头合成速率。这表明黑米花青素可能会减少高脂肪饮食诱导的肝脏内大量胆固醇的合成,并减少脂肪酸的从头合成。
2.7 黑米花青素对高脂小鼠肠道菌群的影响
2.7.1 OTU 分析
基于OTU 绘制韦恩图,统计多组样品中所共有和独有的OTU 数目[29],比较各组小鼠间肠道菌群的OTU数目组成相似性及特异性差异,结果如图8所示。通过Venn 图分析了高脂组、低中高剂量黑米花青素组和茶多酚组五组间共有和独有的OTU 数目。五组小鼠盲肠内容物样品中总OTU 数目为10 033 个,共有的OTU 数目为136 个,约为总OTU 数目的1.36%。五组样品独有的OTU 数目如下:HFD 组2 551 个(25.43%)、LBRE 组1 609 个(16.04%)、MBRE 组722 个(7.20%)、HBRE 组1 090 个(10.86%)及TP组2 024 个(20.17%),各组特有的OTU 数目所占比例较大,说明各组间细菌群落组成存在较大的差异性。去除共有的OTU 数目后,HFD 组中特异性的OUT 数目显著高于低中高剂量花青素组,表明摄入黑米花青素的小鼠与HFD 组小鼠的菌群分布具有显著差异性。
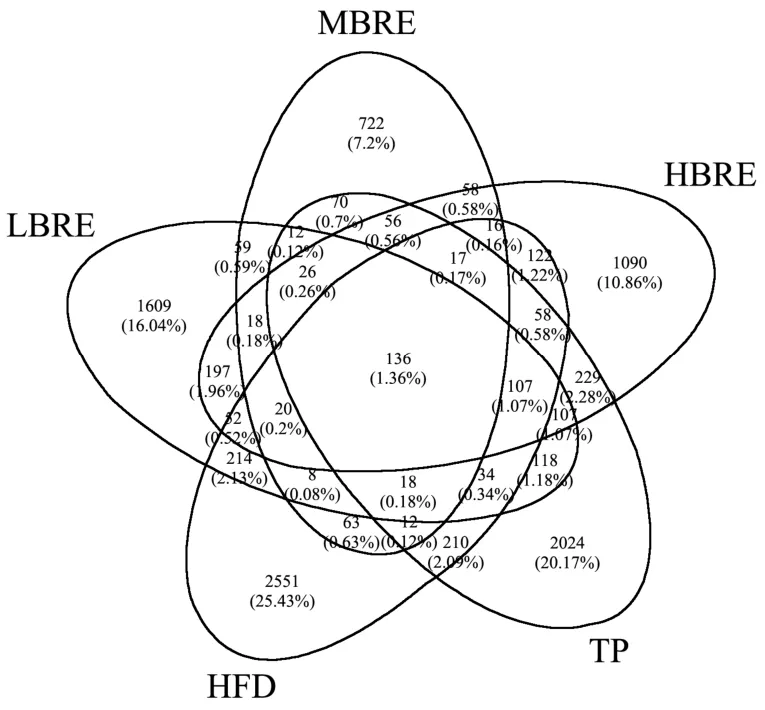
图8 各组肠道菌群OTU 数目的韦恩图Fig.8 Venn diagram of the number of OTUs of each group of intestinal flora
2.7.2 多样本聚类分析
PCoA 图可表明样本间差异性,距离与差异呈正比。如图9 所示,样本层次聚类与主成分分析均显示,组间物种组成相似性呈现较大差异。HFD 组菌群与其余各组的距离较远,表明摄入黑米花青素后菌群结构产生显著差异。结果表明BRE 干预对高脂小鼠的肠道微生物群有调节作用。
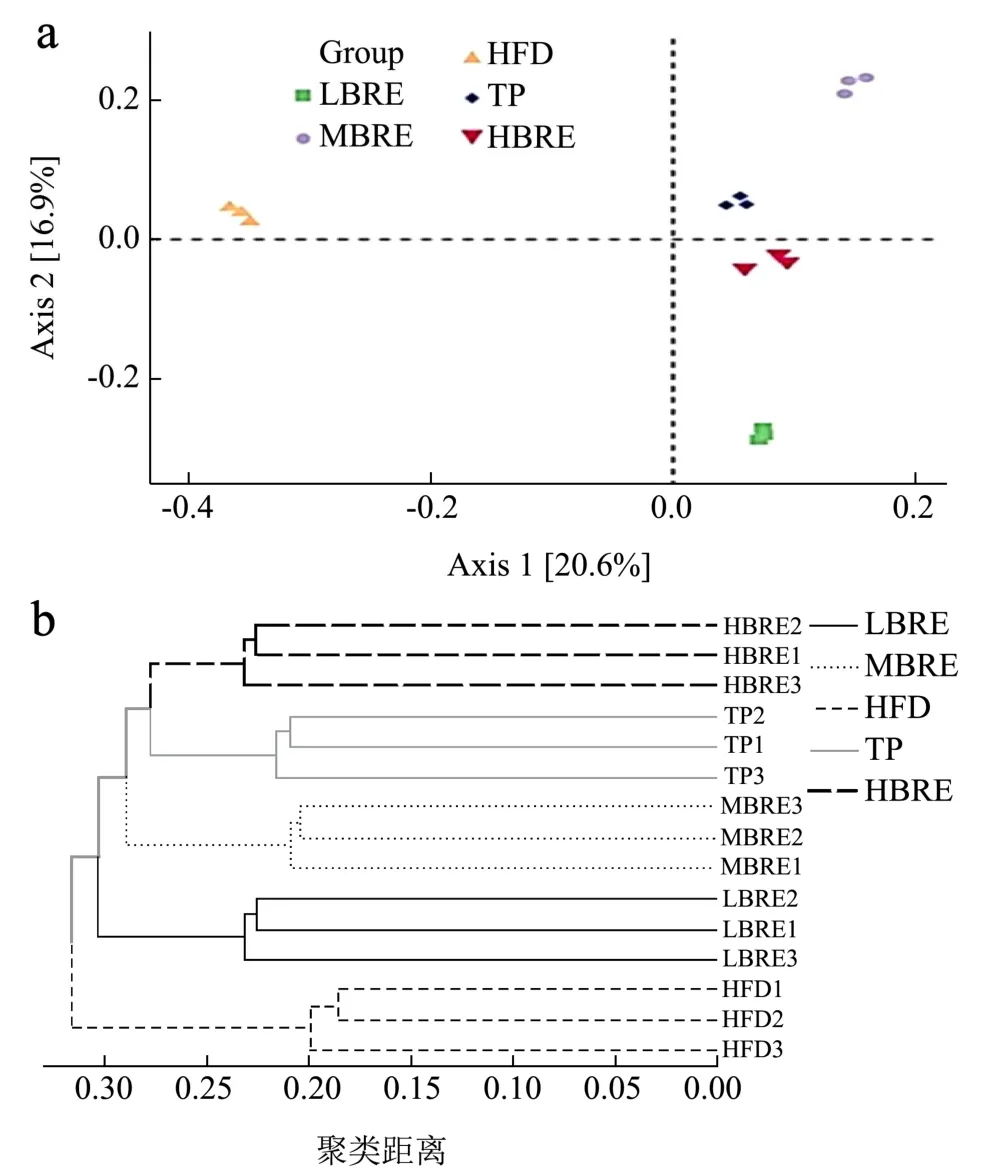
图9 基于主成分分析(a)和聚类分析(b)的微生物群落结构差异Fig.9 Deference of microbial community structure based on principal component analysis (a) and cluster analysis (b)
2.7.3 肠道群落组成分析
根据物种注释结果,门和属水平下相对丰度的物种及其比例见图10 和图11。肠道菌群中可检出的占主导地位的门水平下细菌种类分别是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)。其中,物种相对丰度排名前三的分别是厚壁菌门、拟杆菌门和变形菌门。厚壁菌门和拟杆菌门在肠道菌群中参与能量代谢。厚壁菌门与拟杆菌门的比值(F/B)是反应肠道菌群紊乱的重要指标,比值增加表明体内出现炎症,而肥胖者肠道中这两种菌的比值较高。

图10 门水平微生物组成柱状图Fig.10 Column diagram of microbial composition at phylum level
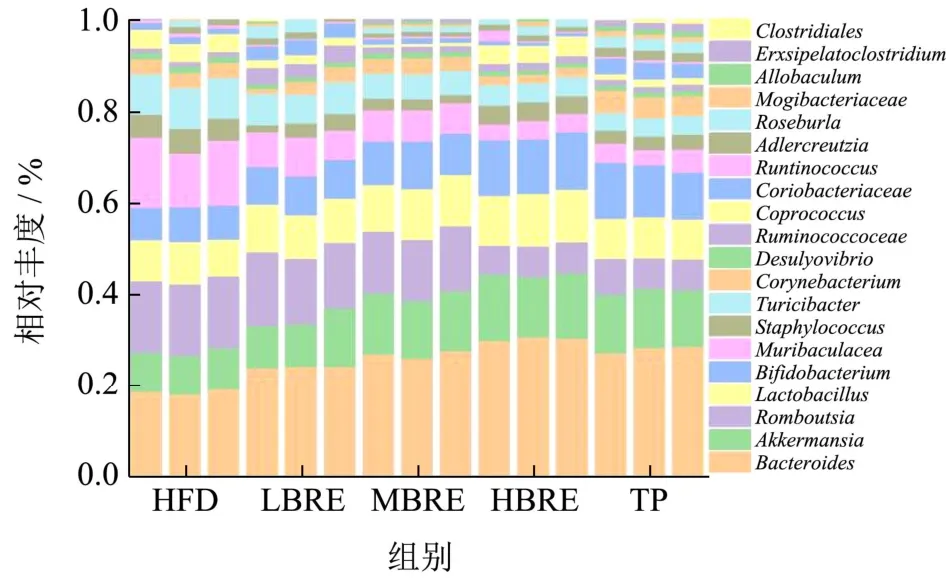
图11 不同剂量BRE 对肠道菌群属水平相对丰度的影响Fig.11 Effect of different doses of BRE on the relative abundance of gut flora genus levels
如图10 所示,在门水平上,与HFD 组相比,BRE组均降低了厚壁菌门/拟杆菌门的比值。HBRE 组厚壁菌门相对丰度下降(13.16%)拟杆菌门相对丰度增加(26.92%)。与HFD 组相比,L-BRE 组中拟杆菌门的相对丰度降低了19.23%,厚壁菌门/拟杆菌门比值为1.29,而变形菌门升高18.18%。在物种分类学分析结果中,BRE 干预在各个分类水平上调节了高脂小鼠肠道微生物组成。与高脂组相比,LBRE、MBRE、HBRE组和TP 组在门水平上均降低了变形菌门的数量,增加了拟杆菌门的数量。
如图11 所示,与HFD 组相比,不同剂量BRE组及TP 组,尤其是HBRE 组,显著提高了益生菌(如乳杆菌属、嗜黏蛋白阿克曼菌属、瘤胃球菌、双歧杆菌属和拟杆菌属)的相对丰度。阿克曼氏菌属(Akkermanni)可以降低与小鼠高脂肪饮食相关的内毒素水平,并通过降解肠道中的黏蛋白,调节肠道内粘液厚度和维持肠道屏障完整性进而调节机体代谢。因此,阿克曼菌属在调节肠道代谢功能和改善免疫反应方面都起着重要作用。苏黎世杆菌属(Turicibacter)与宿主机体内胆汁酸水平密切相关,胆汁酸浓度升高会导致苏黎世杆菌细菌生长被抑制。双歧杆菌(Bifidobacterium)可粘附于肠上皮细胞作为肠道粘膜屏障稳定剂,改善肠道微环境,增强肠道屏障。瘤胃球菌代谢后产生丁酸盐,发挥抗炎作用,维持肠道健康。
其中,阿克曼氏菌属(Akkermanni)、瘤胃球菌属(Ruminococcaceae)、乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和拟杆菌属(Bacteroides)的相对丰度分别增加了53.29%、51.87%、23.80%、54.28%及69.38%。同时BRE 也能显著下调致病菌属的丰度,如罗姆布茨菌属(Romboutsia)、毛茛菌属(Muribaculacea)和苏黎世杆菌(Turicibacter)的丰度分别降低了56.40%、64.29%及53.53%。上述结果表明,添加BRE 对高脂膳食引起的肠代谢紊乱有显著的调节作用并能显著提高肠道菌群的多样性。黑米花青素具有促进益生菌及抑制有害菌的作用,可作为一种潜在的益生元物质。
2.7.4 黑米花青素对高脂小鼠肠道短链脂肪酸的影响
BRE 在胃肠道中几乎不被消化吸收,通常也被认为是有效的益生元[30]。但肠道微生物可以利用BRE,产生短链脂肪酸等代谢产物。短链脂肪酸可以维持肠道黏膜屏障完整性和免疫功能[31]、调节肠道抗炎反应[32,33]、促进肠道蠕动、降低血糖和胆固醇水平、参与脂肪代谢和能量供应[34]。
表1 中显示了HFD、LBRE、MBRE、HBRE 与TP 组小鼠粪便中短链脂肪酸浓度,并将各组小鼠粪便中短链脂肪酸浓度进行对比分析。乙酸(12~18 mg/kg)是小鼠粪便中的主要短链脂肪酸,其次是丙酸(2~7 mg/kg)和丁酸(1~4 mg/kg)。还检测到少量的戊酸(0.04~0.09 mg/kg),异戊酸(0.02~ 0.04 mg/kg)和异丁酸(0.02~0.06 mg/kg)。与HFD 组相比,LBRE、MBRE 及HBRE 组干预均提高了小鼠粪便中乙酸、丙酸及丁酸的浓度。其中,HBRE 组对小鼠肠道内产生短链脂肪酸的促进作用最显著。阳性对照组(TP 组)也与BRE 组的变化趋势相似。因此,摄入BRE 可以提高肠道短链脂肪酸含量,增强肠道屏障功能,也有助于改善机体代谢稳态。

表1 各组小鼠粪便中SCFAs 的含量(mg/kg)Table 1 Contents of SCFAs in feces of mice in each group (mg/kg)
3 结论
本研究通过开展动物实验,探究黑米花青素对高脂膳食小鼠体内脂质代谢及肠道菌群的影响。黑米花青素显著降低高脂膳食小鼠血清中TC、TG 和LDL-C的浓度,并提高了HDL-C 浓度。结果表明黑米花青素可以降低高脂膳食诱导的小鼠血脂水平。通过对小鼠肝脏转录组进行分析,低、中及高剂量黑米花青素组均提高了小鼠肝脏中PPARα的表达水平,Hmgcr和Cyp7a1基因的表达也被调节,这些基因与PPARα相关并参与脂质代谢。同时,黑米花青素干预也显著影响了氧化应激相关通路,这表明其具有调节脂代谢紊乱的作用。通过分析不同组小鼠盲肠组织中的肠道菌群丰度差异性,可知不同剂量BRE 及阳性对照组均可显著提高小鼠肠道中益生菌丰度,如双歧杆菌、拟杆菌属、乳酸杆菌及嗜黏蛋白阿克曼菌等。其中,HBRE 组与HFD 组差异最为显著。除此之外,不同剂量BRE 组及TP 组均降低了苏黎世杆菌、罗姆布茨菌及毛茛菌等有害菌属的丰度,表明对有害菌具有抑制作用。本研究表明,BRE 对高脂膳食诱导的肥胖小鼠具有调节肠道菌群,增强肠道屏障等有益作用。
综上所述,本研究通过动物实验探究了黑米花青素对高血脂症的影响,并探讨了黑米花青素改善脂代谢紊乱及调节肠道菌群的作用机制。研究发现不同剂量黑米花青素均能显著抑制高脂饮食下小鼠的体质量增加,降低血脂并改善脂代谢。此外,黑米花青素也对肠道菌群产生了较显著的影响,提高了小鼠体内短链脂肪酸含量。因此,黑米花青素被证明可能通过改善脂代谢及肠道菌群组成从而改善高血脂症。

