膳食脂质肠道消化及吸收的研究进展
刁小琴,刘冠华,陈晓东,贾瑞鑫,刘登勇,关海宁
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
膳食脂质是各类食物含油脂的总和,是机体能量、必需营养物质和生物活性成分的重要来源或载体,其最主要成分是甘油三酯(Triglyceride,TAG)、甘油二酯(Diacylglycerol,DAG)、单甘酯(Monoacylglycerol,MAG)、游离脂肪酸(FFA)以及少量磷脂和胆固醇等[1]。然而,膳食脂质的消化吸收需以一种“易溶解、可吸收”的构象形态加以实现。口腔的初级乳化、胃中的消化水解以及直到十二指肠完全乳化都是消化历程中关键的环节[2],肠道作为消化50%~70%脂质的主要场所,实现了吸收,转运和代谢的全部过程。因此,明确影响消化吸收的主要因素,探究小肠消化动力学以及脂质形态特征对促进脂质代谢与调控至关重要,其理论基础在开发新的脂类产品过程中也显得尤为关键。
本文在叙述脂质肠道消化途径的基础上,进一步阐述了其在肠道消化过程的界面作用,并从自身形态、相互作用、酯键特征以及胆汁盐等多方面综述了影响消化的主导因素。同时就转运调节因子、分子吸收路径以及微生物调控途径三个方面阐明脂质在肠道吸收历程中的作用机理,为下一阶段膳食脂质的高效能利用与新型脂质的创新性研发提供借鉴与依据。
1 脂质在肠道中的消化行为
1.1 脂质肠道消化的途径
膳食脂质依次经口腔、胃、肠三个阶段进行消化吸收,首先在口腔内,脂质经过牙齿、舌头的机械作用咀嚼磨碎成小颗粒,与唾液中的酶、蛋白充分混合,进行初步乳化;形成的粗乳状液进入胃后,脂质进一步发生乳化形成脂质-水界面,经过胃脂肪酶的作用特异性水解TAG 中的Sn-3位,产生游离脂肪酸和1,2-DAG,脂质在胃中消化率为10%~30%,随后伴随高剪切力作用在十二指肠完全乳化。经前十二指肠消化后的各种膳食脂质及初步消化产物(TAG、DAG、FFAs 等)在胃排空作用下分批进入小肠的空肠腔段。与此同时脂肪酸会刺激小肠黏膜中的I 细胞使其向体液中释放胆囊收缩素(CCK),CCK 促进消化液如胆汁和胰液的分泌,并通过导管的运输进入小肠肠腔,胰液中的胰脂肪酶特异性作用于甘油与脂肪酸分子连接的酯键从而推动脂质消化继续进行[3,4]。在胆汁盐和共脂肪酶协助下,胰脂肪酶附着于脂肪乳滴界面,并通过共脂肪酶、胰脂肪酶的作用使脂质界面呈开放状态,位于乳滴中心的膳食脂质被水解[5]。胰脂肪酶的特异性决定了其首先作用于Sn-1 位的酯键,产生Sn-2,3 甘油二酯,然后攻击Sn-3 位酯键,生成Sn-2甘油一酯[6,7]。Sn-2 位的脂肪酸分子由于热力学结构不稳定,会发生分子重排,转移至Sn-1 或Sn-3 位,进一步被水解,最终生成甘油和游离脂肪酸[7,8],整个消化的途径如图1 所示。
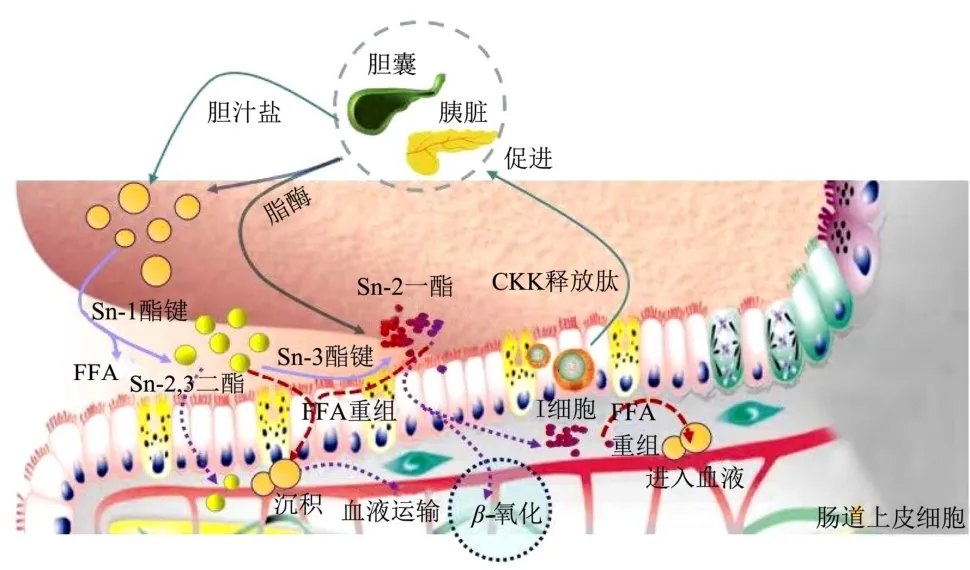
图1 膳食脂质在肠道的消化途径Fig.1 Digestion pathway of dietary lipids in the intestine
此外,Verkempinck 等[9]在模拟小肠体外消化的研究中发现,逐渐增加的胆汁盐可能会导致油水界面聚积更多的脂质消化产物,从而阻碍脂肪酶活性。这项研究说明,在肠道的消化途径中胆汁盐的浓度是脂类水解进程的限制因素,其主要涉及脂解界面作用,脂解界面作用与水解前乳化的效果同样重要。Liu 等[10]研究了不同链长非乳化甘油三酯在不同模型下的消化行为,乳化甘油三酯可以在小肠期前完成4.5%~24.5%的消化,从而验证脂肪酶的乳化行为在脂水解中同样发挥了关键作用。Acevedo 等[11]也在研究食品乳液与脂质消化关系时提到,稳定的乳液能够正常转运至十二指肠,而不稳定的乳液容易发生絮凝、聚结和相分离等,对小肠阶段的消化产生不利影响。而脂解界面作用与水解前的乳化作用均会改变乳液结构的稳定性,进而影响消化过程。
1.2 脂质肠道消化的界面作用
界面作用在脂质消化过程中发挥重要作用,由于乳化屏障的“阻拦”,胰脂肪酶与共脂肪酶不能单独吸附在乳滴界面,而胆汁盐则通过“造山位移”作用可以将起屏障作用的表面活性剂分子取代,致使表面活性剂分子尾端相连聚集成球从表面解吸。Reis 等[12]研究发现,乳化剂和脂肪酶之间的竞争性吸附是决定混合乳化剂稳定乳液的脂解动力学的关键因素,胆汁盐的界面作用帮助脂肪酶将乳化剂剔除,从而为脂肪酶提供了作用区域,发挥脂肪酶的水解作用。Infantes-Garcia 等[13]利用司盘20-CP 和吐温80 两种乳化剂来测定脂解动力学,也证实了竞争性吸附现象(如造山位移)是稳定乳剂脂解的决定因素,并证明界面的改变可以控制乳剂的脂解动力学。
伴随着表面活性分子的解析,胆汁盐与表面活性剂分子聚集后也会解吸脱离界面,脂肪酶与共脂肪酶形成脂肪酶络合物在新界面上吸附,从而实现有效水解。Chen 等[14]在研究焙烧和煮沸对山茶籽油脂界面结构稳定性和消化的影响时发现,加热处理会改变油脂的界面结构,表现为界面颗粒尺寸增大以及吸附在界面处的蛋白质变性,从而导致了脂质消化增加。Bakala等[15]也得出,当甘油二酯与甘油三酯混合时,胰脂肪酶对甘油二酯表现出更高的亲和力,造成此现象的原因可能是不同甘油酯的脂/水界面物理性质的差异,包括脂质分子面积、界面张力、粘度等。因此,为改善脂质在肠道中的消化进程,行之有效的途径是通过改变其界面的结构性状,或者通过酯键的修饰提高与酶的亲和性。消化过程中的界面作用如图2 所示。
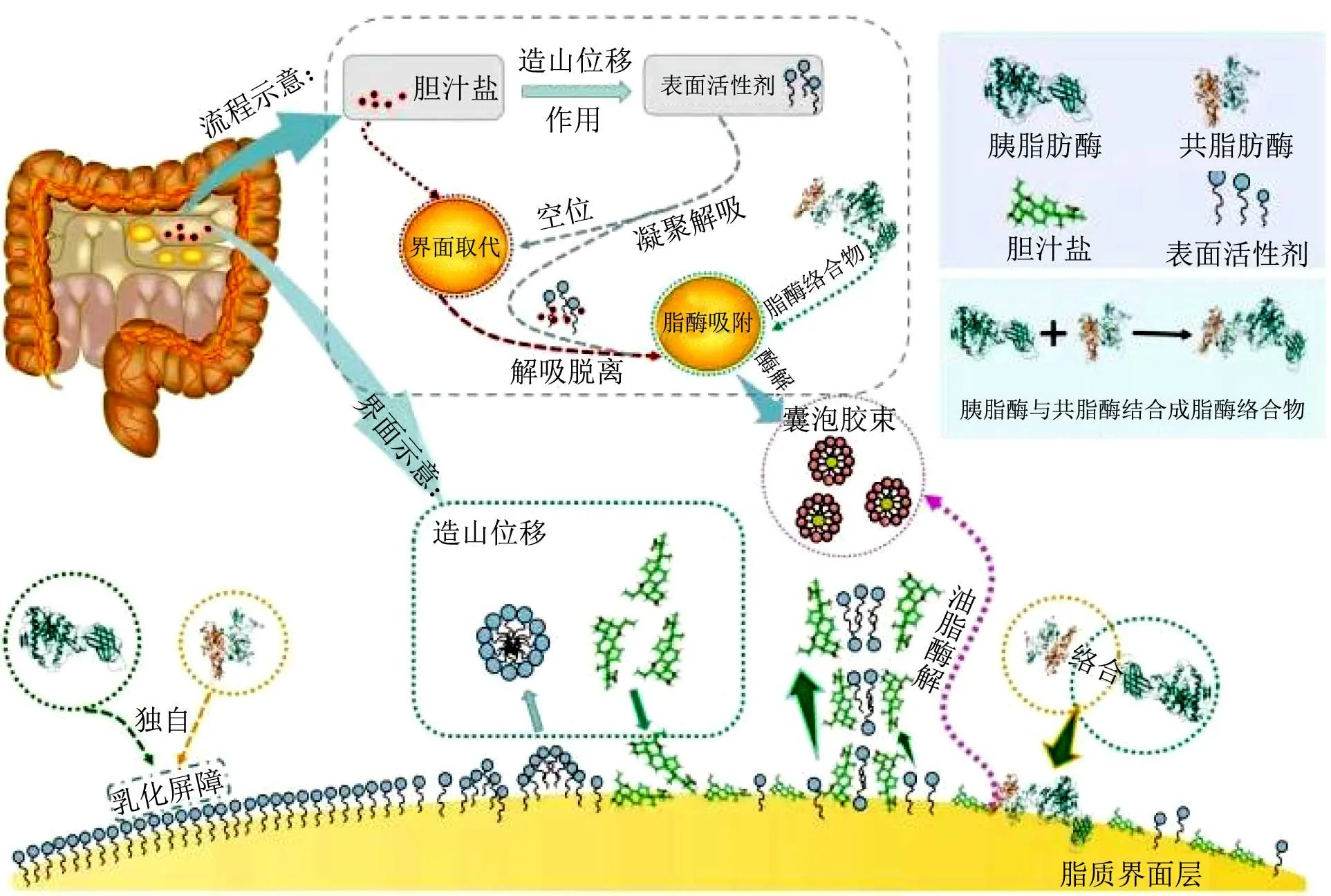
图2 膳食脂质在肠道消化过程的界面作用Fig.2 Interface function of dietary lipids on intestinal digestion
2 脂质肠道消化的影响因素
脂质在肠道内的消化受多种因素的影响,这其中包括脂质本身的状态,也包括各种活性物质,如脂肪酶,胆盐,蛋白以及各种小分子物质等。
2.1 脂质形态的影响
2.1.1 自身形态的影响
脂质的物理状态取决于组成脂质的TAG 单体或复合物的熔点[16,17],通常固态脂肪含量高的乳化脂肪更不易被脂解[18]。Bonnaire 等[19]研究了乳化液中脂质的物理状态对胰脂肪酶体外消化率的影响,结果发现,含液体颗粒的乳状液中脂质消化的速率和程度均高于含固体颗粒的乳状液,这可能是由于脂滴的物理状态会影响脂肪酶在脂滴表面的吸附。此外,脂滴在固体和液体状态下的界面组成有明显的差异,这都会对脂肪酶水解脂质产生影响[20]。Lin 等[21]通过比较液态、半固态和固态三种脂基微胶囊的消化程度,发现液态和半固态的凝胶基质提高了脂滴的聚集稳定性,使脂滴暴露的表面积增大,脂解程度较固态脂高,从而得出脂基微胶囊的物理状态在很大程度上决定了脂质消化的结论。由此可见,食物基质的特征、组成及结构会影响脂肪酶与脂质的接触,也会改变脂质的结构,特别是当食物基质物理状态发生改变时,消化行为会受到很大的影响。
2.1.2 相互作用下形态的影响
蛋白质与脂质间的相互作用也显著影响着脂质的水解程度[22]。Guevara-Zambrano 等[23]研究了植物奶昔中蛋白质对脂质消化速率的影响,发现蛋白质的存在减缓了脂质消化的速率,但不影响脂肪在小肠末端分解的最终程度。这可能是由于蛋白质聚集物起屏障作用,阻碍脂滴与胰脂酶的接触,然而蛋白质最终会被肠道内的蛋白酶逐渐分解,当蛋白质被分解后,胰脂肪酶可以与脂滴再次接触从而保证水解继续进行。此外,膳食纤维的添加会延缓胃排空时间,限制脂质在小肠内的乳化程度进而减缓脂肪消化分解的速度[24]。矿物质如钙等与脂质易形成不溶性钙皂,也会制约脂质的消化和代谢[25]。
2.2 脂质构型变化的影响
膳食脂质中脂质的构型对消化也会产生重要的影响,包括脂肪酸的链长、饱和度以及脂肪酸在整个甘油三酯中的位置等。由于胰脂肪酶水解的特异性,甘油三酯的酯键位置也成为膳食脂质消化的影响因素。Nagata 等[26]在研究甘油三酯的位置异构体时发现,对于构型为Sn-1 和Sn-3 位是中链脂肪酸,而Sn-2 位为长链脂肪酸的甘油三酯,胰脂肪酶对其水解程度是其它构型甘油三酯的2~3 倍。Infantes-Garcia 等[13]构建胃分解模型,发现Sn-2 位置酯键的水解速度达不到Sn-1 和Sn-3 位置酯键水解速度的一半,这对不同位置脂肪酸构成的油脂在小肠阶段的消化速度产生了影响。此外,胰脂肪酶作用Sn-3 位的脂肪酸,如DHA和EPA 时,所发挥的水解速度低于同位置的其它种类脂肪酸[27]。也有研究发现,胰脂肪酶对Sn-1 和Sn-3位是长链脂肪酸的膳食脂质水解作用较低,而相同位置是中链或者短链脂肪酸的膳食脂质更有利于水解进行[28]。Zhu 等[29]使用乳脂、大豆油、金枪鱼作为原料制备稳定乳化剂进行体外消化实验,发现饱和脂肪酸的消化速率高于不饱和脂肪酸,短链脂肪酸高于中链脂肪酸高于长链脂肪酸。Ye 等[30]构建单阶段体外消化模型,发现棕榈油的游离脂肪酸释放量高于猪油和菜籽油,这是由于棕榈油甘油三酯分子中Sn-1,3 位主要为短链饱和脂肪酸,有利于胰腺脂肪酶的水解,而猪油和菜籽油中甘油三酯分子中Sn-1,3 位主要为不饱和脂肪酸,限制了肠道消化过程水解反应的发生。Xu等[31]研究了五种富含甘油二酯油脂(大豆油、橄榄油、菜籽油、山茶花油和亚麻籽油)的消化行为差异,发现不饱和脂肪酸比饱和脂肪酸更容易释放,具有较高不饱和度的甘油二酯分子消化率更高,这似乎与前人的研究结论不同,可能是由于甘油二酯的分子结构与甘油三酯不同而造成的。
2.3 胆汁盐的影响
胆汁盐是很好的内源性乳化剂,是体内亲脂性物质增溶所必需的物质[32],不仅能乳化膳食脂质,而且对于胰脂肪酶向脂肪乳滴表面附着,脂质水解等都起着重要作用。Ye 等[33]研究了三种典型食用油的界面行为,发现各种消化产物在胆汁盐的作用下,会进一步形成极小的胶束或囊泡,并从小肠粘膜边缘扩散到小肠内腔,这种细小的胶束囊泡通过被动扩散在小肠上皮细胞中由高浓度向低浓度逐渐吸收。这说明胆汁盐可以促进酶解作用,将脂质水解成细小油滴,从而推进脂质水解进程的发生。Parker 等[34]使用原子力显微镜观察六种不同胆汁盐在固体疏水表面上的吸附,发现胆汁盐和肠内脂肪酶之间是通过吸附作用来促进胰脂肪酶吸附的。胆盐存在时脂解反应正常,这是由于膳食油脂在消化过程中,胆汁盐吸附在脂肪乳滴表面,疏水面朝乳滴中心的油相,亲水面朝向外界的水相,这种“造山位移”作用将不溶的脂解物排除,为脂肪酶提供了作用区域,脂酶复合物吸附在界面从而继续水解作用。Macierzanka 等[35]研究也发现在没有胆盐的情况下,脂肪分解的产物无法从界面中去除,因此不能以混合胶束的形式溶解,非混合胶束形态不易被小肠上皮细胞吸收。这也证实了胆汁盐的解吸作用对酶水解有重要贡献。因此,胆盐的作用形式可以总结为两方面:一方面胆盐促进脂质、界面脂肪酶、共脂肪酶复合物吸附,进而促进酶催化脂肪分解;另一方面,胆盐将不溶性脂解产物从界面解吸,使其以混合胶束的形式穿梭于肠道粘膜,并被吸收。这是两种截然不同的作用,这两个干预方式可以概括为促进吸附与解吸。
此外,Michels 等[36]以肉仔鸡为研究对象,通过改变脂肪酶与胆汁盐浓度等体外消化条件,发现脂质消化速率受胆盐浓度和脂肪酶活性之间相互作用的影响。在特定胆盐浓度下,脂肪酶活性受到抑制,这表明胆盐除促进吸附与解吸外,还可以通过改变浓度影响胰脂肪酶活性进而干预脂质的消化速率。Sari 等[37]在利用横断面和纵向研究两种方式解析胆盐激活脂肪酶及其酶活性随泌乳期变化规律时发现,胆盐激活脂肪酶的浓度和活性随泌乳期延长而降低,也发现胆盐浓度改变会增强或抑制脂肪酶活性。由此可知,胆汁盐除了自身发挥作用,还会与其他物质相互作用从而影响膳食脂质消化。
2.4 脂肪酶的影响
肠道内起主要消化作用的是胰脂肪酶类和共脂肪酶,胰脂肪酶是由胰腺细胞产生的胰液外分泌酶,对肠道腔内消化膳食脂肪至关重要。外分泌胰腺除分泌胰脂肪酶外,还会产生胰脂肪酶相关蛋白1(PLRP1)和2(PLRP2)[38]。PLRP1 对甘油三酯没有水解活性,而已知的PLRP2 能水解甘油三酯,并根据不同物质表现出宽泛的底物选择性[39]。Mateos-Diaz 等[40]研究PLRP2 的活性时发现,磷脂与胆盐的存在会改变脂质/水界面的性质,并与PLRP2 相互作用,从而保障脂解反应历程的有效推进。
胰脂肪酶很难单独发挥水解活性,这是由于胰脂肪酶会被胆汁盐和许多乳化剂抑制活性,这时需要共脂肪酶将盖子结构域打开,从而协助胰脂肪酶吸附到乳液界面。因此最佳的胰脂肪酶活性要在共脂肪酶的存在下才能发挥作用[41]。Reis 等[42]报道,胰脂肪酶的底物是非水相的脂质聚集物,吸附到界面前需要共脂肪酶与胆汁盐的协助形成脂肪酶复合物,才能进行水解作用。此外,胰脂肪酶还需要胰蛋白作为酶活性的辅助因子发挥作用,脂质消化的程度主要还是受到脂肪酶活性的影响[43]。由此可见,脂肪酶水解甘油酯并不是一个单独的反应,而是在各种脂肪酶、蛋白以及活性物质的共同协作下完成。
3 脂质肠道吸收的影响因素
3.1 转运调节因子的影响
脂质吸收是在小肠上皮与肠腔内存在浓度差的条件下扩散完成,这种扩散只发生在小肠内腔中的游离脂肪酸浓度远高于小肠上皮细胞的情况下。然而,当小肠腔内游离脂肪酸浓度较低时,需要转运酶类介导的方式才能被小肠上皮细胞吸收。其中起关键性运输作用的是脂肪酸转运系统(CD36 和脂肪酸结合蛋白FABPpm)以及脂肪酸跨膜转运载体蛋白(FATPs)[44,45]。实质上脂肪酸跨膜转运载体蛋白(FATPs)是一类转运蛋白的总称,由6 种亚型组成,转运蛋白的表达和转运都可以高度调控,不仅影响脂质的代谢和吸收,还与细胞生长和增殖等有关[46]。Lebrun 等[47]研究发现肠道中的CD36 是通过调节脂质吸收效率的细胞信号传导来促进脂质消化和吸收。Zhao 等[48]研究发现CD36 作为一种模式识别受体,可以传递细胞内信号以控制脂质稳态,具体作用途径是激活AMPK 通路来改善细胞内脂质积累促进消化。
3.2 脂质在肠道中的分子吸收路径
在肠道中,甘油三酯(TAG)在小肠前端被胰脂肪酶水解成单酰甘油(MAGs)和脂肪酸(FFAs),磷脂被水解成溶血磷脂和脂肪酸,胆固醇(CEs)被水解成游离胆固醇和脂肪酸[49]。不同的消化产物被小肠上皮细胞的吸收方式不同,短链脂肪酸通过被动扩散的方式直接穿过细胞膜,然后依次通过小肠系膜静脉、门静脉最终被吸收。中链脂肪酸(MCFA)和长链脂肪酸(LCFA)主要通过脂肪酸转运蛋白家族(FATPs)运输至小肠上皮细胞内,其整个分子吸收路径如图3[50]所示。
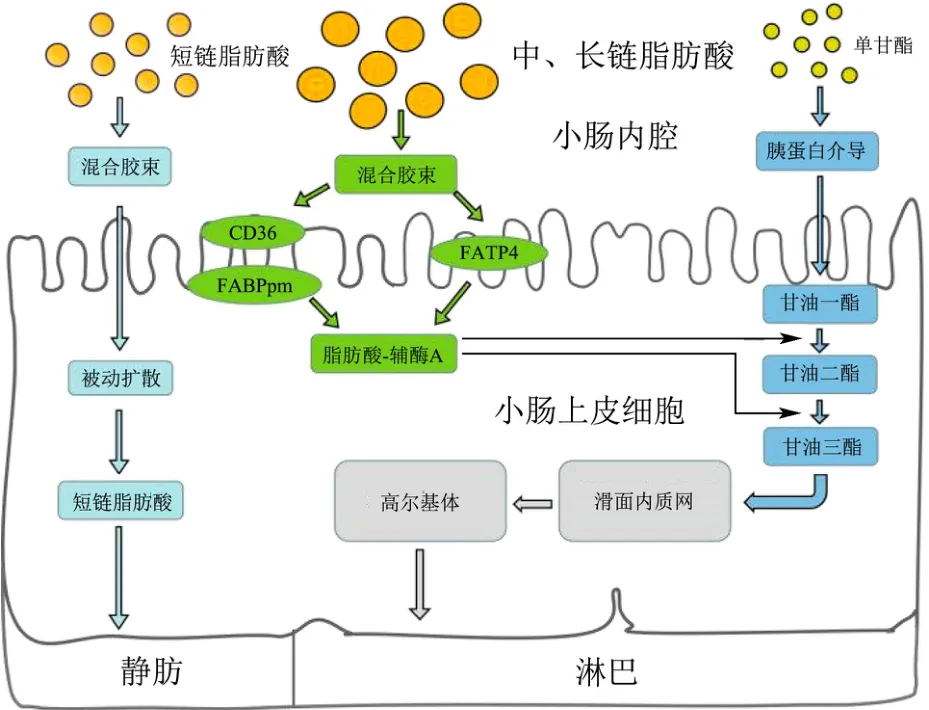
图3 膳食脂质在肠道中的分子吸收路径Fig.3 Molecular absorption pathway of dietary lipid in the intestine
然而,脂肪酸在TAG 分子中的位置异构,决定了其是以FFA 的形式,还是以Sn-2 MAG 的形式被吸收[51]。同时,CD36 和FABPpm 也能在小肠上皮细胞表面接收MCFA 和LCFA,转运至细胞内,增加局部脂肪酸浓度,这将有助于进一步提高CD36 在小肠上皮细胞顶膜转运脂肪酸的效率[47]。进入到小肠上皮细胞后,FABP 在小肠上皮细胞内侧与脂肪酸结合,运输脂肪酸参与下一分子代谢过程。也有研究推测认为MAG 可能是通过膜蛋白介导的促进运输进入小肠上皮细胞[52]。Wang 等[53]研究婴儿奶粉时发现,在甘油三酯分子中位于TAG 分子Sn-1 和Sn-3 位的油酸被胰脂肪酶特异性水解,留下Sn-2 位的棕榈酸,位于Sn-2位的棕榈酸可以更高效地被吸收,因此这为婴幼儿配方奶粉的设计提出了新的思路。此外,由于膳食脂质在吸收过程中可以重新合成,进程的调控可以改变膳食脂质的吸收速率,从而调节肠道内的脂质代谢。
3.3 肠道微生物的调控影响
进入肠道中的膳食脂质与其外环境的菌群有着相互促进或者制约的关联,从而影响着其吸收途径,其三者的作用关系如图4 所示。
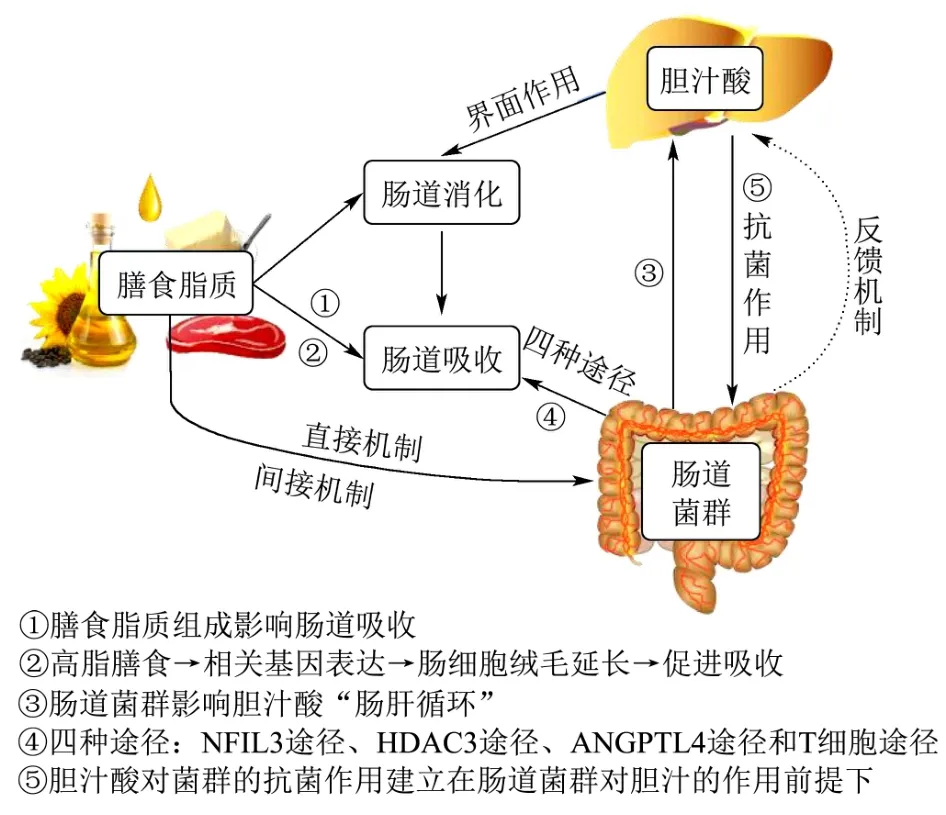
图4 膳食脂质、肠道菌群与脂质消化吸收的作用关系Fig.4 The relationship between dietary lipids,intestinal flora and lipid digestion and absorption
正常情况下人体肠道菌群处于平衡状态,但不当的膳食结构如高能、高脂饮食会造成肠道菌群失衡导致脂质代谢物发生变化[54,55]。大多数评估膳食脂质与肠道菌群影响的研究都是在回肠和结肠中进行,而对空肠研究较少,一方面是由于空肠pH 值较低,所含微生物数量相比其他肠区较少,另一方面样本很难进入空肠管腔内获取,现有的数据大多来自小鼠或患者的内窥镜样本。然而,空肠作为消化吸收的主要场所,少量的微生物依然会对肠道吸收造成显著的影响[56]。
3.3.1 膳食脂质对肠道微生物的影响
膳食脂质对微生物含量影响可分为直接机制和间接机制。膳食脂质可以从特定的膳食成分中提取能量从而直接促进或抑制微生物的生长;间接机制如饮食来源脂类化合物可以通过影响宿主代谢和免疫系统间接地塑造肠道菌群,如高脂饮食可能破坏肠道屏障,从而影响微生物界面,造成微生物稳态失调[57]。Clara等[58]研究发现脂类对空肠脂肪酸代谢相关基因表达产生影响,简单说就是高脂膳食会导致空肠中脂质代谢相关基因的改变,空肠会根据饮食中脂类的含量来调整其脂类吸收能力。Chang 等[59]测定了在纯化后的低脂膳食(LFD)和高脂膳食(HFD)作用下十二指肠、空肠、回肠和盲肠的肠道菌群,发现高脂膳食对空肠和回肠肠道菌群结构的影响最大,而空肠是膳食脂质肠道内消化吸收的主场所。因此膳食脂质对肠道菌群的影响最终反馈在自身的消化和吸收的作用上。
3.3.2 肠道菌群与胆汁酸和消化的制约关系
肠道菌群与胆汁酸在脂质代谢的过程中呈现较强的“交互”效应[60]。Yu 等[61]在研究时发现牛至草提取物(HOEP)通过重塑肠道微生物群来调节胆汁酸和短链脂肪酸代谢,胆汁酸又在脂解过程中为脂肪酶提供界面作用;Liu 等[62]发现重金属通过影响肠道微生物组成和激活受体信号来改变胆汁酸组成,因而胆汁酸在肠道菌群间接调节脂质消化时充当了“桥梁”角色。Winston 等[63]在小鼠模型中发现,当肠道微生物群落增殖和细菌生长时,可以通过给予胆汁酸来改善,从而抑制细菌过度生长,这表明胆汁酸具有抑菌作用。Zhang 等[64]添加超细牦牛骨粉来改变肠道微生物群落结构,造成如胆汁酸、不饱和脂肪酸等代谢产物增加,这些代谢产物有利于调节脂质代谢途径。因此,胆汁酸可以影响肠道微生物的群落结构,反过来,肠道微生物能够改变胆汁酸的分泌,并影响肠道消化。
3.3.3 肠道菌群对脂质吸收的影响
通常情况下,肠道内的微生物发挥作用与机体代谢紧密联系。Martinez-Guryn 等[65]研究表明微生物对小肠中脂质消化和吸收至关重要,肠道内的微生物是通过控制肠内分泌信号的传导系统以及影响肠细胞中脂肪酸的局部转运从而发挥介导作用。Wang 等[66]研究了益生菌在高脂饮食诱导下的脂代谢紊乱机制,发现益生菌的调节机制是激活AMPK 信号通路以调控脂肪的合成和分解,同时益生菌还具有调节胆固醇和胆汁酸分泌的作用,进而维持脂质消化稳定,并对肠道菌群结构和吸收产生积极的影响。王萌等[67]总结肠道菌群促进脂质吸收的机制,通过调控上皮细胞相关基因表达来促进脂质吸收,包括四种途径:NFIL3 途径、HDAC3 途径、ANGPTL4 途径和T 细胞途径。Hua 等[68]在高脂饮食中使用雷公藤红素影响肠道菌群的分布,使脂质不能正常通过转运蛋白被小肠绒毛吸收,从而验证了肠道菌群在脂质吸收中发挥的重要作用。由此可见,通过改变肠道菌群来调控脂质吸收从而避免肥胖等疾病的发生,同时明确肠道菌群干预脂质吸收的机制与途径,对于调节脂质代谢有着重要的作用。
4 结语
膳食脂质在肠道中消化的情况取决于其结构及其组成,同时伴随着肠道分泌物与菌群等多条件的制约与协助,这些成分彼此间影响,共同决定了膳食脂质在肠道中的消化历程。肠道在脂消化吸收的过程中,稳态的维持是脂质与肠道微生物相互作用共同的结果。膳食脂质摄入不平衡将导致的代谢类障碍,其路径之一是由于肠道菌群的不良性响应而造成;反之,小肠中的某些微生物也会参与调节肠道的消化和吸收功能,并且起到维持肠道正常免疫功能的作用。对于深入开展在肠道阶段膳食脂质的消化行为与吸收机制,可以为阐明不同膳食脂质消化吸收特性,及其对肠道健康的影响提供进一步的认识,并为指导油脂消费和功能性食品的加工提供一定的参考。此外,由于不同种类的脂质进入人体后所引起消化系统的免疫应答、反馈调节不同,不同种类脂质体的肠道消化特性差异有待于进一步探究;健康膳食脂质的开发利用,如甘油二酯具有良好的降脂抑重功效,类似物质有待于挖掘。肠道菌群可以增加或减少脂质吸收,是否可以使用益生菌等安全有效的菌株来调控治疗脂代谢疾病,都值得进一步深入探究。

