串联荧光标记LGG-1检测秀丽线虫表皮自噬流
朱 怡, 严晨啸,2, 杨玉妍,3, 傅 容*
(1. 苏州大学生物医学研究院, 江苏苏州 215123; 2. 南京医科大学基础医学院, 南京 211166; 3. 苏州贝康医疗器械有限公司, 江苏苏州 215123)
自噬是一种进化上保守的分解代谢机制,通过该机制,真核细胞运用膜运输途径降解循环胞内成分。自噬可降解错误折叠的蛋白质、清除受损的细胞器,并为细胞提供可持续的生物分子和能量,从而在饥饿、氧化、热激等应激条件下维持细胞稳态。因此,自噬与许多生理病理过程均密切相关,例如胚胎的发育、衰老、饥饿、感染免疫等。自噬主要有3种类型,即微自噬、巨自噬和分子伴侣介导的自噬(CMA)。本研究关注的是巨自噬(以下简称自噬)的检测。自噬涉及一系列动态的膜形成和融合过程,自噬被诱导后,首先会形成1个月牙形的双膜囊,称为吞噬泡(phagophore); 这个囊进一步膨胀并最终闭合,产生1个包裹着自噬底物的双膜隔室,称为自噬小体(autophagosome); 自噬小体进一步与溶酶体融合形成自噬溶酶体(autolysosome), 最终完成成熟过程并降解自噬底物。从自噬小体被诱导生成到自噬小体被溶酶体融合消化的整个动态过程又称为自噬流(autophagic flux)[1]。在哺乳动物活体内实时观察特定组织中的自噬过程具有相当大的难度,秀丽隐杆线虫(Caenorhabditiselegans)则为解决这一问题提供了良好的生物模型。秀丽隐杆线虫不仅有高度保守的自噬基因,而且通体透明,因此极大方便对其活体各个组织的自噬情况进行显微观察。
与哺乳动物相比,秀丽隐杆线虫表皮结构简单,主要由一层多核上皮细胞构成,是研究表皮细胞生理病理机制的理想模型。近年来研究显示自噬在线虫表皮的发育,免疫防御和结构损伤中发挥重要作用[2-4]。而深入解析表皮细胞自噬的调节机制则需要实时检测表皮细胞在不同发育阶段及环境刺激下的自噬流变化情况,但目前尚缺乏准确且特异性地检测表皮细胞自噬流的方法。哺乳动物LC3的同源蛋白LGG-1是在线虫中最常用于检测自噬的标记蛋白。LGG-1及其同源蛋白LC3一样通过C末端的脂化而被募集到自噬小体膜上。2003年, Melendez及其同事构建了第1个由其本身的启动子驱动表达GFP::LGG-1的虫株[5], 该虫株迅速成为在秀丽隐杆线虫中标记自噬小体最常用的方法(虫株DA2123[6])。但由于GFP在酸性坏境下易被淬灭,因此GFP::LGG-1只能显示自噬小体而不能显示自噬溶酶体。而自噬的诱导增强,自噬溶酶体的形成障碍或溶酶体降解功能异常均可导致GFP::LGG-1聚集增加,因此需要采用其他方法进一步分辨以上不同的自噬调节状态。鉴于GFP和mCherry对溶酶体的酸性pH值具有不同的敏感性,因而串联融合蛋白GFP::mCherry::LGG-1被构建,这使得自噬溶酶体(仅mCherry阳性)和自噬小体(GFP和mCherry双阳性)不仅都能被显示出,还可被区别开来,从而实现对自噬流更全面的监测,但目前该融合蛋白分别构建在PIE-1启动子和LGG-1自身启动子的下游[7-8]。PIE-1启动子只表达于早期胚胎和生殖细胞[9], 而LGG-1自身启动子表达组织众多,因此用于监测表皮细胞自噬情况时容易受到相邻组织自噬信号的干扰。
本课题组采用表皮特异性启动子DPY-7P构建DPY-7P::GFP::mCherry::LGG-1转基因虫株。接着通过RNAi敲降自噬负向调控因子mTOR的同源蛋白LET-363和自噬溶酶体形成的必需成分RAB-7, 然后利用激光共聚焦显微镜观察并统计DPY-7P::GFP::mCherry::LGG-1所标记的自噬小体和自噬溶酶体数量,从而验证该报告系统可有效检测自噬流的诱导和抑制。此外,研究也利用该报告系统进一步证实机械损伤在单个表皮细胞内产生对自噬的远端促进效应。因此本研究开发的DPY-7P::GFP::mCherry::LGG-1转基因虫株可用于进一步探究表皮细胞在各种生理病理过程中的自噬,为解析表皮自噬机制和生理意义提供有效的工具。
1 材料与方法
1.1 虫株和菌株
1) 试验动物: 野生型秀丽隐杆线虫
2) 细菌品系: 大肠埃希菌菌株OP50-尿嘧啶缺陷型线虫饲养菌种、感受态细胞DH5α
3) RNAi文库:C.elegansChr RNAi library (英国Source Bioscience公司)。
1.2 主要试剂
硼酸、Tris碱、胆固醇、Tween-20、IPTG、EDTA、琼脂、琼脂糖等(上海生工生物工程公司), Peptone (北京索莱宝科技公司), NGM琼脂(德国Calbiochem公司), 各种限制性内切酶(美国NEB公司), ClonExpress MultiS (南京诺唯赞生物科技公司), PrimeSTAR GXL Premix (日本TaKaRa公司), 胶回收试剂盒(德国Qiagen公司), 质粒提取试剂盒(美国Axygen公司), QIAquick spin miniprep kit (德国Qiagen公司), 线虫NGM培养基、M9缓冲液、bleach溶液(自配)。
1.3 线虫培养
将OP50单菌落接种至50 mL的LB液体培养基中, 37 ℃振荡培养过夜。吸取200 μL经检验无污染的大肠埃希菌OP50菌液于6 cm NGM固体培养基上,过夜晾干后在37 ℃培养箱中倒置培养。挑取健康的野生型秀丽隐杆线虫放置其中,线虫在20 ℃培养箱中培养,注意观察线虫的生长状态并及时分盘培养。
1.4 重组质粒DPY-7P::GFP::mCherry::LGG-1的构建
1.4.1 利用PCR技术获得目的基因LGG-1和mCherry的片段
1) 引物序列: LGG-1-F为5′-GCATGGACGAGCTGTACAAGATGAAGTGGGCTTACAAGGAG-3′, LGG-1-R为5′-ACCGGCGCTCAGTTGGAATTTTTGTGTCTTCTTCGTTTATTCATG-3′; mCherry-F为5′-ACAAACAGCATTCGTATAATCTCGAGATGGTGAGCAAGGG-3′, mCherry-R为5′-CT
TGTACAGCTCGTCCATGCC-3′。
2) PCR扩增及切胶回收: 使用PimeSTAR GXL Premix, 根据说明书配置反应体系,进行PCR反应,使用胶回收试剂盒进行切胶回收。
1.4.2 重组质粒的构建
1) 连接: 使用ClonExpress MultiS试剂盒进行连接反应。
2) 转化: 使用感受态细胞DH5α进行转化试验,最后将菌液均匀涂布于含氨苄的LB固体培养基上,然后在37 ℃条件下培养过夜。
1.4.3 重组质粒的筛选鉴定
1) PCR扩增: 挑取单菌落使用PrimeSTAR GXL Premix进行PCR反应,阳性对照是从野生型线虫中提取的DNA模板,阴性对照是从阴性克隆菌落提取的DNA模板。
2) 酶切鉴定: 使用质粒提取试剂盒提取重组质粒进行酶切验证,使用限制性内切酶StuI 和SpeI, 得到3个酶切片段,长度分别为4 518、1 845和222 bp。
3) 样品送苏州金唯智生物科技公司进行测序。
1.5 DPY-7P::GFP::mCherry::LGG-1转基因虫株的构建
1.5.1 试验前准备
1) 挑选生长状态良好、处于年轻成虫阶段的野生型秀丽隐杆线虫备用。
2) 制备显微注射针及载有琼脂糖的盖玻片,并在烘箱中烘干备用。
3) 使用QIAquick spin miniprep kit提取质粒备用。
4) 配制注射液,成分为10 ng·μL-1质粒DPY-7P::GFP::mCherry::LGG-1, 20 ng·μL-1标记基因表达载体MYO-2P::GFP (咽部表达绿色荧光蛋白), 450 ng·μL-1载体质粒pPD49.78。
1.5.2 显微注射
将配制的注射液注入线虫生殖腺,一次注射约30条线虫,将注射好的线虫置于20 ℃培养箱内培养恢复。
1.5.3 筛选
待显微注射过的线虫恢复正常状态后,在NGM固体培养基上单独培养P0代线虫直到F1代线虫大量出现,在荧光体式显微镜下观察并挑取咽部表达GFP的F1代线虫于新的NGM固体培养基上,从而筛选出传代率较高的虫株。
1.6 RNAi
1.6.1 RNAi培养基的制备
根据所需敲降基因的基因序列号,查找其对应的RNAi克隆在RNAi文库里的位置,划板摇菌后提取质粒测序验证,将验证正确的RNAi单菌落进行RNAi培养基制备。
1.6.2 线虫同步化
1) 将DPY-7P::GFP::mCherry::LGG-1转基因虫株用线虫NGM培养基培养至有较多的成虫。
2) 用1 mL M9缓冲液收集线虫于洁净的1.5 mL EP管中,待线虫沉降至管底后弃上清,重复此步骤直至溶液澄清(约2~4次)。
3) 加入1 mL现配的bleach溶液,室温静置60 s。
4) 以3 800 r·min-1转速离心60 s。
5) 弃去上清,加入1 mL M9缓冲液,以3 800 r·min-1转速离心60 s。
6) 弃去上清,留存溶液约50 μL, 将管底的混合物转移到普通的线虫NGM培养基上。
7) 20 ℃培养12 h, 待卵孵化后备用。
1.6.3 RNAi处理
将同步化后孵化的L1转基因虫株转移到上述制备完成的RNAi固体培养基上, 20 ℃培养至成年。
1.6.4 制片观察
快速地挑取足量的线虫放在制备好的琼脂糖载玻片上,琼脂糖上已提前滴加适量盐酸左旋咪唑溶液,小心盖上盖玻片,并用胶布将盖玻片固定在载玻片上。沿盖玻片边缘加入适量M9缓冲溶液,从而避免线虫干涸死亡。使用激光共聚焦显微镜采集图像。
1.7 表皮机械损伤
挑取成虫至预冷的NGM培养皿上,手持显微注射针对其进行针刺损伤,在线虫身体前端制造1个伤口。损伤后的线虫转移至新培养皿上恢复1.5或3 h后进行GFP::mCherry::LGG-1荧光信号采集。
1.8 自噬点测量统计
1) 测量: 选取同一视野下红绿荧光双通道、红色荧光单通道和绿色荧光单通道3张图像。在线虫表皮细胞处选定面积为631.2 μm2的矩形测量框(保存备用,所有样本测量均使用同一测量框), 对测量框内聚集的荧光点用圆形工具圈定,分别测量该荧光聚集点的红色荧光和绿色荧光的强度并保存。以上操作均使用Image J 图像处理系统。
2) 数据统计: 红光荧光强度与绿光荧光强度比值>0.47记为自噬溶酶体(autolysosome); 红光荧光强度与绿光荧光强度比值≤0.47, 若绿色荧光通道没有明显聚集点,计为无效数据,反之记为自噬小体(autophagosome)。统计分析采用unpairedt检验。
2 结果与分析
2.1 构建DPY-7P::GFP::mCherry::LGG-1质粒和转基因虫株
首先通过 PCR 获得mCherry和LGG-1的基因片段,然后将其插入到DPY-7P::GFP载体中,经过PCR 鉴定和酶切鉴定(图1.A—C), 经测序验证DPY-7P::GFP::mCherry::LGG-1质粒构建成功,显微注射入线虫,构建出传代率较高的转基因虫株。共聚焦显微镜观察该质粒特异性地在表皮细胞中表达,且绿色通道显示在正常培养条件下未发生大量聚集(图1.D), 与先前报道的表皮的自噬水平相当[10]。因此认为该外源表达系统未因过表达而干扰自噬过程,可较好地反映表皮自噬的本底水平。
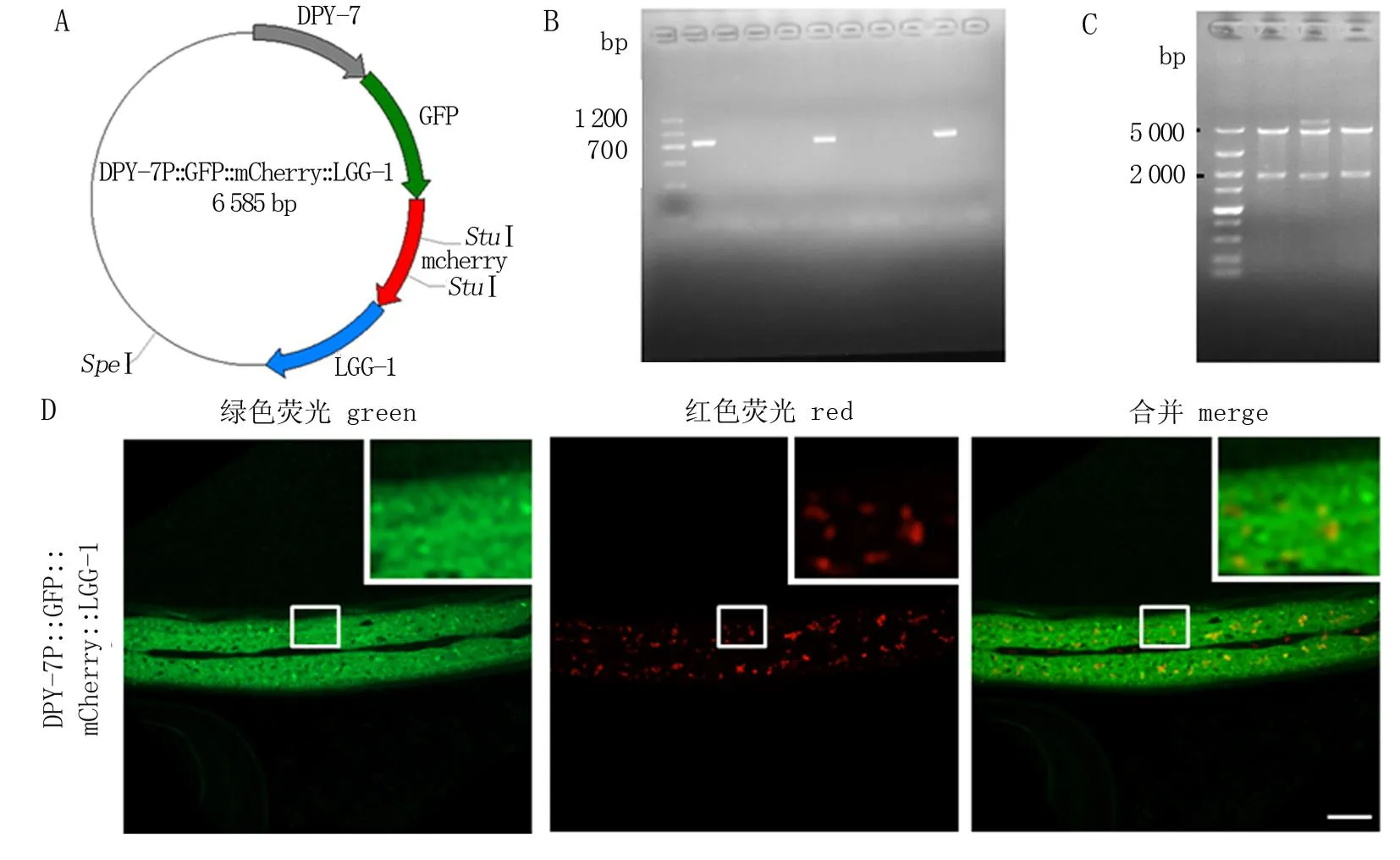
图1 构建DPY-7P::GFP::mCherry::LGG-1转基因虫株*Fig.1 Construction of the DPY-7P::GFP::mCherry::LGG-1 transgenic strain* A. DPY-7P::GFP::mCherry::LGG-1质粒图谱; B. 菌落PCR扩增mCherry片段; C. SpeⅠ、StuⅠ双酶切质粒后的电泳图; D. DPY-7P::GFP::mCherry::LGG-1在成虫表皮细胞中的表达情况。右上角显示实线框区域的放大图; 比例尺代表20 μm。* A. The DPY-7P::GFP::mCherry::LGG-1 plasmid; B. mCherry fragments amplified by colony PCR; C. The electrophoresis of the plasmid digestion by SpeⅠ and StuⅠ; D. The expression of DPY-7P::GFP::mCherry::LGG-1 in the adult epidermis. The boxed areas are enlarged in insets. Scale bar is 20 μm.
2.2 利用LET-363/mTOR RNAi诱发自噬检测DPY-7P::GFP::mCherry::LGG-1报告系统的有效性
LET-363是哺乳动物mTOR的同源蛋白质。该蛋白质是已知的负向调控自噬的关键蛋白质,先前研究[11]显示RNAi敲降线虫的LET-363可诱导表皮细胞发生自噬,因此作者利用LET-363 RNAi来验证DPY-7P::GFP::mCherry::LGG-1报告系统能否反映自噬的激活。DPY-7P::GFP::mCherry::LGG-1转基因虫株从孵化开始喂食表达LET-363 dsRNA的大肠埃希菌直到成年,利用激光共聚焦拍摄其表皮细胞。由于自噬溶酶体中的酸性环境会导致GFP淬灭,因此理论上来说GFP/mCherry双阳性的黄色聚集点为自噬小体,而mCherry单阳性的红色聚集点为自噬溶酶体。但由于同等条件下mCherry荧光蛋白本身的强度和GFP不同,单纯靠主观判断颜色来区分自噬小体和自噬溶酶体并不准确。因此作者根据mCherry和GFP亮度的比值0.47为阈值(https://www.fpbase.org/collection/2/), 聚集点的红色信号与绿色信号的比值>0.47被计为自噬溶酶体,比值≤0.47则计为自噬小体。使用激光共聚焦显微镜采集图像并统计分析,结果表明LET-363 RNAi显著增加自噬小体和自噬溶酶体的数量(图2), 与LET-363 RNAi增强自噬流的报道相符合,说明DPY-7P::GFP::mCherry::LGG-1报告系统可有效地反映自噬流的增强。
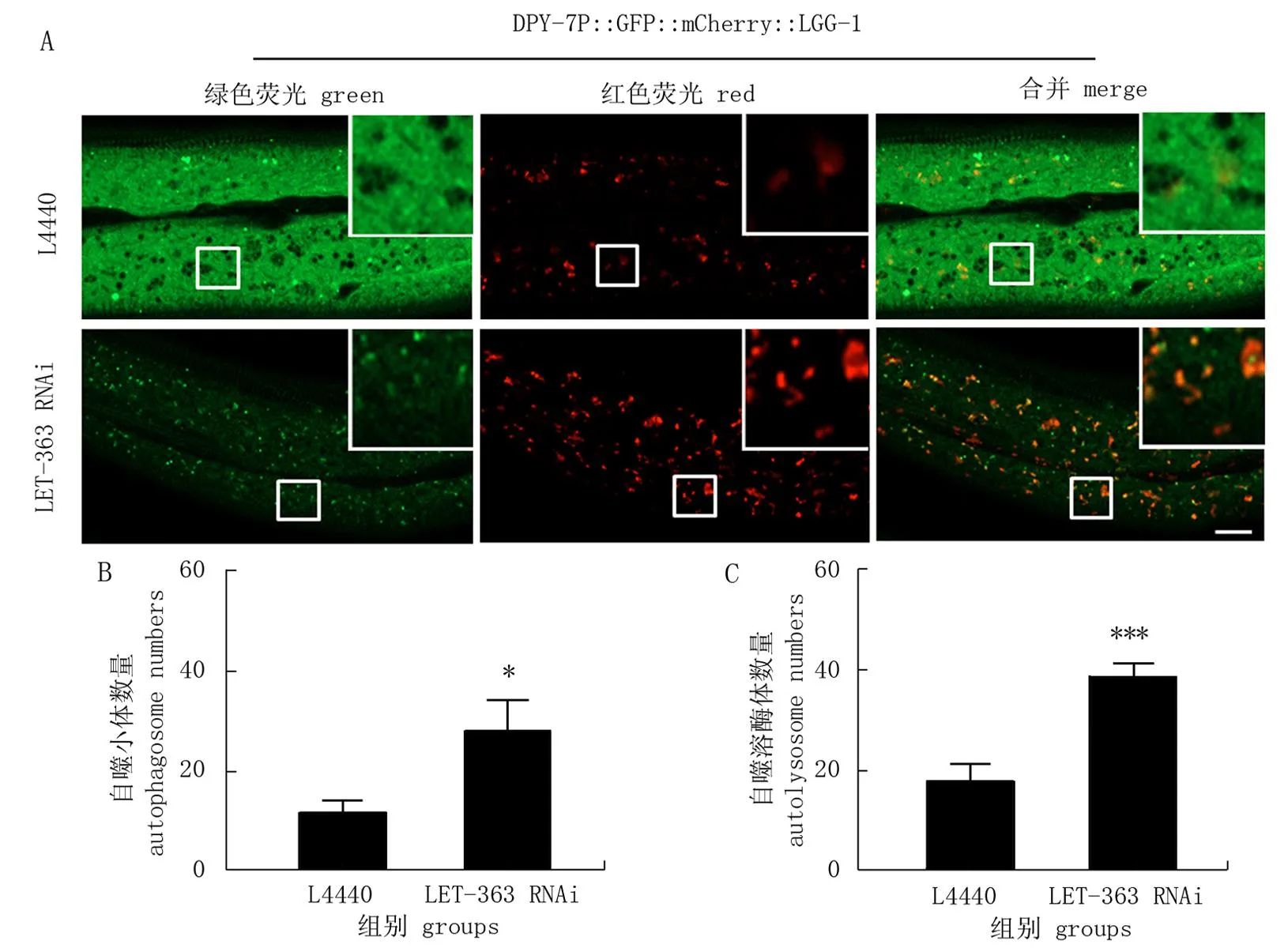
图2 DPY-7P::GFP::mCherry::LGG-1显示自噬流被LET-363/mTOR RNAi诱导*Fig.2 DPY-7P::GFP::mCherry::LGG-1 shows the induction of autophagic flux by LET-363/mTOR RNAi* 在对照L4440和LET-363 RNAi处理的成年线虫表皮中, DPY-7P::GFP::mCherry::LGG-1标记的自噬小体和自噬溶酶体的排布情况(A)和数量统计(B、C)。比例尺代表10 μm。 *P<0.05, *** P<0.001 (t检验)。* The pattern (A) and number (B, C) of PDPY-7::GFP::mCherry::LGG-1 labeled autophagosomes and autolysosomes in the adult epidermis treated with L4440 or LET-363 RNAi. Scale bar is 10 μm. *P<0.05, *** P<0.001 (t-test).
2.3 利用RAB-7/RAB7A RNAi阻断自噬检测DPY-7P::GFP::mCherry::LGG-1报告系统的有效性
RAB-7/RAB7A具有 GTPase活性, 是自噬溶酶体形成的必需成分[8]。因此作者利用RAB-7 RNAi来验证DPY-7P::GFP::mCherry::LGG-1报告系统能否反映自噬溶酶体形成障碍所导致的自噬流阻断。DPY-7P::GFP::mCherry::LGG-1转基因虫株从孵化开始喂食表达RAB-7 dsRNA的大肠埃希菌直到成年,然后利用激光共聚焦拍摄其表皮细胞。检测结果表明RAB-7 RNAi导致自噬小体数量大幅度增加,而自噬溶酶体数量无明显变化,与自噬溶酶体形成过程受阻的试验预期相符合(图3)。综合LET-363 RNAi的结果可见, DPY-7P::GFP::mCherry::LGG-1报告系统能很好地分辨自噬的诱发增强与自噬溶酶体的形成障碍。
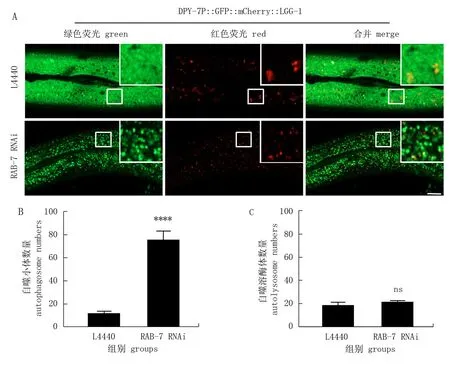
图3 DPY-7P::GFP::mCherry::LGG-1显示自噬流被RAB-7/RAB7A RNAi抑制*Fig.3 DPY-7P::GFP::mCherry::LGG-1 shows the inhibition of autophagic flux by RAB-7/RAB7A RNAi* 在对照L4440和RAB-7 RNAi处理的成年线虫表皮中, DPY-7P::GFP::mCherry::LGG-1标记的自噬小体和自噬溶酶体的排布情况(A)和数量统计(B、C)。比例尺代表10 μm。**** P<0.000 1; ns. 无显著性(t检验)。* The pattern (A) and number (B, C) of DPY-7P::GFP::mCherry::LGG-1 labeled autophagosomes and autolysosomes in the adult epidermis treated with L4440 or RAB-7 RNAi. Scale bar is 10 μm. **** P<0.000 1; ns. no significant (t-test).
2.4 DPY-7P::GFP::mCherry::LGG-1检测机械损伤对表皮自噬的调节
上皮组织构成人类大多数器官的物理屏障,并不断面临物理损伤和各种结构损伤的挑战。然而,上皮细胞机械损伤或支撑结构的破坏是否影响以及如何影响受损细胞本身的自噬过程仍不完全清楚。最近,利用线虫表皮上皮细胞层作为模型进行研究,发现机械损伤引起的结构破坏在单个表皮细胞内可产生对自噬的近端抑制和远端促进的效应[4]。为更详细地观察机械损伤伤口附近以及远离伤口区域的自噬状态,作者利用DPY-7P::GFP::mCherry::LGG-1报告系统呈现针刺损伤下表皮不同区域的自噬小体和自噬溶酶体的变化。与已报道的DPY-7P::GFP::LGG-1转基因观察结果[4]一致的是,伤口附近的自噬小体没有增加,而在远离伤口的虫体后端,自噬小体和自噬溶酶体的数量均增多,说明远离伤口的区域自噬的活性是增强的。此外,值得注意的是,损伤1.5 h后红色通道显示GFP::mCherry::LGG-1在伤口附近形成的聚集小体增多,且这些红色的聚集小体在恢复3 h后进一步形成了管状; 另一个有意思的现象是,在损伤恢复3 h后, GFP::mCherry::LGG-1还形成围绕伤口的环状结构(图4)。
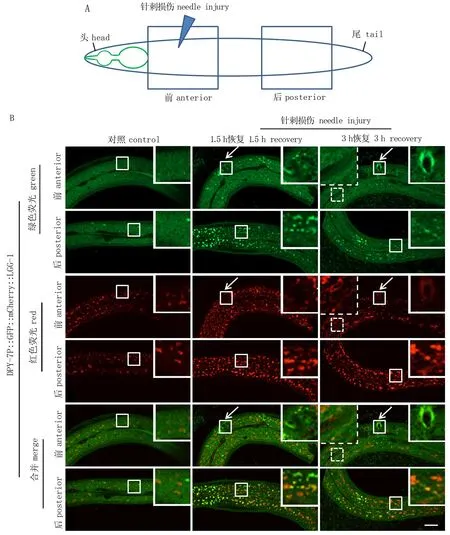
图4 机械损伤对表皮细胞自噬的调节*Fig.4 Autophagy regulation by mechanical injury in epidermal cells* A. 针刺损伤线虫的示意图, 三角形指示的是针刺的位置, 正方形标注的是线虫前半身和后半身的拍摄区域。B. DPY-7P::GFP::mCherry::LGG-1在对照或针刺损伤恢复1.5或3 h后的成年线虫表皮中的排布情况。实线框显示针刺区域并于右上角放大展示, 箭头所指的为伤口区域, 虚线框标注红色管状结构并于左上角放大展示。比例尺代表20 μm。* A. Schematic diagram of a worm injured by needle, the triangle indicates the injury site, the boxes mark the imaging area of the anterior and posterior part. B. The pattern of DPY-7P::GFP::mCherry::LGG-1 in the adult epidermis with or without needle injury after 1.5 or 3 hours recovery, the solid boxes are enlarged in right insets, the arrows point to the injury site. Dashed areas with red tubular structures are enlarged in left insets. Scale bar is 20 μm.
3 讨论
串联融合蛋白GFP::mCherry::LGG-1/LC3已广泛用于不同生物体的自噬研究[8,12-13]。但该系统的测量方法仍存在一定的问题。首先在同等条件下mCherry (15.8)本身的亮度是弱于GFP (33.6)的(https://www.fpbase.org/collection/2/), 其次研究发现与溶酶体共定位的mCherry::GFP::LC3聚集点仍然存在绿色信号,说明自噬小体与溶酶体融合过程中GFP并没有立即淬灭[14]。这些问题导致通过主观判断聚集点的颜色来分辨自噬小体和自噬溶酶体是不准确的。作者以mCherry和GFP的亮度比0.47为阈值,根据定量结果分辨自噬溶酶体和自噬小体可提高准确度。但这个阈值是根据理论推理设定的。接下来还需要进一步验证该报告系统的测量方法是否准确以及是否具有更加普遍的有效性。例如,可通过分析DPY-7P::GFP::mCherry::LGG-1与溶酶体的共定位试验,将分辨自噬小体和自噬溶酶体的红绿信号比值的进一步精确化。此外,该报告系统还存在一个缺陷,即在正常情况下红色通道显示GFP::mCherry::LGG-1形成聚集,这些聚集可能是由mCherry荧光蛋白本身易发生聚集的性质导致的而不是LGG分子本身的生理状态,在利用该工具时应予以注意。
先前研究发现线虫表皮支撑结构MUP-4的破坏可导致溶酶体活性增强[15]。有意思的是,作者发现红色通道显示GFP::mCherry::LGG-1在伤口附近形成的聚集小体增多,而绿色的自噬小体并没有增多。因此,推测伤口处增多的红色GFP::mCherry::LGG-1聚集小体可能不是自噬溶酶体,而是因结构损伤导致的溶酶体活性增强从而增加对GFP::mCherry::LGG-1的吞噬而导致的; 且在损伤后3 h, 红色通道显示GFP::mCherry::LGG-1标记了管状结构的形成。而先前的研究显示溶酶体活性增强会形成管状结构[15], 这就支持了机械损伤伤口处溶酶体活性增强的假设。而这一假设还需要溶酶体染色或标记进一步证明。
利用小鼠模型的研究发现表皮细胞自噬通过调控细胞因子CCL2促进表皮细胞的迁移和增殖以及成纤维细胞的活化从而帮助伤口愈合[16]。然而自噬在受损细胞自身修复中的作用尚不清楚。线虫的表皮主要由一个大的多核细胞Hyp7组成,是研究受损细胞自身修复机制的良好模型。有意思的是,作者发现GFP::mCherry::LGG-1在线虫表皮受伤3 h后围绕伤口形成了环状结构(图4)。而先前的研究报道了线虫表皮细胞伤口愈合时肌动蛋白在受伤后30 min即可在伤口处形成完整的环状[17]。最近研究[4]发现敲除线虫自噬基因ATG-3或ATG-18并不影响伤口愈合过程中肌动蛋白环的形成。鉴于LGG-1聚集到伤口处形成环的时间晚于肌动蛋白,作者推测自噬并不参与肌动蛋白环的形成,而可能参与肌动蛋白环的降解或其他过程。
上皮细胞覆盖于机体与外部环境接触的表面,往往受到各种各样的外界刺激,是机体应激反应的重要屏障,而自噬是细胞应对不利条件的重要自救手段。本研究构建的转基因虫株提供了一种方便且特异性的方法用于检测线虫表皮自噬流的情况,将为更加深入地了解线虫表皮细胞中的自噬机制提供了有力的研究工具。
4 结论
本研究构建的DPY-7P::GFP::mCherry::LGG-1转基因虫株,不仅利用表皮特异性启动子DPY-7P有效避免其他组织中荧光信号的干扰,而且在串联融合蛋白mCherry::GFP::LGG-1的基础上设计了对自噬溶酶体和自噬小体更客观的定性定量方法。在虫株构建完成后,通过RNAi敲降自噬调节因子LET-363/mTOR和RAB-7/RAB7A, 证明了该报告系统的测量方法既可以反映自噬诱导的增加也可反映自噬溶酶体形成的障碍。作者进一步利用该报告系统验证了机械损伤造成表皮细胞远离伤口的区域自噬增强的结论,并发现机械损伤可能导致伤口区域溶酶体的激活以及LGG-1聚集到伤口处形成环状结构。

