负载Wharton’s Jelly源间充质干细胞来源外泌体的水凝胶可促进小鼠创面修复
徐崔博诚,徐正保,余承洋,蒋祖福
台州市中心医院台州学院附属医院肛肠科,浙江 台州 318000
治疗严重的皮肤创伤,如大面积皮肤伤口、糖尿病伤口和皮肤烧伤等,通常需要清创手术、补充生长因子或使用生物活性敷料配合负压治疗[1],但这些疗法的治疗效果对于许多患者来说往往并不令人满意。免疫系统在皮肤创伤后的炎症期和修复期都起着重要作用,免疫细胞和分泌的外泌体不仅直接参与创面修复阶段,还通过旁分泌机制发挥调节作用[2]。外泌体是一种由细胞分泌的细胞外囊泡,含有蛋白质、DNA 和RNA[3]。近年研究证实,来自各种细胞的外泌体作为细胞间交流的信使参与了免疫反应[4],如间充质干细胞衍生的外泌体参与了抗原提呈、免疫激活和免疫抑制等免疫反应[5]。
研究发现,静脉注射的外泌体由于被单核吞噬细胞大量清除而导致半衰期较短,其治疗效果因保留时间短暂而受到明显限制,单纯提供更多的外泌体并不能延长其半衰期[6]。因此,目前需要开发一种新的方法来延长外泌体的保留时间,以增强其疗效。海藻酸盐水凝胶由于具有良好的生物相容性,凝胶化过程温和,而且其机械性能与细胞外基质相似,因此在组织工程和再生医学领域得到广泛应用[7]。将这种水凝胶注射到皮肤创面中,可为受损创面提供物理支持,从而增加疤痕厚度[8]。在最近的一项研究中,Shafei等[9]使用海藻酸盐水凝胶作为生物活性物质的载体,将装载有脂肪干细胞来源的外泌体的凝胶注入皮肤创伤组织,发现凝胶可以延长外泌体的保留时间,并增强外泌体对皮肤创伤的修复作用。本研究将WEX 负载在海藻酸钠水凝胶中,开发了一种可注射的基于海藻酸钠的WEX 水凝胶,以期延长WEX 的体内保留时间,提高其在皮肤创伤中的修复效果,并探讨其可能的作用机制。
1 材料与方法
1.1 动物、细胞、试剂及仪器
20 只6~7 周龄雌性C57BL/6J 小鼠购于北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2016-0011]。所有涉及动物的实验均通过台州市中心医院机构动物保护与使用委员会审查(2020-02)。
巨噬细胞RAW264.7 细胞株购于美国模式培养物保藏所;WJMSC 为武汉普诺赛生命科技有限公司产品。胎牛血清、1%青霉素-链霉素溶液、DMEM/F12 培养基和RPMI-1640 培养基为Gibco 公司产品;巨噬细胞集落刺激因子为北京百普赛斯生物科技股份有限公司产品;ExoQuick-TCTM外泌体提取试剂盒为北京博迈斯生物科技有限公司产品;BCA 蛋白定量试剂盒、海藻酸钠为Sigma 公司产品;CD9、CD86、CD81、CD206、Calnexin、VEGF 为Abcam 公司产品;HE染色试剂盒和Masson 三色染色试剂盒为北京索莱宝科技有限公司产品。大肠埃希菌(E.coliATCC 8099)和金黄色葡萄球菌(S.aureusATCC 6538)为上海鲁微科技有限公司产品;CD31 一抗为武汉伊莱瑞特生物科技股份有限公司产品。
UV-2550 紫外分光光度计为岛津公司产品;AR 1500ex 流变仪为TA Instruments 公司产品;S-3400I 型扫描电子显微镜为Hitachi 公司产品;NanoSight NS300 纳米粒度分析仪为Malvern Panalytical 公司产 品 ;357 酶标仪 为ThermoScientific 公司产品;GX35 倒置显微镜为Olympus 公司产品;FACSymphonyTMA3 流式细胞仪为BD公司产品。
1.2 细胞培养
经检测,WJMSC无细菌、真菌、支原体和病毒污染,表达多种干细胞特异性标志物,并具有良好的增殖和分化潜力。WJMSC 在含有10%无外泌体血清和1%青霉素-链霉素溶液的DMEM/F12培养基中培养。
巨噬细胞在含有10%血清、10 ng/mL 的巨噬细胞集落刺激因子、1%青霉素-链霉素溶液的RPMI-1640 培养基中培养,培养基每隔一天更换1次。在第7天收集细胞用于后续实验。
1.3 WEX提取并鉴定
收集第3~5代WJMSC 的上清液,使用外泌体提取试剂按1∶5 的比例加入上清液中,在4 ℃下孵育过夜(12 h 以上),将样品在室温下以1500×g离心30 min,去除上清液。最后,用100~500 μL PBS重新悬浮所获得的外泌体。
将上述提取的WEX 加入5×SDS 缓冲液[30 mmol/L Tris-Hcl(pH=6.8)、2% SDS、0.05%溴酚蓝、12.5%甘油和2.5%巯基乙醇]中煮沸5 min。然后将20 μg WEX 加到10% SDS 聚丙烯酰胺凝胶各个泳道中,将样品转移到PVDF 膜上,用5%牛奶在室温下阻断1 h,加入适量CD9(稀释度为1∶1000)和CD81(稀释度为1∶500)一抗并在4 ℃孵育过夜。TBST 洗涤三次后,加入二抗(稀释度为1∶10 000)室温处理2 h,再加入DAB 显色剂显色,采用Bio-Rad 凝胶成像仪记录蛋白条带灰度并拍照。
1.4 制备WEX水凝胶和表征其物理特性
在室温下,将海藻酸钠粉末溶解在PBS 中,形成2%(w/v)海藻酸钠溶液。为了确定最佳的海藻酸钠水凝胶系统,使用不同浓度的氯化钙溶液研究WEX 的控释能力。将海藻酸钠溶液分别与1%、2%(w/v)氯化钙溶液以1∶4的体积比混合,形成海藻酸钠水凝胶。然后将30 μg WEX 加入50 μL 海藻酸钠溶液中,搅拌,形成含有WEX 的海藻酸钠水凝胶。
WEX水凝胶经真空冷冻干燥,取干品断面真空喷金后使用扫描电子显微镜观察水凝胶的微观结构,使用流变仪来评估水凝胶的流变行为。体外WEX释放测试在37 ℃条件下温和摇动中进行。将制备好的100 μL WEX 水凝胶转移到200 μL PBS(pH=7.4)溶液中。每两天去除上清液,加入新鲜PBS。然后用BCA 蛋白检测试剂盒测定释放到培养基中的WEX 质量,进而计算得到累积释放的WEX质量。某一时刻WEX的累积释放率(%)=mt/m0×100%,式中mt代表t 时刻WEX 累积释放质量,m0代表凝胶中WEX总质量。
1.5 流式细胞术检测巨噬细胞中CD86和CD206的表达
将巨噬细胞以5×104个/孔的细胞密度接种在24孔板中,分为空白对照组、水凝胶对照组、WEX对照组和WEX 水凝胶组,分别用PBS、海藻酸钠水凝胶提取液、WEX 悬浮液(20 μg/mL)、WEX 水凝胶提取液(WEX 浓度为20 μg/mL)处理细胞并孵育24 h,收集细胞,并与Fc受体阻断剂孵化,以减少非特异性抗体结合,细胞重新悬浮在染色缓冲液中,用荧光标记的CD86 和CD206 抗体染色后,使用流式细胞仪对细胞进行检测。
1.6 制备小鼠全层皮肤创伤模型及分组干预
将小鼠麻醉后俯卧在手术台上,用电剪刀和脱毛蜡依次剃除背部区域的毛发后,用活检穿孔器在每只小鼠背部打出直径12 mm的皮肤全层圆形伤口。所有小鼠随机分为三组,每组6只,分别为空白对照组(50 μL PBS)、WEX 对照组(30 μg WEX 加入50 μL PBS)和WEX 水凝胶组(30 μg WEX 封装于50 μL 海藻酸钠水凝胶)。所有药物每日1 次局部涂抹于伤口部位。术后第0、3、6、9、12、15 天观察伤口部位并拍照,使用Image-Pro Plus 6.0软件进行残余创面百分比分析,残余创面百分比=第n天创伤面积/第0天创伤面积×100%
1.7 平板计数法评价WEX水凝胶的抗菌功效
将第3 天的小鼠皮肤组织用2 mL 无菌等渗氯化钠溶液匀浆,将100 μL匀浆添加到革兰阴性菌培养基(选择性培养大肠埃希菌)和甘露醇盐琼脂培养基平板(选择性培养金黄色葡萄球菌)。将平板置于37 ℃的生化培养箱中进行倒置培养24 h后,对平板上的菌落形成单位进行计数。
1.8 HE染色观察组织病理学变化
手术后15 d,采用颈椎脱位法对小鼠实施安乐死,解剖出伤口组织后立即用4%多聚甲醛固定48 h,然后用梯度乙醇脱水。石蜡包埋后将皮肤组织切成5 μm 的薄片,将切片用100%二甲苯脱蜡3 min,100%乙醇水化3 min,95%乙醇水化3 min,苏木精染色5 min,去离子水洗涤5 min;用酸性乙醇(1%盐酸溶液溶于70%乙醇溶液中)浸泡5次,并用去离子水冲洗,氨水处理后用去离子水冲洗;用伊红溶液在室温下染色1 min,梯度乙醇脱水(95%乙醇2 min,100%乙醚2 min)并用二甲苯清除(100%二甲苯30 min)。切片置于光学显微镜下观察。
1.9 Masson染色观察组织病理学变化
经脱蜡和水化后,切片在56 ℃下用Bouin 溶液处理15 min,18~26 ℃的水浴中冷却5 min 后,室温下使用苏木精溶液染色5 min,用去离子水冲洗,用Biebrich 碱性品红染色5 min,去离子水冲洗1 min;室温下用磷钨酸/磷钼酸溶液处理5 min,置于苯胺蓝溶液中5 min,用1%乙酸处理2 min,并通过不同浓度乙醇溶液(70%、80%、90%、100%)脱水,在二甲苯中清除5 min。所有切片在蔡司扫片机下进行图像采集,使用Image-Pro Plus 6.0图像处理软件分析胶原蛋白沉积率。
1.10 免疫组织化学检测组织中CD86、CD206和CD31的表达
术后第15 天用免疫组织化学检测创面组织中巨噬细胞的极化情况。皮肤组织用5%甲醛固定过夜,采用梯度乙醇脱水法将组织脱水后包埋在石蜡中切片。组织切片用10 mmol/L 柠檬酸钠缓冲液在94 ℃下修复15 min后,冷却至室温并用1%牛血清白蛋白密封30 min。随后,分别用CD86、CD206和CD31一抗处理切片,再用生物素化标记的二抗孵化,并用苏木精重新染色。最后在光学显微镜下观察染色切片。CD86、CD206和VEGF 在细胞质中呈棕黄色,CD31 表达于细胞膜中呈棕黄色。随机选择20 个视野并在低倍镜下拍照,采用Image-Pro Plus 6.0 图像处理软件分析CD86和CD206在肿瘤组织中的积分光密度值。
1.11 统计学方法
使用GraphPad Prism 8.0软件进行统计分析。Kolmogorov-Smirnov检验用于验证正态性,正态分布的计量数据用均数±标准差()表示,使用单因素方差分析或双因素方差分析进行比较,Tukey 法进行多重比较检验,P<0.05(两侧)为差异具有统计学意义。
2 结果
2.1 成功提取WEX
扫描电子显微镜结果显示,WEX呈圆形或椭圆形(图1);WEX 的密度为1.34×109/mL,平均直径为(118.0±21.7)nm。蛋白质印迹法结果表明,分离的外泌体富含内体四联跨膜蛋白,如CD9 和CD81(外泌体阳性标志物),而外泌体阴性标志物Calnexin 蛋白在分离的外泌体中几乎不存在(图2)。可见从WJMSC上清液中成功提取WEX。
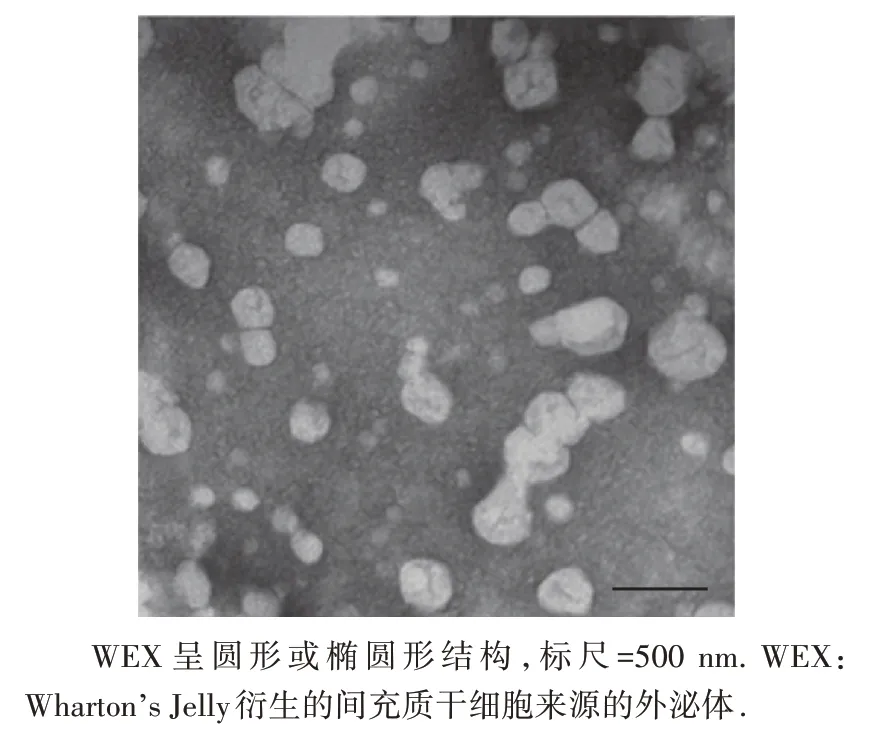
图1 电子显微镜下WEX图像Figure 1 Electron microscopy image of WEX
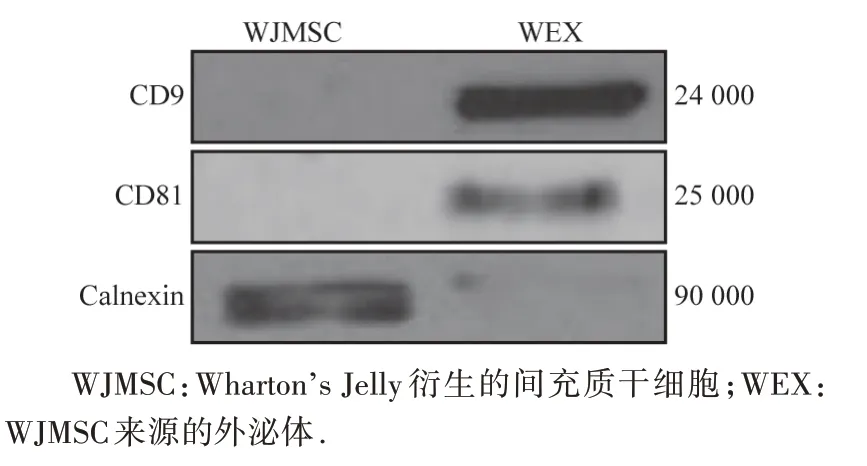
图2 WEX中外泌体相关标志物的蛋白电泳图Figure 2 Exosomal markersin WEX determined by Western blotting
2.2 WEX水凝胶表征结果
结果显示,含1%氯化钙溶液的水凝胶在7 d内释放了95%的WEX,且在最初的3 d 内有明显的爆发性释放效果;而含2%氯化钙溶液的水凝胶在7 d 内只释放了62%的WEX(图3)。皮肤创伤的炎症期和修复期主要发生在第1 周内[1]。因此,选择1%氯化钙溶液制备的海藻酸钠水凝胶进行后续研究。
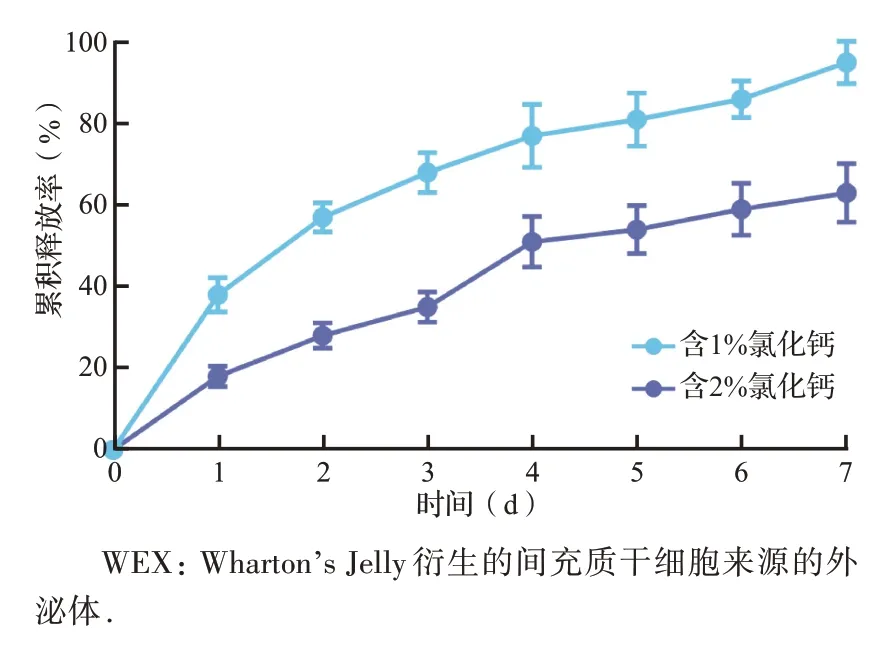
图3 含不同浓度氯化钙的WEX 水凝胶药物释放曲线Figure 3 Drug release profile of WEX-gel with different concentrations of CaCl2
对WEX 水凝胶的流变学特性进行检测发现,WEX水凝胶的储能模量(G')为(1541±36)Pa,远大于损耗模量(G″),见图4。透射电子显微镜图像显示,WEX 水凝胶表面有许多孔隙,大小从50 到150 μm 不等,高分辨率图像可以观察到负载在WEX水凝胶中的外泌体颗粒(图5)。
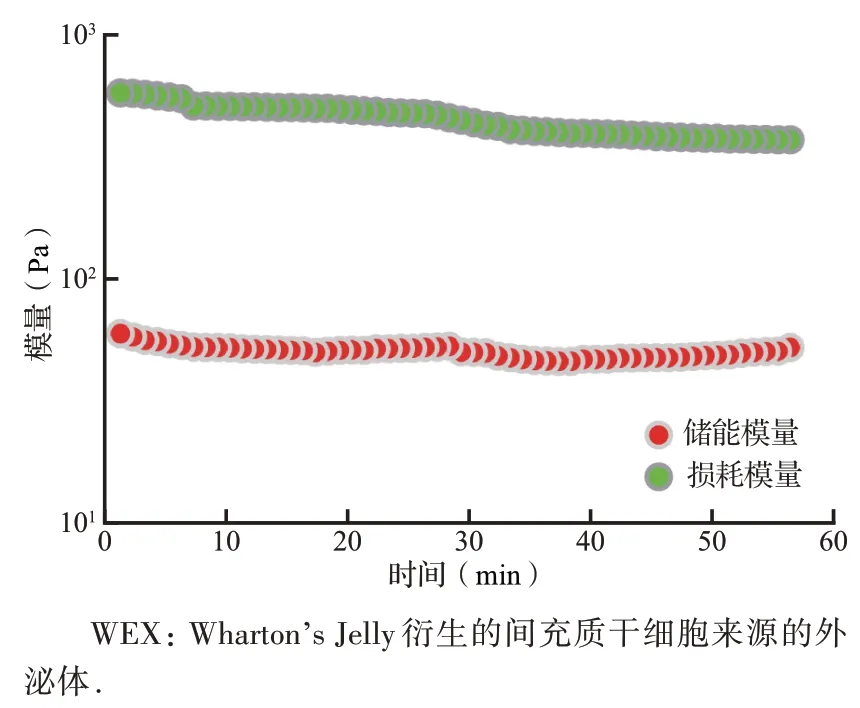
图4 不同时间WEX 水凝胶的储能模量(G')和损耗模量(G″)Figure 4 The storage modulus and loss modulus of WEX-gel determined by rheometer

图5 WEX水凝胶的扫描电子显微镜图像Figure 5 Representative scanning electron microscopy images of WEX-gel
2.3 WEX水凝胶可调节体外巨噬细胞极化
流式细胞术检测结果表明,与空白对照组比较,海藻酸钠水凝胶对巨噬细胞中CD86(与M1型巨噬细胞相关的表型标志物)和CD206(与M2型巨噬细胞相关的表型标志物)的阳性表达无明显影响(图6)。与水凝胶对照组比较,WEX 可下调CD86 的阳性表达(P<0.05),但对CD206 的阳性表达无明显影响;WEX 水凝胶可明显下调CD86的阳性表达(P<0.05),同时显著促进CD206阳性细胞比例(P<0.05)。与水凝胶对照组比较,补充WEX 或WEX 水凝胶后M2 型/M1 型巨噬细胞的比率增加(P<0.05)。见表1。表明WEX 可促进体外巨噬细胞从M1型极化为M2型。
表1 四组巨噬细胞中CD86和CD206阳性比例比较Table 1 Positive rates of CD86 and CD206 in macrophages(,n=3)
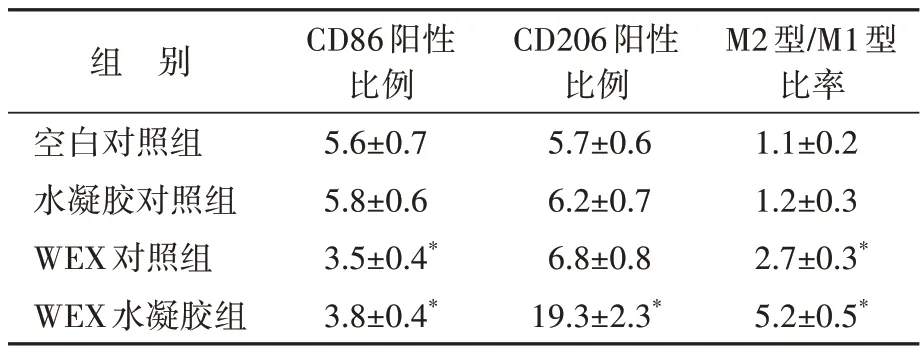
表1 四组巨噬细胞中CD86和CD206阳性比例比较Table 1 Positive rates of CD86 and CD206 in macrophages(,n=3)
与水凝胶对照组比较,*P<0.05.WEX:Wharton’s Jelly 衍生的间充质干细胞来源的外泌体.
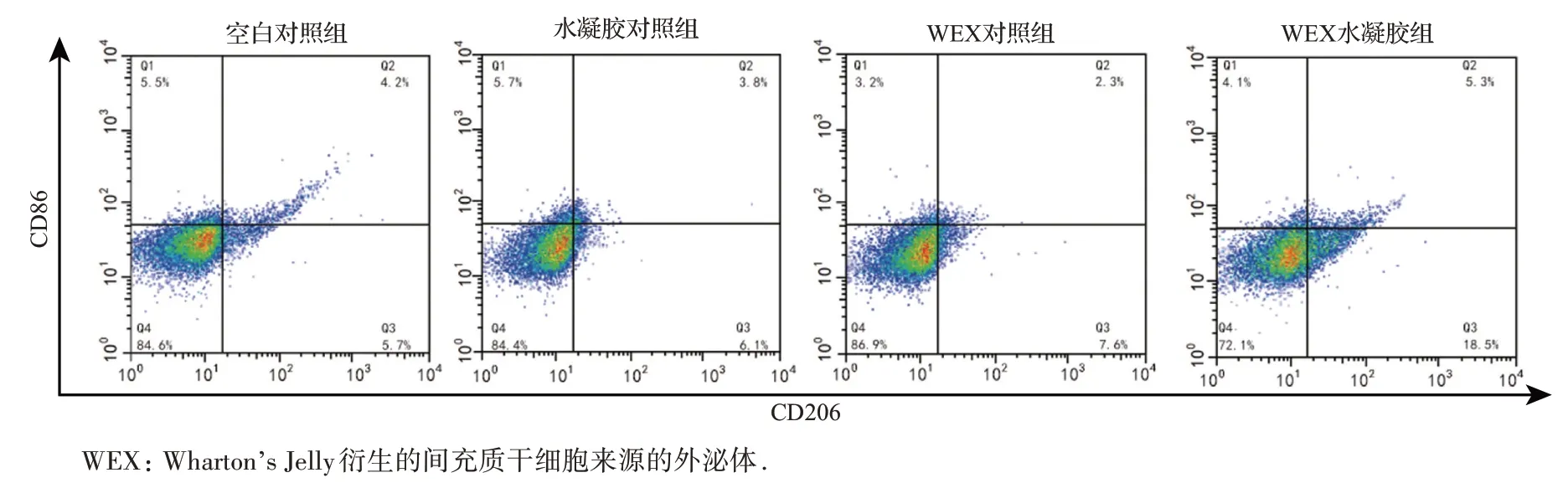
图6 四组巨噬细胞中CD86和CD206的阳性表达流式细胞术检测结果Figure 6 Positive expression of CD86 and CD206 in macrophages analyzed by flow cytometry
2.4 WEX水凝胶可促进模型鼠皮肤创伤愈合
小鼠全层皮肤创伤模型中。术后3 d,空白对照组创面可见明显红肿及分泌物,其余两组均未见明显伤口炎症及感染迹象。术后7 d,三组创面均开始结痂,伤口明显收缩,其中WEX 水凝胶组愈合最好。术后15 d,WEX 水凝胶组皮肤创面几乎完全愈合,而其他组仍可见不同程度未愈合的创面,空白对照组、WEX 对照组和WEX 水凝胶组残余创面百分比分别为(27.5±3.4)%、(15.3±1.2)%和(7.6±1.1)%。与空白对照组比较,WEX对照组残余创面百分比明显缩小(P<0.05),表明单独使用WEX 对皮肤创面恢复有促进作用。与WEX 对照组比较,WEX 水凝胶组残余创面百分比进一步缩小(P<0.05),见图7。结果表明,WEX水凝胶可增强WEX对皮肤创伤的修复作用。
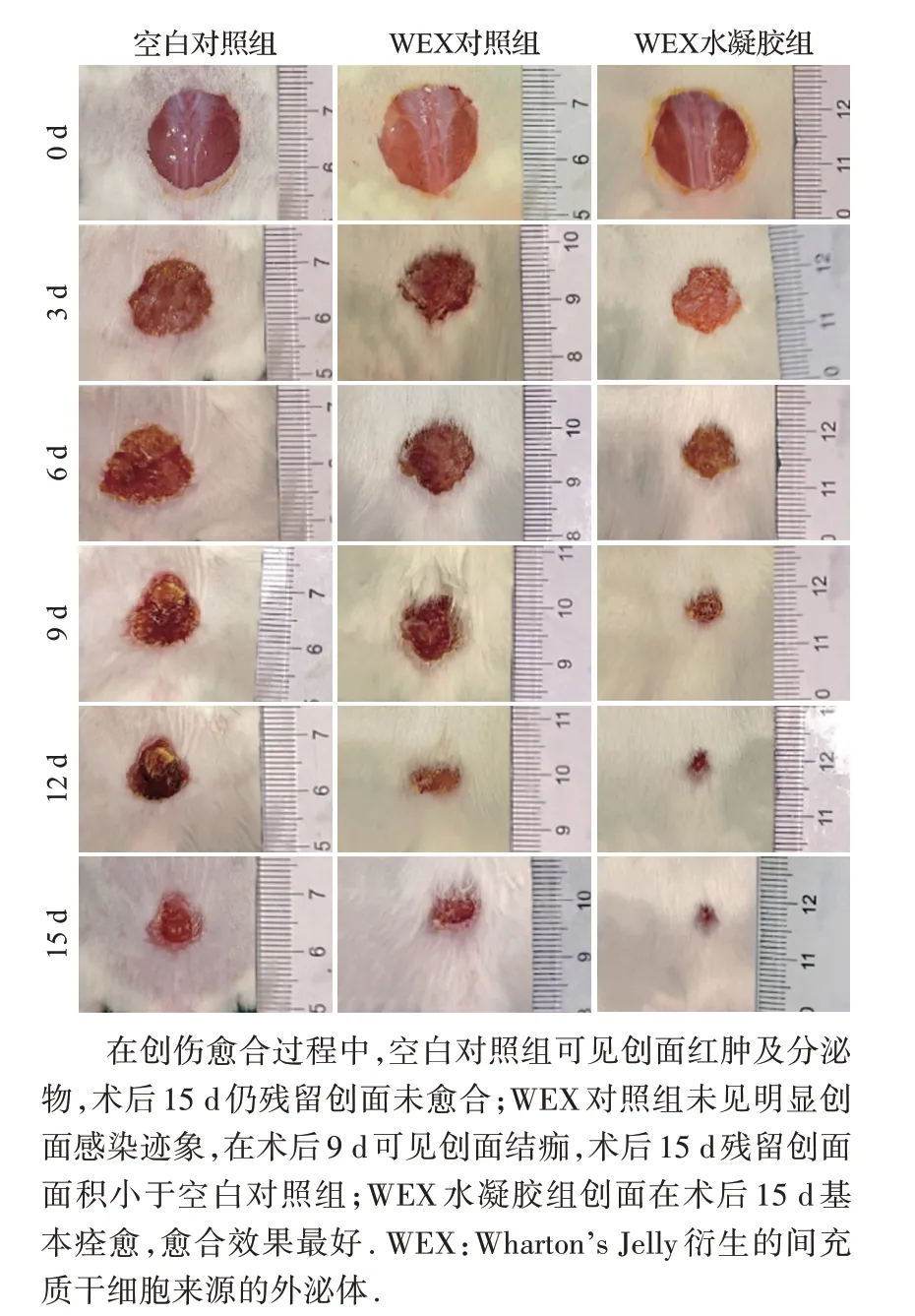
图7 三组干预后不同时间创面外观Figure 7 Wound healing in blank control,WEX control and WEX-gel groups at different time points
2.5 WEX水凝胶具有体内抗菌作用
将第三天的创面组织进行培养,WEX水凝胶组创面中大肠埃希菌和金黄色葡萄球菌均减少(图8),存活数均少于WEX 对照组(均P<0.05),见表2。结果说明WEX 水凝胶具有优异的抗菌性能。
表2 三组琼脂平板菌落计数的定量结果比较Table 2 Quantitative analysis of colony counts on agar plates in three groups(,CFU×105)
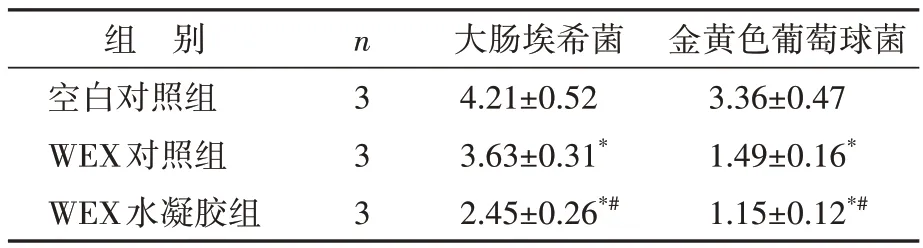
表2 三组琼脂平板菌落计数的定量结果比较Table 2 Quantitative analysis of colony counts on agar plates in three groups(,CFU×105)
与空白对照组比较,*P<0.05;与WEX 对照组比较,#P<0.05.WEX:Wharton’s Jelly 衍生的间充质干细胞来源的外泌体;CFU:菌落形成单位.
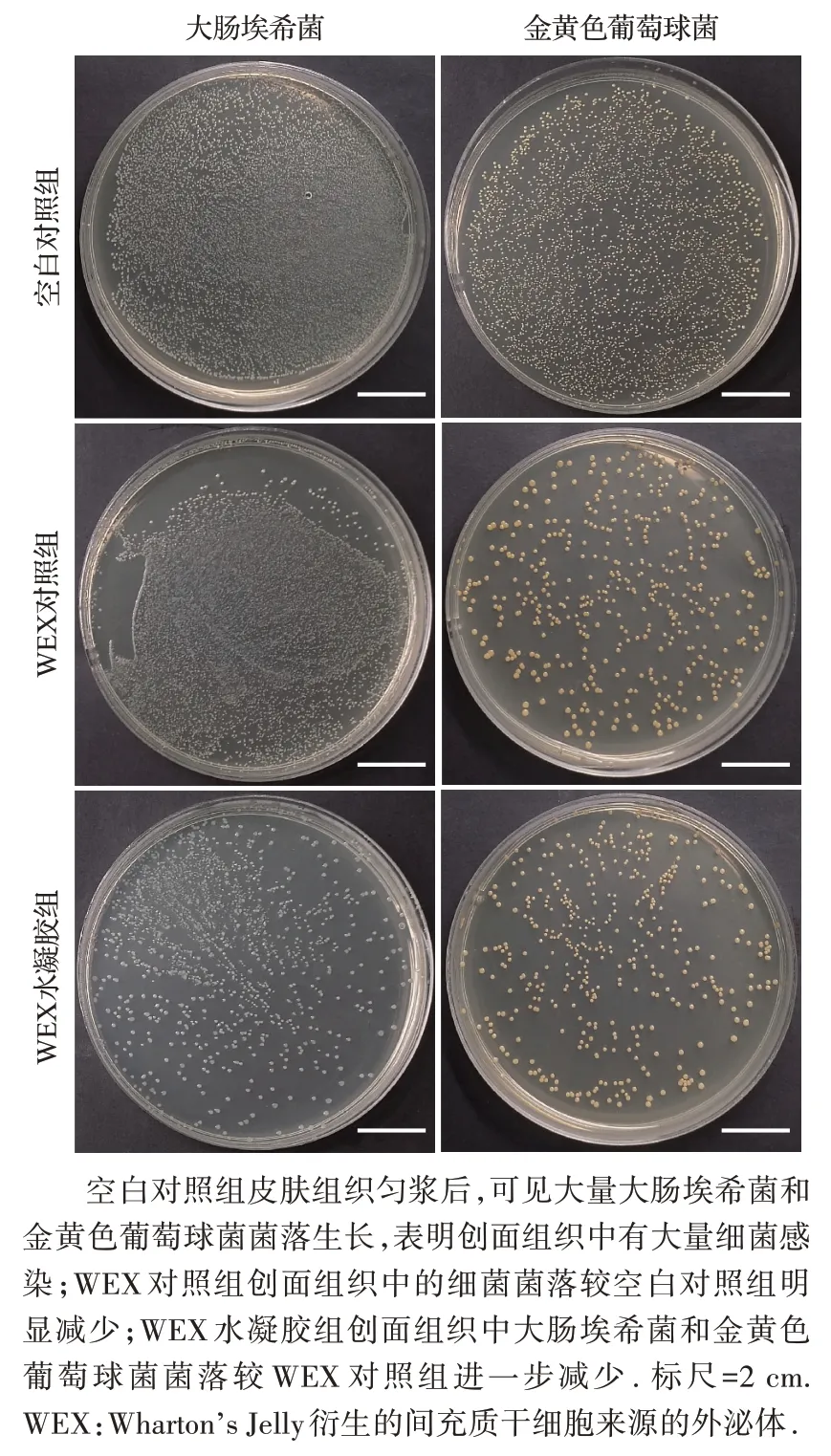
图8 三组小鼠创面组织大肠埃希菌和金黄色葡萄球菌培养结果大体观Figure 8 Cultures of E.coli and S. aureus in would tissue of mice in three groups
2.6 WEX 水凝胶可促进创面皮肤组织新生
组织病理学检查结果,三组皮肤组织均可观察到不同程度的炎症反应,空白对照组的炎症反应最为严重,表现为局部出血、大量炎症细胞聚集、纤维组织和结缔组织大量减少;与空白对照组比较,WEX 对照组的炎症反应有所减轻;与WEX 对照组比较,WEX 水凝胶组创面组织中的炎症细胞明显减少。WEX水凝胶组的真皮厚度比其他组厚(均P<0.05),且真皮内的成纤维细胞更加丰富;与WEX 对照组比较,WEX 水凝胶组的新生毛囊数明显增多,WEX水凝胶组的胶原蛋白沉积率也增加(均P<0.05),见图9和表3。
表3 三组创面皮肤组织中真皮厚度、新生毛囊数、胶原蛋白沉积率比较Table 3 Quantitative analysis of dermal thickness,number of new hair follicles,and collagen deposition rate of wound skin tissues in three groups(,n=3)
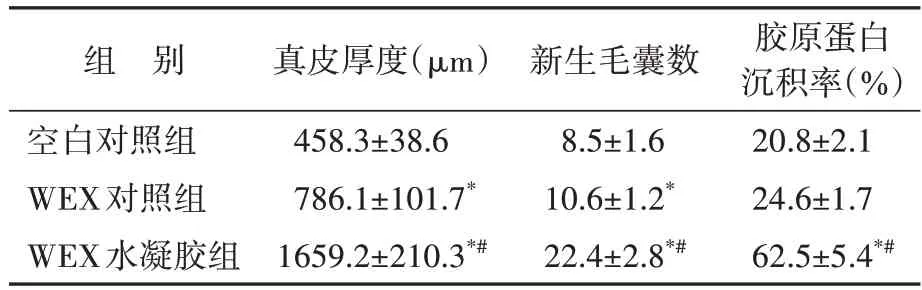
表3 三组创面皮肤组织中真皮厚度、新生毛囊数、胶原蛋白沉积率比较Table 3 Quantitative analysis of dermal thickness,number of new hair follicles,and collagen deposition rate of wound skin tissues in three groups(,n=3)
与空白对照组比较,*P<0.05;与WEX 对照组比较,#P<0.05.WEX:Wharton’s Jelly衍生的间充质干细胞来源的外泌体.
2.7 WEX水凝胶可调节体内巨噬细胞极化和血管新生
CD86 在各组创面组织中均有不同程度表达。与空白对照组比较,WEX 对照组和WEX 水凝胶组中CD86 的阳性表达均减少(P<0.05),同时WEX 水凝胶组CD86 的阳性表达少于WEX 对照组(P<0.05)。与空白对照组比较,WEX 对照组CD206阳性表达增加(P<0.05);与WEX 对照组比较,WEX 水凝胶组CD206 阳性表达进一步增加(P<0.05)。见图10、表4。提示WEX 水凝胶可促进创面组织中的巨噬细胞从M1 型极化为M2 型巨噬细胞。
表4 三组创面组织中巨噬细胞极化和血管新生相关标志物相对表达水平比较Table 4 Comparison of macrophage polarization and angiogenesis related biomarkers in wound tissues of each group(,n=3)
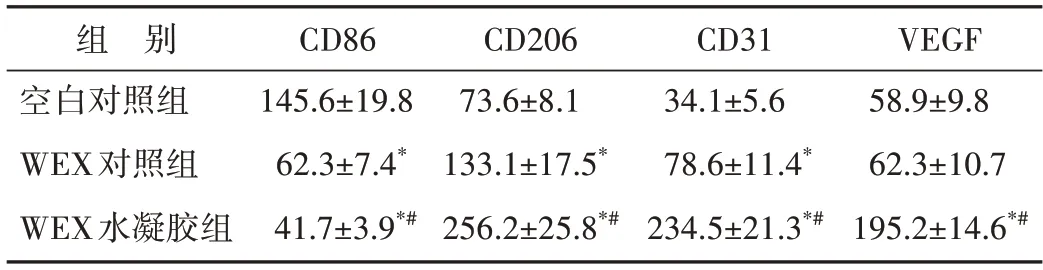
表4 三组创面组织中巨噬细胞极化和血管新生相关标志物相对表达水平比较Table 4 Comparison of macrophage polarization and angiogenesis related biomarkers in wound tissues of each group(,n=3)
*与空白对照组比较,P<0.05;与WEX 对照组比较,#P<0.05.WEX:Wharton’s Jelly 衍生的间充质干细胞来源的外泌体;VEGF:血管内皮生长因子.

图10 三组创面组织中巨噬细胞极化和血管新生相关标志物的表达(免疫组织化学法)Figure 10 The expression of CD86,CD206,CD31 and VEGF in skin tissue of each group(immunohistochemical method)
与空白对照组比较,WEX 对照组CD31 阳性表达增加(P<0.05);与WEX 对照组比较,WEX 水凝胶组CD31 阳性表达进一步增多(P<0.05)。与空白对照组比较,WEX 对照组VEGF 阳性表达无明显变化(P>0.05);与WEX 对照组比较,WEX 水凝胶组VEGF 阳性表达增多(P<0.05),见图10、表4。提示WEX 水凝胶可促进创面组织的血管新生。
3 讨论
WJMSC等干细胞疗法可以加速创面愈合,从而在组织再生和伤口修复中发挥重要作用。基于此,本研究构建了海藻酸纳水凝胶和WEX 的复合体,并应用于小鼠全层皮肤创伤模型,结果表明这种复合材料能促进小鼠皮肤创伤后的创面恢复,其作用机制与WEX 促进巨噬细胞从M1型极化为M2型有关。
作为一种新型的非细胞疗法,外泌体在皮肤创伤后的创面愈合和皮肤重塑中发挥重要作用[3-5]。目前普遍认为,干细胞衍生的外泌体具有与干细胞本身相同甚至更好的组织修复能力。更重要的是,与细胞移植比较,外泌体介导的干细胞疗法具有更高的稳定性和可储存性,无异位组织形成的风险,而且发生免疫排斥的可能性更小。然而,外泌体应用于皮肤创伤治疗存在一定挑战,因为外泌体会从注射部位迅速流失,且在体内存活时间很短。因此,将外泌体与生物材料结合起来,在不影响其生物活性的情况下,延长外泌体在移植部位的保留时间,以促进外泌体的疗效已成为开发基于外泌体疗法的研究重点。许多研究表明,水凝胶可以增强细胞的特性和过程,如细胞生长速度、骨形成和血管吻合等;水凝胶还可以包裹细胞,形成支架并作为药物载体,从而提高药物的生物利用度[10]。Shi等[11]使用可生物降解和生物相容性的壳聚糖/丝绸水凝胶海绵,将人类牙龈间充质干细胞衍生的外泌体输送到小鼠的糖尿病伤口组织,这种水凝胶复合物可以通过增强再上皮化、胶原蛋白沉积和血管新生来促进伤口愈合。此外,一种PF-127 水凝胶被发现对保留人类脂肪间充质干细胞衍生的外泌体有好处,并且这种组合促进了小鼠大面积皮肤创伤修复[12]。但很少有研究调查干细胞源性外泌体与海藻酸盐水凝胶的组合对皮肤创伤的治疗效果。海藻酸盐水凝胶具有良好的耐受性,不良事件发生率低[7]。因此,将海藻酸盐水凝胶与具有治疗作用的生物活性因子联合应用,可以提供一个更好的治疗方法。然而,海藻酸盐水凝胶是否能影响WEX 对皮肤创伤的疗效仍是未知数。为了确定最佳的海藻酸钠水凝胶系统,本研究检测了1%和2%的氯化钙溶液对WEX 水凝胶控释能力的影响。考虑到皮肤创伤的炎症期和修复期主要发生在第1 周内[1],本研究选择了1%氯化钙溶液制备的水凝胶,其能在1周内释放几乎全部的WEX,符合创面修复的病理生理过程。除此以外,由1%氯化钙组成的水凝胶表现出的储能模量值也更适合于皮肤组织工程[10]。在体内实验中,本研究将WEX 水凝胶应用到皮肤创面,与预期一致的是,WEX 水凝胶增强了WEX 对皮肤创面的修复效果,表现为炎症反应减轻、真皮厚度和新生毛囊数增加、胶原蛋白沉积区域扩大和丰富的新生血管。表明WEX水凝胶可延长WEX 的保留时间,从而加强了WEX在皮肤创伤中的治疗作用。
皮肤创面愈合过程一般可分为止血期、炎症期、增殖期和成熟期[13]。止血期通常在皮肤损伤出血后几十秒内停止;随后,炎症期在皮肤创伤后数小时内开始,在促炎性细胞因子的诱导下,中性粒细胞和巨噬细胞聚集在伤口区域,杀死入侵的病原体并清除坏死的组织碎片;在创伤后24 h 内开始增殖期,典型特征是表皮基底层细胞大量增殖和创面边缘新生血管形成;在创伤后第3 天开始的成熟期,创面开始出现新生肉芽组织和疤痕组织,以增强伤口部位的完整性并最终闭合伤口[14]。先前研究表明,皮肤创面愈合涉及皮肤细胞、免疫细胞和细胞外基质成分之间复杂的相互作用[15]。巨噬细胞在伤口愈合过程的不同阶段发挥着关键作用[2]。巨噬细胞大致分为M1型和M2 型,M1 型巨噬细胞多见于损伤修复早期,可以清除伤口中的外来病原体和坏死组织碎片,其特点是产生大量促炎性细胞因子,如IL-1β和肿瘤坏死因子-α,从而导致创伤部位早期的器官功能障碍[16]。M1 型巨噬细胞可转化为M2 型,活化的M2 型巨噬细胞可以通过参与抗炎因子的产生和分泌来缓解炎症反应[17]。同时,M2 型巨噬细胞通过招募附近的成纤维细胞,促进损伤部位胶原蛋白沉积,从而促进创面的成熟和修复[18]。越来越多的证据表明,伤口环境中高比例的促炎型巨噬细胞和低比例的抗炎型巨噬细胞是伤口愈合的巨大障碍[19]。在伤口局部注射胰岛素可以促进M1 型巨噬细胞极化为M2 型巨噬细胞,从而影响炎症反应过程,最终加速术后感染伤口的愈合[20]。最近的一项研究表明,作为一种Th2型免疫诱导剂,IL-33添加到皮肤伤口中可以显著上调巨噬细胞中的M2型/M1型比值,从而增强皮肤细胞增殖和血管新生来加速小鼠糖尿病伤口模型的愈合[21]。上述研究表明,促进巨噬细胞从M1 型向M2 型极化可以为难治性伤口愈合提供有效的治疗方法。本文资料显示,WEX可有效降低体外CD86 阳性表达的巨噬细胞比例,同时上调CD206 阳性表达的巨噬细胞比例,表明WEX 可以调节体外巨噬细胞的表型。与体外实验结果相仿,体内实验中WEX 水凝胶可有效促进创面组织中的巨噬细胞由M1 型极化为M2 型,充分表明WEX 水凝胶可能主要通过调节巨噬细胞的极化过程,从而发挥对皮肤创伤的修复作用。除此以外,微生物感染会严重阻碍伤口愈合,理想的伤口敷料应具有良好的抗菌性能[10]。大多数获得性伤口感染的微生物来源是多种的,其中金黄色葡萄球菌最常见[19]。在本研究中,WEX水凝胶可有效抑制创面中细菌生长,对金黄色葡萄球菌的抑制效果更加明显。推测其原因是WEX 水凝胶可缓慢释放WEX 到创面微环境中,通过调节巨噬细胞的极化,从而产生优异的抗菌功能。M2 型巨噬细胞可以通过释放转化生长因子-β、VEGF 等血管生长因子来刺激血管内皮细胞和成纤维细胞的活化[22]。新血管的形成对于协调伤口愈合至关重要。慢性伤口不愈合主要是由于血管生成受损,无法为受伤部位提供足够的营养[23]。本研究也观察到WEX 水凝胶显著提高了创面组织中CD31 的表达,同时创面组织中VEGF 的表达也在WEX 水凝胶的作用后得以明显上调,进一步验证了WEX 水凝胶通过调节M2 型巨噬细胞的极化来促进血管新生和细胞增殖,同时抑制炎症反应,进而达到促进创面愈合的效果,这为WEX 水凝胶在难愈性创面修复中的临床转化提供了实用的治疗方法。
总之,本研究开发了一种基于藻酸盐水凝胶的负载WEX 水凝胶系统,可延长WEX 在创面的停留时间,通过促进巨噬细胞从M1 型极化为M2型,达到促进皮肤创面愈合的效果。本研究结果为创伤性皮肤缺损的临床治疗提供理论依据。然而,值得注意的是,治疗创伤性皮肤损伤需要多管齐下,WEX 水凝胶可以与其他治疗方法(如手术换药、血糖控制、抗生素等)相结合,从而达到理想的治疗效果。
志谢研究得到浙江省医学会临床科研基金(2019ZYCA182)支持
AcknowledgementsThis study was supported by Clinical Research Fund of Zhejiang Provincial Medical Association
利益冲突所有作者均声明不存在利益冲突
Conflict of InterestsThe authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

