浅表CD34阳性纤维母细胞肿瘤研究进展
刘旭, 刘娇, 陈路, 胡余昌, 刘宇飞
浅表CD34阳性纤维母细胞肿瘤(superficial CD34-positive fibroblastic tumor,SCPFT)是一种罕见的软组织交界性肿瘤,最早由Carter等[1]于2014年首次报道,不久后由Hofvander等[2]和Puls等[3]发现该肿瘤存在PRDM10基因重排,直到2020年,第5版WHO骨与软组织肿瘤分类的问世,才将此肿瘤正式收录在成纤维细胞/肌成纤维细胞性肿瘤中[4],对其生物学行为定义为中间性(偶有转移),该肿瘤具有局部侵袭性,可向真皮、皮下组织和筋膜深层浸润[5]。以往的病理医师及学者们把此病诊断为低度恶性纤维组织细胞瘤或低级别肉瘤(非特指)[6]。近年来,关于此肿瘤的文章报道有所增加,但大部分文章都是病例报道,很少有对该疾病的整体归纳,截至2023年9月,全球文献报道约150例。我们对该疾病的认识仍然存在很多局限性,本文通过回顾国内外已报道文献,从病因、临床表现、影像学、病理、治疗及预后等方面进行归纳和总结,希望对临床医师提供系统性的认识和参考,避免漏诊和误诊。
1 病因
目前,SCPFT的病因不明,肿瘤的起源为成纤维细胞增生,有学者认为与日光照射没有直接关系[7],但均无证据。
2 临床表现
多数患者常因发现包块数年后渐进增大伴疼痛就诊。SCPFT发生部位表浅,通常表现为皮下组织内、筋膜上存在的无痛性肿块,与肌肉组织无粘连,表皮膨隆,无明显瘙痒感,大部分皮肤没有破溃,少数存在溃疡或感染的表现。据文献报道,皮肤表面颜色为黄色、白色或深棕色[1,8]。肿瘤生长几天至十几年,大多数生长数月至数年,发病年龄广,报道显示,最小年龄8岁,最大年龄85岁,平均年龄40岁左右,成人更多见,男性略多于女性,最常发生于下肢大腿[9],占大多数,其次为上肢和背部,极少发生于颈部、胸部、腋窝、腹壁、乳房或外阴[1,8-11]。肿瘤直径0.8 ~10.0 cm[12],一般不超过5.0 cm[13-14]。无特殊全身表现、实验室异常指标及家族遗传倾向。
3 影像学
超声显示为皮下低回声边界清楚的肿瘤[15],易与血管瘤和脂肪瘤混淆;CT平扫显示肿瘤位于皮下脂肪组织,轮廓分明,呈低或中等密度,增强CT显示肿瘤弥漫性均匀弱强化[16];核磁共振(MRI)T1加权成像显示肿块内低信号强度,边界相对清楚,T2加权成像显示高信号强度,部分病例具有分叶状结构[17];PET-CT摄取增强,最大标准摄取值(SUV)为2.570[18]。
4 大体
SCPFT质地中等偏硬,切面呈均匀的米黄色至棕褐色[19],罕见纯白色[20],部分学者描述为结节状鱼肉样或分叶状外观[18],边界较清,肿瘤周围被纤维脂肪包绕,偶可紧贴肌肉生长,但未见长入肌肉内表现。部分瘤组织可见到局灶的包膜或没有明确的包膜。
5 诊断
SCPFT通过临床很难直接诊断,症状不典型,没有明确的实验室指标异常提示,加之临床医师对此病的认识不够,大多数会误诊为脂肪瘤或纤维瘤等。合并溃疡的患者,误诊为软组织感染及瘢痕增生,甚至是皮肤鳞状细胞癌。病理为该病唯一确诊的依据。细胞学穿刺标本,镜下主要由梭形细胞组成,单个或成簇排列,混杂散在的大而多形的细胞,核染色质细腻到空泡状,部分细胞核轮廓不规则,形状奇特,核仁清晰,核分裂罕见[21],胞浆丰富呈颗粒状至“玻璃样”特征,背景是胶原化的间质碎片散在少量的炎性细胞[22]。尽管这些细胞形态具有足够的特征性,但由于取材组织的局限性,仍然需要和很多软组织肉瘤进行区别。手术完整切除的肿瘤,显微镜下是弥漫增生的梭形细胞中混杂异型性显著的多形性细胞。梭形细胞可以是稀疏的不具有异型或具有轻度异性的长杆状细胞,胞质不明显,核小,核染色质细腻,核仁不清,也可以是密集的胖梭形细胞,核偏大,核染色质深,核仁可见;明显异型的细胞表现为多形性核或怪异的核,可以是短梭形、不规则形、胖梭形或类圆形,这种细胞不弥漫,也不呈巢团状,散在于形态相对较温和的梭形细胞之间,核染色质深,核仁明显,部分胞质透亮,核偏位,似脂肪母细胞样,偶可见核内包涵体;尽管这个肿瘤显示出令人担忧的核特征,但是未见核分裂像或极少见核分裂像,一般≤1/50 HPF,最高≤5/50 HPF[1],没有非典型核分裂像或病理性核分裂像。存在组织细胞/泡沫细胞和淋巴细胞浸润,偶可见到浆细胞、中性粒细胞及嗜酸性粒细胞。约20%的病例可以见到丰富的嗜酸性玻璃样/颗粒状细胞质,类似于颗粒细胞瘤样改变;部分病例可见到局限性明显扩张的血管间隙伴纤维蛋白样物质沉积或含铁血黄素沉积,类似于多形性透明变性血管扩张性肿瘤;少见的情况下,肿瘤内可见局灶的黏液样变及骨化[23];通常无坏死。
免疫组化是非常重要的参考依据,该肿瘤细胞质和膜弥漫表达CD34,其次,据文献报道,瘤细胞还会表达Vimentin、WT1(52%病例核阳性)和CADM3(95%病例胞质阳性)。有学者指出WT1阳性的病例均存在PRDM10基因重排,提示二者可能存在一定联系[9]。CADM3叫做细胞黏附分子3,以往研究发现,CADM3主要分布在神经元细胞膜上,对神经元轴突的形成具有重要作用,也被称作Necl1/TSLL1/SynCAM3[24]。该抗体目前并没有广泛应用于临床诊断,常表达于施万细胞及其起源的肿瘤(如颗粒细胞瘤)、部分神经分化的肿瘤(如神经鞘瘤)及SCPFT,其他类型软组织肿瘤中一般不会出现强而弥漫的表达。多形性脂肪肉瘤、黏液纤维肉瘤、多形性未分化肉瘤和黏液炎性纤维母细胞肉瘤可出现局灶的弱表达,但不会弥漫的表达,未来该指标可能会有更多的研究报道。最近Sugita等[25]认为所有SCPFT存在cyclin D1的弥漫核表达。该抗体为细胞周期蛋白,并非具有明显的特异性。肿瘤局灶或散在表达CKpan(70%病例细胞质阳性),局灶表达Desmin、SMA或CD68[26]。Ki-67增殖指数<1%,最高为5%,部分文献报道复发病例Ki-67增殖指数最高为15%[11]。不表达P53、CD31、ERG、S100、SOX-10、HMB45、Melan A、INI1、Fli-1、H-caldemon、βcatenin、CD99、STAT6、ALK。
分子方面,目前认为约42%的患者存在PRDM10-STT基因重排,这与PRDM10基因突变(通常为MED12-PRDM10融合和CITED2-PRDM10融合)的软组织肿瘤存在部分重叠。有学者还发现少数病例可存在MED12-PRDM10融合[27]。最近很多学者提出将PRDM10-STT基因重排的肿瘤与SCPFT视为同一种肿瘤[9,11,28],因为二者不仅在基因改变方面相似,而且存在相似的形态学特点及免疫组织化学表达,随着研究的不断深入,后续可能将二者合并为一种肿瘤。
6 鉴别诊断
见表1。
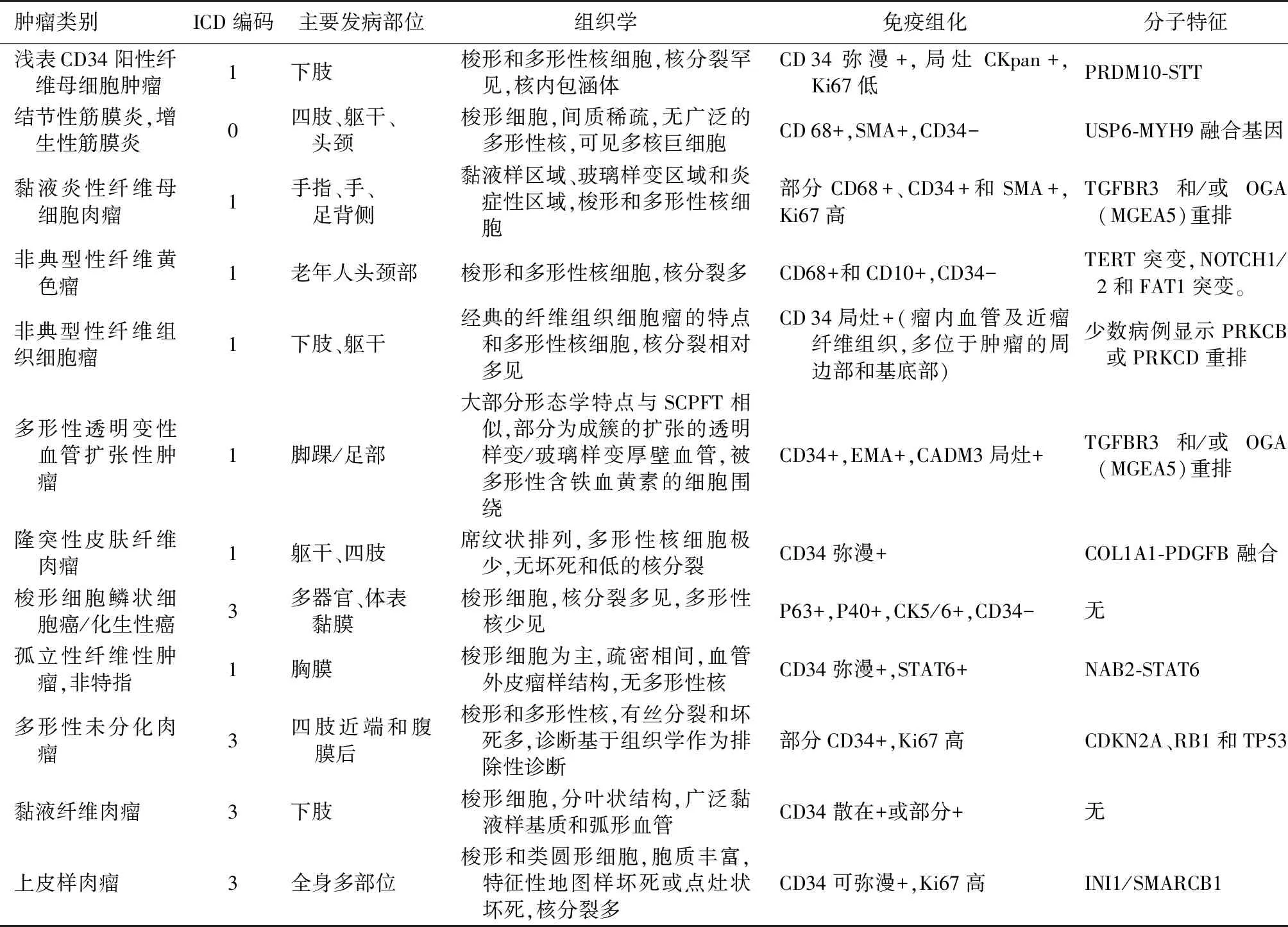
表1 浅表CD34阳性纤维母细胞肿瘤与其他软组织肿瘤鉴别表
7 治疗及预后
主要采取手术扩大切除,保证切缘阴性,部分学者提出Mohs显微手术,保证最小化的切缘阴性[5]。多数患者初次治疗仅采取了肿瘤的局部切除,后续又进行了扩大切除或密切随访。大部分患者预后良好,无疾病的复发。个别报道病例出现复发或淋巴结转移[1,8-9,21,29-30],复发和转移发生率约10%。对于复发和转移的患者,行病变的再次扩大切除术,没有加做放、化疗的文献报道。
8 小结
SCPFT是CD34阳性家族中一个新发现的实体梭形细胞软组织肿瘤。这种肿瘤很难与其他多形性软组织肿瘤区分。目前,我们还是受限于此病的罕见性和认识的不足,未来需要更多的临床数据进行研究,准确的识别它,特别是与高度恶性的真性肉瘤区别开,具有重要的临床价值,避免误诊或过度治疗。

