减量化修复地块土壤微生物群落多样性及影响因子初探
张书源
(1.上海市地矿工程勘察(集团)有限公司,上海 200072;2.中国地质学会城市地质灾害防控技术创新基地,上海 200072)
上海“十四五”规划建议,崇明坚持生态优先,绿色发展,持续推进世界级生态岛建设。为贯彻相关规定,政府计划对崇明目前存在的不符合用地要求的土地进行减量化处理,通过工程技术手段将其恢复成可供生态或农业使用的地块[1]。然而,环境效益较差的建设用地在减量化修复后,仍存在土壤质量低和种植效益差等问题[2],因此对修复后土壤的生态功能恢复情况值得深入探究。
对于减量化修复的地块,往往侧重于土壤肥力与土壤污染风险评价的研究,容易忽视土壤生态功能,而微生物作为土壤物质循环与污染物降解的主要参与者,是土壤生态功能的重要指标[3-4]。土壤受到污染后,环境因子会有直接变化,从而间接影响土壤生态系统,导致土壤肥力下降,微生物多样性降低等现象[5]。受到土壤污染的影响,微生物群落的多样性和结构也会随之改变[6]。近年来,随着高通量测序技术的发展,国内外学者陆续对土壤微生物群落展开研究,如:研究表明土壤环境因子如有机质、重金属等对土壤微生物多样性和群落组成影响较大[7];选取有机碳、全氮、酶活、微生物数量作为生态肥力评价指标,发现有机物料能提高土壤酶活和微生物数量,从而提高土壤质量[8];土壤中的微生物可以通过一系列生长代谢来降解有机污染物或转化重金属,以此来改善土壤环境,提高土壤质量[9-10]。综上,对于土壤微生物群落的研究已有一定基础,但对于减量化修复地块的物生物群落组成和结构的研究鲜有报道。
本论文选取崇明区向化镇某钢厂的减量化地块为研究对象,采用高通量测序技术研究减量化地块修复前后土壤微生物群落多样性和群落结构影响,探讨土壤减量化修复后理化性质的变化与微生物群落的相关性,旨在为减量化修复地块整治复垦和土壤健康管理提供理论依据和数据支持。
1 材料与方法
1.1 研究区概况及采样点选取
研究区位于上海市崇明区向化镇,位于崇明岛东部,地势平坦,地处亚热带,年平均气温大约为15.1 ℃,年平均降雨量约1020 mm,气候温和湿润,日照充足,四季分明,全镇总面积53.78 km2,耕地面积4.12 万亩(约27.47 km2)。向化镇南北紧邻长江,属岛屿水网地区,水源丰富。本研究选取崇明向化镇某钢厂减量化地块进行土壤监测样点布设,均匀选取三个监测点:一个位于典型污染区(CM1)监测点,两个普通污染区(CM2、CM3)监测点,并选取距离污染修复区500 m 以外的自然林地土壤作为对照点(CK),具体见图1。

图1 土壤采样点位图Fig.1 Soil sampling point map
1.2 采样方法与指标检测
(1)采样方法
2021 年7 月,选取典型污染区监测点(CM1)和两个普通污染区(CM2、CM3)监测点,污染修复区500 m以外的自然林地土壤作为对照点(CK),每个监测点区域采取三个土壤样本,每个样本用五点取样法采取0~20 cm 耕作层土壤放入盆中混合,去除表层杂物、石块等装入无菌密封袋中,于4 ℃低温保存,及时送至实验室进行土壤理化性质、酶活及微生物检测。
(2)指标检测
除常规指标SOM、水溶性盐总量、TN、AP、AK 指标外,考虑到该地块减量化修复后会进行后续整理复垦工作,选取Fe、锰(Mn)、锌(Zn)三个重金属指标来反映该钢厂减量化后对照区和污染区土壤重金属含量变化,选取脲酶(UE)、蔗糖酶(SC)、过氧化氢酶(CAT)、中性磷酸酶(NP)来表征土壤质量变化,以便于研究土壤减量化修复后理化性质的变化与微生物群落的相关性。
土壤理化指标:SOM、水溶性盐总量、TN、AP、AK、Fe、Mn、Zn,SOM 测定方法采用重铬酸钾氧化法;TN 测定方法采用半微量凯氏法;AP 测定方法采用钼锑抗比色法;水溶性盐总量测定方法采用重量法;AK 采用火焰光度法测定;Fe、Mn、Zn 测定方法为电感耦合等离子体发射光谱法。
土壤酶活指标:选取UE、SC、CAT、NP 四种酶,测定方法参照《土壤酶及其研究法》[11]。
土壤微生物指标:首先用DNA 试剂盒对土壤样品中微生物DNA 进行提取,再使用NanoDrop ND-1000分光光度计测定提取的DNA 浓度和质量,使用微生物16SrRNA 基因V3~V4 区的引物进行PCR 扩增,通过QIIME 平台进行分析,将序列拼接后进行质控、冗余分析和测序,操作分类单元(OTU)抽平后分析使用[12-13]。
1.3 数据处理方法
原始数据处理采用EXCEL2020 计算分析,理化性质和酶活的标准差及显著性差异计算用SPSS 软件分析完成,用R 软件进行主成分分析和差异分析。
2 结果与讨论
2.1 减量化修复对土壤理化性质的影响
崇明减量化修复地块与对照地块土壤理化性质如表1所示,CK 组的土壤SOM 含量显著高于CM1 组、CM2 组、CM3 组(P<0.05),分别高出2.08 倍、2.99 倍、1.51 倍;CK 组土壤TN 含量显著高于CM1 组、CM2 组(P<0.05),分别高出2.86 倍、1.74 倍;CK 组土壤AP 含量显著高于CM1 组、CM2 组、CM3 组(P<0.05),分别高出17.14 倍、14.80 倍、9.05 倍;CM1 组土壤中的含盐量显著高于其他点位(P<0.05),高达8.33g/kg,分别是CK 组、CM2 组、CM3 组的22.51、20.83、19.37 倍。该修复场地之前为冷轧钢厂,金属类物质含量较多,而金属类物质对土壤微生物、土壤中根际养分的转化吸收、植物作物具有多重影响,可直接或间接影响土壤的生态环境[14]。CM1 组的土壤Fe 含量显著高于CK 组和CM3(P<0.05),分别高出1.13倍和1.10倍,Mn和Zn无显著性差异(P>0.05),但CK 组Zn 含量高于CM1 组、CM2 组、CM3 组,说明典型污染区土壤重金属含量较高,但减量化修复也有一定成效。整体来看,CK 组土壤SOM、TN、AP 含量高,间接体现出未被污染地块土壤肥力保持能力较高。

表1 不同地块土壤理化性质Table 1 Soil physicochemical properties of different plots
2.2 减量化修复对土壤酶活性的影响
土壤酶活是土壤生态系统的重要组成部分,是土壤生态健康和质量的重要生物指标[15],UE 在土壤中广泛存在,土壤氮循环密切相关[16-17];SC 和CAT 与土壤SOM 与微生物活性相关,可以表征土壤肥力与土壤质量[18],磷酸酶可以促进土壤中磷素循环,也可以间接反映土壤生态健康[19]。崇明减量化修复地块与对照地块土壤酶活性如表2 所示,CK 组UE 活性高达742.12 μg/d/g,显著高于CM1、CM2、CM3三组2.43倍、2.17倍、1.98倍(P<0.05),污染修复区不同点位之间(CM1 组和CM3 组)也呈现显著性差异(P<0.05);CK 组SC 活性高达33.25 mg/d/g,显著高于CM1、CM2、CM3 三组16.79 倍、7.15 倍、3.03 倍,研究表明,SC 活性越高,土壤质量越高[20],说明对照组土壤质量好于污染修复地块;CK 组NP 显著高于CM1、CM2、CM3 三组13.07 倍、9.63 倍、5.55 倍,土壤CAT活性四组无显著性差异(P>0.05)。整体来看,未被污染地块酶活性较强,污染修复地块经修复后酶活性仍较低。有研究表明土壤酶活性受到土壤环境的影响较大[21-22]。
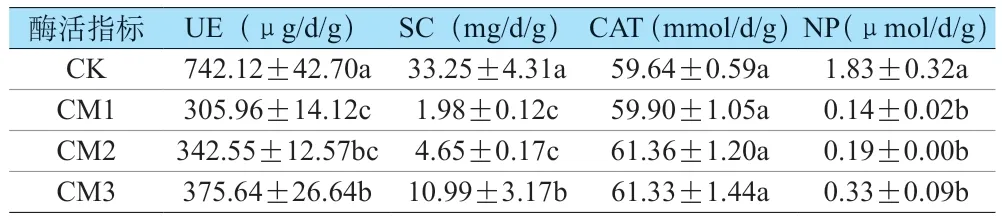
表2 不同地块土壤酶活性Table 2 Soil enzyme activities of different plots
2.3 减量化修复对土壤微生物多样性和群落的影响
(1)土壤微生物多样性分析
崇明减量化修复地块与对照地块土壤微生物多样性可以通过多样性指数表示,来反映土壤生态系统的稳定性,Shannon 指数表示微生物群落多样性,Ace 指数表示微生物群落丰富度,Coverage 指数表示微生物群落覆盖度。如表3 所示,CM1 组的Shannon 指数和Ace 指数均显著低于其他三组(P<0.05),CM1 组Shannon 指数显著低于CK 组、CM2 组、CM3 组7.95%、9.54%、4.61%,CM1 组Ace 指数显著低于CK 组、CM2 组、CM3 组9.70%、33.68%、22.70%,说明该地块微生物多样性和丰富度最差。结合土壤理化性质和酶活性来看,CM1 酶活性较低,土壤质量较差,说明污染物浓度高的地块会抑制土壤酶活性,从而抑制微生物的生长代谢[23]。Coverage 指数均在95%以上,表明样本测序深度合理,满足后续数据分析需求。
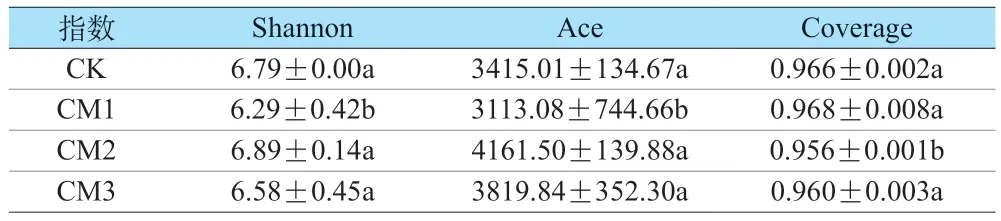
表3 不同地块土壤微生物多样性指数Table 3 Soil microbial diversity index of different plots
(2)土壤微生物群落PCoA 分析
选用主成分分析法来估算各样本点序列间的距离,以此来分析污染修复点位和对照点微生物群落结构的差异。如图2 所示,两个主坐标的解释度分别为50.87%和26.99%,横轴解释度较高。CK 组和CM1 组分布在PC1轴的正负两侧,且与CM2 组,CM3 组未交集,说明CK 组、CM1 组与CM2 组、CM3 组群落结构差异较大,CM2 组和CM3 组样本点有重合,说明微生物群落结构较为相似。整体来看,对照组与污染修复区点位差异明显,可能是由于土壤污染物浓度不同对微生物群落结构有所影响。土壤污染会一定程度上改变土壤结构与性质,会影响土壤中营养物质的分布[24],修复后的土壤微生物生活环境发生变化,但减量化对土壤的修复程度是有限的。
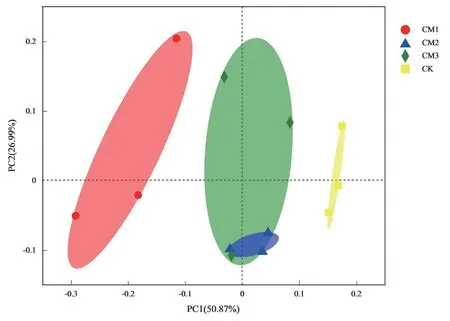
图2 不同点位土壤微生物群落PCoA 图Fig.2 PCoA map of soil microbial community at different sites
(3)土壤微生物群落结构组成分析
将OTU 进行物种分类学注释后,共检测到50 个门,不同点位土壤微生物的门水平相对丰度如图3 所示,丰度最高的菌门为绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)和厚壁菌门(Firmicutes)等,分别土壤细菌的16.62%~28.21%、15.50%~21.94%、10.10%~19.66%、6.51%~19.33%和4.12%~8.41%。蓝细菌门(Cyanobacteria)在CM1 中占比高达15.81%,但在对照组仅占0.40%,说明污染修复后可能有利于个别菌群相对丰度增加。污染修复地块绿弯菌门(Chloroflexi)高于对照地块,随着污染程度加深,酸杆菌门(Acidobacteriota)的相对丰度逐渐降低,与有关研究结果[25]一致。
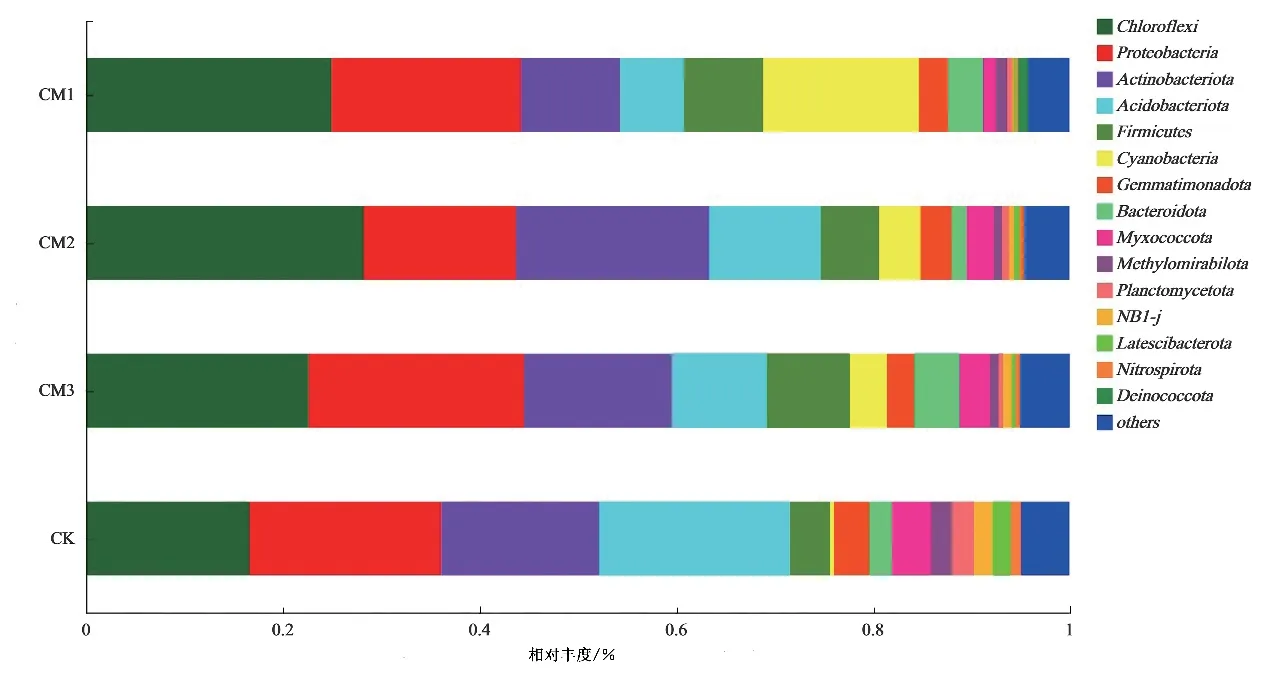
图3 不同点位土壤中微生物的相对丰度(门水平)Fig.3 Relative abundance of microorganisms at phylum level in different soil samples
共检测到1057 个属,不同点位土壤微生物的属水平相对丰度如图4 所示,CM1 优势菌属为norank_f_A4b、Microcoleus_Es-Yyy1400、Bacillus、unclassified_o__Cyanobacteriales等,分别占细菌总数的7.17%、4.52%、3.40%、2.78%;CM2 优 势 菌 属 为norank_f__norank_o__norank_c__KD4-96、norank_f_A4b、Gaiella、norank_f__norank_o__Chloroplast等,分别占细菌总数的4.82%、3.35%、3.05%、2.90%;CM3 优 势 菌 属 为norank_f__norank_o__SBR1031、Bacillus、Enterobacter、norank_f__norank_o__Chloroplast等,分别占细菌总数的4.02%、3.43%、3.42%、2.68%;CM4 优势菌属为norank_f__Vicinamibacteraceae、norank_f__norank_o__Vicinamibacterales、norank_f__norank_o__norank_c__KD4-96、norank_f__Gemmatimonadaceae等,分别占细菌总数的6.65%、4.89%、3.42%、2.75%。

图4 不同点位土壤中微生物的相对丰度(属水平)Fig.4 Relative abundance of microorganisms at genes level in different soil samples
(4)环境因子对微生物群落结构的影响
本研究采用12 种环境因子来分析环境因子对微生物群落结构的影响如图5 所示,主要影响微生物群落结构的环境因子为水溶性盐总量、Fe、AK、AP、SC等。水溶性盐总量对蓝细菌门(Cyanobacteria)、绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)有正相关作用,与放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)有负相关作用;SOM、NP 与变形菌门(Proteobacteria)、放 线 菌 门(Actinobacteriota)和酸杆菌门(Acidobacteriota)有正相关作用,与绿弯菌门(Chloroflexi)和蓝细菌门(Cyanobacteria)有负相关作用;AK、Fe、Mn 与变形菌门(Proteobacteria)、和蓝细菌门(Cyanobacteria)有正相关作用,与绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)有负相关作用。

图5 环境因子与微生物门水平相关性RDA 图Fig.5 RDA diagram of correlation between environmental factors and microorganisms in phylum level
细菌作为土壤中最为丰富的微生物,对保持土壤生态健康至关重要。冯慧琳等[15]研究表明,土壤酶的产生主要来源于植物根系和土壤微生物,且土壤酶的主要来源之一是土壤微生物中的细菌,可以看出土壤酶与微生物存在密切关联。本研究发现,放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)的相对丰度与土壤酶存在正相关关系,蓝细菌门(Cyanobacteria)与土壤酶存在负相关关系,说明不同门类细菌的作用方式有差异性。且污染修复土壤与对照组土壤污染物浓度不同,理化性质也会有所不同,进而影响土壤微生物群落结构[26]。
土壤环境因子与微生物群落相关性分析如图6 所示,Heatmap 图显示了环境因子对研究区域土壤微生物的影响程度。酸杆菌门(Acidobacteriota)、Latescibacterota、Myxococcota、NB1-j 与AP、UE、SC 和NP 呈显著正相关(P<0.05),浮霉菌门(Planctomycetota)、酸杆菌 门(Acidobacteriota)和Latescibacterota 与 水 溶 性 盐总量、Fe 和Mn 呈显著负相关(P<0.05),蓝细菌门(Cyanobacteria)与TN、AP、UE、SC 和NP 呈显著负相关(P<0.05),与水溶性盐总量呈显著正相关(P<0.05),拟杆菌门(Bacteroidota)与Fe 和AK 呈显著正相关(P<0.05),放线菌门(Actinobacteriota)与AK 呈显著负相关(P<0.05)。相关研究表明重金属与细菌多样性具有一定的相关性[27],与本研究研究结果一致。
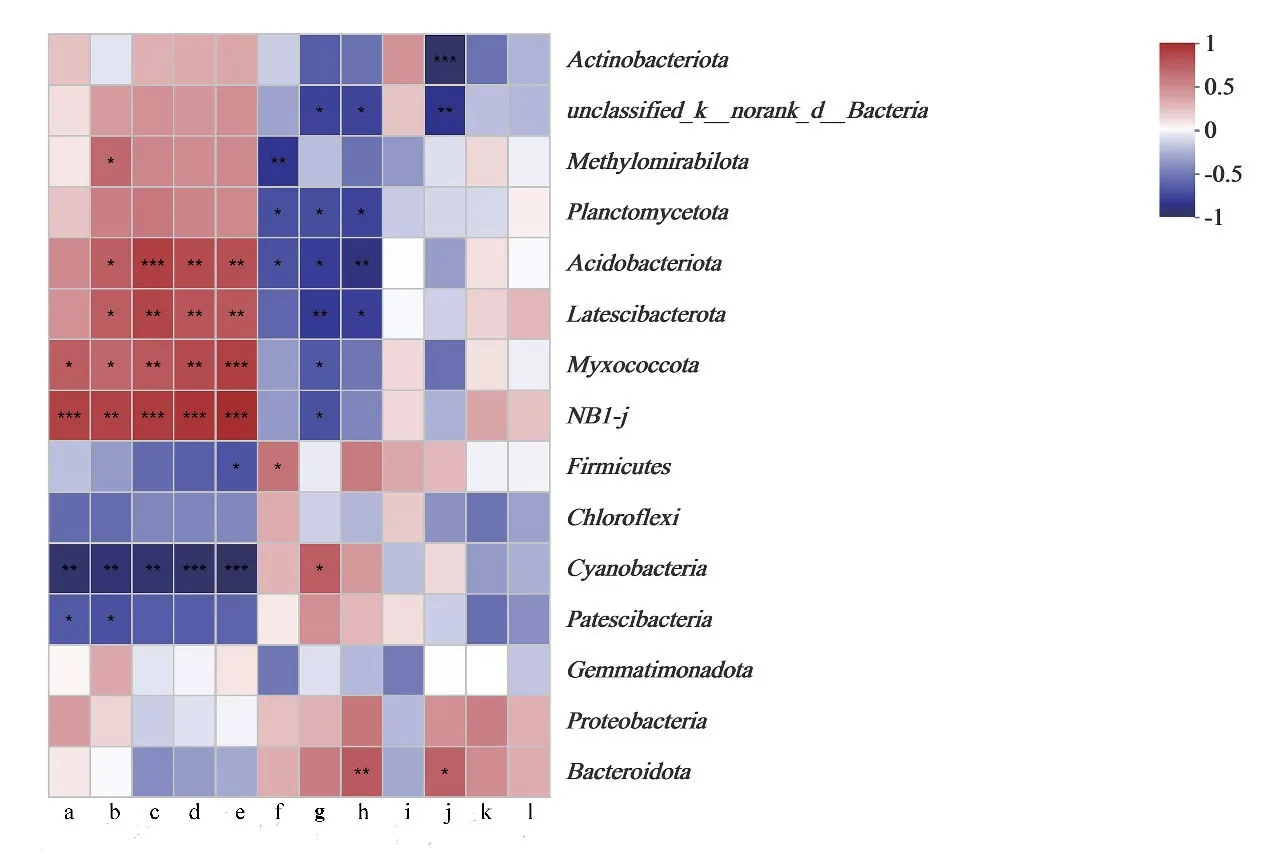
图6 环境因子与微生物门水平相关性Heatmap 图Fig.6 Heatmap diagram of correlation between environmental factors and microorganism in phylum level
AP、UE、SC、NP、水溶性盐总量和Fe 与土壤微生物群落存在较强的相关性,表明环境因子的改变影响某些微生物的生长,进而影响微生物多样性和群落结构,而微生物群落结构的改变也会反过来作用于土壤环境因子,二者具有一定的关联性。
3 结论
本研究选取崇明某减量化修复地块采集土壤样品,采用Illumina Miseq 高通量测序技术,分析土壤理化性质与酶活性对污染修复地块微生物群落组成的影响,主要结论如下:
(1)CK 组SOM、TN 和AP 含量显著高于污染区(CM1组、CM2 组、CM3 组)(P<0.05),CM1 组重金属含量较高,说明未被污染地块土壤肥力保持能力较高。CK组UE、SC、NP 均显著高于CM1 组、CM2 组、CM3 组(P<0.05),说明未被污染地块酶活较强,土壤酶活性受环境因子影响较大。
(2)CM1 组的Shannon 指数和Ace 指数均显著低于其他三组(P<0.05),说明该地块微生物多样性和丰富度最差,污染物浓度高的地块会抑制土壤酶活性,从而抑制微生物的生长代谢。
(3)丰度最高的菌门为绿弯菌门(Chloroflexi),占比为16.62%~28.21%,CK 组与CM1 组土壤微生物群落结构差异较大,说明环境因子会影响微生物群落结构,且放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)的相对丰度与土壤酶活存在正相关关系,蓝细菌门(Cyanobacteria)与土壤酶存在负相关关系,说明不同门类细菌的作用方式也具有差异性,土壤理化性质与微生物群落结构具有一定的关联性。主要影响微生物群落结构的环境因子为水溶性盐总量、Fe、AK、AP、SC 等。减量化修复对改善土壤理化性质、酶活性及物生物群落有一定的影响,在提升土壤生态环境质量有重要意义,但对于后续复垦及农业种植需要设计更加完备的实验进行研究。

