HILIC模式下UPLC-MS/MS测定多个注射剂中依地酸二钠含量
刘晓强,刘 毅,蒋晓勤*
(1.常州市食品药品纤维质量监督检验中心,江苏 常州 213102;2.中国食品药品检定研究院,北京 102600)
乙二胺四乙酸二钠(也称依地酸二钠,EDTA-2Na)是一种常用的注射剂稳定剂,其与微量的金属离子可形成稳定的螯合物,避免了金属离子对药物自身氧化的催化作用,有利于提高药物在制备、存储和临床配制过程中的稳定性[1-3]。EDTA-2Na被列为GRAS安全物质,收载于美国FDA《非活性组分指南》,英国也被许可用于非注射和注射给药制剂。在药物制剂中EDTA-2Na被用作螯合剂的一般浓度为 0.005 %~0.1 %(w/v)。但必须指出如果人体大量摄入EDTA-2Na,它会与血液及骨骼中的钙形成水溶性螯合物,被排出体外,引起低血钙症或骨钙流失[4-6],因此,需严格控制注射剂中EDTA-2Na用量。同时,基于一致性评价的要求,仿制药处方中各成分来源及含量均需与参比制剂一致。因此,探索一种能评估各品种制剂中依地酸二钠含量的方法既能满足一致性评价的实际需要,同时也能用于评估各制剂临床用药风险。
1 仪器与试药
1.1 仪器
LCMS-8060型高效液相色谱-质谱联用仪(含岛津LC-30A高效液相色谱仪、电喷雾离子化接口、三重四极杆质谱检测器、色谱工作站,日本岛津);XP205电子天平(瑞士Mettler Toledo);TG16-WS台式高速离心机(湖南湘仪);Milli-Q纯水机(德国Merck)。
1.2 试药
维生素C 注射液(生产企业A,批号:21060213,规格:2 ml:0.5 g);盐酸多巴胺注射液(生产企业B,批号:2101131,规格:2 ml:20 mg);注射用奥美拉唑钠(生产企业C,批号:B2106181,规格:40 mg);注射用艾司奥美拉唑钠(生产企业D,批号:20210308,规格:40 mg);注射用泮托拉唑钠(生产企业E,批号:51200801,规格:2 ml:0.5 g)。乙腈(质谱级,霍尼韦尔国际公司);乙酸铵(国药集团);依地酸二钠(美国Sigma);冰醋酸(上海泰坦);硫酸铜(上海泰坦);实验用水(实验室自制)。
2 方法与结果
2.1 色谱条件
采用安捷伦InfinityLab Poroshell 120 HILIC-Z(3.0 mm×100 mm,2.7 μm),流速为1.0 ml/min,流动相A:20 mmol/L乙酸铵溶液(用冰醋酸调节pH值至3.0),流动相B:乙腈,按表1进行梯度洗脱;柱温35 ℃,进样量10 μl。
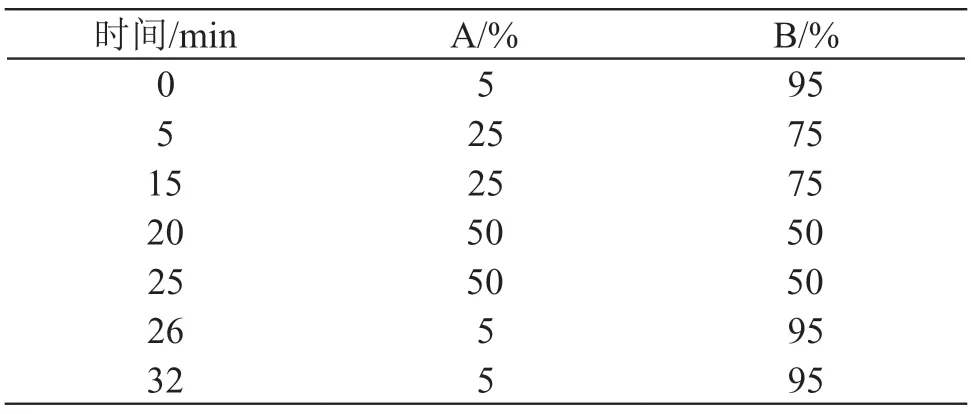
表1 梯度洗脱程序
2.2 质谱条件
电喷雾电离(ESI)源,多反应监测(MRM)模式,负离子模式,雾化气流量:3 L/min,加热气流量:10 L/min,接口温度:300 ℃,脱溶剂温度:526 ℃,曲型脱溶剂管(CDL)温度:250 ℃,加热块温度:400 ℃,干燥气流量:10 L/min。定量离子及定性离子参数详见表2。
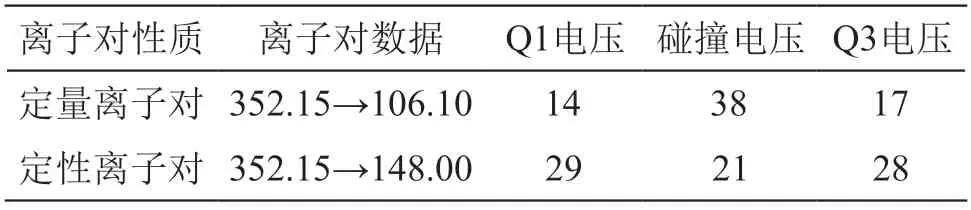
表2 定量离子及定性离子参数
2.3 溶液配制
2.3.1 对照品储备溶液的制备 取EDTA-2Na对照品约0.1 g,精密称定,置100 ml量瓶中,加水适量使溶解并稀释至刻度,摇匀即得(1 mg/ml)。精密量取溶液2 ml,置200 ml量瓶中,精密加入0.04 mol/L硫酸铜溶液4 ml,加水适量使溶解并稀释至刻度,摇匀,静置30 min,即得10 μg/ml EDTA-2Na溶液。
2.3.2 供试品溶液的配制
2.3.2.1 盐酸多巴胺注射液供试品溶液的制备方法精密量取样品6 ml,置10 ml量瓶中,精密加入0.04 mol/L硫酸铜溶液0.2 ml,加水稀释至刻度,摇匀,静置30 min。精密量取上述溶液2 ml,置200 ml量瓶中,加水稀释至刻度,摇匀即得,平行制备两份。
2.3.2.2 维生素C注射液供试品溶液的制备 精密量取样品1 ml,置100 ml量瓶中,精密加入0.04 mol/L硫酸铜溶液2 ml,加水稀释至刻度,摇匀,静置30 min,即得。
2.3.2.3 注射用奥美拉唑钠、注射用艾司奥美拉唑钠、注射用泮托拉唑钠供试品溶液的制备 取样品1瓶量,精密称定,置50 ml量瓶中,加水适量使溶解,精密加入0.04 mol/L硫酸铜溶液1 ml,加水稀释至刻度,摇匀,静置30 min。取上述溶液离心,精密量取上清2 ml,置200 ml量瓶中,加水稀释至刻度,摇匀即得。
2.3.3 标准曲线溶液的制备 依次精密量取对照品储备液2,3,5,5,5 ml,分别置200,100,100,50,25 ml量瓶中,加水稀释至刻度,摇匀即得浓度依次为0.1,0.3,0.5,1,2 μg/ml的标准曲线溶液。
2.4 专属性
取水、0.004 mol/L硫酸铜溶液、0.5 μg/ml标准曲线溶液、注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液、注射用泮托拉唑钠供试品溶液、盐酸多巴胺注射液供试品溶液、维生素C注射液样品溶液各10 μl,依次进样,色谱图见图1。水、0.004 mol/L硫酸铜溶液在EDTA-Cu处均未出峰,不干扰检测。0.5 μg/ml标准曲线溶液、注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液、注射用泮托拉唑钠供试品溶液、盐酸多巴胺注射液供试品溶液、维生素C注射液供试品溶液EDTA-Cu峰形良好,注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液、注射用泮托拉唑钠供试品溶液、盐酸多巴胺注射液供试品溶液、维生素C注射液供试品溶液EDTA-Cu定量离子峰与定性离子峰峰面积比例(100:75)与对照品溶液基本一致。
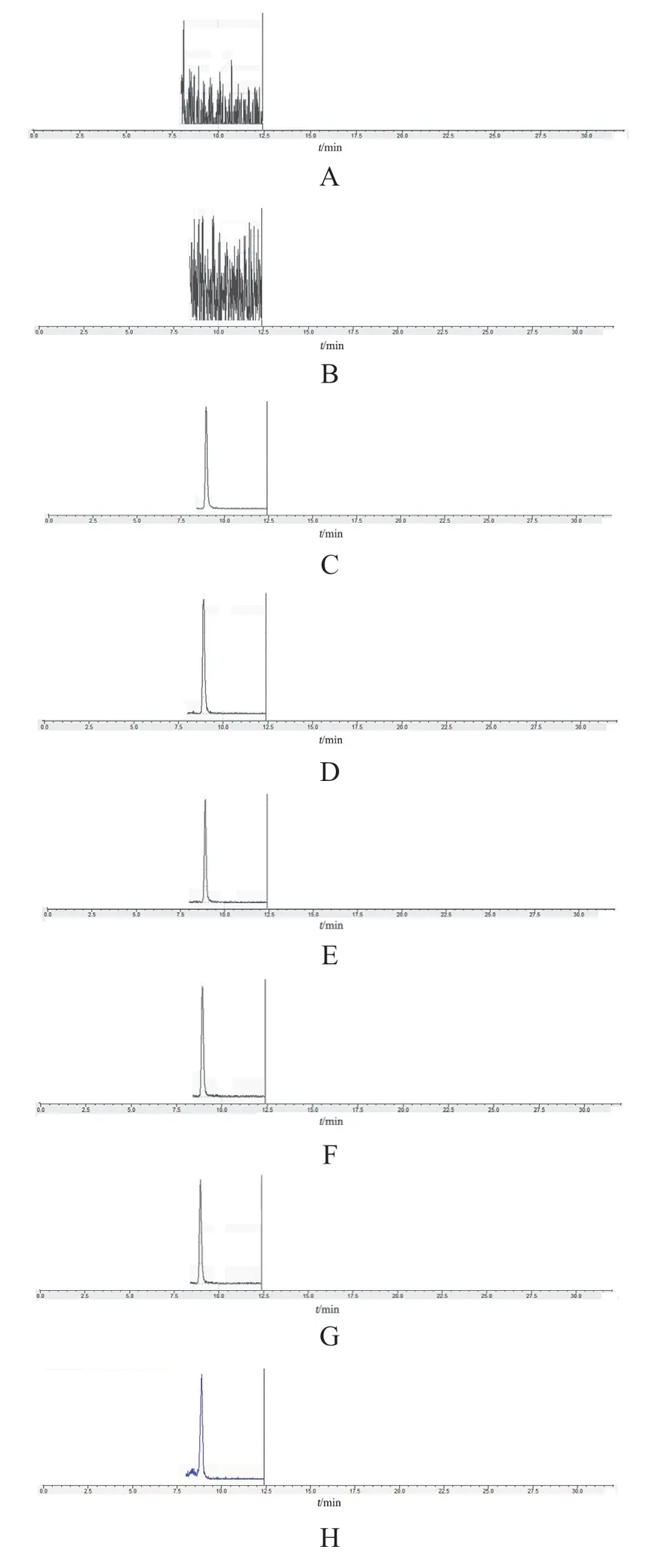
图1 专属性试验色谱图
2.5 线性
标准曲线溶液依次进样分析,以峰面积(A)为纵坐标,以浓度(C)为横坐标作图,回归方程:A=106 337C-2305.82,r=0.999 98,EDTA-Cu在0.1~2 μg/ml范围内线性关系良好。
2.6 精密度
取注射用泮托拉唑钠约1瓶量,精密称定,置50 ml量瓶中,加水适量使溶解,精密加入0.04 mol/L CuSO4溶液1 ml,加水稀释至刻度,摇匀,静置30 min。取上述溶液离心,精密量取上清2 ml,置200 ml量瓶中,加水稀释至刻度,摇匀即得。平行制备6份样品,依次进样,取峰面积代入标准曲线中计算依地酸二钠含量。
2.6.1 重复性 6份泮托拉唑钠供试品溶液依地酸二钠含量依次为0.205,0.202,0.206,0.210,0.208,0.201 μg/ml,均值为0.205 μg/ml,RSD为1.54 %,表明方法重复性良好。
2.6.2 中间精密度 分别由3人分3 d采用3台不同的仪器分别测定6份注射用泮托拉唑钠供试品溶液,仪器分别为岛津LC-MS/MS-8060,AB LC-LCMS/MS-4500+和岛津LC-MS/MS-8050,3个批次数据依次为:0.205,0.202,0.206,0.210,0.208,0.201 mg/L;0.203,0.206,0.206,0.204,0.196,0.206 mg/L;0.201,0.205,0.199,0.207,0.202,0.200 μg/ml;均值为0.204 μg/ml,RSD为1.68 %,表明方法中间精密度良好。
2.7 检测限与定量限
2.7.1 检测限 精密量取0.1 μg/ml标准曲线溶液5 ml,置50 ml量瓶中,加水稀释至刻度,摇匀即得(0.01 μg/ml),取上述溶液进样,色谱图见图2,S/N为5,检测限为0.01 μg/ml。

图2 检测限溶液色谱图
2.7.2 定量限 精密量取0.1 mg/L标准曲线溶液3 ml,置10 ml量瓶中,加水稀释至刻度,摇匀即得(0.03 mg/L),取上述溶液进样,色谱图见图3,S/N为16,定量限为0.03 μg/ml。
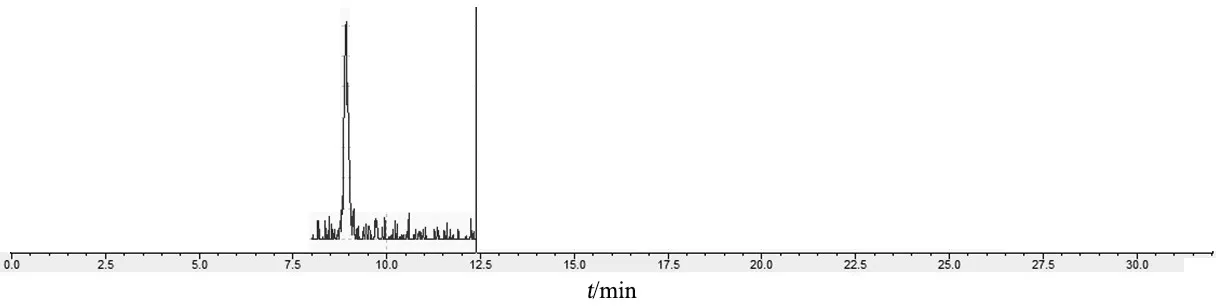
图3 定量限溶液色谱图
2.8 加样回收试验
2.8.1 溶液制备
2.8.1.1 EDTA-2Na对照品储备溶液A(实际浓度:3.15 mg/ml)的制备 取EDTA-2Na对照品约0.3 g,精密称定,置100 ml量瓶中,加水适量使溶解并稀释至刻度,摇匀即得。
2.8.1.2 EDTA-2Na对照品溶液A(实际浓度:315 μg/ml)的制备 精密量取EDTA-2Na对照品储备溶液A 5 ml,置50 ml量瓶中,加水稀释至刻度,摇匀即得。
2.8.1.3 EDTA-2Na对照品储备溶液B(实际浓度:2.08 mg/ml)的制备 取EDTA-2Na对照品约0.2 g,精密称定,置100 ml量瓶中,加水适量使溶解并稀释至刻度,摇匀即得。
2.8.1.4 EDTA-2Na对照品溶液B(实际浓度:208 μg/ml)的制备 精密量取EDTA-2Na对照品储备溶液B 5 ml,置50 ml量瓶中,加水稀释至刻度,摇匀即得。
2.8.2 盐酸多巴胺注射液加样回收率测定 依次精密量取盐酸多巴胺注射液样品3 ml,分别置10 ml量瓶中,依次精密加入EDTA-2Na对照品溶液A 400,500,600 μl,精密加入0.04 mol/L CuSO4溶液0.2 ml,加水稀释至刻度,摇匀,静置30 min。精密量取上述溶液2 ml,置200 ml量瓶中,加水稀释至刻度,摇匀即得。每个浓度平行制备3份。按2.1及2.2项下条件测定。
2.8.3 维生素C注射液加样回收率测定 依次精密量取维生素C注射液样品1 ml,分别置200 ml量瓶中,依次精密加入EDTA-2Na对照品溶液B 400,500,600 μl,加水适量,精密加入0.04 mol/L硫酸铜溶液4 ml,加水稀释至刻度,摇匀,静置30 min,即得。每个浓度平行制备3份。按2.1及2.2项下条件测定。
2.8.4 注射用奥美拉唑钠、注射用艾司奥美拉唑钠、注射用泮托拉唑钠加样回收率测定 依次取样品1瓶量,分别精密称定,置100 ml量瓶中,依次精密加入EDTA-2Na对照品储备溶液A 400,500,600 μl,加水适量使溶解,精密加入0.04 mol/L硫酸铜溶液2 ml,加水稀释至刻度,摇匀,静置30 min。取上述溶液离心,精密量取上清2 ml,置200 ml量瓶中,加水稀释至刻度,摇匀即得。每个浓度平行制备3份。按2.1及2.2项下条件测定。
结果见表3。由表3可见,盐酸多巴胺注射液低、中、高浓度的加样回收率均在97 %左右,且平行性良好;维生素C注射液低、中、高浓度的加样回收率均在94 %左右,且平行性良好;注射用奥美拉唑钠、注射用艾司奥美拉唑钠、注射用泮托拉唑钠低、中、高浓度的加样回收率均在99 %左右,且平行性良好。
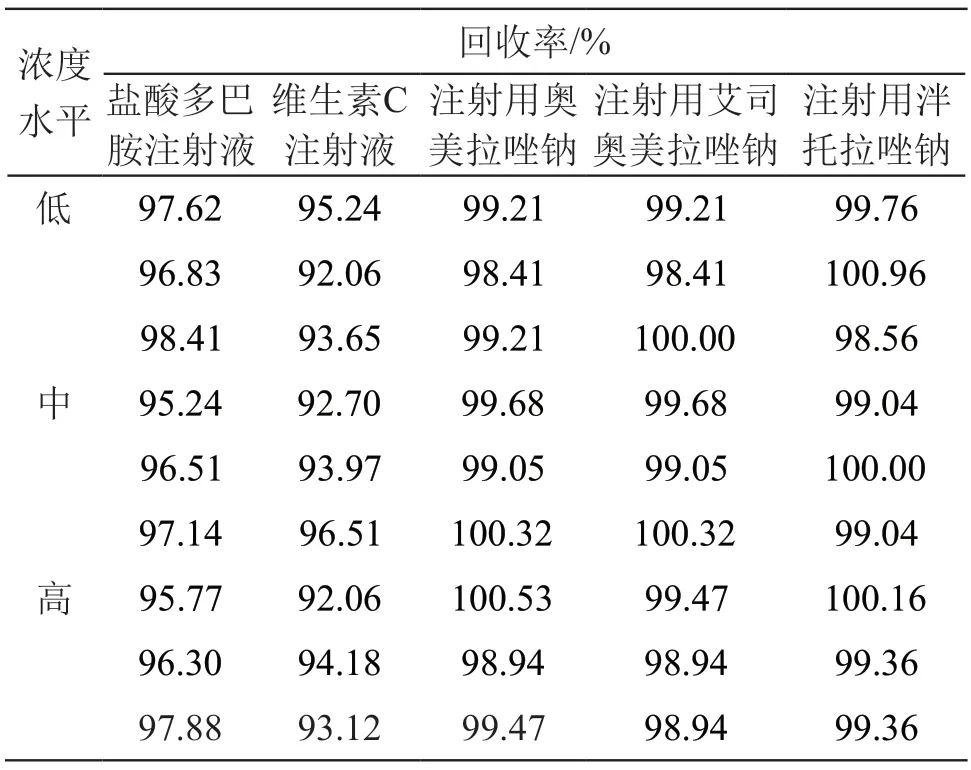
表3 加样回收试验结果
2.9 耐用性
2.9.1 柱温耐用性 分别设置柱温为30 ℃及40 ℃,其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,保留时间无明显变化,表明该方法柱温耐用性良好。
2.9.2 流速耐用性 分别设置流速分别为0.8 ml/min及1.2 ml/min,其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,表明该方法流速耐用性良好。
2.9.3 色谱柱耐用性 改用岛津Shim-pack GIS HILIC(4.6 mm100 mm,5 μm),其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,表明该方法柱温耐用性良好。
2.9.4 仪器耐用性 分别采用AB LC-MS/MS-4500+及岛津LC-MS/MS-8050检测,其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,表明该方法仪器耐用性良好。
2.9.5 梯度耐用 分别按表4、表5梯度洗脱程序,其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,表明该方法梯度耐用性良好。

表4 梯度洗脱程序1

表5 梯度洗脱程序2
2.9.6 流动相pH耐用性 分别将流动相A pH调至2.5及3.5,其他色谱及质谱条件不变,依次取0.5 μg/ml标准曲线溶液进样测定。结果显示,依地酸二钠峰峰形良好,表明该方法流动相pH耐用性良好。
2.10 膜过滤试验
依次取0.5 μg/ml标准曲线溶液、盐酸多巴胺注射液供试品溶液、维生素C注射液供试品溶液、注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液、注射用泮托拉唑钠供试品溶液适量,采用0.22 μm滤头过滤,分别将初滤液及弃去1,3,5,7,9 ml后的续滤液依次进样。结果表明,依地酸二钠标准曲线溶液、盐酸多巴胺注射液供试品溶液、维生素C注射液供试品溶液、注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液和注射用泮托拉唑钠供试品溶液中依地酸二钠均无膜吸附作用,但仍建议实验时如需过滤,弃去2~3 ml初滤液。
2.11 稳定性考察
2.11.1 依地酸二钠对照品溶液稳定性考察 分别于4,8,12,2,3,48,60,72,84,96 h,取0.5 μg/ml标准曲线溶液进样测定,峰面积无明显差异(RSD为0.77 %),表明依地酸二钠对照品溶液96 h内稳定。
2.11.2 供试品溶液依地酸二钠稳定性考察 分别于4,8,12,24,36,48 h,取盐酸多巴胺注射液供试品溶液、维生素C注射液供试品溶液、注射用奥美拉唑钠供试品溶液、注射用艾司奥美拉唑钠供试品溶液、注射用泮托拉唑钠供试品溶液进样测定,各溶液中待测物峰面积无明显差异(RSD依次为0.66 %,0.92 %,0.60 %,0.42 %,0.49 %),表明各供试品溶液中依地酸二钠48 h内稳定。
2.12 样品测定
按2.3项下方法依次制备标准曲线溶液及供试品溶液,按2.1及2.2项下条件测定,取峰面积代入标准曲线中计算依地酸二钠含量。盐酸多巴胺注射液、维生素C注射液、注射用奥美拉唑钠、注射用艾斯奥美拉唑钠、注射用泮托拉唑钠中依地酸二钠含量分别约为48 μg/ml,140 μg/ml,1.5 mg/瓶,1.5 mg/瓶,1.0 mg/瓶。
3 讨论
3.1 螯合金属离子的选择
EDTA螯合金属离子稳定性排序为Mo6+>Bi3+>Fe3+>Cu2+>Zn2+>Fe2+>Mn2+>K+>Ca2+>Mg2+,其中较为常用的螯合金属离子为Fe3+、Cu2+[7-8],EDTA-2Na与Cu2+形成螯合物的稳定常数为1018.7,而与Fe3+可形成更为稳定的螯合物,稳定常数为1024.2[9]。为避免供试品溶液中可能存在的金属离子对检测结果的干扰,选择采用CuSO4溶液中的Cu2+作为络合离子与EDTA形成稳定的螯合物。未选择更稳定的Fe3+是因为虽然对照溶液出峰更好,但预实验结果表明维生素C注射液加样回收率较差且平行性较差,可能Fe3+与维生素C之间存在氧化还原反应有关。
3.2 分析方法的选择
预试验时采用DAD检测器进行分析,但维生素C注射液的规格分别为2 ml:0.5 g及5 ml:1 g,即维生素C的浓度为0.25 g/ml及0.2 g/ml,若直接进样或低倍数稀释(10倍以内)后进样,维生素C会出现显著的柱过载现象,基线上升导致EDTA-2Na峰积分不准确甚至被淹没而导致无法积分,因此采用UPLC-MS/MS+HILIC柱法进行确证及分析。同时需说明的是,对盐酸多巴胺注射液、注射用奥美拉唑钠、注射用泮托拉唑钠、注射用艾司奥美拉唑钠及部分EDTA-2Na浓度较高的维生素C注射液该方法也可使用DAD为检测器,用峰面积定量,采用全波长紫外吸收图谱进行辅助定性。
3.3 反应时间的选择
预试验时,对照品及供试品溶液加入CuSO4溶液并定容后均立即进样,标准曲线线性及供试品溶液平行性均有问题,怀疑反应需要时间并进行相关实验验证。研究发现,对照品及供试品溶液加入CuSO4溶液并定容后立即、静置5,10,20,30,40,50,60 min后依次测定,其中立即、静置5,10,20,30 min测定峰面积依次上升,静置30,40,50,60 min测定峰面积无明显变化,因此确定对照品及供试品溶液加入CuSO4溶液并定容后均需静置30 min后方可进样。
4 结论
该方法专属性、线性及范围、重复性、中间精密度、加样回收率、检测限与定量限、耐用性、对照品溶液及供试品溶液稳定性均较好,可以用于测定维生素C注射液、盐酸多巴胺注射液、注射用奥美拉唑钠、注射用艾司奥美拉唑钠、注射用泮托拉唑钠中EDTA-2Na含量。
——一个解释欧姆表刻度不均匀的好方法

