肾移植术后血管并发症的诊疗策略
张江伟 丁小明
自1954年约瑟夫·默里进行了第1 例成功的肾移植手术以来,肾移植是目前治疗终末期肾病最有效的方法,移植肾1年存活率达95%以上[1]。随着供受者评估标准、器官获取和保存、肾移植手术和血管吻合等技术的不断进步,肾移植术后血管并发症的发生率有所下降,为1.35%[2]。然而,肾移植术后血管并发症仍然是比较严重的手术并发症,可导致移植物丢失或受者死亡[3]。因此,本文就肾移植术后常见血管并发症的发生概况、临床表现、诊断、治疗策略和结果进行评述,旨在为此类患者的诊疗提供参考,降低血管并发症发生率,提高移植效果和受者生存率。
1 肾移植术后血管并发症的发生概况
21世纪被称为“器官移植的时代”,器官移植目前被认为是治疗终末期器官衰竭最有效的方法,其中肾移植是开展最早、数量最多、成功率最高的器官移植。肾移植术后常见的血管并发症主要包括血管狭窄、动脉夹层(髂内外动脉、移植肾动脉)、假性动脉瘤、破裂或血栓等[4]。Bessede 等[2]研究证实血管并发症的发生与移植物存活时间缩短相关,可导致1.66%的移植物丢失和0.16%的受者死亡。因此,肾移植术后血管并发症的早发现、早诊断和早治疗是非常重要的。数字减影血管造影(digital subtraction angiography,DSA)是诊断多种血管并发症的金标准,同时应与急性排斥反应、药物性肾损害、肾后性梗阻、BK 病毒性肾病等鉴别。但是移植肾功能较差的患者发生造影剂肾病的风险较高[5],虽然根据欧洲泌尿生殖放射学会(European Society of Urogenital Radiology,ESUR)造影剂安全委员会的研究证实,肾移植受者发生造影剂肾病的风险并不高于非移植患者[6],然而在临床实践中仍然认为肾损伤风险会随着造影剂剂量的增加而增加,尤其是在肾移植受者中必须重视这一点[7-9]。
笔者总结的肾移植术后血管并发症的病因如下:(1)受者因素,常见于高龄、糖尿病史、动脉粥样硬化和心脏病史、高血压病史、巨细胞病毒(cytomegalovirus,CMV)感染史、腹压突然升高、术侧血管外伤或手术史、高凝状态等;(2)供者因素,高龄供者、边缘供者、供者肾动脉病变、供者来源性感染(donor-derived infection,DDI)等;(3)移植相关因素,移植肾功能延迟恢复(delayed graft function,DGF)、供肾冷缺血时间>24 h、免疫诱导方案、排斥反应等;(4)手术相关因素,供肾获取过程中造成的动脉内膜损伤、血管吻合技术不良、术后瘢痕挛缩、移植肾放置不当、周围血肿机化后肾动脉受压、动脉过长成角或扭曲等[10-13]。
自2015年1月1日起,公民逝世后器官捐献成为除活体亲属器官捐献外的唯一器官来源[14]。然而,公民逝世后器官捐献时代边缘供肾、供者基础疾病导致血管病变、DDI、冷缺血时间延长、DGF 发生率增加等不利因素进一步增加了血管并发症发生的潜在风险[15-17]。因此全面系统地了解肾移植术后血管并发症的种类、病因、临床特征和治疗方法,有针对性预防,及时发现、明确诊断和精准治疗是救治成功的关键。
2 肾移植术后常见血管并发症的诊疗
2.1 动脉狭窄
移植肾动脉狭窄(transplant renal artery stenosis,TRAS)是肾移植术后最常见的血管并发症,多发生于术后3~6 个月,发生率为1%~23%[18]。TRAS 的临床表现为难治性或新发高血压,移植肾功能损害伴少尿和水肿,部分移植肾听诊时出现新发血管杂音[19]。鉴于导致TRAS 原因较多,治疗方案需精准化、个体化,若处理及时得当大部分移植肾功能3~5 d 可得到改善,研究表明,得到及时有效治疗的TRAS 患者长期生存率与无狭窄患者相似[20]。Lacombe[21]根据狭窄的位置对TRAS 进行分类,根据受累部位提出了不同的高危诱发因素,吻合口狭窄:(1)外科缝合技术不佳,过多使用止血药物;(2)受者血管动脉内膜切除后与髂内动脉端-端吻合;(3)供者和受者动脉之间存在较大尺寸差异(端-端吻合);(4)器官获取和灌注过程中内膜损伤。吻合口前狭窄:(1)受者动脉进行性动脉粥样硬化;(2)受者动脉钳夹损伤。吻合口后狭窄:(1)进行性动脉粥样硬化;(2)恢复性损伤;(3)供者肾动脉钳夹损伤;(4)急性排斥反应(不太明确)。不同狭窄出现临床症状的时间有所不同,早期吻合口狭窄通常是由外科吻合技术造成的,器官获取或低温机械灌注过程中内膜损伤也是另一个诱发因素[22]。吻合口近端或远端的狭窄通常出现相对较晚,这些部位动脉狭窄的最常见原因是进行性动脉粥样硬化,影响移植肾动脉或受者髂血管,而弥漫性狭窄可能是排斥反应引起血管炎的结果[23]。
对于尚未引起血流动力学及肾功能改变的TRAS,可予以保守治疗,注意控制血压及定期复查狭窄的进展情况。经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)是首选的治疗方法,成功率为85%~93%[24]。PTA 主要包括球囊导管扩张和血管内支架成形术,前者适用于轻度TRAS 或儿童肾移植受者,术后再狭窄率为13%~25%[20,25],后者被认为是更好的TRAS 治疗方法,但也有支架置入失败、肾动脉剥离、动脉撕裂等风险,发生率约为4%[26]。手术治疗适用于PTA 无法治疗的吻合口狭窄或严重远端动脉狭窄的患者,据报道手术成功率为63%~92%,其中12%的患者可能再次出现狭窄[27-28]。西安交通大学第一附属医院3 例不同类型移植肾动脉狭窄的治疗见图1。
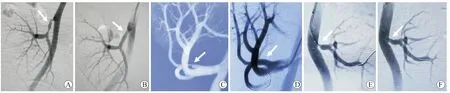
图1 不同类型移植肾动脉狭窄的治疗方式Figure 1 Treatment for different types of artery stenosis in renal allograft
2.2 髂外动脉夹层
髂外动脉夹层是一种发生率不高但不得不重视的严重血管并发症,发生率为0.3%[29],常发生在肾移植术中或术后数日至几个月内。髂外动脉夹层是在原发病、动脉粥样硬化、高血压、血管损伤、外科操作等基础上导致动脉壁内膜变性、动脉壁剪切力增加,导致内膜和中膜分离,血液进入[30-31]。一旦髂外动脉夹层被明确诊断或高度怀疑,尤其是围手术期的髂外动脉夹层,应立即处理,以减少动脉剥离的进一步进展,并保护移植肾和下肢的血供。目前肾移植术中髂外动脉夹层的主要治疗方法包括人工血管置换、介入治疗、供者动脉移植[32-34]。人工血管置换术适用于术中突发的、严重的髂外动脉夹层,能够快速、高效地解决夹层问题,但费用相对高昂。介入治疗多用于术后出现的髂外动脉夹层,创伤小、安全性较高,技术难点在于区分真假腔及进入真腔[35],主要缺点为造影剂肾毒性、动脉穿刺损伤等[36];供者动脉移植术适应证与人工血管置换术类似,组织相容性更好,但需获取器官时预留直径相同的血管或建有血管库的移植单位。本中心1 例肾移植术中髂外动脉夹层治疗见图2。
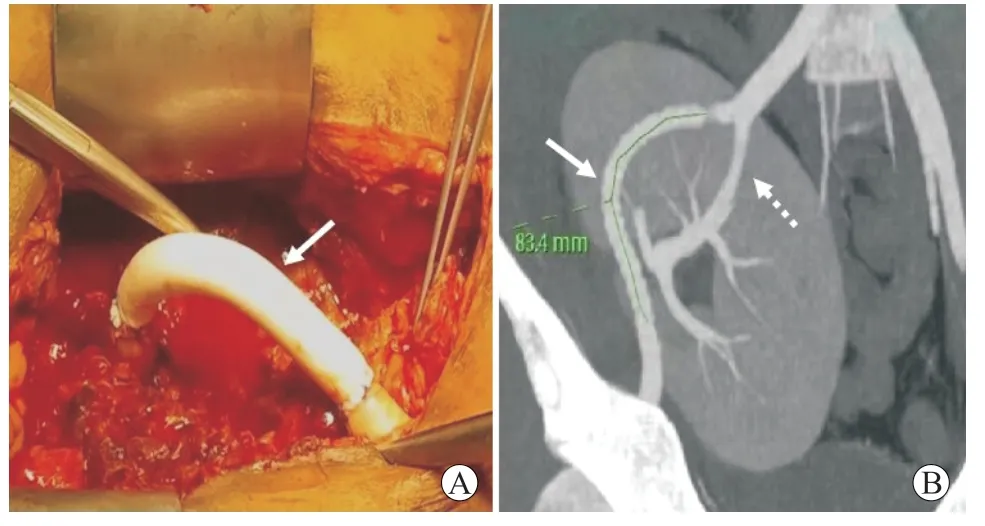
图2 肾移植术中髂外动脉夹层的治疗Figure 2 Treatment of external iliac artery dissection during kidney transplantation
2.3 血栓
肾血管血栓形成是一种极其严重的并发症,是术后早期移植肾丢失的主要原因,占1 个月内移植物丢失的1/3[37]。我国一项多中心研究纳入儿童肾移植704 例,其中83 例移植肾丢失,最主要原因为肾血管血栓形成(28 例,33.7%)[38]。
移植肾动脉血栓的发生率为0.3%~6.1%,主要发生在术后2 周内[39],通常是由外科操作、排斥反应、严重的肾动脉狭窄、儿童肾移植和高凝状态等引起[40]。移植肾动脉血栓最重要的体征是移植物灌注变差或消失而导致尿量骤减及肾功恶化,彩色多普勒超声检查是最初优选的无创检查。围手术期出现移植肾动脉血栓更多是由于外科技术问题造成,例如移植肾摆放不当或肾动脉过长、血管吻合不良、供肾多支动脉、供者肾动脉或受者髂动脉内膜不光滑、硬化斑块脱落、动脉夹损伤内膜、继发血栓形成,其它原因如高凝状态、急性排斥反应、血管周围侵袭性感染、其它部位血栓脱落等[21,41]。对于细小分支栓塞可予以观察,部分血栓形成可溶栓治疗。肾动脉主干栓塞应尽快手术探查,可切开血管取出血栓,用低温灌注液进行二次灌注冲洗,重新血管吻合,术后抗凝治疗,积极处理原发疾病及诱因;也可先切取移植肾,经低温工作台取出血栓、修复血管后重新再植。术后10~14 d 内不建议实施血管内介入取栓,出血风险较大[42]。肾动脉血栓导致移植肾功能难以恢复者,应予以切除肾脏。尽管有国内外均有报道介入治疗或溶栓成功的案例,但在大部分情况下,切除移植肾仍是难以避免的[42]。
移植肾静脉血栓是肾移植术后一种严重的早期血管并发症,发生率为0.5%~4.0%[43],临床症状包括疼痛、移植肾和同侧下肢肿胀以及低热等[22]。诊断通常采用彩色多普勒超声检查,显示无静脉血流和异常动脉信号,伴有平台样反向舒张血流以及移植物体积肿胀、增大[44]。一旦确诊为移植肾静脉血栓,几乎都需要进行手术探查,绝大多数最终会导致移植肾丢失。鉴于此类血管并发症导致移植物丢失率高,针对病因积极预防是最好的治疗选择,尤其是儿童肾移植受者,应该减少使用较小供肾、选较粗的血管进行吻合、避免血管受牵拉、谨防血管痉挛、适当抗凝、卧床1 周及纠正酸中毒等[38]。本中心肾动脉和静脉血栓的治疗见图3。
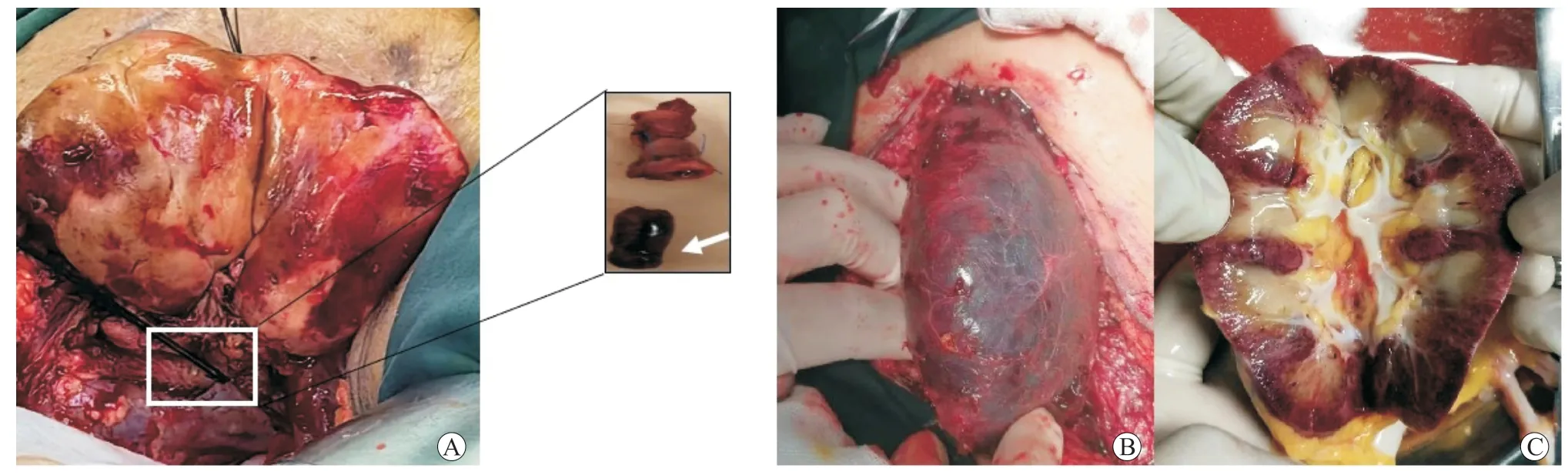
图3 移植肾动脉和静脉血栓的治疗Figure 3 Treatment of artery and vein thrombosis in renal allograft
2.4 血管破裂
由于手术因素导致的肾动脉或静脉破裂通常发生在术后2 周内,感染引起的血管破裂多见于术后2~4 周或更多,这往往导致移植物丢失甚至受者死亡[45-46]。肾动脉破裂进展迅速、危及生命,一旦诊断出来,应积极处理,做好手术准备,根据血管破裂的病因进行手术探查[47-48]:(1)血管缝合不良引起吻合口出血,予以修补血管;(2)感染性动脉炎导致血管破裂,尤其有耐药菌感染证据,建议切除移植肾,抗感染治疗。对于移植肾动脉与髂外动脉吻合者,建议切除移植肾后结扎髂外动脉感染部位近端、远端,感染部位开放,血管远端行股动脉-人工血管-对侧股动脉转流手术或同侧腋窝动脉-人工血管-股动脉转流手术,恢复术侧下肢血供。本中心移植肾动脉破裂的治疗见图4。

图4 移植肾动脉破裂的治疗Figure 4 Treatment of artery rupture in renal allograft
2.5 假性动脉瘤
假性动脉瘤较为少见,包括肾内型和肾外型,总体发生率<1%[49]。器官获取时过度牵引肾蒂、插管灌注损伤肾动脉、血管吻合技术欠佳、髂动脉硬化及医源性损伤、手术部位感染(特别是真菌感染)等,可能导致假性动脉瘤的发生。小的假性动脉瘤临床表现通常无症状,当动脉瘤持续增大或破裂时,部分患者可能会出现疼痛、肿胀、肾周血肿、低血压、血尿和移植物功能异常等,导致失血性休克和危及生命的情况。对于尚未引起肾血流动力学和肾功能改变的动脉瘤,可选择保守治疗。如果动脉瘤已经破裂或有破裂的高风险,可以进行肾动脉栓塞、覆膜支架植入或开放手术修复[22]。髂动脉假性动脉瘤诊疗与移植肾动脉瘤类似,临床表现为肾周搏动性肿块并伴有疼痛、肿胀,大部分移植肾功能和血流可能受影响较小,高血压或移植物功能障碍可能是由于移植肾血管受动脉瘤压迫造成的。通过彩色多普勒超声检查可以明确诊断,其特征与肾假性动脉瘤相似。本中心肾外型假性动脉瘤的治疗见图5。

图5 肾外型假性动脉瘤的治疗Figure 5 Treatment of extrarenal pseudoaneurysm
2.6 移植肾破裂
移植肾破裂也是相对少见的并发症,发生率为0.3%~9.6%,主要发生在术后2 周内,也可以发生在术后数年,可直接导致移植物丢失和受者死亡[50]。肾破裂的临床表现为移植肾区突然疼痛、肿胀,伴有少尿、血尿、血压下降,严重者为失血性休克。若包膜下破裂出血或小范围破裂、出血控制良好、肾功能正常者,应予以保留肾脏,绝对卧床制动,局部压迫止血,治疗诱发病因,使用止血药物治疗,密切观察出血情况,做好手术准备。如果血流动力学不稳定或破裂出血到肾周区域,应立即进行手术探查。
2.7 肾动脉扭结
血管保留过长、不适当活动、血管收缩、儿童肾移植或大的盆腔间隙是移植肾血管扭结的诱发因素。移植动脉扭结很难与TRAS 完全区分开来,可能与血管移位或移植物随时间推移移位有关[51]。手术仍然是血管扭结的主要治疗方法,如果没有血栓形成,移植肾可以通过手术探查、重新定位移植肾或其他技术来修复。对于不适合手术干预的患者,PTA 是一种替代选择,但治疗效果并不理想,这可能会增加血管痉挛、破裂或剥离的风险[52]。笔者建议保留的血管不宜太长、切口空间适中、术后活动不宜剧烈,对于儿童患者来说,将移植肾表面的脂肪组织与切口组织缝合固定,可减少术后早期血管扭结的发生。
2.8 动静脉瘘
移植肾内动静脉瘘是经皮肾穿刺活组织检查(活检)引起的最常见的血管损伤类型,发生率为1%~18%[53]。当相邻的动脉和静脉分支同时撕裂时,就会形成动静脉瘘。据报道,先前存在的高血压和肾钙质沉着症是出现活检后动静脉瘘的危险因素[54]。多普勒超声检查是诊断动静脉瘘的首选方式,在肾内动脉和邻近的静脉中会看到异常的湍流,改变了肾脉管系统的正常走向。80%病例是无症状的,动静脉瘘可自行消退;对于存在血尿、高血压和肾内“窃血”现象导致移植物功能障碍[55],首选治疗方法是血管造影导管引导的腔内栓塞术,使用金属线圈选择性的栓塞可最大程度地减少功能性移植肾组织的损失[56]。开放手术(部分甚至全肾切除术)目前被认为是最后的治疗手段,但可能会损伤移植肾[57]。
3 西安交通大学第一附属医院肾移植术后血管并发症情况
西安交通大学第一附属医院2015年1月至2022年1月期间完成的2 304 例肾移植手术,其中男1 658 例,女646 例。54 例肾移植术后发生血管并发症,发生率为2.34%,最常见的血管并发症是移植肾动脉狭窄(3 6 例),其次是髂外动脉夹层(5 例)、肾动脉破裂(4 例)、肾静脉血栓(3 例)、肾动脉血栓(2 例)、假性动脉瘤(2 例)、肾动脉夹层(1 例)、肾动脉扭结(1 例)。40 例接受了PTA 治疗,其中球囊导管扩张3 例,血管内置入支架治疗37 例;14 例接受开放手术。最终,9 例行移植肾切除术,总体有效治疗率为83%(45/54)。大多数肾移植术后血管并发症都可以通过PTA 得到令人满意的治疗效果,但对于肾动脉破裂、动脉血栓、静脉血栓、动脉扭结等严重血管并发症的整体治疗效果较差,移植肾丢失率较高64%(9/14),需要重点预防和关注(表1)。
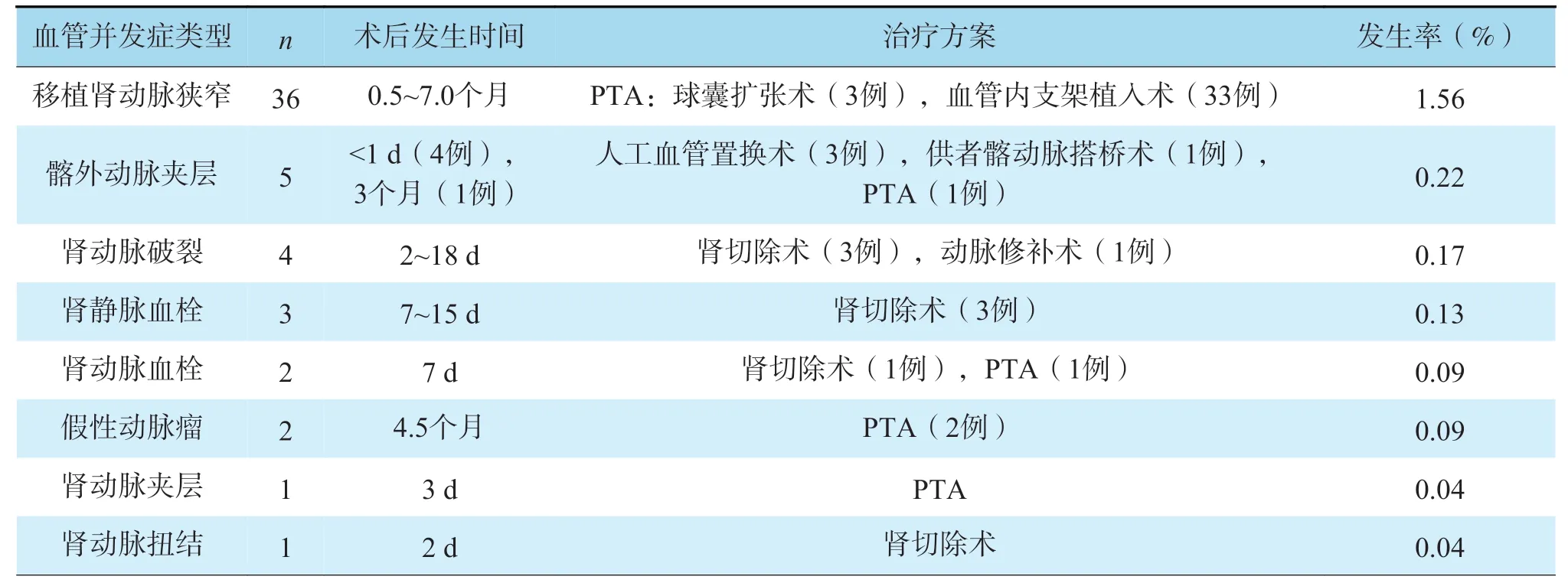
表1 肾移植术后血管并发症概况Table 1 Overview of vascular complications after kidney transplantation
4 小结
虽然肾移植术后血管并发症的发生率并不高,但治疗不当仍可对移植肾功能造成不可逆的损害,甚至危及受者生命,应予以足够重视。“防患于未然”,如何减少肾移植术后血管并发症的发生,重点是预防,我们建议对于高危供者进行全面细致评估,合理选择血管段,术中轻柔操作,改进血管缝合技术,术后针对性预防,多学科协作治疗可以预防或减少血管并发症的发生。

