柴油加氢脱氮集总动力学模型及应用
黄 镇,鞠雪艳,丁 石,聂 红,习远兵
(中石化石油化工科学研究院有限公司,北京 100083)
国Ⅵ柴油标准[1]要求硫(S)和多环芳烃(PHAs)质量分数分别小于10 mg/kg和7%。虽然并未对氮(N)含量提出明确要求,但众所周知中间馏分油中的N会导致柴油变色和胶质化,影响产品的稳定性;同时,相比S和PHAs,N在催化剂表面的吸附能力更强,极易占据催化剂的活性中心,进而抑制超深度脱硫及多环芳烃脱除反应的进行,成为国Ⅵ标准清洁柴油生产过程中的重要障碍[2]。为了削弱N对超深度脱硫和多环芳烃饱和的抑制作用,一种方式是改进催化剂并提高催化剂的加氢脱氮(HDN)活性、选择性及稳定性;另一种方式是从工艺参数方面入手,采用适当的氢分压(p)、反应温度(T)及液时空速(LHSV)优化操作条件[3]。
动力学模型作为指导催化剂设计和工艺优化的重要手段,一直是研究的重点。Novaes等[4]将T、p、LHSV与脱氮活性相关联,建立了受多参数影响的Langmuir-Hinshelwood(L-H)动力学模型,模型采用4阶Runge-Kutta方法求解具有很好的预测效果。Tang等[5-7]根据HDN反应活性的差异建立了考虑主要反应条件和氮化物自阻碍因素的二集总、三集总、四集总和五集总4种动力学模型,其中四集总动力学模型具有最优的拟合效果,拟合值与实验值的相对误差<5%。随着中国柴油需求量的不断降低,中间馏分油主要以直馏柴油和催化柴油为主,焦化柴油等重质柴油比例逐渐减低,因此柴油中N的复杂度大大降低,通过二维气相色谱-质谱(GC-MS)联用等手段,可将柴油中HDN反应活性的差异提高到族组成水平,但根据族组成的差异建立多集总HDN动力学模型少有报道。另外,柴油中所有含氮化合物可分为两类[8]:碱性氮化物(BN)和非碱性氮化物(NBN)。在柴油加氢精制过程中,BN主要影响催化剂的酸位,NBN主要影响催化剂中的硫化物活性组分,因此分别将BN和NBN自抑制因素引入到HDN动力学模型中有助于提高模型的准确度。
基于上述报道,笔者采用GC-MS和氮化学发光检测器(NCD)分别对柴油产物中的氮化物进行定量和定性分析,得到不同工艺条件下含氮化合物的类型分布。根据实验结果建立五集总L-H加氢脱氮动力学模型,微分方程采用Levenberg-Marquardt优化算法求解,拟合得到T、H2/油体积比(V(H2)/V(Oil))、p、LHSV以及杂质含量(硫化氢(H2S)、BN和NBN)等影响因素的动力学参数,并借助HDN实验数据,对模型进行了验证和应用。
1 实验部分
1.1 原料和试剂
本研究所用的直馏柴油和催化裂化柴油均取自国内某炼油厂工业装置,按照直馏柴油与催化裂化柴油质量比为4调和得到混合原料油,混合原料油的性质及烃类组成见表1。高纯氢气(H2),体积分数99.999%,京辉气体厂产品;吡啶、咔唑(分析纯),SiC微球,北京国药集团化学试剂有限公司产品。

表1 混合原料油的性质及烃类组成Table 1 Properties and hydrocarbon composition of mixed feed oil
1.2 催化剂
实验用催化剂为商用NiMo/Al2O3加氢精制催化剂,其各项理化性质见表2。本实验所用催化剂为长0.2 cm、直径0.18 cm的蝶形颗粒。根据文献[9]报道,当催化剂颗粒足够小时,可以忽略内扩散的影响。
1.3 实验装置与工艺条件
加氢反应实验采用如图1所示的中型加氢装置,主要包括进料系统、反应系统、气-液分离系统和产品收集系统4部分。其中反应系统由内径为2.48 cm、长度为128 cm的反应管及温控原件组成,整个反应管自上而下可分为3部分:第一部分装填高度为40 cm的SiC微球,用于将进料混合物加热至反应温度,实现液相与H2进料的均匀混合;第二部分位于反应器的中间段,15 mL催化剂以及50 g SiC微球均匀混合装填,由于加氢过程是强放热反应,采用与催化剂相同尺寸的惰性颗粒稀释催化剂可有利于控制温升,防止反应器内热点的生成;第三部分反应器底部装填高度为60 cm的SiC小球,用于保护管路并防止催化剂流失堵塞管路。反应器的温度由均匀分布于催化剂床层的3条热电偶控制,可保证反应器的等温操作环境,且温度偏差为±1 ℃。

表2 NiMo/Al2O3催化剂的化学组成及物理性质Table 2 Chemical composition and physical properties of NiMo catalysts

HP—High pressure;LP—Low pressure;MFC-1—Mass flow controller-1;MFC-2—Mass flow controller-2;R-1—Reactor-1; TIC-1—Temperature indicating controller-1;TIC-2—Temperature indicating controller-2;TIC-3—Temperature indicating controller-3图1 加氢反应实验装置Fig.1 Experimental setup for hydrogenation reaction
催化剂采用含有CS2质量分数为2%的煤油为硫化油进行预硫化,待催化剂活性稳定后开始实验。
实验采用控制变量法,探究了T、p、氢/油体积比(V(H2)/V(Oil))变化对HDN的影响,反应条件:T为330~360 ℃,p为5~8 MPa,V(H2)/V(Oil)为300~800。
为考察原料中H2S、BN和NBN含量变化对HDN反应及动力学参数的影响,考察了T为350 ℃、p为6.4 MPa、LHSV为4 h-1和V(H2)/V(Oil)=300反应条件下分别添加质量分数1%~4%的H2S、50~150 mg/kg BN以及120~480 mg/kg NBN时氮化物的反应特点。原料中添加H2S的方法是根据二甲基二硫(DMDS)受热易分解形成H2S的特点来实现的。另外,为不影响外加氮化物对原料中氮化物的影响,选择添加的碱性氮化物为吡啶,非碱性氮化物为咔唑。
2 HDN集总动力学模型的建立和求解方法
2.1 HDN集总动力学模型的建立
图2为原料和不同液时空速条件下HDN产物的氮类型分布图。从图2可以看出,在高空速条件下苯胺和吲哚快速反应完全,因此本研究未对这两类氮化物进行讨论。其中难反应氮化物的主要类型为咔唑类氮化物,根据甲基数的不同可将咔唑类氮化物分为一甲基咔唑(MC)、二甲基咔唑(DMC)、三甲基咔唑(TMC)、四甲基咔唑(TEMC)、五甲基咔唑(PMC)5个集总。
为简化动力学模型,在计算动力学过程中做出以下假设:
1)忽略催化剂的失活。
2)本实验所用LHSV为4~12 h-1,空速较高条件下认为可以忽略外扩散的影响。

Aniline Indole MC DMC TMC TEMC PMC MC—Methyl-carbazole;DMC—Dimethyl-carbazole; TMC—Trimethyl-carbazole;TEMC—Tetramethyl-carbazole; PMC—Pentamethyl-carbazole(1)Product at LHSV=4 h-1;(2)Product at LHSV=6 h-1;(3)Product at LHSV=9 h-1;(4)Product at LHSV=12 h-1;(5)Feedstock图2 原料和不同液时空速(LHSV)条件下 HDN原料与产物的氮类型分布谱图Fig.2 Nitrogen type distribution diagram of feedstock and products for HDN at different LHSV Reaction conditions: T=350 ℃;p=6.4 MPa,V(H2)/V(Oil)=300;
3)催化剂的颗粒足够小时内扩散的影响可以被忽略。
4)在滴流床反应器中,由于床层高度与催化剂粒径之比很大,轴向返混的影响可以忽略;在忽略内、外扩散影响的情况下,反应器中的物流符合平推流模型。
5)动力学模型中的表观反应速率常数可以用Arrhenius方程表示,忽略化学平衡的影响。
6)加氢路径可以通过C—N健的直接断裂来描述,而不存在反应物之间的其他反应。
基于上述假设及五集总的设计方式,每个集总的动力学模型方程可以用式(1)表示[10];对式(1)积分得到式(2),可用于预测氮化物含量。
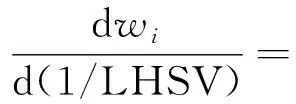
(i=1,2,3,4,5)
(1)

(2)
式中:wTN为总氮的质量分数,mg/kg;wi为集总MC、DMC、TMC、TEMC、PMC的质量分数,mg/kg;i=(1,2,3,4,5),1为MC,2为DMC,3为TMC,4为TEMC,5为PMC;Ai为指前因子;Eai为集总1,2,3,4,5的活化能,J/mol;LHSV为液时空速,h-1;R为气体常数,J/(mol·K);T为反应温度,K;ni为反应级数;mi、ai、KH2S,i、KNBN,i、KBN,i为拟合参数;p为反应压力,MPa;V(H2)/V(Oil)为氢气/原料油体积比;wH2S为H2S质量分数,%;wNBN为非碱性氮化物质量分数,mg/kg;wBN为碱性氮化物质量分数,mg/kg。
2.2 HDN集总动力学模型的求解
拟合动力学参数所需的实验数据如表3所示。式(1)使用MATLAB中变步长自适应Runge-Kutta方法求解,以式(3)为目标函数,当目标函数达到最小值时,计算程序即输出计算结果。
(3)
式中:SSE为误差平方和;exp为实验值;fit为拟合值;i为氮化物;j为实验数。
3 HDN五集总动力学模型模拟结果
根据不同工艺条件下HDN产物各集总的含量,结合所建立的动力学模型,回归得到动力学参数,如表4所示。由表4可见,动力学参数的相关系数(R2)均大于0.9650。为了验证动力学可靠性,比较了动力学方程拟合值与实验值之间的误差(见图3),结果说明,五集总HDN动力学模型在操作条件T为330~360 ℃、p为5.0~8.0 MPa、LHSV为4~12 h-1、V(H2)/V(Oil)为300~800范围内能够准确预测氮化物含量。
由表4还可见,五集总模型的级数均在1.0~1.1之间,说明HDN反应均符合准一级反应,这与现有HDN反应动力学报道[11-14]相一致。MC、DMC、TMC、TEMC和PMC加氢反应的活化能在130~145 kJ/mol之间,说明HDN反应过程受热力学影响较大,升温有助于提高HDN反应活性。指前因子以及各拟合参数与反应原料和催化剂种类的关联度较高,能够反映所用NiMo催化剂催化混合原料油时,不同空速条件下受压力、氢/油比及杂质(H2S、NB和NBN)含量的影响程度[15-17]。
表3 不同工艺条件下氮类型产物分布Table 3 Distribution of nitrogen-type products under different process conditions

表4 HDN五集总动力学参数拟合结果Table 4 Fitted results of five lumped model parameters of HDN
4 HDN五集总动力学模型对工艺条件的优化
使用拟合得到的HDN五集总动力学模型,根

MC—Methyl-carbazole;DMC—Dimethyl-carbazole; TMC—Trimethyl-carbazole; TEMC—Tetramethyl-carbazole;PMC—Pentamethyl-carbazole图3 NiMo催化剂上HDN动力学模型拟合值 与实验值的比较Fig.3 Comparison between fitted values and experimental values of kinetics model on NiMo catalyst
据式(3)计算得到不同工艺条件下总氮含量变化规律,可以模拟加氢过程中氮化物含量的变化规律,用于优化反应条件实现氮化物的快速脱除,为硫化物和多环芳烃的深度脱除提供良好的反应环境。
4.1 反应温度对总氮含量的影响
图4为p=6.4 MPa、V(H2)/V(Oil)=300和LHSV=4 h-1条件下反应规律。由图4可见:随着反应温度的升高,总氮含量逐渐降低;温度越高,氮化物的脱除速率越快。但是随着温度的升高,催化剂的结焦速率加快,导致催化剂快速失活,从而导致转化率降低,因此在选择最佳反应温度时应同时考虑转化率和催化剂寿命,因此选择快速脱除氮化物的最优温度为350 ℃。
4.2 反应压力对总氮含量的影响
图5为T=350 ℃、V(H2)/V(Oil)=300和LHSV=4 h-1条件下HDN反应规律。由图5可见,随着反应压力的升高,总氮含量降低。因为压力升高,单位体积内氢气浓度增加,氮化物与氢气的接触频率增加,升压对HDN有利。氮化物的脱除以加氢路径为主,因此提高反应压力对HDN脱除能力影响较明显;但是反应压力升高,对反应器的材质提出很高的要求,所以根据钢材的耐压特性,选择最优的反应压力为6.4 MPa。

图4 不同反应温度(T)下五集总模型预测 总氮质量分数(wTN)的变化规律Fig.4 Change laws of total nitrogen mass fraction (wTN) predicted by the five-lumped model at different reaction temperatures (T) Reaction conditions:p=6.4 MPa; V(H2)/V(Oil)=300; LHSV=4 h-1

图5 不同反应压力(p)下五集总模型预测 总氮质量分数(wTN)的变化规律Fig.5 Change law of total nitrogen mass fraction (wTN) predicted by the five-lumped model at different reaction pressures (p) Reaction conditions:T=350 ℃;V(H2)/V(Oil)=300;LHSV=4 h-1
4.3 氢/油体积比对总氮含量的影响
图6为T=350 ℃、p=6.4 MPa和LHSV=4 h-1条件下HDN反应规律。由图6可见,随着氢/油体积比增大,产物中总氮含量略降低。这说明氢/油体积比不是影响HDN的关键因素。氢/油体积比的增加虽然有利于更多的氢参与反应,提高加氢精制的程度,但反应物在催化剂床上的停留时间随着氢/油体积比的增加而减少,导致反应时间缩短,加氢精制程度降低。因此选择最优的氢/油体积比为300。
4.4 硫化氢含量对总氮含量的影响
图7为T=350 ℃、V(H2)/V(Oil)=300、p=6.4 MPa和LHSV=4 h-1条件下,H2S质量分数为1%~4%时的HDN反应规律。由图7可见,H2S含量越高,对HDN反应活性的抑制越明显。因为H2S会竞争吸附在催化剂活性位上,占据催化剂的配位不饱和位点,将硫空位(CUS)转化为饱和位点(-SH),从而影响HDN的反应活性。雅宝公司[18]利用不同催化剂对HDN和HDS反应活性的差异进行研究,采用催化剂级配技术在反应器上部装填HDN反应活性更强、HDS活性相对较弱的催化剂,通过抑制HDS来降低H2S对HDN的影响,从而提高HDN反应速率。
4.5 氮化物自抑制对总氮含量的影响
反应条件在T=350 ℃,V(H2)/V(Oil)=300,p=6.4 MPa和LHSV=4 h-1下,分别添加质量分数120、240、480 mg/kg的NBN或50、100、150 mg/kg的BN,考察外加不同含量非碱性氮化物或碱性氮化物对HDN反应的影响,结果如图8所示。由图8可见,碱性氮化物相比非碱性氮化物对HDN反应活性的影响更大,反应时间为0.25 h时,添加50 mg/kg的BN与240 mg/kg NBN的总氮质量分数相等,均为19.8 mg/kg。Topsoe等[19]认为,碱性氮化物相比非碱性氮化物不仅具有更强的竞争吸附能力,而且还可以与来自相邻-SH基团的H+离子发生反应,形成竞争吸附能力更强的鎓离子,从而使可用于氢化的氢原子数量减少,进一步抑制HDN反应的发生。因此,在加氢反应器前添加吸附装置尽可能降低碱性氮化物的浓度,有助于提高HDN反应速率。
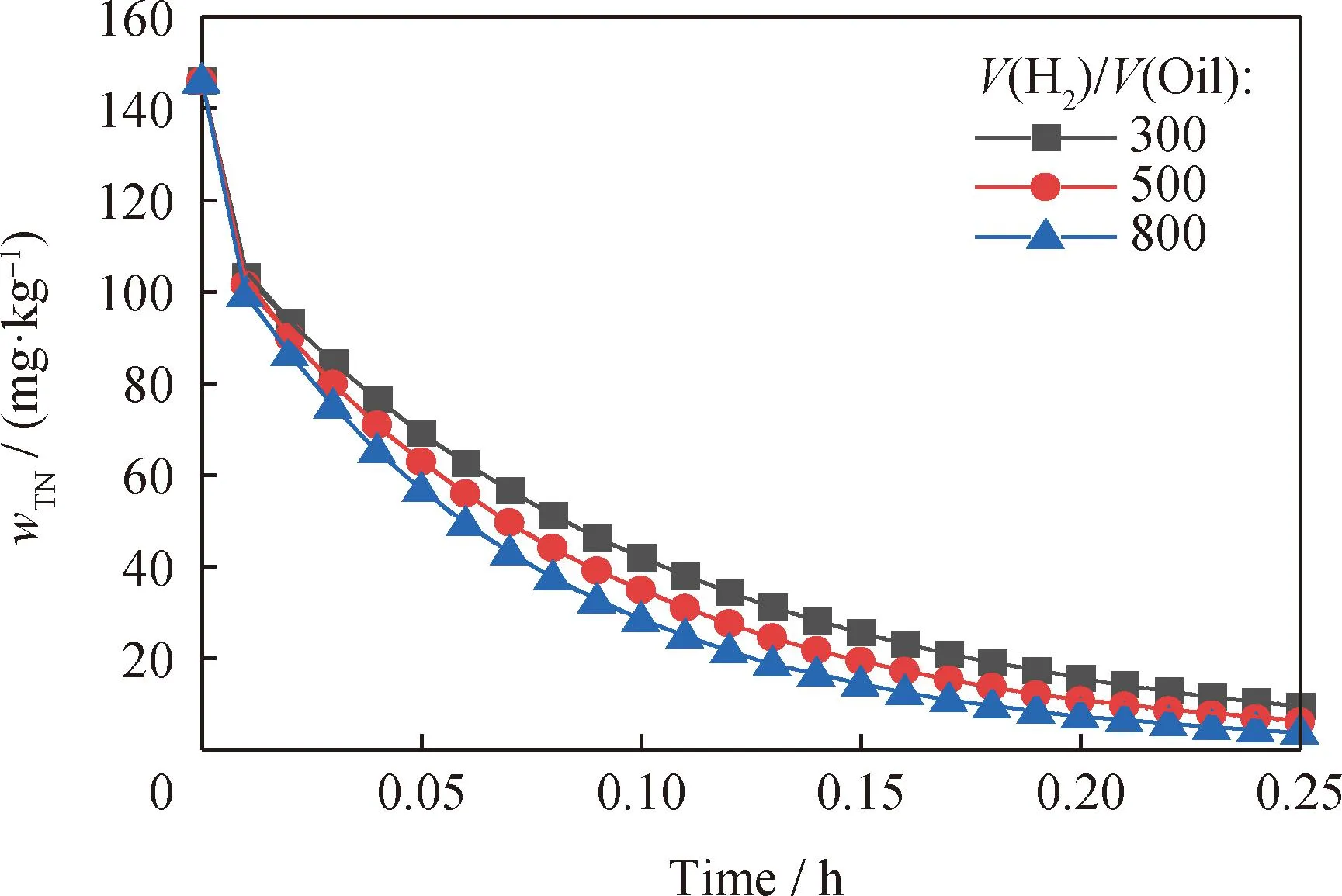
图6 不同氢/油体积比(V(H2)/V(Oil))下 五集总模型预测总氮质量分数(wTN)的变化规律Fig.6 Change laws of total nitrogen mass fraction (wTN) predicted by the five-lumped model at different Hydrogen/Oil volume ratios (V(H2)/V(Oil)) Reaction conditions:T=350 ℃;p=6.4 MPa;LHSV=4 h-1
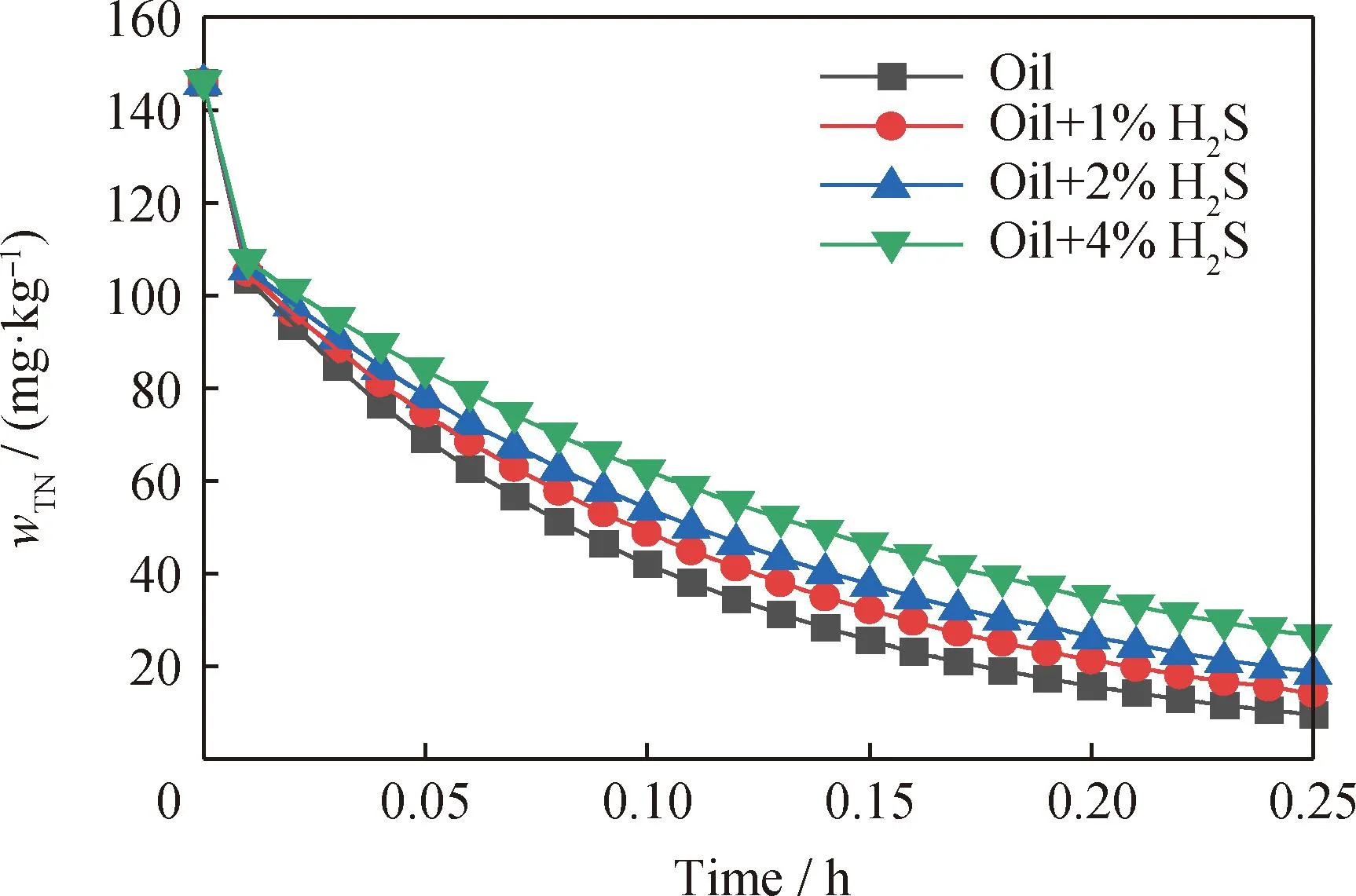
图7 不同H2S质量分数下五集总模型预测 总氮质量分数(wTN)的变化规律Fig.7 Change laws of total nitrogen mass fraction (wTN) predicted by the five-lumped model at different H2S mass fractions Reaction conditions:T=350 ℃; V(H2)/V(Oil)=300; p=6.4 MPa;LHSV=4 h-1
5 结 论
(1)通过GC-NCD对柴油加氢过程中含氮化合物的类型进行识别,发现柴油HDN过程以咔唑类氮化物为主,并依据甲基侧链数的不同建立了含反应温度、反应压力、液时空速、氢/油体积比以及杂质含量(硫化氢、碱性氮化物和非碱性氮化物)等影响因素的五集总Langmuir-Hinshelwood加氢脱氮(HDN)动力学模型,该模型符合实际柴油的HDN过程,拟合值与实验值的吻合度较高,R2均大于0.9650。
(2)五集总模型能够用于预测加氢产物中氮化物含量分布及工艺条件的优化。模拟结果表明,在反应温度为350 ℃、反应压力为6.4 MPa、氢/油体积比为300 条件下,建立催化剂级配体系与原料预处理系统有利于实现氮化物的快速脱除,进而为超深度脱硫和芳烃饱和提供良好的反应环境。

