UDP-糖基转移酶GmSGT2催化金盏花苷E的半乳糖基修饰
孙秋艳,郭 芳,李 春,2,冯旭东
(1.北京理工大学 化学与化工学院 化学工程系 生物化工研究所 医药分子科学与制剂工程工业和信息化部重点实验室,北京 100081;2.清华大学 化学工程系 工业生物催化教育部重点实验室,北京 100084)
三萜化合物因其种类繁多、结构多样以及具备丰富的生理药理活性被广泛应用于食品、医药和化妆品等领域,已经成为人类生活中不可缺少的一部分[1]。三萜化合物通过适度引入糖基修饰可增加化合物的水溶性,减少毒副作用;同时,因糖基种类及结构的多样性,糖基修饰又可进一步丰富三萜化合物及其衍生物的种类,生成具有不同药理学功能的化合物[2-3]。如,人参皂苷只有两种苷元,即达玛烷型和齐墩果烷型,但通过不同糖基修饰衍生出的人参皂苷在25种以上[4]。目前,三萜化合物及其糖苷衍生物主要由植物提取、化学合成以及生物合成等方式获得。由于一些特定的三萜糖苷化合物在植物中含量低且植物生长周期长,所以植物提取法耗时费力,来源于甘草根中的甘草酸,需要挖根提取,严重破坏土壤生态和植被[5-6]。化学法糖基修饰通常需要苛刻的反应条件、多步骤的保护/去保护过程来控制糖修饰的区域选择性,所以存在反应过程烦琐、产物定向性差、单糖修饰居多等缺点[7-8]。随着糖基数量的增加,这些问题更加严重,无法实现绿色可持续性生产。近年来,通过生物酶法合成糖苷类化合物受到了越来越多的关注。特别是,利用UDP-糖基转移酶(UGT)可以解决上述问题,因为酶催化反应条件温和,以高区域选择性将UDP-糖从供体转移到受体,可实现高效合成糖苷衍生物[9-12]。
目前,越来越多的UGT被鉴定及表征,并作为绿色生物催化剂,用于合成高价值糖苷化合物[13-15]。如,UGT51催化原人参二醇糖基化生成潜在的抗癌药物人参皂苷Rh2[16]。来源于乌拉尔甘草的UGT73C11,催化甘草次酸糖基化生成甘草次酸-3-氧-单葡萄糖(GLMG)[17]。来源于拟南芥的AtUGT78D2和AtUGT79B1催化槲皮素生成槲皮素-3-氧-葡萄糖基-木糖苷等[18]。目前报道的大多数UGT仅能实现单糖基修饰,对于可实现两个或两个以上糖基修饰的UGT研究报道较少,但利用UGT实现二糖或多糖修饰对合成糖苷衍生物具有重要意义。由于缺少实现二糖或多糖修饰的UGT,这限制了糖苷衍生物的多样性,不利于挖掘具有更多价值的糖苷衍生物。
这个故事流传非常广,以至于“割席断交”成了一个成语,在后世常被用来表示自己的高洁不愿意同流合污。金块代表的是世人梦寐以求的财富,官员的豪华仪仗代表的是世人无限向往的尊贵。但是对于知识分子特别是古代士族来说,富和贵都和所谓的“清名”成了矛盾,正因为大多数世俗的人追求富贵,所以少数士族读书人的特立独行才有着“世人皆浊我独清”的傲立于世的姿态,仿佛这是一种时尚一种无上的光荣。后人读这个故事,大多在自觉不自觉地接受一种道德评判,即管宁是清高的,华歆是世俗的;管宁相对来说是正面的人物值得学习,华歆相对来说是反面人物,要接受世俗的唾弃与不屑。
金盏花苷E又称去葡萄糖竹节参皂苷,是从竹节参中提取得到的五环三萜糖苷类化合物,在抑制HepG2细胞增殖扩散方面具有重要作用[19]。目前已报道的金盏花苷E糖基修饰类型仅有葡萄糖基修饰,特别是半乳糖作为一种重要的糖基修饰,在改善天然产物的药理活性方面具有重要作用。如,在大豆皂醇B单葡萄糖醛酸(SBMG)的3号位葡萄糖醛酸再修饰一个半乳糖即形成大豆皂苷Ⅲ,其抗疱疹病毒、抗溶血、保肝能力增强[20-21];半乳糖修饰糖苷衍生物大豆皂苷Bb,可以治疗骨质疏松等。但鲜有对金盏花苷E进行半乳糖修饰的报道。
来源于大豆的UDP-糖基转移酶GmSGT2可以催化SBMG、甘草次酸单葡萄糖醛酸(GAMG)和尿苷二磷酸半乳糖(UDP-Gal)反应,分别生成甘草次酸单葡萄糖醛酸-半乳糖(Gal-GAMG)与大豆皂苷Ⅲ[22-23]。GAMG、SBMG同属于齐墩果烷型五环三萜化合物,结构与金盏花苷E十分相似,因此,通过对该酶的序列及结构的进一步分析,推测GmSGT2可能具备催化金盏花苷E的功能。因此,本研究中,笔者首次对大豆糖基转移酶GmSGT2催化金盏花苷E进行功能验证,并通过分子对接研究揭示GmSGT2催化金盏花苷E与UDP-半乳糖反应时的识别机制,以期为利用酶法合成新的半乳糖苷衍生物提供指导意义。
1 材料与方法
1.1 菌株与质粒构建
质粒pET28a-GmSGT2及工程菌E.coliBL21-GmSGT2 (DE3),笔者所在课题组前期构建保存。GmSGT2基因(登录号为AB473730.1)、E.coliDH5α与E.coliBL21(DE3),北京博迈德基因技术有限公司;pET28a质粒,德国Novagen公司。
要评估一个P波未下传是由于被阻滞还是被干扰所致,首先要看心房率。当心房率足够慢,则可诊断为阻滞。心房率过快(>135次/min)时出现的房室分离P波未下传心室,通常是由生理性不应期引起的房室传导功能障碍所致,此种情况不能诊断为房室阻滞[1]。
1.2 试剂与仪器
利用AKTA纯化仪对GmSGT2粗酶液进行Ni2+柱纯化,用5倍柱体积重蒸水(ddH2O)清洗Ni2+柱,再用5倍柱体积蛋白纯化平衡液(50 mmol/L PBS、25 mmol/L咪唑、15 mmol/L NaCl,pH 7.4)平衡Ni2+柱,流速1.0 mL/min 将GmSGT2粗酶液过Ni2+柱,用5倍柱体积含有75 mmol/L咪唑的洗脱液(50 mmol/L PBS、75 mmol/L咪唑、15 mmol/L NaCl,pH 7.4)清洗杂蛋白,再用3倍柱体积含有225 mmol/L咪唑的洗脱液(50 mmol/L PBS、225 mmol/L咪唑、15 mmol/L NaCl,pH 7.4)洗脱目标蛋白并收集至离心管,测定蛋白浓度,得到GmSGT2纯酶。(50 mmol/L 不同pH的 PBS配制参照Thermo Scientific官网PBS溶液配制)。
LC-30A型超高效液相色谱仪(UPLC),日本岛津公司;6460 Triple Quad型液相色谱-质谱联用仪, Agilent公司;PowerPac 3000gajf 电泳仪,Bio-Rad有限公司;DK-8D型恒温水浴锅,上海一恒科技有限公司;AKTA纯化仪, GE Healthcare公司;Jinbio低温高压细胞破碎仪,广州聚能纳米生物科技股份有限公司;Avanti-JXN-26型高速冷冻离心机,贝克曼库尔特公司;Nanodrop 2000c型超微量分光光度计,赛默飞世尔科技公司。
1.3 GmSGT2工程菌株的培养与纯化
将构建成功的BL21接种到含有50 μg/mL卡那青霉素的30 mL LB液体培养基中,37 ℃摇床过夜培养,按照体积分数1%的接种量,将种子液接种至新鲜LB培养基中,37 ℃培养至OD600为0.8,加入终浓度为0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),16 ℃过夜诱导后8 000 r/min离心2 min收集菌体,按照体积比1∶40加入50 mmol/L的Na2HPO4-NaH2PO4-NaCl缓冲液(PBS,pH 7.5)重悬菌体,在4 ℃、100 MPa条件下,利用低温超高压破碎仪破碎4次,12 000 r/min离心30 min,收集上清液,得到粗酶液。
所用引物由安升达(天津)生物科技有限公司合成;金盏花苷E,天津伐木易生物科技有限公司;UDP-阿拉伯糖(UDP-Ara)、UDP-半乳糖(UDP-Gal),广州昂飞生物科技有限公司; UDP-木糖(UDP-Xyl)、UDP-葡萄糖(UDP-Glc)、UDP-葡萄糖醛酸(UDP-GlcA)、UDP-鼠李糖(UDP-Rha),苏州汉酶生物技术有限公司;齐墩果酸、白桦脂酸,阿拉丁试剂(上海)有限公司;3-氧-葡萄糖-齐墩果酸、28-氧-葡萄糖-齐墩果酸、3,28-氧-双葡萄糖-齐墩果酸、3-氧-葡萄糖-白桦脂酸、28-氧-葡萄糖-白桦脂酸,自制;其他所用化学药品均为市售分析纯。
1.4 金盏花苷E半乳糖苷衍生物检测方法
反应样用0.22 μm有机滤膜过滤,利用UPLC检测,检测条件:色谱柱Agilent公司的InfinityLab Poroshell 120 EC-C18(100 mm×2.1 mm,2.7 μm)、检测波长203 nm、流动相为乙腈(A)和0.1%磷酸(B)、流速为0.3 mL/min、柱温箱40 ℃、上样量3 μL,具体梯度洗脱程序为0~1.0 min 60% B溶液、1~2.4 min 43% B溶液、2.4~2.6 min 40% B溶液、2.6~3.4 min 30%B溶液、3.4~4.25 min 24% B溶液、4.25~4.6 min 5% B溶液、4.6~5.0 min 0% B溶液、5.0~6.5 min 0% B溶液、6.5~7.0 min 60% B溶液、7.0~9.5 min 60% B溶液。LCMS检测条件同UPLC检测方法,流动相为乙腈(A)和0.1%甲酸(B),采用阴离子与阳离子双模式检测。
2) 墙体水平位移时程曲线:在此选择三个有代表性的墙体水平位移监测点ZQT-01、ZQT-03、ZQT-23随着土方开挖的变形时程曲线进行分析,三个测点的变形时程曲线见图3~图5。
1.5 GmSGT2酶学性质表征
因为GmSGT2可以催化SBMG与UDP-Gal反应生成大豆皂苷Ⅲ,还可催化GAMG生成GAMG-Gal,同时SBMG与GAMG都属于齐墩果烷型五环三萜化合物,且3号位均修饰一个葡萄糖醛酸,金盏花苷E均符合以上结构特征。因此,以UDP-Gal为糖基供体,金盏花苷E为糖基受体,探究GmSGT2的催化活性,结果如图1所示。
1.课内:开展“以学生为主体,教师为主导,训练为主线”的情境教学法,进行情境教学探索与研究。课堂教学中采用“贴近生活展现情境”“引导学生扩写,描述情境”“利用音乐渲染情境”三情境法开展课堂教学,唤醒他们自身对生活的感受,使学生由被动的学习者,变为有主观情感积极参与的艺术再创造者。进行情境教学法探索与研究对老师的知识、能力及奉献精神提出了更高的要求,需要老师精心设计教学内容,同时借助多媒体技术,将同学们带入诗境;做好适当铺垫,凭借诗境,弄清诗意;反复吟诵,咀嚼诗句,体验诗情。
病理表现 灰黄色肿物1枚,表面光滑,包膜完整,切面灰黄色,质中,局部见钙化。光镜下可见典型的细胞致密区(Antoni A区)及细胞疏松区(Antoni B区),瘤细胞呈编织状排列,未见明确栅栏状结构(图3),免疫组织化学检查显示:波形蛋白 (弥漫强+)、S-100(弥漫强+)(图4)。结合形态及免疫组织化学染色结果,考虑为神经鞘瘤。
为了探究GmSGT2的最适温度,构建100 μL反应体系,反应体系同热稳定性,在不同反应温度(25、30、35、40、45、50、55和60 ℃)条件下反应时间2 h,加400 μL甲醇终止反应,UPLC检测。定义在40 ℃下 GmSGT2 催化金盏花苷E反应的酶活为100%。
为了探究GmSGT2的最适pH,构建100 μL反应体系,反应体系同上,使用不同pH的50 mmol/L缓冲液定容至100 μL,在35 ℃条件下反应2 h,加400 μL甲醇终止反应,UPLC检测,其中,pH 5~6的缓冲液为柠檬酸钠-柠檬酸,pH 6~8的缓冲液为Na2HPO4-NaH2PO4,pH 8~9的缓冲液为Tris-HCl,pH 9~14的缓冲液为Na2CO3-NaHCO3。定义在pH 9.0 Tris-HCl条件下,GmSGT2 催化金盏花苷E反应的酶活为100%。
为了探究GmSGT2糖供体特异性,构建100 μL反应体系,分别使用UDP-Ara、UDP-Gal、UDP-Xyl、UDP-Glc、UDP-GlcA和UDP-Rha作为糖供体,金盏花苷E为糖基受体,反应体系同上,在35 ℃条件下反应2 h;探究GmSGT2底物特异性,构建100 μL反应体系, UDP-Gal为糖基供体,分别使用金盏花苷E、齐墩果酸、白桦脂酸、3-氧-葡萄糖-齐墩果酸和28-氧-葡萄糖-齐墩果酸、3,28-氧-双葡萄糖-齐墩果酸、3-氧-葡萄糖-白桦脂酸、28-氧-葡萄糖-白桦脂酸作为糖基受体,反应体系同上,在35 ℃条件下反应2 h,加400 μL甲醇终止反应,UPLC检测。
由原始的决策原则[10]可知,当证据融合后出现两个或者多个可信度值相同且最大时,原始准则无法判断。若选择某元素作为结果可能导致误判。为了解决以上问题,改进后的决策原则的结果满足式(7)。
为了探究GmSGT2催化金盏花苷E的酶活影响,设计两组实验,构建100 μL反应体系,实验组一:GmSGT2 50 μg,金盏花苷E 500 μmol/L,UDP-Gal 500 μmol/L,pH7.5的50 mmol/L PBS缓冲液定容至100 μL,35 ℃水浴锅,反应时间分别为1、2、3、4、5和6 h,加400 μL甲醇终止反应,12 000 r/min离心1 min,过膜,利用UPLC进行检测。实验组二:GmSGT2 100 μg,其反应体系、反应时间、检测方法同实验组一。
1.6 GmSGT2催化金盏花苷E动力学常数测定
为了测定GmSGT2对金盏花苷E的催化效率,构建100 μL反应体系,加入GmSGT2 25 μg,UDP-Gal 50 mmol/L,金盏花苷E 浓度分别为0.05、0.08、0.1、0.2、0.25、0.5、1、2和5 mmol/L,在最适温度、pH条件下反应10 min,加400 μL甲醇终止反应,UPLC检测;利用GraphPad Prism 9.0进行拟合。
1.7 蛋白分子对接
UDP-Gal和金盏花苷E使用ChemBioDraw 12.0 and ChemBio3D 12.0进行修饰。利用SWISS-MODEL(https:∥swissmodel.expasy.org/)对GmSGT2蛋白同源建模,获得GmSGT2的3D结构,利用AutoDockTools-1.5.6进行对接分析,使用PyMOL 1.8进行可视化分析。
2 结果与讨论
2.1 GmSGT2催化金盏花苷E生成半乳糖苷衍生物及MS分析结果
为了探究GmSGT2在35 ℃条件下的热稳定性,构建100 μL反应体系,加入GmSGT2 50 μg,金盏花苷E 500 μmol/L,UDP-Gal 500 μmol/L(无特殊说明,底物浓度均为500 μmol/L),pH 7.5的50 mmol/L PBS定容至100 μL,将GmSGT2置于35 ℃的水浴锅,分别取不同时间(0、0.5、1.0、1.5、2、3、4、5和6 h)的蛋白在35 ℃反应1 h后,加400 μL甲醇终止反应,12 000 r/min离心1 min,过膜,利用UPLC进行检测。定义GmSGT2 催化金盏花苷E 0 h反应的酶活为100%。

图1 GmSGT2催化金盏花苷E生成半乳糖苷衍生物Fig.1 Synthesis of galactoside derivatives from calunduloside E by GmSGT2
教师介绍:20世纪初期,一些生物学家已经在一些昆虫的细胞中发现了性染色体。教师展示雄果蝇的染色体图、男性的染色体图,并提出问题:(1)X染色体、Y染色体大小相同吗?(2)X染色体都比Y染色体大吗?(3)X染色体、Y染色体是同源染色体吗?(4)所有生物都有性染色体吗?教师展示X染色体、Y染色体的同源区段和非同源区段的图片,以此加深学生对性染色体的认识。
2.2 GmSGT2催化底物特异性
以常用的UDP-Ara、UDP-Xyl、UDP-Glc、UDP-Gal、UDP-Rha和UDP-GlcA作为糖基供体,以金盏花苷E为糖基受体,探究了GmSGT2的糖供体特异性,结果如图2所示。
由图1可知:GmSGT2可催化金盏花苷E与UDP-Gal反应,仅在3.4 min出现1个新峰,推测为金盏花苷E-半乳糖;对新峰进行LC-ESI-MS分析(图1(c)),新峰分子量为794.6,与推测结果一致,说明GmSGT2催化金盏花苷E仅生成金盏花苷E-半乳糖,无其他副产物生成。
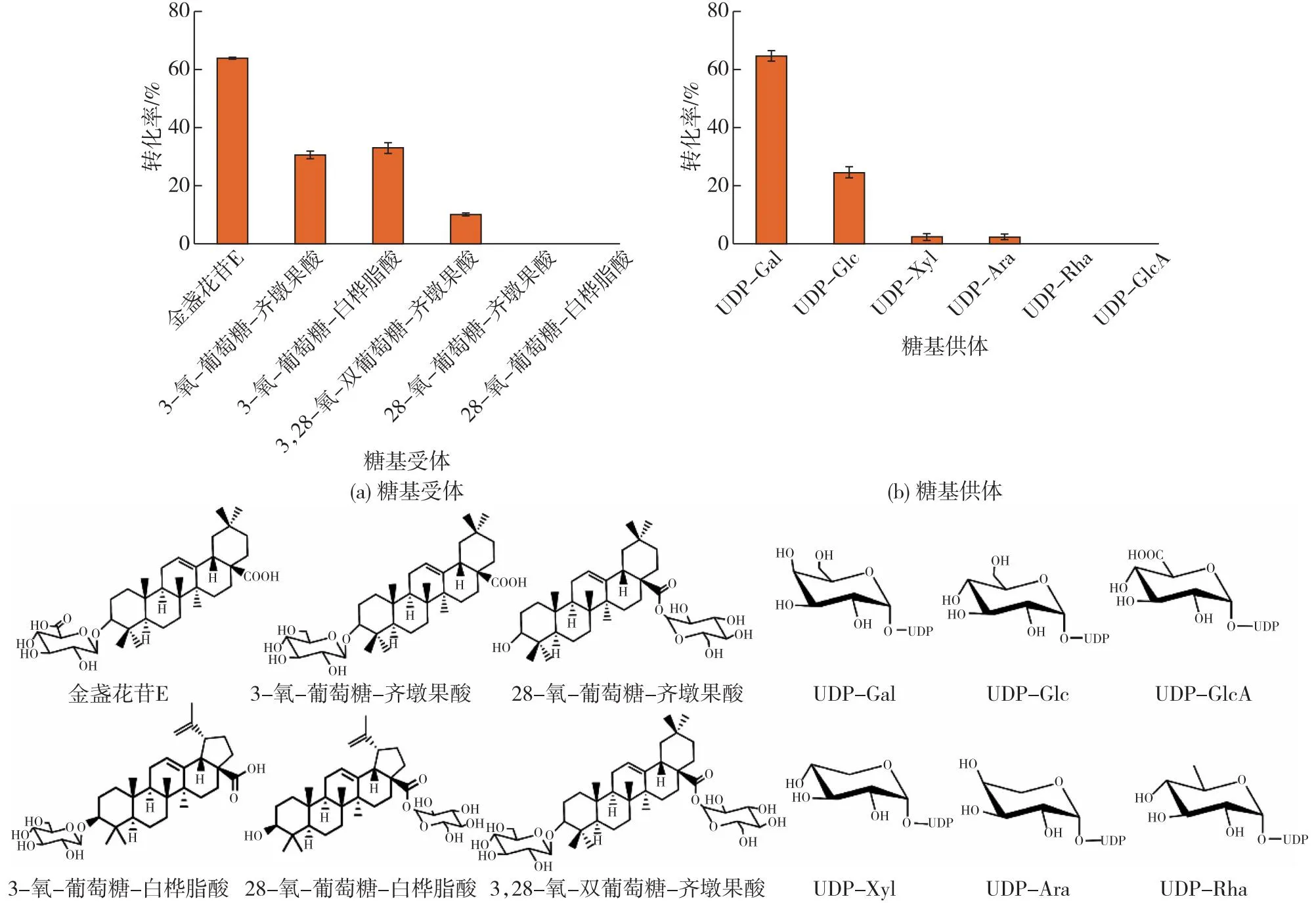
图2 GmSGT2的糖基受体、糖基供体特异性Fig.2 Specificity of sugar acceptor and donor of GmSGT2
由图2可知:GmSGT2催化UDP-Gal与金盏花苷E反应活性最高,金盏花苷E转化率为64.72%,催化UDP-Glc、UDP-Xyl和UDP-Ara反应的酶活性次之,金盏花苷E转化率分别为24.43%、22.59%和16.03%, 这与文献[23]报道一致,GmSGT2更偏好于UDP-Gal为糖基供体。这可能与GmSGT2天然催化活性有关,GmSGT2催化SBMG与UDP-Gal反应生成大豆皂苷Ⅲ[22]。
GmSGT2还可催化3-氧-葡萄糖-齐墩果酸、3,28-氧-双葡萄糖-齐墩果酸、3-氧-葡萄糖-白桦脂酸与UDP-Gal反应;GmSGT2不能催化28-氧-葡萄糖-齐墩果酸、28-氧-葡萄糖-白桦脂酸,说明GmSGT2仅能实现3号位糖上加糖,不能实现28号位糖上加糖。虽然同为五环三萜单糖修饰化合物,但催化金盏花苷E的效率要高于其他化合物,这可能是因为其3号位修饰的是葡萄糖,而非葡萄糖醛酸,因为SBMG作为天然底物,其修饰就是葡萄糖醛酸,与金盏花苷E结构更接近。
2.3 GmSGT2催化金盏花苷E反应酶学性质表征
探究不同反应条件下GmSGT2催化金盏花苷E的酶学性质,结果见图3(a)~(c)。

图3 温度、pH、孵育时间和酶量对转化率或酶活的影响Fig.3 Effects of temperature,pH,incubation time and enzyme concentration on the conversion rate or enzyme activity
由图3(b)可知:当pH为7.5时,GmSGT2酶活最高,GmSGT2催化金盏花苷E的最适pH约为7.5;在pH为7.5~9的缓冲液中,碱性GmSGT2酶活较高,均在80%以上。在相同pH不同类型缓冲液中,GmSGT2催化金盏花苷E的酶活也不一样,在pH为6的柠檬酸钠-柠檬酸缓冲液中,其相对酶活仅有63.13%,而在pH为6的Na2HPO4-NaH2PO4缓冲液中,其相对酶活为87.20%,相差了24.07%。即使是相同pH的不同缓冲液也会对酶的活性产生影响,这与文献[23-24]结果一致。与多数UDP-糖基转移酶催化特点相似,GmSGT2催化反应的最适pH为7~9,偏碱性。
由图3(a)可知:GmSGT2催化金盏花苷E的最适温度是40 ℃,当温度为35 ℃时,相对酶活为89.40%;当温度达到45 ℃时,GmSGT2相对酶活受到较大影响,相对酶活为48.36%,GmSGT2受温度影响较大。这与GmSGT2催化GLMG的结果相似,在45 ℃条件下,GmSGT2催化GLMG的相对酶活约为最适温度下的48%,活性下降明显,但GmSGT2催化GAMG受温度影响比GLMG与金盏花苷E的影响较小。与其他UGT性质相似,如UGT73P28催化环黄芪醇反应的最适温度是37 ℃,而UGT催化反应的最适温度为35~40 ℃[24]。
由图3(c)可知:当孵育0.5 h后,GmSGT2对金盏花苷E和UDP-Gal的相对酶活依然有90.32%;孵育2 h后,GmSGT2相对活性剩余74.23%,GmSGT2催化活性下降相对缓慢;在2 h之后,稳定性急剧下降,孵育3 h后,GmSGT2相对酶活为35.93%;经过5 h的孵育,GmSGT2相对酶活性仅剩9.76%。
为了进一步验证GmSGT2催化金盏花苷E与UDP-Gal反应酶活,设置不同酶量反应、定点时间取样检测,结果如图3(d)所示。由图3(d)可知:与GmSGT2热稳定性趋势一致,当控制GmSGT2为50 μg时,反应3 h后,金盏花苷E转化率趋于稳定,转化率为72.67%;当酶量增加至100 μg,保持其他反应条件不变,金盏花苷浓度仍为0.5 mmol/L,3 h后金盏花苷E的转化率达到95.03%,说明在相同时间内,限制金盏花苷E转化率的主要原因是有效酶分子数量,通过增大酶量,金盏花苷E转化率达到95%。在100 μg酶量的反应体系下,当金盏花苷E浓度为250 μmol/L时,可实现底物100%转化。
GmSGT2从大豆cDNA中克隆获得,所用引物为GmSGT2-F:5′-C ̄G ̄C ̄G ̄G ̄A ̄T ̄C ̄C ̄A ̄T ̄G ̄G ̄A ̄G ̄A ̄A ̄G ̄A ̄A ̄G ̄A ̄A ̄G ̄G ̄G ̄T ̄G ̄A ̄G ̄C ̄T ̄A ̄A-3′,GmSGT2-R:5′-A ̄T ̄A ̄A ̄G ̄A ̄A ̄T ̄G ̄C ̄G ̄G ̄C ̄C ̄G ̄C ̄T ̄T ̄A ̄A ̄G ̄G ̄A ̄T ̄T ̄G ̄G ̄G ̄T ̄G ̄C ̄G ̄G ̄T ̄C ̄T ̄C ̄T ̄T ̄G ̄A-3′。引物包含2个限制性内切酶位点BamHⅠ、NotⅠ,分别位于GmSGT2的5′端和3′端。将6个组氨酸残基融合到重组酶GmSGT2的N端,消化连接GmSGT2基因至表达载体pET28a,构建pET28a-GmSGT2质粒。将得到的质粒通过大肠转化至大肠杆菌感受态细胞DH5α和BL21(DE3)。
1.3 统计学处理 采用SPSS21.0统计软件进行分析。计量资料以表示,进行Pearson相关分析,以P<0.05为差异有统计学意义。
2.4 GmSGT2催化金盏花苷E的动力学常数
利用GraphPad Prism 9.0软件进行拟合,结果如图4所示。
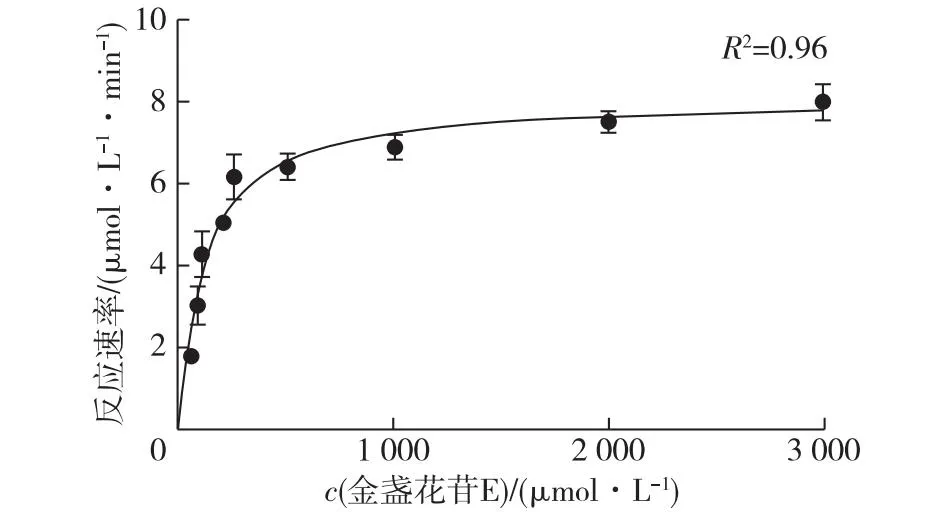
图4 GmSGT2米氏动力学常数的测定Fig.4 Michaelis constant of GmSGT2
由图4可知:GmSGT2催化金盏花苷E反应的Km(Km为酶催化反应速率达到最大反应速率一半时的底物浓度)为(0.12±0.03) mmol/L,kcat(kcat为催化常数)为(0.32±0.02) s-1,催化效率kcat/Km是(2.71±0.22) L/(mmol·s),与文献[23]的结果相比,GmSGT2催化GAMG的催化效率kcat/Km是0.78 L/(mmol·s),GmSGT2催化金盏花苷E的催化效率kcat/Km是催化GAMG 的3.4倍[23]。由此可见,GmSGT2催化UDP-Gal反应时,金盏花苷E是更好的糖基受体。
2.5 GmSGT2分子对接
通过SWISS-MODEL,GmSGT2同源建模的参数分别为Seq Identity:65.50%;GMQE:0.89;QMEAN:-1.26,说明UGT73P12可以作为GmSGT2模型[9],通过AUTODOCK-Vina对接,结果如图5所示。

图5 GmSGT2催化金盏花苷E与UDP-Gal反应的底物识别机制Fig.5 Substrate recognition mechanism of GmSGT2 toward calunduloside E and UDP-Ga-Gal
由图5可知:Ser19、Ala146、Arg260、Tyr262、Ser291、Leu353、Trp370、Asn371、Thr372和Glu391发挥底物识别作用,His20作为催化氨基酸,与Asp123-金盏花苷E形成复合体,催化金盏花苷E反应生成半乳糖苷衍生物,这与已报道的UDP-糖基转移酶底物催化机制一致[24-25]。通过分子对接阐明GmSGT2底物识别机制,便于理解GmSGT2催化的反应机制。
选择李维平主编的《蛋白质工程》[9]为教材.该书为“案例版”生物工程系列规划教材,普通高等教育“十二五”规划教材.
3 结论
GmSGT2催化金盏花苷E与UDP-Gal反应得到新的糖苷衍生物金盏花苷E-半乳糖。GmSGT2还可催化3-氧-葡萄糖-齐墩果酸、3,28-氧-双葡萄糖-齐墩果酸、3-氧-葡萄糖-白桦脂酸与UDP-Gal反应生成新的半乳糖苷衍生物。GmSGT2催化金盏花苷E的最适温度、pH分别为40 ℃、7.5,这与多数糖基转移酶特征一致。在最适温度、pH反应条件下,GmSGT2催化金盏花苷E的催化效率kcat/Km为(2.71±0.22) L/(mmol·s)。
通过分子对接分析发现,Ser19、Ala146、Arg260、Tyr262、Ser291、Leu353、Trp370、Asn371、Thr372和Glu391发挥底物识别作用,His20-Asp123-金盏花苷E形成复合体,催化金盏花苷E反应生成半乳糖苷衍生物。

