假单胞菌Rs-198的IAA合成途径分析
王立娟,杨义琳,高慧鑫,张延妍,何艳慧,武占省,,卢华丹
(1. 西安工程大学 环境与化学工程学院 西安市纺织化工助剂重点实验室,陕西 西安 710048;2. 石河子大学 化学化工学院,新疆 石河子 832003)
在植物根际土壤发现的82%的促生菌(PGPRs)都可以利用色氨酸或者其中间物合成植物激素吲哚-3-乙酸(IAA)、细胞分裂素、赤霉素等调节植物生长发育的物质,刺激植物侧根和根毛的过量生长,进而增加对矿物营养和水分子的吸收,最终促进植物生长[1-5]。其中,IAA是最常见的天然生长素,对植物根系的生长具有有益作用,常被用作蘸根剂的主要成分[6-7]。有研究表明,施加107CFU/mL的BacillusamyloliquefaciensSQR9可以增加黄瓜根长137%和根表面积88%,而同样处理敲除其IAA基因的菌株却未对黄瓜的生长产生明显影响,由此推测菌株SQR9产生的IAA是其发挥促生作用的主要机制[8-9]。
在PGPRs中,IAA的合成主要有5种依赖色氨酸的途径,分别是吲哚乙酰胺(IAM)途径、吲哚丙酮酸(IPyA)途径、色胺(TAM)途径、吲哚乙腈(IAN)途径和色氨酸侧链氧化酶途径,而且在一种细菌中可能存在一条或者多条途径[10-12]。Liu等[13]利用高效液相色谱-质谱/质谱(HPLC-MS/MS)分析菌株B.pyrrociniaJK-SH007的发酵液,在其中检测到了IAA及其中间物吲哚乙酰胺,同时也检测到了微量的吲哚丙酮酸、吲哚乙腈和色胺,表明IAM途径为菌株JK-SH007合成IAA的主要途径。Idris等[14]发现,在添加5 mmol/L色氨酸的条件下,BacillusamyloliquefaciensFZB42菌株的IAA的分泌量增加了5倍;此外,其trp营养缺陷型突变体E101(ΔtrpBA)和E102(ΔtrpED)以及E103(ΔysnE)和E105(ΔyhcX)的培养滤液中的IAA浓度显著降低,这3个突变株在促进植物生长方面的效率也明显较低,说明FZB42菌株依赖色氨酸的生长素合成与其促进植物生长功能是相关的。曾秀丽等[15]研究发现,与敲除突变株相比,草螺菌ZXN111的tyrB基因回补菌株产IAA的能力显著恢复,但与野生型菌株相比,其 IAA 合成量仍然较少,可见tyrB基因在草螺菌ZXN111合成IAA途径中起关键作用,但不是唯一的合成途径。
笔者所在课题组已经从棉花根际分离出的优势菌株恶臭假单胞菌Rs-198具有产生IAA的能力[16-17],然而其合成途径并未解析。因此,本研究对Rs-198菌株的IAA合成途径进行深入探索,以期对该菌株作为潜在生物肥料的工业化应用提供理论依据和参考。
1 材料方法
1.1 材料
假单胞菌(Pseudomonassp.)Rs-198,由笔者所在课题组前期从植物根际土壤中获得[18-19](GenBank登录号:PRJNA780237)。菌株培养条件为1%的种子液接种于液体营养培养基(NA),30 ℃、170 r/min培养36 h。
辣椒:市售普通辣椒种子。
种植基质:市售的珍珠岩(粒径2 mm)和蛭石(粒径0.5 mm),混合比例为2∶3(体积比)。
1.2 方法
1.2.1P.putidaRs-198生长测定
在灭菌后分装有50 mL的NA培养基中分别添加一定量的色氨酸使其终质量浓度为0.1、50、100、150和200 mg/L。接种P.putidaRs-198后在30 ℃、170 r/min培养24 h,在波长600 nm处测定OD600。
P.putidaRs-198生长曲线测定:在色氨酸终浓度为50 mg/L的NA培养液中接种P.putidaRs-198后,30 ℃、170 r/min培养,再分别在接种后的6、12、24、48、72 和96 h吸取3 mL培养液,测定OD600,绘制生长曲线。
1.2.2 IAA的定性定量检测
IAA的测定采用Salkowski比色法[20],用紫外分光光度计测定反应液在波长530 nm处的吸光值A530,绘制标准曲线,再根据标准曲线计算发酵液中IAA的含量。
1.2.3 HPLC法测定发酵液中的IAA量
发酵液中IAA的测定参照文献[9]的方法,并加以改进:测试液为不同菌株发酵液,制备待测液后,吸取1 mL发酵液离心,于8 000 r/min、4 ℃离心10 min,取上清液置于净离心管中,用1 mol/L HCl溶液调节pH至2.5,随后使用等体积的乙酸乙酯萃取3次,之后使用真空旋转蒸发仪蒸干,甲醇复溶定容至5 mL,随后转移至离心管中保存在-20 ℃冰箱中备用。上样前,上清液经0.22 μm滤膜过滤后,再进行HPLC分析,根据标准曲线的峰面积计算IAA含量。HPLC分析使用的色谱柱为Agilent Technologies ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5μm),柱温为30 ℃,流动相为甲醇-0.6%乙酸溶液(两者体积比为1∶1),流速为0.8 mL/min,检测波长为254 nm。
1.2.4 IAA合成途径分析
在NA培养基中分别添加一定质量的中间物(吲哚乙腈、吲哚丙酮酸、色胺或吲哚乙酰胺),使其终质量浓度为80 mg/L。在接种P.putidaRs-198菌株后的3、6和12 h收集发酵液,经样品前处理后,利用HPLC法测定发酵液中中间物吲哚乙腈、吲哚丙酮酸、色胺或吲哚乙酰胺以及目标终产物IAA的浓度变化。
1.2.5 含色氨酸发酵液辣椒促生能力测定
通过盆栽实验测定含色氨酸发酵液的促生能力。盆栽实验设置有5个处理组:①单纯NA发酵液(CK);②NA发酵液离心后的上清液(NA-S);③NA发酵液离心后的菌体重悬于等体积的无菌水(NA-C);④NA培养基添加色氨酸后的发酵液离心的上清液(TRY-S);⑤色氨酸添加后发酵液离心的菌体重悬于等体积的无菌水(TRY-C)中。将以上处理液浸泡灭菌的辣椒种子10 min后,播种。待辣椒苗长到两叶一心的时候,取样测量辣椒苗的根长、株高、茎粗(游标卡尺测量)和鲜质量等指标。
1.2.6 数据分析
采用Excel记录并处理相关实验数据,采用ANOVA进行单因素方差分析,用Origin 9.0(Origin Lab公司)绘图。
2 结果与讨论
2.1 色氨酸加量对P. putida Rs-198生长和IAA产量的影响
考察外源添加不同量的色氨酸对P.putidaRs-198生长和IAA产量的影响,结果见图1。由图1可知:与单纯的NA培养基培养相比,虽然添加色氨酸并没有显著影响P.putidaRs-198细胞的生长,但是IAA的产量随色氨酸加量的增加会显著增加,当色氨酸的质量浓度分别为50、100、150和200 mg/L时,IAA的产量分别是不添加色氨酸发酵液的2.47倍、4.02倍、4.88倍和5.07倍。另外,培养基中色氨酸终质量浓度为200 mg/L时的IAA产量是为50 mg/L色氨酸的2倍,然而细胞数量却相对减少了21%。但是与Myo等[21]添加不同浓度色氨酸对NKZ-259菌株产IAA的研究结果不一致,当色氨酸为10 g/L时,IAA的产量仅为40.22 mg/L。这可能是因为过高的色氨酸对细胞的渗透压产生了不利影响,影响了菌株细胞的生长。因此,综合考虑P.putidaRs-198菌株的其他促生特性,选择50 mg/L色氨酸加量进一步探究其对P.putidaRs-198的细胞生长和IAA产量的关系。
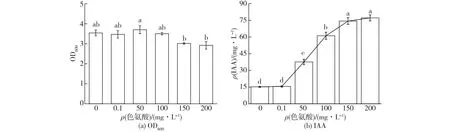
图1 色氨酸浓度对P. putida Rs-198的生长及IAA产量的影响Fig.1 Effects of tryptophan concentrations on P. putida Rs-198 growth and IAA production
在上述实验的基础上,考察添加50 mg/L色氨酸对P.putidaRs-198生长曲线及IAA产量的影响,结果见图2。由图2可知:外源添加色氨酸并未对P.putidaRs-198的生长曲线,尤其是各生长期的长短产生影响,P.putidaRs-198细胞生物量在2个处理组中均在培养24 h时达到最大;两个处理组的P.putidaRs-198的IAA产量都会随发酵时间延长逐渐增加,经50 mg/L色氨酸处理后,IAA产量显著高于对照组,并且在96 h时IAA产量可以达到55.52 mg/L,是对照组(15.53 mg/L)的3.58倍。而Liu等[13]研究发现,菌株B.pyrrociniaJK-SH007的IAA产量会随着色氨酸浓度的增加而持续升高,但是当色氨酸的质量浓度为8.0~10.0 mg/mL时,合成的IAA开始减少,但是依然高于对照组的产量,且在36 h时到达最大(6.969 mg/L)。这主要可能是由于在6~24 h期间为细胞生长的对数期,细胞快速分裂,即24~36 h为生长稳定期,细菌在生长后期开始产生并积累次级代谢产物IAA。类似的,色氨酸的添加不会显著影响菌株R.tropiciCIAT 899的生长曲线,并且其产生的IAA的量也是开始时缓慢,中期稳定,中后期达到最大(47.83 mg/L)[22]。
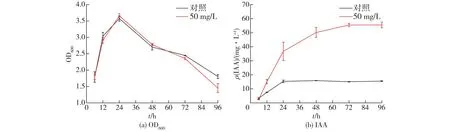
图2 色氨酸对P. putida Rs-198生长曲线和IAA产量影响Fig.2 Effects of exogenous tryptophan on P. putida Rs-198 growth and IAA production
2.2 P. putida Rs-198合成IAA中间代谢产物分析
2.2.1 吲哚丙酮酸添加对P.putidaRs-198代谢产物的影响
在P.putidaRs-198的发酵培养基中添加吲哚丙酮酸(IPyA),以判断其是否可以利用IPyA合成IAA,结果见图3。由图3可知:发酵3 h时,IAA的产量为4.60 mg/L;而12 h时,IAA的含量达到20.94 mg/L,是不添加IPyA处理组的2.16倍,且此时IPyA已被完全消耗殆尽。另外,IPyA的下游另一类产物吲哚-3-乳酸(ILA)从3 h起就有较高的含量,但是随时间延长并未有明显变化,而IAA的量却在逐渐增加,表明IPyA在发酵3 h之后的消耗主要是在向IAA转化,有可能是因为P.putidaRs-198菌株含有充足的吲哚丙酮酸脱羧酶及醛脱氢酶,使得IPyA不断向IAA转化。然而,添加色氨酸后,P.putidaRs-198菌株中IAA的量并不会无限制增长,这可能是因为此菌缺乏从色氨酸到吲哚丙酮酸转化的氨基转移酶,所以推断P.putidaRs-198依赖IPyA途径合成IAA,这是主要限速步骤。而Koga等[23]发现,在最高添加1 mg/mL色氨酸的肠杆菌发酵液中,同时检测到了IAA、ILA和吲哚-3-乙醇(TOL),但是在有氧条件下IAA的产量较高,而在少氧条件下,ILA和TOL的产量则要高一些,充分说明肠杆菌通过IPyA和吲哚乙醛(IAAld)将色氨酸转化为IAA。
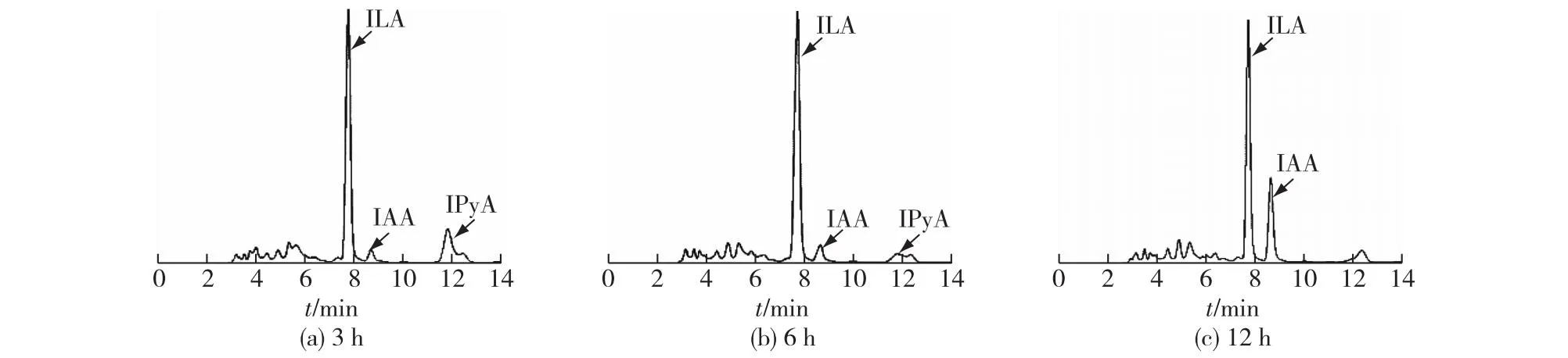
图3 IPyA添加对P. putida Rs-198合成IAA的影响Fig.3 Effects of IPyA on IAA production in P. putida Rs-198
2.2.2 色胺添加对P.putidaRs-198代谢产物的影响
考察外源添加色胺(TAM)对P.putidaRs-198代谢产物的影响,结果见图4。由图4可知:在发酵3 h时,发酵液中的TAM的含量较高,且未检测到IAA;而在6和12 h时,TAM峰面积减小的同时,IAA的峰面积却逐渐增大,表明P.putidaRs-198可以利用TAM途径合成IAA。同时发现,在12 h时,发酵液中仍有TAM,表明P.putidaRs-198可以TAM为底物合成IAA,但是该途径中催化IAA转化的色胺氧化酶或醛脱氢酶产量有限,限制了其向IAA的不断转化。结合IPyA途径的醛脱氢酶量充足可以推断,色胺氧化酶为P.putidaRs-198可通过TAM途径利用色氨酸合成IAA,色胺氧化酶是主要限速酶。
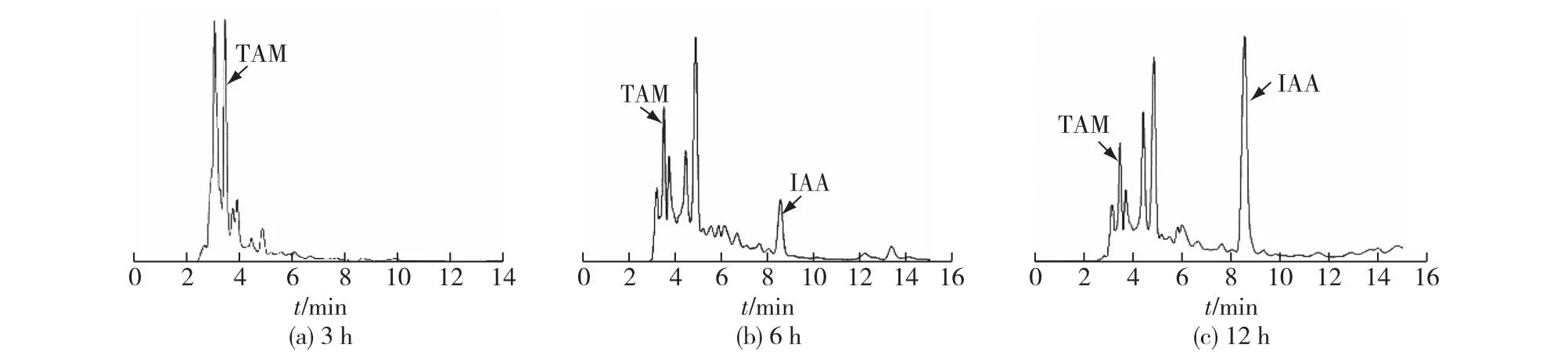
图4 添加TAM对P. putida Rs-198合成IAA的影响Fig.4 Effects of TAM addition on IAA production in P. Putida Rs-198
2.3.3 吲哚乙酰胺添加对P.putidaRs-198代谢产物的影响
考察外源添加吲哚乙酰胺(IAM)对P.putidaRs-198代谢产物的影响,结果见图5。由图5可知:在发酵培养3、6和12 h时,IAM的浓度并没有发生明显的变化;与不添加IAM相比,IAA的产量变化也不显著,分别为0.56、1.50和8.32 mg/L,表明P.putidaRs-198菌株可能无法利用外源添加的IAM来合成IAA。
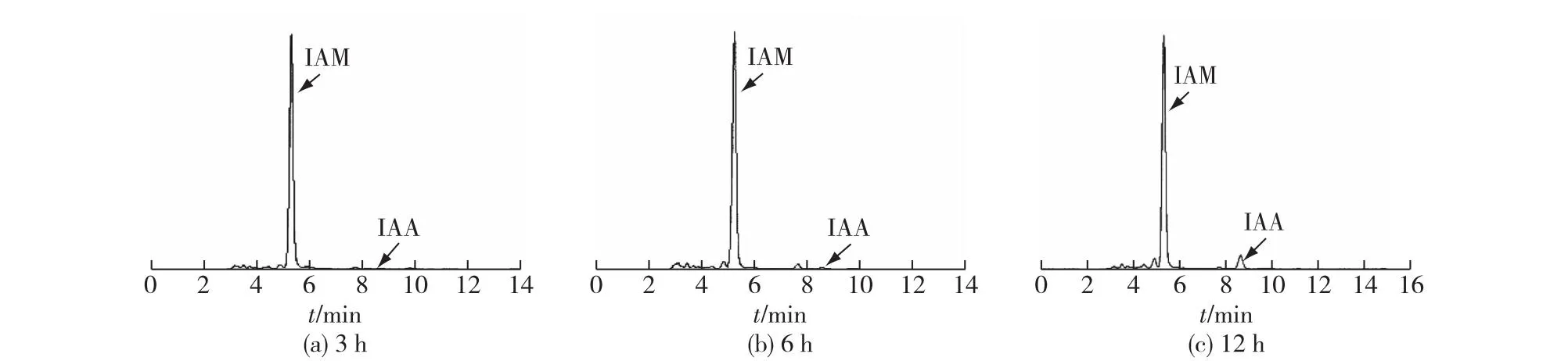
图5 外源添加IAM对IAA合成的影响Fig.5 Effects of IAM addition on IAA production in P. putida Rs-198
2.2.4 吲哚乙腈添加对P.putidaRs-198代谢产物的影响
考察外源添加吲哚乙腈(IAN)对P.putidaRs-198代谢产物的影响,结果见图6。由图6可知:与添加IAM类似,发酵培养3、6和12 h时, IAN的浓度并没有产生明显的变化,特别12 h时发酵液中IAA的浓度与对照相比反而减少了59.37%,可以推断,P.putidaRs-198并不能利用外源添加的IAN合成IAA。
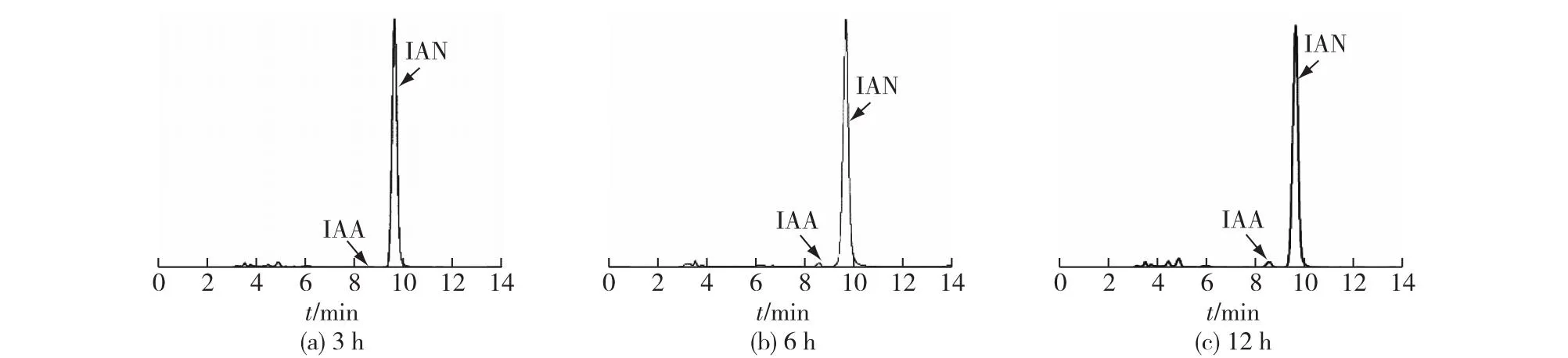
图6 外源添加IAN对P. putida Rs-198 IAA合成的影响Fig.6 Effects of exogenous addition of IAN on IAA production in P. Putida Rs-198
2.3 P. putida Rs-198菌株中与IAA合成相关酶编码基因分析
对P.putidaRs-198进行了全基因组测序和KEGG功能注释,结果见表1。由表1可知:在KEGG的mapko00380色氨酸代谢途径中,5个与IAA相关酶编码基因被鉴定出来,其中,有吲哚乙酰胺途径的单加氧酶(IaaM,EC 1.13.12.3)、吲哚乙酰胺水解酶(AmiE,EC 3.5.1.4)。目前,IAM途径是细菌研究最为深入的吲哚乙酸合成途径,IAA合成前体色氨酸首先由色氨酸单加氧酶(IaaM)氧化为IAM,第二步是IAM水解酶将IAM转化为IAA和氨,这一途径也为植物提供了额外的氮源,然而这一途径产生的IAA只占IAA总合成量的1%[2]。因此,这也解释了为什么P.putidaRs-198全基因组数据分析结果中同时含有色氨酸单加氧酶(IaaM)和酰胺酶(AmiE)。但本研究结果显示,额外添加的IAM并未明显增加IAA合成的产量。此外,吲哚乙腈途径中的腈水解酶(nitrilase,EC 3.5.5.1)被注释,但没有发现从色氨酸到吲哚乙腈反应途径的氧化还原酶和醛肟水解酶。同时还发现,参与色胺途径、吲哚丙酮酸、色氨酸侧链氧化途径中的醛脱氢酶(EC 1.2.1.3)以及色胺到吲哚-3-乙醛的色氨酸氧化酶(MAO,EC 1.4.3.4),但是没有发现从色氨酸到色胺反应途径的色氨酸脱羧酶、吲哚-3-乙醛的氨基转移酶和吲哚丙酮酸脱脱羧酶以及色氨酸侧链氧化酶。这与在添加TAM以及IPyA对P.putidaRs-198代谢产物的影响结果一致,TAM、IPyA消耗的同时,IAA逐渐增加,说明该菌中含有色胺氧化酶和醛脱氢酶。
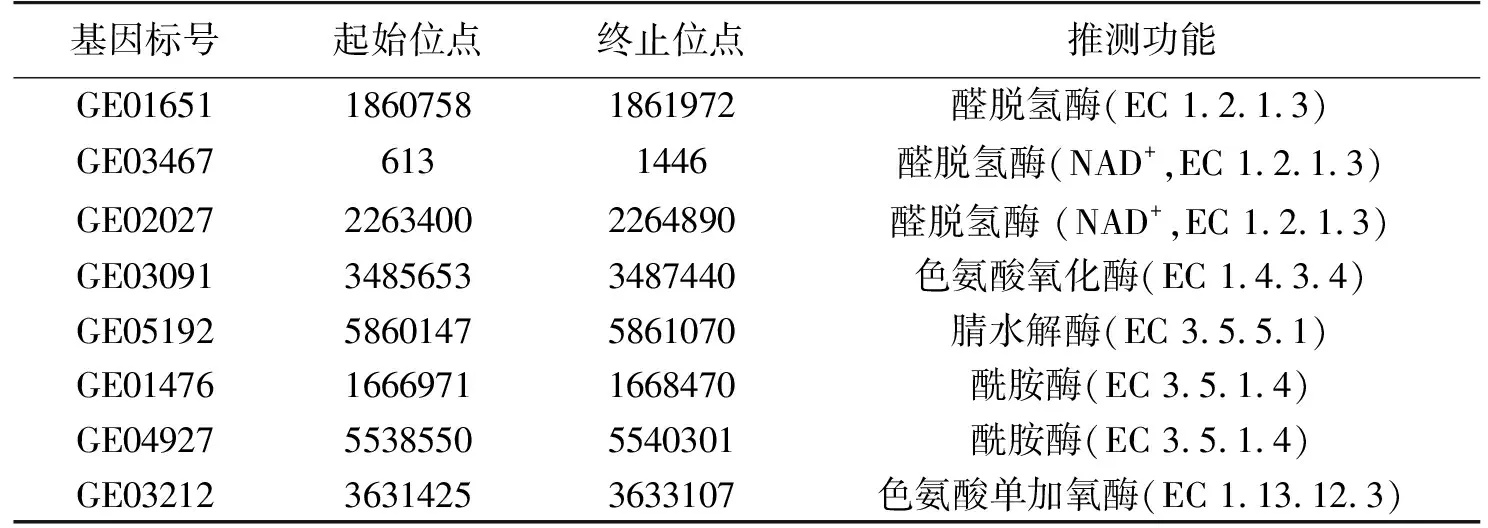
表1 P. putida Rs-198合成IAA的基因信息及功能注释
因此推测的P.putidaRs-198菌株IAA合成途径如图7所示,绿色斜体字为菌株编码的相关酶,蓝色表示可以利用的中间物。粗箭头表示丙酮酸脱羧酶和色胺氧化酶催化吲哚丙酮酸和色胺生成产物吲哚乙醛以及醛脱氢酶在途径中占主导地位。
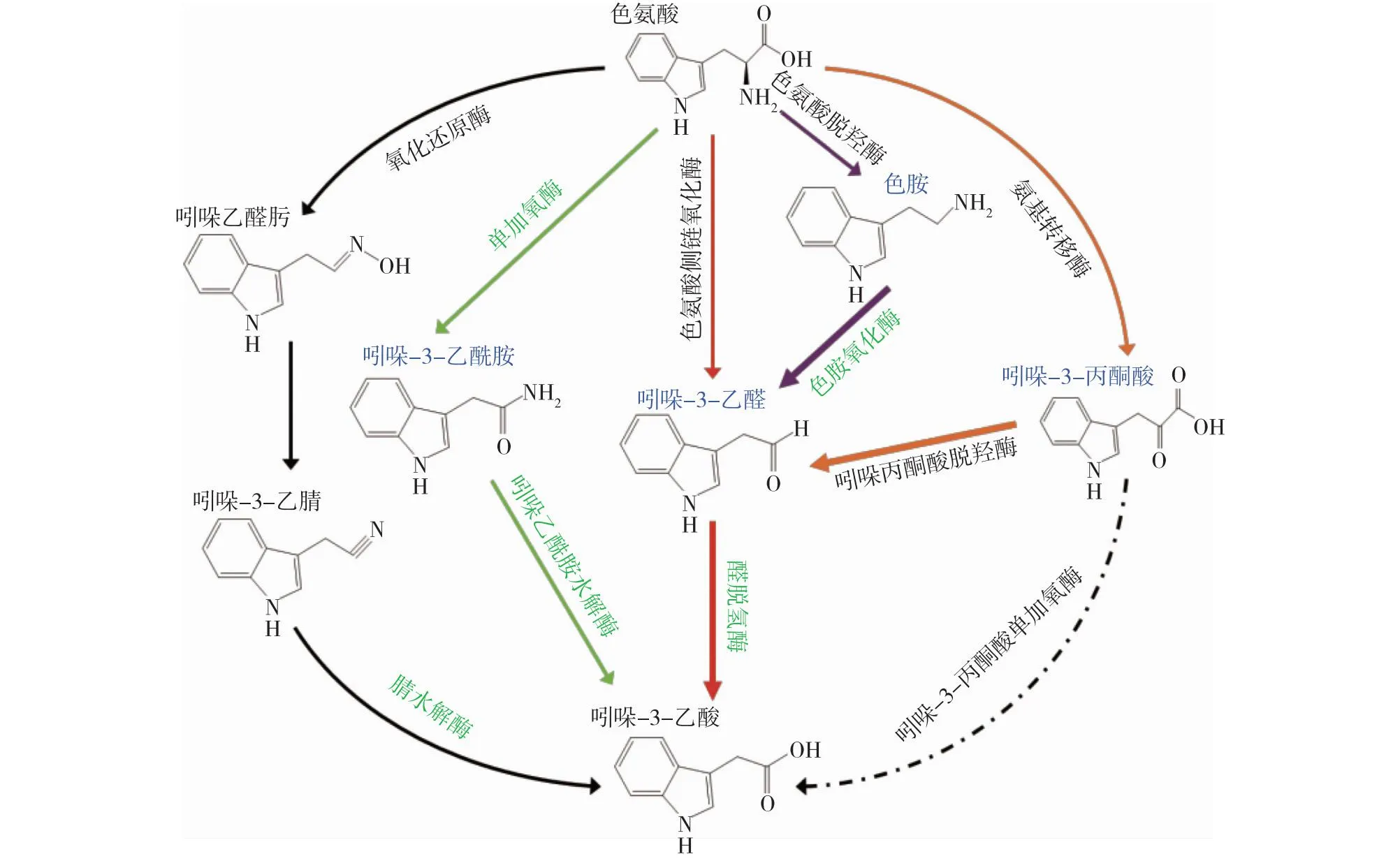
图7 P. putida Rs-198菌株IAA合成途径推测Fig.7 IAA synthetic pathway speculation of P. putida Rs-198
2.4 添加色氨酸培养的P. putida Rs-198对辣椒生长影响
利用盆栽实验比较添加色氨酸的发酵液对辣椒生长的影响,结果见表2。由表2可知:NA-S和NA-C处理组与全发酵液组相比,并不能显著影响辣椒植株的生长;添加色氨酸之后再培养P.putidaRs-198获得的发酵液,其上清液(Try-S)和菌悬液(Try-C)都可以明显促进辣椒的根长、株高和茎粗,根长分别增长了35.31%和21.34%、株高分别增高了31.99%和18.73%、茎粗分别增加了22.75%和11.51%。这可能是因为色氨酸的添加促进P.putidaRs-198合成的大量IAA,主要积累在上清液中。可见,外源添加色氨酸发酵P.putidaRs-198可以促进辣椒苗的生长。这与文献[9,24]的结果较为一致。因此,在应用P.putidaRs-198时,在它的培养基中补充关键氨基酸色氨酸将会使其在土壤中发挥更好的促生效果。
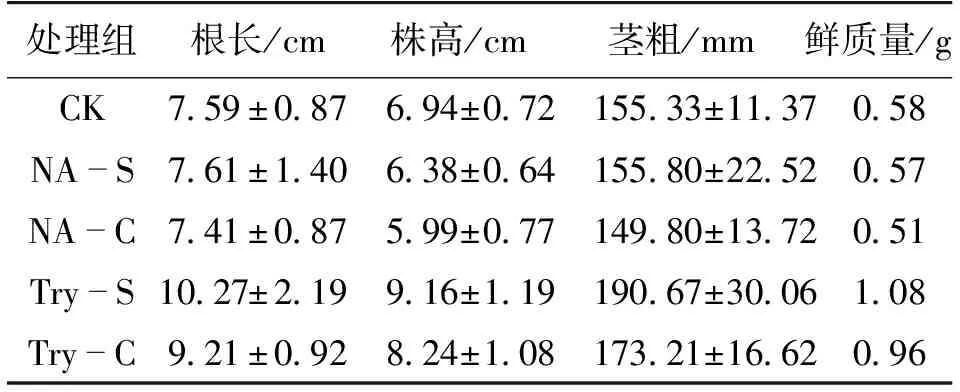
表2 色氨酸发酵液对辣椒苗生物量的影响
3 结论
经研究发现,添加低浓度色氨酸对P.putidaRs-198菌株的生长不产生影响,但是其IAA合成量却可以随着色氨酸加量的增加而显著增加;50 mg/L色氨酸为最佳加量,可用于P.putidaRs-198生长曲线及IAA合成途径分析。在P.putidaRs-198中,对色氨酸到IAA的途径分析结果表明,IPyA和TAM为P.putidaRs-198合成IAA利用的主要中间物,也是主要合成途径,其中色胺氧化酶为限速酶。另外,IAM和IAN的添加并不影响P.putidaRs-198合成IAA。盆栽实验表明,添加50 mg/L色氨酸培养P.putidaRs-198后的发酵上清液和菌悬液都可以明显增加辣椒苗的生物量,充分证明P.putidaRs-198菌株可以利用色氨酸合成IAA,是非常有潜力的新型植物促生菌剂。

