灯盏花素对心肌缺血再灌注损伤大鼠的心肌保护作用
孙玉艳,杨 然,高丽华
1.开滦总医院心内科,唐山 063000;2.开滦总医院药剂科,唐山 063000;3.沧州市人民医院心血管内科,沧州 061001
缺血性心脏病是心内科常见的心血管疾病,其引发的急性心肌梗死及心力衰竭是心脏类疾病患者的主要死亡原因[1]。灯盏花素是从传统苗药灯盏细辛中提取制成的制剂,可扩张脑血管、增加脑部血流量,临床常用于治疗脑供血不足、脑血管意外、脑血栓等症[2-3]。有研究表明[4],其可有效降低炎性因子的表达水平,抑制氧化应激及促凋亡蛋白表达,从而对大鼠脑缺血再灌注损伤产生治疗作用。本研究通过建立心肌缺血再灌注损伤(myocardial ischemiareperfusion injury,MIRI)大鼠模型,观察灯盏花素对其心肌的保护作用,并探讨其可能的机制。
1 仪器与材料
1.1 仪器
生物机能实验仪(上海玉研科学仪器有限公司);CX33 显微镜(日本Olympus 公司)。
1.2 试药
灯盏花素(质量分数为99%,上海曙灿实业有限公司);肌酸激酶同工酶(MB isoenzyme of creatine kinase,CK-MB)、心肌肌钙蛋白T(cardiac troponin T,cTnT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒均购自上海抚生实业有限公司;兔抗大鼠白细胞介素-23(interleukin 23,IL-23)、白细胞介素-17(interleukin 17,IL-17)一抗均购自艾比玛特医药科技(上海)有限公司。
1.3 动物
SD 大鼠60 只,SPF 级,雄性,8 周龄,体质量为(270±20) g,购自上海吉辉实验动物饲养有限公司,生产许可证号为SCXK(沪)2017-0012。
2 方法
2.1 分组与预干预
将大鼠适应性饲养1 周后随机分为健康组、模型组、灯盏花素低剂量组、灯盏花素高剂量组,各15 只;参照文献方法[5],灯盏花素低剂量组、灯盏花素高剂量组大鼠腹腔注射灯盏花素生理盐水溶液(50、100 mg·kg-1);健康组、模型组大鼠腹腔注射等体积生理盐水。每日1 次,干预5 d[5]。
2.2 MIRI 模型的建立
大鼠末次干预结束禁食禁水12 h,腹腔注射戊巴比妥钠麻醉大鼠,仰卧位固定于工作台,颈部、胸腹部备皮消毒,生物机能实验仪连接四肢记录心电图,切开颈部及气管,气管插管并连接小动物呼吸机机械通气,开胸暴露心脏,撕开心包膜,将一直径为2 mm 消毒软管与冠状动脉左前支一并结扎,30 min 后松开结扎线、取出软管,再灌注2 h。以结扎后心电图ST 段显著升高、再灌注后ST 段自高点下降1/2 以上为建模成功[6]。模型组、灯盏花素低剂量组、灯盏花素高剂量组大鼠建立MIRI 模型,健康组仅插管开胸,不进行结扎操作,各组均纳入10 只进行后续实验。
2.3 心电图指标的检测
用生物机能实验仪记录并分析再灌注过程中大鼠室颤(ventricular fibrillation,VF)、室性心动过速(ventricular tachycardia,VT)的发生次数、持续时间。
2.4 组织取材
再灌注结束后,采集大鼠腹主动脉血,低温离心机离心10 min (3 000 r·min-1,离心半径为8 cm),置于4 ℃冰箱中冷藏保存;采血后脊椎脱臼处死大鼠,迅速摘取心脏,切取部分心肌组织分成2份,1 份置于多聚甲醛溶液(40 g·L-1)中保存24 h,常规脱水、透明、浸蜡、包埋,切成厚度为4 μm 的切片用于组织病理观察;1 份置于-80 ℃冰箱中冷冻保存,用于蛋白检测。剩余部分心脏置于-80 ℃冰箱中冷冻20 min 后,取出,用于2,3,5-氯化三苯基四氮(2,3,5-triphenyltetrazolium chlorid,TTC)染色实验。
2.5 TTC 染色检测心肌梗死面积
取冷冻20 min 的剩余心脏,自结扎以下均匀切为厚度为2 mm 的心肌切片4 片,浸入TTC 溶液室温染色30 min,PBS 清洗,40 g·L-1多聚甲醛固定,采集照片后用Image 软件分析红、白二色区域的面积,计算心肌梗死面积。心肌梗死面积=(白色面积/红色面积)×100%。
2.6 血清心肌损伤指标的检测
取冷藏保存的部分血清,经酶联免疫吸附试验(ELISA)检测血清心肌损伤指标CK-MB、cTnT活性水平,根据试剂盒说明书操作,用酶标仪测定450 nm 处的吸光度(A)值,绘出曲线,计算CK-MB、cTnT 活性。
2.7 血清氧化应激指标的检测
取冷藏保存的部分血清,用TBA 法、WST-8 法检测血清氧化应激指标MDA 和SOD 水平,按照试剂盒说明书要求设计实验步骤,计算血清MDA 质量浓度、SOD 活性。
2.8 血清炎性因子的检测
取冷藏保存的部分血清,经ELISA 检测血清炎性因子TNF-α、IL-1β水平,根据试剂盒说明书操作,用酶标仪测定570 nm 处的A值,绘出曲线,计算TNF-α、IL-1β的质量浓度。
2.9 HE 染色观察心肌组织的病理学变化
取心肌组织切片,用二甲苯脱蜡,用梯度酒精水化,用自来水冲洗,经苏木精液染色5 min,用自来水冲洗,用盐酸酒精分化,用氢氧化钠溶液漂洗,用伊红液染色2 min,常规脱水、透明,用中性树脂封片,于显微镜下观察心肌组织的病理改变。
2.10 检测心肌组织IL-23、IL-17 蛋白的表达水平
取冷冻保存的心肌组织,剪碎后用研磨机研磨、匀浆,加入预冷的RIPA 裂解细胞,用低温离心机离心12 min(8 000 r·min-1,离心半径为10 cm),取上清液,经BCA 试剂盒提取总蛋白并定量。取40 μg,以体积比1∶4 混合上样缓冲液,金属浴煮沸5 min,同上述离心方法离心,取上清液,恒压下电泳分离,转至PVDF 膜,用BSA 封闭液封闭2 h,加入兔抗大鼠IL-23、IL-17 一抗(1∶500),4 ℃冷藏过夜,用TBST 清洗,加入二抗(1∶2 000),常温孵育2 h,用TBST 清洗,ECL 液发光,暗盒显色,经凝胶分析仪扫描分析蛋白条带灰度值,以IL-23、IL-17 蛋白灰度值与内参GAPDH 灰度值之比表示IL-23、IL-17蛋白的相对表达量。
2.11 统计学方法
用SPSS 21.0 统计学软件分析数据,用(±s)表示计量资料,以多因素方差分析检验多样本计量资料,以LSD-t检验分析两两样本。P<0.05 表示差异有统计学意义。
3 结果
3.1 大鼠心电图指标的比较
与模型组比较,灯盏花素低剂量和灯盏花素高剂量组大鼠VF、VT 发生次数减少,VF、VT 持续时间缩短,灯盏花素高剂量组的变化更显著(P<0.05)。见表1。
表1 各组大鼠心电图指标的比较 (n=10,±s)Tab.1 Comparison of electrocardiogram indexes of rats in each group (n=10,±s)

表1 各组大鼠心电图指标的比较 (n=10,±s)Tab.1 Comparison of electrocardiogram indexes of rats in each group (n=10,±s)
注:与模型组比较,aP<0.05;与灯盏花素低剂量组比较,bP<0.05。
组别模型组灯盏花素低剂量组灯盏花素高剂量组VF 发生次数/次9.50±0.90 5.10±0.60a 2.70±0.30b VF 持续时间/min 23.43±2.52 17.44±2.15a 11.05±0.96b VT 发生次数/次9.40±0.9 5.80±0.60a 4.10±0.50b VT 持续时间/min 24.43±2.43 20.66±2.72a 14.81±1.85b
3.2 大鼠心肌梗死面积的比较
与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组大鼠心肌梗死面积占比降低,灯盏花素高剂量组的变化更显著(P<0.05)。见表2。
表2 各组大鼠心肌梗死面积占比的比较 (n=10,±s)Tab.2 Comparison of the proportion of myocardial infarction area in each group of rats (n=10,±s)

表2 各组大鼠心肌梗死面积占比的比较 (n=10,±s)Tab.2 Comparison of the proportion of myocardial infarction area in each group of rats (n=10,±s)
注:与模型组比较,aP<0.05;与灯盏花素低剂量组比较,bP<0.05。
组别模型组灯盏花素低剂量组灯盏花素高剂量组心肌梗死面积占比50.32%±5.41%41.70%±4.44%a 25.42%±2.51%b
3.3 大鼠血清心肌损伤指标的比较
与健康组比较,模型组血清CK-MB、cTnT 活性升高(P<0.05);与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组血清CK-MB、cTnT 活性降低,灯盏花素高剂量组的变化更显著(P<0.05)。见表3。
表3 各组大鼠血清心肌损伤指标CK-MB、cTnT 活性的比较 (n=10,±s)Tab.3 Comparison of serum myocardial injury indexes CKMB and cTnT activity levels in each group (n=10,±s)

表3 各组大鼠血清心肌损伤指标CK-MB、cTnT 活性的比较 (n=10,±s)Tab.3 Comparison of serum myocardial injury indexes CKMB and cTnT activity levels in each group (n=10,±s)
注:与健康组比较,aP<0.05;与模型组比较,bP<0.05;与灯盏花素低剂量组比较,cP<0.05。
组别健康组模型组灯盏花素低剂量组灯盏花素高剂量组CK-MB/(ng·mL-1)0.99±0.11 6.56±0.65a 4.46±0.64b 2.14±0.23c cTnT/(ng·L-1)44.83±4.07 149.91±17.84a 121.23±12.20b 85.34±10.13c
3.4 大鼠血清氧化应激指标水平的比较
与健康组比较,模型组血清MDA 水平升高、SOD 活性降低(P<0.05);与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组血清MDA 水平降低,SOD 活性升高,灯盏花素高剂量组的变化更显著(P<0.05)。见表4。
表4 各组大鼠血清氧化应激指标MDA、SOD 活性的比较 (n=10,±s)Tab.4 Comparison of serum oxidative stress indexes MDA and SOD activity in each group (n=10,±s)
表4 各组大鼠血清氧化应激指标MDA、SOD 活性的比较 (n=10,±s)Tab.4 Comparison of serum oxidative stress indexes MDA and SOD activity in each group (n=10,±s)
注:与健康组比较,aP<0.05;与模型组比较,bP<0.05;与灯盏花素低剂量组比较,cP<0.05。
组别健康组模型组灯盏花素低剂量组灯盏花素高剂量组MDA/(nmol·mL-1)0.40±0.05 2.30±0.32a 1.43±0.13b 0.68±0.08c SOD/(U·mL-1)93.19±9.88 55.88±6.58a 58.48±8.18b 73.30±7.62c
3.5 大鼠血清炎性因子水平的比较
与健康组比较,模型组血清TNF-α、IL-1β水平升高(P<0.05);与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组血清TNF-α、IL-1β水平降低,灯盏花素高剂量组的变化更显著(P<0.05)。见表5。
表5 各组大鼠血清炎性因子TNF-α、IL-1β 水平的比较 (n=10,±s)Tab.5 Comparison of the levels of serum inflammatory factors TNF-α and IL-1β in each group of rats (n=10,±s)
表5 各组大鼠血清炎性因子TNF-α、IL-1β 水平的比较 (n=10,±s)Tab.5 Comparison of the levels of serum inflammatory factors TNF-α and IL-1β in each group of rats (n=10,±s)
注:与健康组比较,aP<0.05;与模型组比较,bP<0.05;与灯盏花素低剂量组比较,cP<0.05。
组别健康组模型组灯盏花素低剂量组灯盏花素高剂量组TNF-α/(ng·L-1)55.64±4.68 99.71±6.92a 84.54±9.90b 69.27±7.98c IL-1β/(ng·L-1)14.28±1.58 62.61±7.61a 41.81±4.98b 29.80±2.94c
3.6 大鼠心肌组织的病理变化
HE 染色结果显示,健康组心肌细胞形态结构完整,边界清晰可见;模型组心肌细胞肿胀变形,细胞核溶解深染,心肌结构断裂,界限不清,可见大量炎性细胞浸润;灯盏花素低剂量组、灯盏花素高剂量组心肌细胞水肿减轻,细胞核溶解减少,细胞排列较松散但边界可见,灯盏花素高剂量组的变化更显著。见图1。
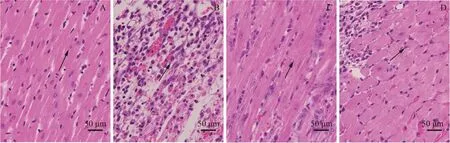
图1 HE 染色观察心肌组织病理变化(×400)Fig.1 The pathological changes of myocardial tissue observed by HE staining (×400)
3.7 大鼠心肌组织IL-23、IL-17 蛋白表达水平的比较
与健康组比较,模型组心肌组织IL-23、IL-17 蛋白的表达水平升高(P<0.05);与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组心肌组织IL-23、IL-17 蛋白的表达水平降低,灯盏花素高剂量组降低更显著(P<0.05)。见表6、图2。
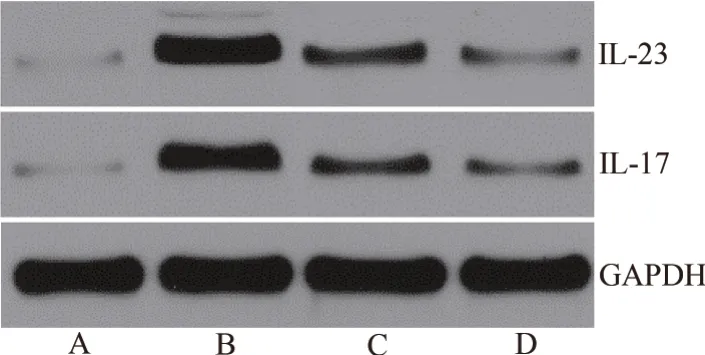
图2 Western blotting 检测心肌组织IL-23、IL-17 蛋白的表达水平Fig.2 Western blotting method to detect the protein expression of IL-23 and IL-17 in myocardial tissue
表6 各组大鼠心肌组织IL-23、IL-17 蛋白表达水平的比较(n=10,±s)Tab.6 Comparison of IL-23 and IL-17 protein expression in myocardial tissue of rats in each group (n=10,±s)
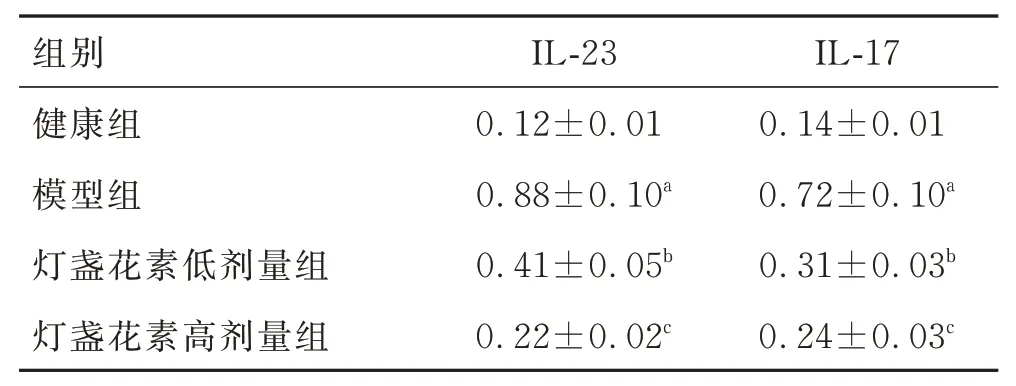
表6 各组大鼠心肌组织IL-23、IL-17 蛋白表达水平的比较(n=10,±s)Tab.6 Comparison of IL-23 and IL-17 protein expression in myocardial tissue of rats in each group (n=10,±s)
注:与健康组比较,aP<0.05;与模型组比较,bP<0.05;与灯盏花素低剂量组比较,cP<0.05。
组别健康组模型组灯盏花素低剂量组灯盏花素高剂量组IL-23 0.12±0.01 0.88±0.10a 0.41±0.05b 0.22±0.02c IL-17 0.14±0.01 0.72±0.10a 0.31±0.03b 0.24±0.03c
4 讨论
MIRI 指心肌缺血一段时间后恢复血供,缺血心肌组织反而产生更严重损伤的病理过程,心肌超微结构在缺血期损伤后进一步变化,表现为心肌肌原纤维膜挛缩破裂,线粒体嵴断裂、溶解[7]。再灌注治疗后冠状动脉疏通,梗死区血氧供给恢复,缺血期引发的损伤性变化更为突出,可造成肌张力及血压骤降、电解质紊乱、电生理异常,导致心肌顿抑、心律失常[8-9]。
MIRI 发病机制复杂,多认为是氧化应激损伤、细胞内钙离子超载、炎症反应爆发及细胞凋亡、自噬等多种因素相互作用的结果,其中过度的炎症反应被认为是其发病的重要机制之一[10]。MIRI 发生后大量中性粒细胞活化,产生呼吸爆发,过量氧自由基损伤血管内皮细胞,吸附免疫细胞并刺激其释放炎性介质,促进中性粒细胞浸润,进一步强化炎症反应,加剧心肌组织损伤[11]。因此,寻找高效安全、抑制心肌组织免疫及炎症反应的新治疗药物或方式对改善MIRI 患者的预后意义重大。
CK-MB 主要存在于心肌组织,当心肌缺血发生后,其血清含量显著升高,其是机体重要的心肌损伤指标,cTnT 是心肌细胞内特异性蛋白,当心肌细胞损伤后,其可迅速进入血液循环,高特异性地反映心肌损伤程度[12-13]。灯盏花素是中药灯盏细辛的主要活性物质,作为一种天然植物黄酮,可抑制血管内皮细胞过氧化损伤,减缓血小板凝聚,改善血液微循环[14]。有研究表明[15-16],灯盏花素可抑制心肌细胞氧化应激反应及细胞凋亡,减轻LPS 诱导的心肌细胞损伤,表明其可作为心肌损伤潜在治疗药物。本研究结果显示,与模型组比较,灯盏花素低剂量组、灯盏花素高剂量组大鼠VF、VT 发生次数减少,心肌梗死面积占比减少,血清CK-MB、cTnT 活性降低,MDA、TNF-α、IL-1β水平降低,VF、VT 持续时间缩短,血清SOD 活性升高,表明灯盏花素可缓解心律失常、减轻心肌损伤及氧化应激反应、炎症反应。
IL-23/IL-17 轴是新发现的一条免疫炎症轴,在多种炎性及自身免疫性疾病发生和发展过程中扮演重要角色,IL-23、IL-17 是该轴的重要调控因子[17-18]。其由IL-23 p19、IL-12 p50 2 个亚单位结合而成,以异二聚体形态发挥生物学作用,其与受体相互作用,激活下游JAK/STAT 通路,同时可诱导初始CD4+T细胞分化为Th17 细胞,IL-23 与STAT3 共同作用促使其分泌促炎因子IL-17,IL-17 又促进前炎症因子TNF-α、IL-1β及多种趋化因子的分泌,进一步加重机体炎症反应,损害心肌组织[19]。GEHA M 等[20]研究认为,抑制IL-23/IL-17 轴活性可减轻小鼠炎症反应及中性粒细胞浸润,治疗夹闭肠系膜上动脉诱发的小肠缺血再灌注损伤,表明IL-23/IL-17 轴在缺血再灌注损伤中的重要作用。本研究结果显示,与健康组比较,模型组心肌组织IL-23、IL-17 蛋白表达水平升高,经灯盏花素干预后两者的水平均降低,且表现为剂量依赖,表明IL-23/IL-17 轴在MIRI中处于异常激活状态,而灯盏花素可能通过抑制该轴活性保护MIRI 大鼠的心肌。
综上所述,灯盏花素可缓解MIRI 大鼠心律失常、减轻心肌损伤及氧化应激反应、炎症反应,推测其作用机制可能与抑制IL-23/IL-17 轴的活性有关。

