人参皂苷Rg3对人晶状体上皮细胞氧化应激损伤的影响
张 可,李 莉
1.河南省许昌市鄢陵县中医院眼科,许昌 461200;2.郑州大学第一附属医院眼科,郑州 450000
年龄相关性白内障是一种以晶状体进行性浑浊为特征的致盲性眼病。晶状体上皮细胞是晶状体的一道生物屏障,研究发现,氧化应激造成晶状体上皮细胞氧化损伤和细胞凋亡是导致白内障的主要机制之一[1]。人参皂苷Rg3可缓解过氧化氢诱导的人肾小球系膜细胞氧化应激损伤,抑制肾小球系膜细胞凋亡[2]。人参皂苷Rg3可增强糖尿病肾病大鼠血清中抗氧化酶的活性,抑制肾脏细胞凋亡[3]。核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase 1,HO-1)信号通路与氧化应激密切相关,苦参水提取物通过激活Nrf2/HO-1 信号通路抑制脂多糖诱导的巨噬细胞炎症反应和氧化应激[4]。柚皮素通过激活Nrf2/HO-1 信号通路增强糖尿病小鼠抗氧化反应,可降低心肌炎症反应,抑制心肌细胞凋亡[5]。本研究通过过氧化氢诱导建立晶状体上皮细胞氧化应激损伤模型,探讨人参皂苷Rg3 对晶状体上皮细胞氧化应激损伤的缓解作用及其机制。
1 仪器与材料
1.1 仪器
全自动酶标仪(美国Bio-Rad 公司);电泳仪(美国BD 公司)。
1.2 试药
人参皂苷Rg3(成都曼思特生物科技有限公司);超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSH-Px)及丙二醛(malondialdehyde,MDA)试剂盒均购自南京建成生物工程研究所;噻唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒(上海碧云天生物科技有限公司);DMEM 培养基及胎牛血清均购自美国Gibco 公司;AnnexinV-FITC/PI 流式细胞凋亡检测试剂盒(南京凯基生物科技公司);Nrf2、Kelch 样环氧氯丙烷相关蛋白1(Kelch like epichlorohydrin related protein 1,Keap1)和HO-1 抗体均购自美国Abcam 公司;过氧化氢(美国Sigma 公司)。
1.3 细胞
人晶状体上皮细胞株SRA01/04(中国科学院上海细胞库)。
2 方法
2.1 MTT 法检测人参皂苷Rg3 对细胞存活率的影响
将复苏后的SRA01/04 细胞培养于含100 g·L-1胎牛血清的DMEM 培养基中,置于培养箱中培养,细胞生长至80%融合时,胰蛋白酶消化传代,取第3代对数生长期细胞,用DMEM 培养基将细胞制成单细胞悬液,密度为5×104个·mL-1,接种于96 孔板,每孔200 μL,用质量浓度分别为0、10、20、40、80 μg·mL-1的人参皂苷Rg3处理细胞6 h,每个质量浓度设置3 个复孔,弃掉培养基,用200 μmol·mL-1过氧化氢处理12 h,每孔加入MTT 溶液(5 g·L-1) 20 μL,置于培养箱中培养4 h,每孔加入DMSO 溶液200 μL,振荡混匀,用全自动酶标仪测定570 nm 处的吸光度(A)值。细胞存活率(%)=(实验组A值/对照组A值)×100%。
2.2 MTT 法检测细胞存活率
取第3 代对数生长期细胞,用DMEM 培养基将细胞制成单细胞悬液,密度为5×104个·mL-1,接种于96 孔板,每孔200 μL,待细胞贴壁生长后,将细胞随机分为正常组(培养基中加入DMSO)、氧化损伤组(培养基中加入过氧化氢200 μmol ·mL-1处理12 h)、人参皂苷Rg3低剂量组(培养基中先加入人参皂苷Rg340 μg·mL-1处理6 h,更换培养基后加入过氧化氢200 μmol·mL-1处理12 h)和人参皂苷Rg3高剂量组(培养基中先加入人参皂苷Rg380 μg·mL-1处理6 h,更换培养基后加入过氧化氢200 μmol·mL-1处理12 h),每组设定3 个复孔。按照2.1 项下方法测定细胞存活率。
2.3 流式细胞仪检测细胞凋亡率
取第3 代对数生长期的细胞,按照2.2 项下方法进行分组处理,预冷PBS 清洗3 次,离心后,加入结合缓冲液500 μL 将细胞重悬,再加入 Annexin V-FITC和 PI 各5 μL,充分混匀,室温下避光反应15 min,流式细胞仪检测细胞凋亡情况。
2.4 氧化应激损伤指标的检测
取第3 代对数生长期的细胞,按照2.2 项下方法进行分组处理,收集各组细胞培养上清液,根据试剂盒说明书检测SOD、MDA 和GSH-Px 含量。
2.5 蛋白印迹法(Western blotting)检测细胞中蛋白的表达情况
取第3 代对数生长期的细胞,按照2.2 项下方法进行分组处理,预冷PBS 清洗细胞3 次,加入RIPA裂解液裂解,4 ℃以12 000 r min-1离心10 min,收集上清液,用二奎啉甲酸法(bicinchoninic acid,BCA)试剂盒测定蛋白质量浓度,调整蛋白质量浓度,加入5 倍量上样缓冲液,煮沸变性。每孔加入蛋白样品20 μL,用SDS-PAGE 电泳凝胶,设定恒压120 V电泳1.5 h,设定恒流0.3 A 进行湿转,用TBST 洗膜3 次,室温封闭1 h,加入Nrf2、Keap1、HO-1 和GAPDH 一抗(1∶1 000),在4 ℃孵育过夜,用TBST洗膜3 次,加入二抗(1∶5 000),室温孵育1 h,用TBST 洗膜3 次,滴加发光液显色,用Image J 分析条带灰度值。目的蛋白相对表达量=目的蛋白灰度值/GAPDH 条带灰度值。
2.6 统计学方法
用SPSS 21.0 统计学软件分析数据,计量资料均以(±s)表示,多样本计量资料比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
3 结果
3.1 人参皂苷Rg3对细胞存活率的影响
细胞存活率随人参皂苷Rg3质量浓度的增加而升高(P<0.05)。见表1。
表1 不同质量浓度人参皂苷Rg3对细胞存活率的影响 (±s,n=3)Tab.1 Effects of different concentrations of ginsenoside Rg3 on cell survival rate (±s,n=3)

表1 不同质量浓度人参皂苷Rg3对细胞存活率的影响 (±s,n=3)Tab.1 Effects of different concentrations of ginsenoside Rg3 on cell survival rate (±s,n=3)
注:与0 μg·mL-1 比较,aP<0.05;与10 μg·mL-1 比较,bP<0.05;与20 μg·mL-1 比较,cP<0.05;与40 μg·mL-1 比较,dP<0.05。
人参皂苷Rg3质量浓度/(μg·mL-1)0 10 20 40 80 FP细胞存活率30.22%±3.39%53.69%±5.16%a 67.51%±3.67%ab 78.79%±2.61%abc 91.09%±3.78%abcd 114.118<0.001
3.2 MTT 法检测的结果
细胞存活率组间比较差异有统计学意义(P<0.05)。与正常组比较,氧化损伤组细胞存活率降低(P<0.05);与氧化损伤组比较,人参皂苷Rg3低剂量组和人参皂苷Rg3高剂量组的细胞存活率升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组的细胞存活率升高(P<0.05)。见表2。
表2 各组细胞存活率的比较 (±s,n=3)Tab.2 Comparison of cell survival rate in each group (±s,n=3)

表2 各组细胞存活率的比较 (±s,n=3)Tab.2 Comparison of cell survival rate in each group (±s,n=3)
注:与正常组比较,aP<0.05;与氧化损伤组比较,bP<0.05;与人参皂苷Rg3低剂量组比较,cP<0.05。
项目正常组氧化损伤组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组FP细胞存活率97.46%±2.03%58.14%±4.04%a 75.84%±4.12%ab 84.41%±4.51%abc 56.454<0.001
3.3 流式细胞仪检测的结果
细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与正常组比较,氧化损伤组细胞凋亡率升高(P<0.05);与氧化损伤组比较,人参皂苷Rg3低剂量组和人参皂苷Rg3高剂量组细胞凋亡率降低(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组细胞凋亡率降低(P<0.05)。 见表3、图1。

图1 流式细胞仪检测细胞凋亡情况Fig.1 The cell apoptosis detected by flow cytometry
表3 各组细胞凋亡率的比较 (±s,n=3)Tab.3 Comparison of cell apoptosis rate in each group (±s,n=3)

表3 各组细胞凋亡率的比较 (±s,n=3)Tab.3 Comparison of cell apoptosis rate in each group (±s,n=3)
注:与正常组比较,aP<0.05;与氧化损伤组比较,bP<0.05;与人参皂苷Rg3低剂量组比较,cP<0.05。
项目正常组氧化损伤组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组FP细胞凋亡率2.31%±0.31%12.63%±1.10%a 8.67%±0.59%ab 5.25%±0.39%abc 131.450<0.001
3.4 氧化应激损伤指标的检测结果
SOD、MDA 和GSH-Px 含量组间比较差异有统计学意义(P<0.05)。与正常组比较,氧化损伤组MDA 含量升高,SOD 和GSH-Px 含量降低(P<0.05);与氧化损伤组比较,人参皂苷Rg3低剂量组和人参皂苷Rg3高剂量组MDA 含量降低,SOD 和GSH-Px 含量升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组MDA 含量降低,SOD 和GSH-Px 含量升高(P<0.05)。见表4。
表4 各组细胞中SOD、MDA 和GSH-Px 含量的比较 (±s,n=3)Tab.4 Comparison of the contents of SOD, MDA and GSH-Px in each group (±s,n=3)
注:与正常组比较,aP<0.05;与氧化损伤组比较,bP<0.05;与人参皂苷Rg3低剂量组比较,cP<0.05。
项目正常组氧化损伤组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组FP SOD/(U·mL-1)84.50±7.79 31.23±7.66a 49.59±5.23ab 67.51±5.12abc 36.544<0.001 MDA/(nmol·L-1)53.03±6.78 113.10±6.16a 88.35±4.12ab 69.66±2.96abc 72.790<0.001 GSH-Px/(U·mL-1)171.23±13.23 73.74±6.88a 115.99±9.68ab 145.54±9.51abc 51.731<0.001
3.5 Western blotting 检测的结果
Nrf2、Keap1 和HO-1 蛋白的相对表达量组间比较差异有统计学意义(P<0.05)。与正常组比较,氧化损伤组Nrf2、Keap1 和HO-1 蛋白的相对表达量降低(P<0.05);与氧化损伤组比较,人参皂苷Rg3低剂量和人参皂苷Rg3高剂量组Nrf2、Keap1 和HO-1 蛋白的相对表达量升高(P<0.05);与人参皂苷Rg3低剂量组比较,人参皂苷Rg3高剂量组Nrf2、Keap1 和HO-1 蛋白的相对表达量升高(P<0.05)。 见表5、图2。

图2 细胞中各蛋白表达Western blotting 图Fig.2 The Western blotting of the expression level of proteins in cells
表5 各组细胞中Nrf2、Keap1 和HO-1 蛋白的相对表达量的比较 (±s,n=3)Tab.5 Comparison of the relative expression levels of Nrf2, Keap1 and HO-1 proteins in each group (±s,n=3)
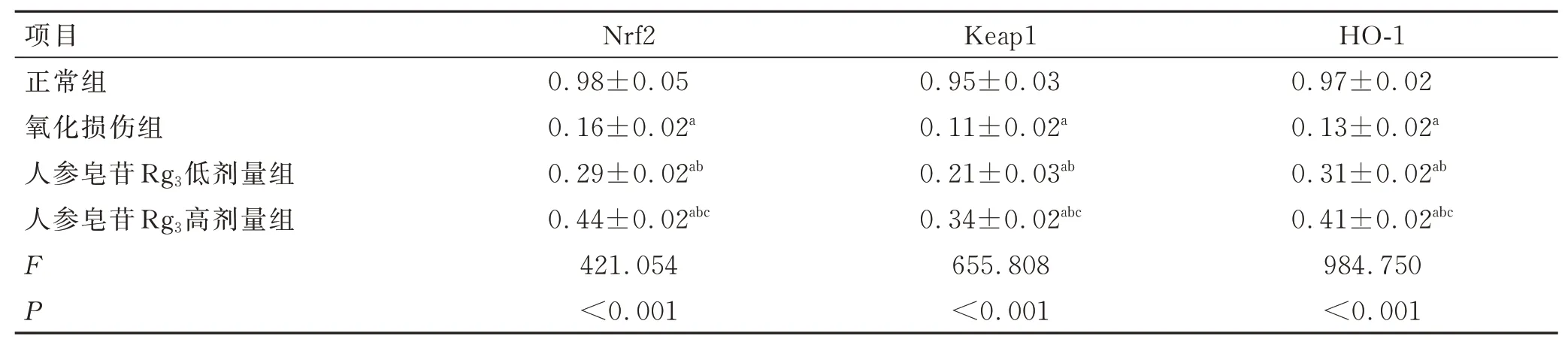
表5 各组细胞中Nrf2、Keap1 和HO-1 蛋白的相对表达量的比较 (±s,n=3)Tab.5 Comparison of the relative expression levels of Nrf2, Keap1 and HO-1 proteins in each group (±s,n=3)
注:与正常组比较,aP<0.05;与氧化损伤组比较,bP<0.05;与人参皂苷Rg3低剂量组比较,cP<0.05。
项目正常组氧化损伤组人参皂苷Rg3低剂量组人参皂苷Rg3高剂量组FP Nrf2 0.98±0.05 0.16±0.02a 0.29±0.02ab 0.44±0.02abc 421.054<0.001 Keap1 0.95±0.03 0.11±0.02a 0.21±0.03ab 0.34±0.02abc 655.808<0.001 HO-1 0.97±0.02 0.13±0.02a 0.31±0.02ab 0.41±0.02abc 984.750<0.001
4 讨论
研究发现,晶状体上皮细胞可保护晶状体免受外界刺激,但是当其在某些刺激因子作用下发生过度凋亡时,上皮细胞的数量减少,渗透性增加,晶状体纤维将无法保持透明状态,从而发生浑浊,并进展为白内障[6-7],而氧化应激引起的晶状体上皮细胞凋亡是发生白内障的机制之一[8-9]。LU B 等[10]研究发现,miR-211 表达下调可增强晶状体上皮细胞抗氧化应激能力,抑制细胞凋亡,促进细胞增殖。外源性过氧化氢可产生大量自由基,造成细胞氧化损伤,因此本研究通过过氧化氢诱导建立晶状体上皮细胞氧化应激损伤模型,探讨人参皂苷Rg3对晶状体上皮细胞氧化损伤的作用及其机制。
人参皂苷Rg3是从我国传统中药人参中提取的活性成分,具有广泛的药用价值,研究报道,人参皂苷Rg3可抑制肝癌细胞增殖和侵袭[11]。HUANG W C 等[12]研究表明,人参皂苷Rg3可降低卵清蛋白诱导的哮喘症小鼠呼吸道炎症反应和氧化应激水平,其可能是一种潜在的免疫调节剂。人参皂苷Rg3可改善对乙酰氨基酚引起的肝损伤,其主要是通过降低炎症反应和氧化应激水平、抑制肝细胞凋亡发挥作用[13]。正常生理状况下,机体抗自由基损伤的酶如SOD 和GSH-Px 可有效清除活性氧和自由基,在维持自由基产生与清除平衡方面发挥重要作用,因此SOD 和GSH-Px 是评估氧化反应的常用指标[14-15]。外源性过氧化氢可产生大量自由基,氧自由基引起细胞脂质过氧化反应,进一步生成MDA,因此MDA水平直接反映了氧自由基的代谢情况和细胞受自由基损伤的程度[16]。本研究结果显示,氧化损伤组细胞MDA 水平高于正常组,而SOD 和GSH-Px 水平低于正常组,人参皂苷Rg3低剂量组和人参皂苷Rg3高剂量组MDA 水平低于氧化损伤组,而SOD 和GSH-Px 水平高于氧化损伤组,结果表明,人参皂苷Rg3可降低过氧化氢诱导的晶状体上皮细胞氧化应激水平。研究表明,UHRF1 过表达可升高过氧化氢诱导的晶状体上皮细胞中SOD 和GSH-Px 水平,同时逆转由氧化应激引起的晶状体上皮细胞凋亡,因此UHRF1 可能成为治疗白内障的潜在治疗靶点[17]。本实验结果显示,氧化损伤组的细胞存活率低于正常组,而细胞凋亡率高于正常组,人参皂苷Rg3低剂量组和人参皂苷Rg3高剂量组的细胞存活率高于氧化损伤组,而细胞凋亡率低于氧化损伤组。结果表明,人参皂苷Rg3可抑制过氧化氢诱导的晶状体上皮细胞凋亡,提高其增殖活性。
Nrf2 是一种与抗氧化应激密切相关的核转录因子,一般情况下,Nrf2 存在于细胞质中,其被锚定于肌动蛋白细胞骨架上,与其阻遏蛋白Keap1 耦联,可被泛素化蛋白酶体降解,仅有少部分Nrf2 与Keap1解离,并转至细胞核发挥作用,Nrf2/Keap 信号通路在氧化应激反应中具有重要调控作用[18]。在氧化应激状态下,一旦受到氧自由基的作用,Nrf2 从Keap1介导的泛素化降解途径分离出来,转移入细胞核,与抗氧化反应元件结合,启动下游多种抗氧化蛋白类基因转录,调节多种抗氧化酶表达,如HO-1、SOD 以及GST 等,从而发挥细胞保护作用[19]。研究表明,葛根素通过激活Nrf2/HO-1 信号通路降低MDA 水平,增强SOD 活性,可防止糖尿病大鼠白内障的发生与进展[20]。本研究结果显示,氧化损伤组Nfr2、Keap1 和HO-1 蛋白相对表达量均低于正常组,而人参皂苷Rg3低剂量组和高剂量组Nfr2、Keap1 和HO-1 蛋白相对表达量均高于氧化损伤组。结果表明,人参皂苷Rg3可激活Nrf2/HO-1 信号通路。
综上所述,人参皂苷Rg3可抑制过氧化氢诱导的晶状体上皮细胞凋亡,提高其增殖活性,可能是通过激活Nrf2/HO-1 信号通路发挥调控作用的,可为临床治疗白内障提供理论依据。

