灯盏细辛基于Psmb8/NF-κB 轴抑制糖尿病肾病大鼠炎症反应
谷 梁,张凤强,王 磊
1.河北省眼科医院内科,邢台 050010;2.秦皇岛军工医院内分泌科,秦皇岛 066000;3.曲阳县人民医院肾内科,保定 073100
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最严重的微血管并发症之一,其特征在于血流动力学和代谢因素的相互复杂作用[1-2]。研究表明,炎症在糖尿病并发症进展中发挥关键作用,抑制炎症反应已成为DN 的潜在治疗策略[3]。β型蛋白酶体亚基8(proteasome subunitβtype 8,Psmb8)为炎症相关基因,其编码的蛋白可与Psmb9 和Psmb10 共同构成免疫蛋白酶体[4],免疫蛋白酶体则有助于调节促炎细胞因子的产生和核因子-κB(nuclear factor-κB,NF-κB)途径的激活[5],表明抑制Psmb8/NF-κB 轴可能是实现DN 抗炎的途径之一。灯盏细辛(erigeron breviscapus,EB)为灯盏花的干燥全株,主要活性成分为黄酮类化合物,具有保护神经、保护心脑血管、抗氧化、抗癌及抗炎等药理作用[6]。本研究拟通过构建DN 大鼠模型探讨EB 对DN 大鼠炎症反应的影响及可能的作用机制,以期为DN 治疗机制的研究及药物的选择提供参考。
1 仪器与材料
1.1 仪器
16580 50 型电泳仪及电泳槽均购自美国Bio-Rad公司;Spectra Max 190 型酶标仪(美国Molecular Devices 公司);MIK RO 220 型超速低温离心机(德国Hettich 公司);罗氏卓越精采型血糖仪(德国罗氏公司);RM2135 型石蜡切片机(德国徕卡公司);7180 全自动生化分析仪(日本日立公司)。
1.2 试药
灯盏细辛注射液(规格为10 mL,云南生物谷药业股份有限公司);链脲佐菌素(streptozotocin,STZ,上海源叶生物科技有限公司);大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)ELISA 试剂盒及Psmb8 抗体均购自北京索莱宝科技有限公司;核因子-κB(nuclear factor-κB,NF-κB)p65、p-NF-κB p65 抗体均购自美国CST 公司;辣根过氧化物酶标记的二抗(美国Abcam 公司)。
1.3 动物
SPF 级7 周龄雄性SD 大鼠60 只,体质量为(200±20) g,购于西安交通大学动物医学中心,许可证号为SCXK(陕西)2018-006。饲养环境:温度为20~25 ℃,相对湿度为45%~55%,12 h 光照/12 h 黑暗循环,充分给予饮水和饲料。
2 方法
2.1 动物模型的制备
60 只大鼠适应性喂养1 周后,用随机数字表选择10 只作为正常组,剩余大鼠持续4 周给予高脂饮食,正常组普通饲养。4 周后所有大鼠禁食但不禁水12 h,高脂饮食组大鼠一次性腹腔注射STZ 35 mg·kg-1,正常组大鼠腹腔注射等量生理盐水[7]。分别于注射后第3、5、7 天检测高脂饮食组大鼠尾静脉随机血糖,若有≥2 次血糖值≥16.7 mmol·L-1,则糖尿病大鼠成功造模[8]。4 周后收集所有造模大鼠尿液,检测24 h 尿蛋白(urine protein,UPro)。若UPro>30 mg·24 h-1,则为DN 大鼠造模成功[9],成功造模41 只。
2.2 分组与干预
成功造模大鼠共41 只,随机剔除1 只后,将剩余大鼠随机分为模型组、EB 低剂量组、EB 中剂量组和EB 高剂量组,每组10 只。EB 低剂量、EB 中剂量和EB 高剂量组分别灌胃EB 20、40、80 mg·kg-1·d-1,正常组和模型组大鼠给予等量生理盐水,持续给药8 周。
2.3 标本采集、血糖与生化指标的检测
给药8 周后,测量大鼠体质量;将各组大鼠分别置于独立代谢笼中,采集所有大鼠24 h 尿液,期间保证无食物残渣污染。将所采集尿液于室温环境下以3 000 r·min-1离心(离心半径为10 cm)10 min,吸取上清液,保存于-80 ℃冰箱中备用,检测UPro。采集尾静脉血,用血糖仪测定空腹血糖(fasting blood glucose,FBG)。用20 g·L-1戊巴比妥钠2.5 mL·kg-1麻醉大鼠后,取下腔静脉血液,4 ℃静置过夜收集血清,置于-80 ℃冰箱中保存。
取所有大鼠双侧肾脏,用4 ℃的生理盐水冲洗,滤纸吸干后称定质量并计算肾脏指数(kidney index,KI),KI=双侧肾脏质量/大鼠体质量。取左肾置于100 mL·L-1的中性甲醛中固定,做病理检查;右肾取新鲜肾组织100 mg,加生理盐水(1∶9)进行匀浆,以3 500 r·min-(1离心半径为10 cm)离心15 min,取上清液于-80 ℃冰箱保存,用于相关分子检测,剩余右肾组织置于液氮中冻存备用。
2.4 肾组织病理学的观察
组织常规固定、脱水透明及石蜡包埋切片后,切片常规脱蜡入水,用苏木素染细胞核1~2 min,水洗,用10 mL·L-1的盐酸乙醇分化数秒,水洗,用氨水反蓝数秒,用流水冲洗,镜下观察细胞核成蓝色,用伊红染色数秒,水洗,梯度乙醇脱水,用二甲苯透明,用树胶封片。封片后均用光学显微镜采集照片。
2.5 肾功能指标及炎症因子的检测
取一部分血清,用全自动生化分析仪检测血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)水平。剩余血清用ELISA 检测TNF-α、IL-1β和IL-8 水平,向酶标板各孔中加入稀释后的上述抗原100 μL,置于37 ℃下孵育90 min。弃上清液后用50 g·L-1胎牛血清封闭40 min。加入对应酶标抗体,用酶标仪在450 nm 波长处测定吸光度,根据各因子的标准曲线计算其水平。
2.6 肾组织Psmb8 和NF-κB p65 mRNA 表达水平的检测
用实时荧光定量聚合酶联反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测Psmb8 和NF-κB p65 的mRNA 表达水平。称定每组大鼠肾组织质量,每10~20 mg 组织加入裂解液300 μL。 充分研磨组织,在匀浆中加入RNase 590 μL 和蛋白酶K 10 μL,混合,于56 ℃孵育20 min,于4 ℃以12 000 r·min-1离心5 min。去除上清液,按照试剂盒说明书提取RNA。用核酸定量仪测定质量浓度。将溶液置于无酶管内,-80 °C 保存。以3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参基因,根据2-ΔΔCt法,用qRT-PCR 试剂盒对每种mRNA 进行实时定量,基因相对表达量=2-ΔΔCt。引物序列见表1。
2.7 肾组织诸项指标蛋白表达量的测定
将肾组织标本从-80 ℃冰箱内取出,称定质量,置于培养皿中,用手术剪剪碎,按照0.1 g·mL-1加入冷Lysis Buffer (Lysis Buffer-磷酸酶抑制剂-PMSF 100∶1∶1),混匀,冰上研磨3 min,转移至预冷的离心管中,于4 ℃以12 000 r·min-1(离心半径为10 cm)离心10 min,提取上清液,BCA 蛋白定量分析,4∶1 加蛋白上样缓冲液,100 ℃变性10 min。SDS-PAGE 蛋白凝胶电泳:制胶,上样,120 V 恒压电泳90 min,PVDF 转膜(200 mA恒流,2 h),用50 g·L-1脱脂牛奶室温封闭2 h,加入一抗Psmb8、NF-κB p65(1∶500)和p-NF-κB p65(1∶500),4 ℃孵育过夜。用TBST 洗涤3 次,加入二抗(1∶5 000),常温下孵育1 h,用增强型化学发光(enhanced chemiluminescence,ECL)试剂显色,用凝胶成像分析系统检测蛋白条带,用软件Image J计算灰度值。
2.8 统计学方法
用SPSS 24.0 软件对数据进行统计学处理,计量结果以(±s)表示,多组间样本均数比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05为差异具有统计学意义。
3 结果
3.1 EB 对DN 大鼠FBG 水平及KI 的影响
大鼠FBG 水平及KI 组间比较差异均有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠FBG和KI 明显升高(P<0.05);与模型组比较,EB 低、中、高剂量组大鼠FBG 和KI 均下降(P<0.05);EB低剂量、EB 中剂量和EB 高剂量组诸项指标水平变化呈剂量依赖性(P<0.05)。见表2。
表2 EB 对DN 大鼠FBG 水平及KI 的影响 (±s,n=10)Tab.2 Effects of EB on FBG and renal weight index in DN rats(±s, n=10)

表2 EB 对DN 大鼠FBG 水平及KI 的影响 (±s,n=10)Tab.2 Effects of EB on FBG and renal weight index in DN rats(±s, n=10)
注:与正常组比较,※P<0.05;与模型组比较,△P<0.05;与EB低剂量组比较,#P<0.05;与EB中剂量组比较,▲P<0.05。
组别正常组模型组EB 低剂量组EB 中剂量组EB 高剂量组FBG/(mmol·L-1)5.31±2.64 24.67±2.27※22.61±2.08※△20.63±1.76※△#18.81±2.01※△#▲KI 4.10±0.52 9.04±0.84※7.25±0.56※△6.69±0.59※△#6.13±0.56※△#▲
3.2 EB 对大鼠Scr、BUN 及24 hUPro 水平的影响
大鼠Scr、BUN 及24 hUPro 水平组间比较差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠Scr、BUN 及24 hUPro 水平升高(P<0.05);与模型组比较,EB 低、中、高剂量组大鼠Scr、BUN 及24 hUPro 水平降低(P<0.05);且EB 低剂量、EB 中剂量及EB 高剂量组诸项指标水平变化呈剂量依赖性(P<0.05)。见表3。
表3 EB 对DN 大鼠Scr、BUN 及24 h UPro 水平的影响 (±s,n=10)Tab.3 Effects of EB on Scr, BUN and 24-hour UPro levels in DN rats (±s, n=10)

表3 EB 对DN 大鼠Scr、BUN 及24 h UPro 水平的影响 (±s,n=10)Tab.3 Effects of EB on Scr, BUN and 24-hour UPro levels in DN rats (±s, n=10)
注:与正常组比较,※P<0.05;与模型组比较,△P<0.05;与EB低剂量组比较,#P<0.05;与EB中剂量组比较,▲P<0.05。
组别正常组模型组EB 低剂量组EB 中剂量组EB 高剂量组Scr/(μmol·L-1)64.11±9.13 106.98±11.16※96.17±9.87※△86.28±10.53※△#76.13±10.47※△#▲BUN/(mmol·L-1)6.68±1.33 16.11±2.22※13.18±2.22※△11.07±2.03※△#8.89±1.96※△#▲24 h UPro/(mg·24 h-1)9.80±1.66 55.62±6.73※48.81±7.08※△43.19±3.81※△#31.47±4.40※△#▲
3.3 EB 对各组大鼠肾组织形态的影响
HE 染色结果显示,正常组大鼠肾脏结构完整,形状规则,未见炎症细胞浸润;模型组中可见肾小球萎缩,细胞外基质增多,胞浆浸润炎性细胞,间质水肿且有大量炎细胞浸润;与模型组比较,EB 低剂量、EB 中剂量和EB 高剂量组大鼠肾组织系膜细胞增生程度、间质内炎细胞浸润量等病理改变及炎症表象均有不同程度的改善。见图1。

图1 各组大鼠肾脏组织HE 染色结果 (×400)Fig.1 HE staining results of rat kidney tissue in each group (×400)
3.4 EB 对大鼠血清中TNF-α、IL-1β 和IL-18 含量的影响
大鼠血清TNF-α、IL-1β和IL-18 含量组间比较差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠血清TNF-α、IL-1β和IL-18 含量均升高(P<0.05);与模型组比较,EB 低剂量、EB 中剂量和高剂量组大鼠血清TNF-α、IL-1β和IL-18 含量均降低(P<0.05),且EB 低剂量、EB 中剂量和EB 高剂量组诸项指标水平变化呈剂量依赖性(P<0.05)。见表4。
表4 EB 对DN 大鼠血清中TNF-α、IL-1β 和IL-18 含量的影响 (±s,n=10)Tab.4 Effect of EB on the content of TNF-α, IL-1β and IL-18 in serum of DN rats (±s, n=10)
注:与正常组比较,※P<0.05;与模型组比较,△P<0.05;与EB 低剂量组比较,#P<0.05;与EB 中剂量组比较,▲P<0.05。
组别正常组模型组EB 低剂量组EB 中剂量组EB 高剂量组TNF-α/(ng·mL-1)57.81±5.65 132.36±10.45※104.21±8.53※△96.93±6.66※△#76.29±6.36※△#▲IL-1β/(ng·mL-1)16.03±1.91 47.37±5.48※41.03±5.28※△35.39±6.02※△#22.39±2.75※△#▲IL-18/(ng·mL-1)14.59±1.74 59.67±6.74※45.76±6.19※△36.63±5.64※△#25.79±2.86※△#▲
3.5 EB 对Psmb8/NF-κB 轴信号蛋白mRNA 表达量的影响
大鼠肾组织中Psmb8 和NF-κB p65 mRNA 相对表达量组间比较,差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠肾组织中Psmb8 和NF-κB p65 mRNA 相对表达量升高(P<0.05);与模型组比较,EB 低剂量、EB 中剂量和EB 高剂量组大鼠肾组织中Psmb8 和NF-κB p65 mRNA 相对表达量降低(P<0.05),且EB 低剂量、EB 中剂量和EB 高剂量组诸项指标水平变化呈剂量依赖性(P<0.05)。见表5。
表5 EB 对肾脏组织中Psmb8 和NF-κB p65 mRNA 表达量的影响 (xˉ±s,n=10)Tab.5 Effects of EB on Psmb8 and NF-κB p65 mRNA expression in kidney tissue (±s, n=10)

表5 EB 对肾脏组织中Psmb8 和NF-κB p65 mRNA 表达量的影响 (xˉ±s,n=10)Tab.5 Effects of EB on Psmb8 and NF-κB p65 mRNA expression in kidney tissue (±s, n=10)
注:与正常组比较,※P<0.05;与模型组比较,△P<0.05;与EB 低剂量组比较,#P<0.05;与EB 中剂量组比较,▲P<0.05。
组别正常组模型组EB 低剂量组EB 中剂量组EB 高剂量组Psmb8 1.02±0.02 4.31±0.34※3.86±0.35※△2.59±0.11※△#1.69±0.13※△#▲NF-κB p65 1.01±0.02 5.61±0.43※4.53±0.15※△3.42±0.12※△#2.24±0.10※△#▲
3.6 EB 对大鼠Psmb8/NF-κB 轴信号蛋白表达量的影响
大鼠Psmb8、NF-κB p65 和p-NF-κB p65 蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与正常组比较,其他4 组大鼠肾组织中Psmb8、NFκB p65 和p-NF-κB p65 蛋白相对表达量升高(P<0.05);与模型组比较,EB 低剂量、EB 中剂量和EB 高剂量组大鼠肾组织中Psmb8、NF-κB p65 和p-NF-κB p65 蛋白相对表达量降低(P<0.05),且EB低剂量、EB 中剂量和EB 高剂量组诸项指标水平变化呈剂量依赖性(P<0.05)。见图2、表6。
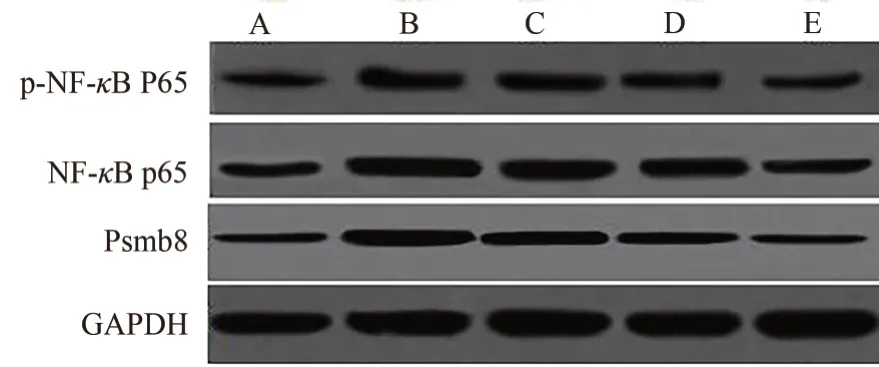
图2 各组大鼠肾脏组织中Psmb8、NF-κB p65 和p-NF-κB p65 蛋白表达电泳图Fig.2 Electrophoresis of protein expression of Psmb8, NF-κB p65 and p-NF-κB p65 in kidney tissue of rats in each group
表6 EB 对肾脏组织相关蛋白表达量的影响 (±s,n=10)Tab.6 Effects of EB on the expression of related proteins in kidney tissue (±s, n=10)

表6 EB 对肾脏组织相关蛋白表达量的影响 (±s,n=10)Tab.6 Effects of EB on the expression of related proteins in kidney tissue (±s, n=10)
注:与正常组比较,※P<0.05;与模型组比较,△P<0.05;与EB 低剂量组比较,#P<0.05;与EB 中剂量组比较,▲P<0.05。
组别正常组模型组EB 低剂量组EB 中剂量组EB 高剂量组Psmb8 0.32±0.05 0.89±0.12※0.68±0.08※△0.47±0.07※△#0.38±0.05※△#▲NF-κB p65 0.46±0.08 0.92±0.03※0.64±0.06※△0.92±0.05※△#0.78±0.10※△#▲p-NF-κB p65 0.28±0.04 0.62±0.09※0.56±0.07※△0.42±0.08※△#0.38±0.07※△#▲
4 讨论
DN 是一种严重的糖尿病(diabetes meltitus,DM)并发症,可引起肾小球硬化和肾间质纤维化[10],同时也是导致DM 患者死亡伤残的重要原因,并且最终会导致蛋白尿或非蛋白尿型的终末期肾病[11]。DN 的典型表现是早期的肾小球高滤过和蛋白尿,然后是进行性肾功能下降,已成为导致DM 高死亡率的重要因素。针对特定炎症介质(如细胞因子)和细胞内信号通路的DN 抗炎策略已在实验模型中显示出关联性,在一定程度上减少了蛋白尿和肾脏的病理变化[12]。由此可见,靶向炎症对糖尿病肾病(diabetic nephropathy,DN)进行治疗,可有效延缓疾病进展,改善疾病症状。
灯盏花有效成分为灯盏乙素、咖啡奎宁酸及原儿茶酸等黄酮类化合物,具有活血化瘀、通经活络及消炎止痛的功效[13]。动物实验表明,灯盏花可减轻DN 大鼠氧化应激反应,从而延缓肾小球硬化[14]。临床研究结果显示,灯盏花可用于辅助治疗2 型DN 患者,有助于抑制炎症反应,减少白蛋白漏出,保护肾功能[15]。在炎症发生、发展过程中,Psmb8/NF-κB轴同样是极其重要的一环,Psmb8 可以作为免疫蛋白酶体的一个亚单位诱导炎症反应[16];NF-κB 则是炎症反应介导的DN 进展的主要转录因子[17-18]。高糖环境下,在肾小球系膜细胞(mesangial cells,MCs)内经免疫蛋白酶体活化的NF-κB 能够诱导包括IL-18 和TNF-α等炎症因子基因的转录,诱导炎症的发生[19],Psmb8 能通过构成免疫蛋白酶体而活化NFκB,促进DN 炎症的发生与发展[20]。
本研究从DN 炎症发病机制出发,选取Psmb8/NF-κB 轴作为药物潜在靶点,以下游炎症因子TNFα、IL-1β和IL-18 为标志物,研究EB 对STZ 诱导的DN 大鼠肾脏炎症的抑制作用及其作用机制。结果表明,EB 低剂量、EB 中剂量和EB 高剂量组大鼠FBG、体质量和KI 比模型组表现出明显改善,而且大鼠的Scr、BUN 水平以及24 h UPro 排泄量降低;提取肾组织样本进行染色后,EB 低、中、高剂量组大鼠肾组织的炎症病理改变有所改善;ELISA 检测结果表明,血清中炎症因子TNF-α、IL-1β和IL-18 的水平亦有所降低。未用EB 干预的模型组大鼠,Psmb8、NF-κB p65 以及p-NF-κB p65 的蛋白表达和Psmb8以及NF-κB p65 mRNA 表达水平均升高,说明在DN 病程中,Psmb8/NF-κB 轴被激活并进一步诱导下游因子的表达,这可能是DN 中炎症发病的原因之一;经EB 干预的实验大鼠通路蛋白和mRNA 的表达水平则相对降低,证实了EB 可通过Psmb8/NF-κB轴对DN 进行抑制,并且此种抑制作用与其降低下游炎症因子TNF-α、IL-1β和IL-18 的表达水平有关。
综上所述,本研究分别从机体、组织、蛋白和mRNA 4 个角度探讨了EB 对DN 大鼠炎症反应的影响,在对实验结果进行分析后发现,EB 对DN 炎症有一定程度的抑制作用,而且这种作用可能与Psmb8/NF-κB 轴及其下游炎症因子有关,但其具体机制仍待进一步研究。

