过表达解偶联蛋白2抑制氧化应激减轻糖尿病小鼠心肌缺血再灌注损伤
丁佳慧 吴建江 程虎 朱阔 于文彬 王江
糖尿病是心肌梗死最常见的危险因素,糖尿病患者更容易发生心肌缺血性功能障碍,包括心肌缺血再灌注损伤(IRI)。糖尿病患者急性心肌梗死或冠状动脉搭桥术后的死亡率是非糖尿病患者的2 倍[1]。心肌IRI 是包括氧化应激、炎症反应、线粒体功能损伤、钙超载、细胞自噬和凋亡等机制的多因素过程[2]。越来越多的证据表明,糖尿病会使心肌IRI 加重和复杂化[3],高血糖会显著诱导IRI 后的心功能障碍和心肌超微结构的破坏[4],而氧化应激反应的加剧可能导致糖尿病心肌IRI 加重[5]。糖尿病时多种信号通路受损,也会导致大部分干预措施对糖尿病心肌IRI 作用减弱甚至消失[6]。解偶联蛋白2(UCP2)是一种质子转运蛋白,位于线粒体内膜。UCP2 可使H+从线粒体膜间隙渗漏到基质中,减少活性氧(ROS)的产生,发挥抗氧化应激作用[7]。研究表明,UCP2 可以通过减少ROS 的产生,改善线粒体结构,减轻高血糖状态下脑IRI[8]。本研究探讨过表达UCP2 是否可以通过抑制氧化应激对IRI 的糖尿病心肌产生保护作用,以期为改善糖尿病患者预后提供理论依据。
1 材料与方法
1.1 小鼠糖尿病模型建立与实验分组
C57BL 雄性小鼠60 只(8 周龄,20~25 g)购自新疆医科大学动物实验中心,所有实验小鼠均自由进食、饮水,实验前适应性喂养1 周。本研究经新疆医科大学第一附属医院动物伦理委员会审查批准。
小鼠采用高脂肪饮食(胆固醇1%、牛胆盐0.2%、蛋黄粉10%、猪油10%、普通饲料78.8%)喂养6 周,第7 周禁食不禁水12 h 后,腹腔注射45 mg/(kg·d)脲佐菌素(STZ)溶液(STZ 溶于冰浴的0.1 mol/L 柠檬酸钠缓冲液,避光,现用现配),每天1 次,连续5 次,腹腔注射于30 min 内完成,第8 周第2 天及第5 天检测空腹血糖,空腹血糖大于11.1 mmol/L 的小鼠确定为糖尿病模型构建成功。采用随机数字表法将糖尿病小鼠分为5 组:假手术组(Sham 组)、缺血再灌注组(I/R 组)、UCP2 抑制剂组(Genipin 组)、空载9 型腺相关病毒(AAV9-NC)组(AN 组)、携带UCP2 基因的AAV9(AAV9-UCP2)组(AU 组),每组12 只。
1.2 AAV9-UCP2腺相关病毒的构建和干预
依据NCBI 数据库检索得到的小鼠UCP2基因序列(NM_011671.5),将编码区序列构建至9 型腺相关病毒(AAV9)载体中,包装完整病毒,构建UCP2过表达的腺相关病毒。小鼠高脂喂养2 周时,AU 组每只小鼠尾静脉注射AAV9-UCP2 5×1011vg,AN 组每只小鼠尾静脉注射AAV9-NC 5×1011vg。
1.3 心肌缺血再灌注损伤模型的建立
第9 周时所有糖尿病小鼠称重备皮,2%七氟烷吸入麻醉后,用20G 穿刺针行气管插管,插管后连接小动物呼吸机行机械通气,潮气量0.8~0.9 mL,呼吸频率120 次/min,吸呼比1 ∶1。Sham组仅切开皮肤后缝合,其余4 组均在胸骨左侧第三肋间隙剪开皮肤及皮下组织,钝性分离肋间肌进入胸腔,切开心包暴露心脏,使用6-0 线从左心耳根下1~2 mm 处穿入,从肺动脉锥左侧边缘穿出,结扎冠状动脉左前降支。缝合方向平行于左心耳下缘,当左心室前壁及心尖周围心肌运动减弱、颜色变白时,提示结扎成功。缺血60 min 后,解除结扎,再灌注120 min。Genipin 组于缺血前14 h 腹腔注射Genipin(美国MCE 公司,货号:HY-17389)100 mg/kg。
1.4 酶联免疫吸附试验检测血清样本
小鼠再灌注120 min 时腹腔注射10%水合氯醛300 mg/kg,抽取腹主动脉血,4 ℃时1 200×g离心10 min,取上清液,酶联免疫吸附试验(南京建成生物工程研究所)检测血清肌钙蛋白I(cTnI)、丙二醛(MDA)、超氧化物歧化酶(SOD)水平,具体操作步骤见说明书。
1.5 流式细胞仪检测心肌ROS产生情况
充分研磨组织,收集细胞悬液离心留沉淀,加入浓度为10 μmol/L 的2,7-二氯荧光素二乙酸酯(DCFH-DA),37 ℃孵育,洗涤重悬,在最佳激发波长488 nm、发射波长525 nm 下使用流式细胞仪检测细胞悬液的荧光强度,以Sham 组作为参照,分析各组的荧光强度。
1.6 透射电镜观察心肌超微结构的变化
采血结束后立即处死小鼠,取心脏,分离左心室,取1 mm3左心室组织,4 ℃固定于戊二醛电镜固定液中24 h,室温脱水后包埋聚合,60~80 nm超薄切片,2%醋酸铀饱和酒精溶液避光染色,清洗后2.6%枸橼酸铅溶液避二氧化碳染色,清洗干燥后透射电镜观察。
1.7 Western blot检测UCP2蛋白的表达
采血结束后立即处死小鼠,取心脏,分离左心室,充分裂解研磨,超声细胞破碎机破碎,4 ℃离心,取上清,用BCA法进行蛋白定量。取所需蛋白样品,煮沸变性,取样品10 μg 于SDS-PAGE 凝胶中电泳,转膜,5%脱脂奶粉封闭2 h,Tris-HCl 缓冲盐溶液(TBST)漂洗。加入兔抗小鼠UCP2 单克隆抗体(1 ∶2 000 稀释,美国Invitrogen 公司),4 ℃孵育过夜。TBST 漂洗后加入山羊抗兔IgG(1 ∶2 000稀释,北京中杉金桥生物技术有限公司),室温孵育2 h,TBST 漂洗,显影,ImageJ 软件分析计算蛋白条带灰度值。
1.8 超声心动图检查
再灌注24 h 时,采用小动物超声心动图(visualsonics VEVO 3100 system,加拿大)对小鼠心功能进行评估。通过M 型超声连续扫描5 个心动周期获取心功能各项参数:每搏输出量(SV)、射血分数(EF)、左室短轴缩短率(FS)。
1.9 统计学分析
采用SPSS 26.0 进行统计学分析,计量资料采用均数±标准差表示,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 心肌损伤标志物、氧化应激指标比较
与Sham 组相 比,I/R 组、Genipin 组、AN 组及AU 组cTnI 和MDA 水平明显升高,ROS 产生增多,SOD 水平明显降低(P<0.05);与I/R 组相比,Genipin 组cTnI 和MDA 水平明显升高,ROS 产生增多,SOD 水平明显降低(P<0.05);与I/R 组相比,AU 组cTnI 和MDA 水平明显降低,ROS 产生减少,SOD 水平明显升高(P<0.05);AN 组与I/R 组cTnI、ROS、MDA 及SOD 水平的差异无统计学意义。见表1。

表1 5组小鼠血清cTnI、ROS、MDA、SOD水平的比较(n=8)
2.2 心肌超微结构的变化
Sham 组肌丝排列有序,无明显溶解或断裂,闰盘完整;线粒体形态完整,排列有序;I/R 组心肌结构严重受损,肌丝溶解甚至断裂,肌浆网扩张;线粒体肿胀,排列紊乱,嵴间隙增宽破裂;Genipin 组心肌结构损伤较I/R 组更严重,心肌结构破坏更明显,细胞广泛坏死,肌丝明显溶解断裂,线粒体显著肿胀破裂;AN 组心肌及线粒体损伤程度与I/R 组相仿;AU 组肌丝有序排列,部分肌丝和肌节间隙增宽溶解,闰盘基本完整,大部分线粒体形态完整,嵴清晰可见,部分线粒体轻微肿胀。见图1。
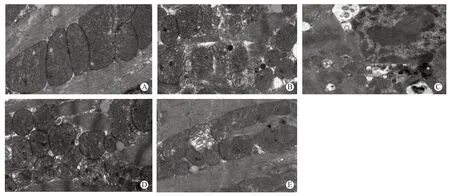
图1 5组小鼠电镜下心肌超微结构图(2%醋酸铀饱和酒精+2.6%枸橼酸铅染色,×6 000)
2.3 UCP2表达水平的比较
与Sham 组(0.55±0.16)相比,I/R 组UCP2表达水平(1.27±0.36)明显增加(P<0.05);与I/R 组相比,Genipin 组UCP2 表达水平(0.58±0.15)明显降低,AU 组UCP2 表达水平(2.01±0.57)明显增加(P<0.05),AN 组与I/R 组UCP2 表达水平(1.28±0.039)的差异无统计学意义。见图2。

图2 小鼠心肌组织UCP2的表达情况
2.4 心功能的比较
与Sham 组相比,I/R 组、Genipin 组、AN 组及AU 组SV、EF、FS 明显降低(P<0.05);与I/R组相比,Genipin 组SV、EF、FS 明显降低(P<0.05),AU 组SV,EF、FS 明显升高(P<0.05),AN 组与I/R 组SV,EF、FS 的差异无统计学意义。见表2。
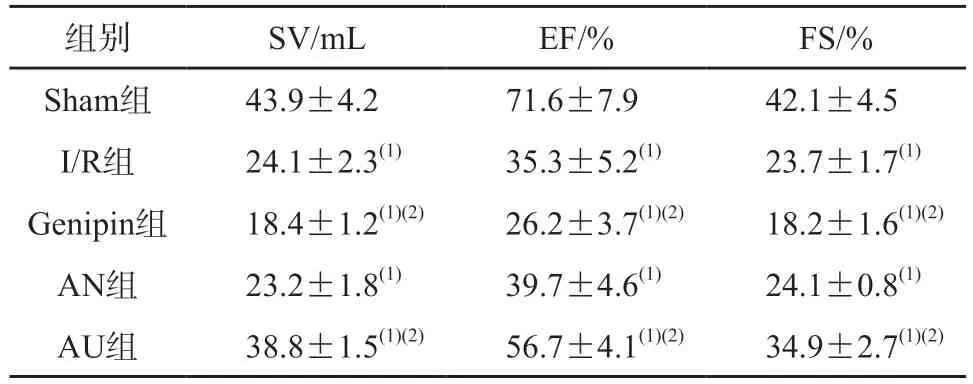
表2 5组小鼠超声心动图检测心功能指标的比较(n=4)
3 讨论
本研究根据文献[9],结扎糖尿病小鼠冠状动脉左前降支建立小鼠心肌IRI 模型。本研究结果显示,与Sham 相比,其他4 组cTnI、MDA 水平明显升高,SOD 水平明显降低,ROS 产生增多,心肌结构受损,肌丝溶解甚至断裂,线粒体肿胀,排列紊乱,嵴间隙增宽破裂,SV、EF、FS 明显降低,提示心肌IRI 模型制备成功。本研究参照文献[10],经尾静脉注射AAV9-UCP2 制备UCP2 过表达小鼠模型,Western blot 结果显示,与I/R 组相比,AU 组UCP2 表达水平明显升高,提示UCP2 过表达小鼠模型制备成功。
糖尿病心肌IRI 加重的机制尚未完全阐明,但继发于高血糖的较高水平的氧化应激,可能会增加糖尿病时心肌对IRI 的易感性[11]。糖尿病患者心肌氧化应激的增加主要由于内源性抗氧化系统受损,内源性自由基清除酶如SOD、过氧化氢酶等活性降低,ROS 清除受阻,破坏了ROS 产生和清除之间的平衡,这种不平衡的加剧可能影响糖尿病患者IRI 的严重程度[12]。ROS 是氧化应激水平的主要标志物,在缺血时生成增加,再灌注时激增,被认为是再灌注损伤的主要介质,介导缺血期的细胞损伤和再灌注期的细胞凋亡[13]。线粒体是细胞ROS的主要来源。UCP2 是ROS 产生的负向调节因子,可通过介导质子漏,降低线粒体膜电位,抑制ROS生成,发挥抗氧化应激作用[14]。此外,UCP2 与谷胱甘肽结合后以非活性状态存在,UCP2 激活后不仅可以减少应激细胞中ROS 的产生,其释放出来的谷胱甘肽还可降低已产生的ROS[15]。有研究表明,UCP2过表达后可减少ROS 的产生,减轻炎症反应,改善脓毒症引起的心肌损伤[16]。
本研究结果显示,与Sham 组相比,I/R 组UCP2 表达水平明显增加,Genipin 组UCP2 表达水平明显降低;且与I/R 组相比,Genipin 组cTnI、MDA 水平明显升高,SOD 水平明显降低,ROS产生增多,心肌结构破坏更明显,细胞广泛坏死,线粒体显著肿胀破裂,SV、EF、FS 明显降低。提示糖尿病小鼠心肌IRI 后会刺激UCP2 表达增加以对抗心肌损伤,然而,在Genipin 抑制UCP2 的表达后,ROS 释放进一步增加,氧化应激反应增强,心肌组织以及线粒体损伤加重,心功能进一步下降。同时,本研究用AAV9-UCP2 转染心肌,上调心肌UCP2的表达,结果显示,与I/R 组相比,AU 组cTnI、MDA 水平明显降低,SOD 水平明显升高,ROS产生减少,心肌结构明显改善,线粒体形态完整,肿胀减轻,嵴清晰可见,SV、EF、FS 明显升高。以上研究结果均提示UCP2 过表达可以抑制ROS 产生,降低糖尿病小鼠心肌IRI 后的氧化应激水平,恢复线粒体的超微结构,减轻心肌损伤,改善心功能。
综上,本研究通过建立糖尿病小鼠心肌IRI 模型,发现糖尿病小鼠心肌发生IRI 时,可刺激UCP2上调;用AAV9-UCP2 转染小鼠心肌时,过表达的UCP2 可以抑制ROS 产生,降低氧化应激水平,减轻糖尿病心肌IRI。
- 国际心血管病杂志的其它文章
- 非编码RNA在主动脉夹层发病中的作用
- 传统心脏起搏器转用无导线起搏器的可行性临床研究

