银杏叶产量性状和莽草酸途径主要代谢物含量株间变异及叶用单株选择
尤晨曦 刘玉华 余鹏飞 郁万文
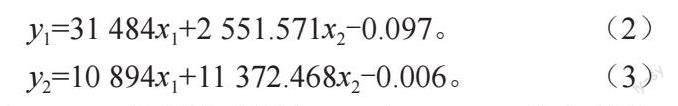


摘 要:【目的】研究莽草酸途径中银杏叶主要代谢物含量及叶产量性状的株间差异,并筛选叶用和特异单株,为银杏莽草酸途径主要代谢物代谢研究和定向培育提供材料。【方法】以55 个银杏单株为材料,分析了银杏叶产量性状(单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量)及莽草酸途径主要代谢物(莽草酸、色氨酸、酪氨酸、苯丙氨酸、总黄酮)含量的株间差异及相关性,基于葉产量性状、主要代谢物含量及主成分分析综合评价多层次筛选出特异单株。【结果】1)银杏叶产量性状和莽草酸途径主要代谢物含量的9 个指标在株间均呈显著或极显著差异,且变异系数均超过10%。2)单叶面积与莽草酸含量呈显著负相关;比叶干质量分别与莽草酸含量、色氨酸含量呈极显著正相关,与酪氨酸含量呈显著正相关;单位枝长叶干质量分别与酪氨酸含量、总黄酮含量呈显著正相关。3)基于主成分综合得分,筛选出的排名前五的单株(23#、24#、20#、29#、34#)的单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量、莽草酸含量、色氨酸含量、酪氨酸含量、苯丙氨酸含量、总黄酮含量的均值比排名后五位的单株(49#、1#、2#、43#、51#)的均值分别提高了41.93%、99.39%、40.47%、53.87%、19.40%、44.87%、49.75%、27.79%、13.26%;基于叶产量性状筛选出高叶产量单株7 个(20#、21#、23#、24#、32#、34#、36#),低叶产量单株11 个(1#、2#、9#、13#、17#、22#、25#、35#、37#、51#、56#);基于莽草酸途径主要代谢物含量筛选出主要代谢物含量高的单株4 个(24#、27#、28#、35#),主要代谢物含量低的单株8 个(1#、2#、3#、10#、16#、42#、53#、56#)。【结论】参试银杏单株的叶产量性状、莽草酸途径主要代谢物含量在株间存在丰富遗传差异,筛选潜力大;基于叶产量性状、主要代谢物含量和主成分分析综合评价多层次筛选出特异单株,为定向培育特异用途的专类园及莽草酸途径主要代谢物代谢研究提供了材料。
关键词:银杏;叶产量性状;主要代谢物;叶用单株选择
中图分类号:S722.3+1;S792.95 文献标志码:A 文章编号:1003—8981(2023)03—0013—11
高产优质药用银杏选育和药用集约栽培已成为叶用银杏栽培的发展方向,并取得了明显进展。开展叶用银杏种质资源研究、选育并推广有效成分含量高且稳定的种质,是叶用银杏种植亟待解决的问题[1-2]。我国学者在高黄酮、高萜内酯良种选育的基础上,筛选出叶产量较高的种质,表现为叶大肥厚、叶产量高[3-4]。大量研究表明,银杏叶中有效成分含量和叶产量在很大程度上受遗传因素的控制,在种源间、家系间、单株间存在显著性差异[2,4-5]。我国银杏分布范围广,种质资源丰富,但收集、考察、评价研究还远远不够。莽草酸途径是连接糖代谢和多酚代谢的主要桥梁,在植物次生代谢途径中起到中心作用。以莽草酸为前体,最终合成多种芳香化合物,包括芳香族氨基酸(色氨酸、酪氨酸、苯丙氨酸)、肉桂酸和多酚化合物(如黄酮类化合物),这些代谢物对植物生长发育、逆境响应及叶品质形成至关重要[6]。因此,选育莽草酸途径主要代谢物特异种质对解析莽草酸途径与下游次生代谢途径的相关关系意义重大。银杏Ginkgo biloba L. 是继八角Illicium verum Hook.f. 以后扩展莽草酸来源的主要替代植物之一,叶产量极大,落叶多为废弃物,亟待开发利用[7]。目前对莽草酸途径银杏叶中主要代谢物代谢的研究十分缺乏,同时对开展相关研究和定向培育的特异种质材料也未筛选出来,所以急需研究基于莽草酸途径中银杏主要代谢物含量及叶产量性状在不同种质间的差异和综合评价。本研究以55 个银杏单株为材料,分析银杏叶产量性状(单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量)和莽草酸途径中主要代谢物(莽草酸、色氨酸、酪氨酸、苯丙氨酸、总黄酮)含量的变异性,筛选出银杏叶产量性状或主要代谢物含量特异的单株,旨在为特异种质及高主要代谢物单株的无性系化、区划和推广提供种质资源,同时为确定莽草酸途径在调控次生代谢途径中的关键因子提供特异材料。
1 材料与方法
1.1 材料与采样
2005 年3 月初在邳州60 个银杏种植苗圃中基于地径和苗高挑选2 年生实生超级苗,每个苗圃挑选2 ~ 3 株,起苗后按照株行距4 m×4 m 定植于南京林业大学银杏资源圃。自2019 年起连续3年统计每个单株树冠中部标准枝的叶产量性状,初选出55 个具有叶用潜力的单株。于2022 年7月中旬采集初选的55 个单株阳面中部树冠外围的3 根长约50 cm 且顶端不带当年生枝的枝条,立刻放进冰盒,带回实验室测定叶产量性状及莽草酸途径主要代谢物含量。
1.2 测定方法
1.2.1 叶产量性状指标
测量每根枝条的长度;再从每根枝条的上、中、下部的短枝上各取1 片中等大小叶片使用EPSON扫描仪扫描,利用PHOTOSHOPE CS6 软件计算单叶面积;将扫描后的叶片80 ℃烘至恒质量,计算单叶干质量和比叶干质量(单叶干质量/ 单叶面积)。把每根枝条上剩余的叶子摘下,放入烘箱110 ℃杀青15 min,降至80 ℃烘至恒质量,测定每根枝条上的叶干质量,加上对应枝条用于扫描的3 片叶的干质量,结合枝条长度计算每个枝条单位枝长叶干质量。每个指标重复3 次。
1.2.2 莽草酸含量
将叶产量指标测定结束的干叶粉碎,过筛,用于莽草酸途径主要代谢物的提取及含量测定。待测液制备:参考Zelaya 等[8] 的方法并略有改动。称取0.050 g 银杏叶干粉,置于15 mL 螺丝试管内,加入10 mL 0.25 mol/L 盐酸混匀,常温下超声辅助提取30 min,然后6 000 rpm 离心10 min,吸取上层清液2.5 mL,然后将其稀释3 倍,即再加入5 mL 提取液,即为莽草酸待测液。每个样品3 次重复。
含量测定:吸取莽草酸待测液0.2 mL 置于10 mL 试管,接着加入2 mL 1%(w/v)高碘酸溶液,混匀,静置3 h 后加入2 mL 1 mol/L NaOH 终止反应,接着加入1 mL 0.1 mol/L 甘氨酸溶液,混匀,采用SpectraMax i3X 多功能酶标仪(美国Molecular Devices 公司)于380 nm 波长下测定吸光值。称取莽草酸标准品(> 98%,上海源葉生物科技有限公司),溶解于0.5 mol/L 盐酸,并定容至10 mL 容量瓶,即得0.5 mg/mL 莽草酸标准品母液。然后将母液分别稀释至不同浓度,采用同样的方法,测定380 nm 波长下吸光值。以各莽草酸标准品浓度为横坐标,吸光度值为纵坐标,利用最小二乘法拟合曲线,得到曲线方程:
y=4.474 2x+0.037 8,r=0.999。 (1)
式中x 为莽草酸溶液浓度(mol/L),y 为溶液在380 nm 的吸光值。
1.2.3 色氨酸、酪氨酸、苯丙氨酸含量
游离氨基酸提取液制备: 参考国标GB/T30987-2020 并略有改动。称取样品0.100 g,加入10 mL 沸水,于95 ℃水浴锅加热10 min,每5 min混匀1 次, 提取2 次, 合并提取液, 并定容至20 mL。每个样品3 次重复。
苯丙氨酸含量测定:参考张静等[9] 的方法并略有改动。取氨基酸提取液1 mL,加入2 mLNaOH-H3BO3 缓冲液(pH 值为10),1.5 mL5 mmol/L 的1,2 萘醌-4 磺酸钠溶液, 混匀静置30 min。以试剂空白为对比,采用SpectraMax i3X多功能酶标仪在474 nm 处测定吸光值。
色氨酸、酪氨酸含量联合测定:参考赫敏[10]、徐澜等[11] 的方法,略有改动。称取0.005 g 银杏叶干粉于10 mL 0.1 mol/L NaOH 溶液,摇匀,30 min后6 000 rpm 离心15 min,上清液待测。最大吸收峰确定:称取0.0204 g L- 色氨酸和0.0181 g L-酪氨酸标准品溶于100 mL 0.1 mol/L NaOH 溶液配制成1 mmol/L 储备液备用。将储备液稀释成0.05 mmol/L 色氨酸溶液和0.05 mmol/L 酪氨酸溶液,0.05 mmol/L 色氨酸和0.05 mmol/L 酪氨酸混合溶液,以0.1 mol/L NaOH 参比,采用UV-1900紫外可见分光光度计在200 ~ 400 nm 内测吸光度。根据光谱图结果,色氨酸和酪氨酸的最大吸收峰分别在283 和297 nm 处。
标准曲线制作:取储备液按不同体积混合,配置成不同浓度混合液,在283 和297 nm 下测定吸光值。利用SPSS 基于多元线性回归法得到吸光值和浓度的回归关系式:
y1=31 484x1+2 551.571x2-0.097。 (2)
y2=10 894x1+11 372.468x2-0.006。 (3)
式中y1、y2 分别为溶液在283 和297 nm 处的吸光值,x1、x2 为色氨酸、酪氨酸浓度(mol/L)。
1.2.4 黄酮含量
黄酮待测液制备:参考吴岐奎等[12] 的方法,电子天平称取样品0.200 g,用直径9 cm 的定性滤纸包裹并用棉线捆绑,用100 mL 石油醚索氏提取除杂8 h 后,将滤纸包放于15 mL 离心管中。加入10 mL 甲醇,60 ℃提取30 min,提取2 次,每次将提取液转移至50 mL 离心管中,定容至20 mL。每个样品3 次重复。
黄酮含量测定:取提取液1.0 mL 置于10 mL离心管中,加入0.3 mL 5% 亚硝酸钠溶液,摇匀静置5 min,然后加入0.3 mL 10% 硝酸铝溶液,摇匀静置6 min, 再加入2 mL 1 mol/L NaOH。摇匀静置10 min 后,取200 μL 置于酶标板,采用SpectraMax i3X 多功能酶标仪于510 nm 处测吸光值。每个样品重复3 次。根据y=0.713 2x+0.059 7,r=0.999 5 计算黄酮浓度,进一步计算黄酮含量。式中x 为总黄酮溶液浓度(mg/mL),y 为溶液在510 nm 的吸光值。
1.3 数据分析
所有指标数据均计作“平均值± 标准差”;使用Excel2010 软件处理数据,IBM SPSS Statistics26 软件进行方差分析、主成分分析以及聚类分析。
2 结果与分析
2.1 银杏叶产量性状株间差异分析
2.1.1 基于叶产量性状的株间变异性
经过方差分析,55 个单株的单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量在株间差异极显著(P < 0.01)。由表1 可知,单叶面积变幅14.047 ~ 39.103 cm2,均值为26.525 cm2,其中排名前3 位的单株为16#、12#、23#,排名后3 位的单株是48#、41#、51#。单叶干质量变幅134.7 ~ 344.3 mg,均值为203.2 mg,其中排名前3 位的单株为23#、24#、20#, 排名后3 位的单株是51#、41#、48#。
比叶干质量变幅5.522 ~ 10.600 mg/cm2,均值为7.725 mg/cm2, 其中排名前3 位的单株为32#、29#、20#,排名后3 位的单株是7#、1#、2#。单位枝长叶干质量变幅为77.0 ~ 395.7 mg/cm,均值为198.6 mg/cm,其中排名前3 位的单株为57#、27#、20#,排名后3 位的单株是50#、33#、31#。基于变异系数大小,上述4 个叶产量性状离散程度由大到小的顺序为单位枝长叶干质量(32.91%)、单叶干质量(23.43%)、单叶面积(20.63%)、比叶干质量(17.49%)。
2.1.2 基于葉产量性状的单株筛选
4 个叶产量性状的变异系数均超过了10%,即在单株间存在丰富的变异,筛选叶产量单一性状高的单株潜力大,但4 个叶产量性状高低的单株是不对应的,不能选出4 个叶产量性状均高的单株。所以参照李卫星等[13] 的方法,设定4 个叶产量性状均高于55 个单株对应指标均值为标准,筛选出20#、21#、23#、24#、32#、34#、36# 高叶产量单株7 个。相反地,设定4 个叶产量性状均低于55 个单株对应指标均值为标准,筛选出1#、2#、9#、13#、17#、22#、25#、35#、37#、51#、56# 低叶产量单株11 个。
2.2 银杏叶莽草酸途径主要代谢物含量株间差异分析
2.2.1 基于叶莽草酸途径主要代谢物含量的株间变异性
经过方差分析,55 个单株叶中莽草酸、色氨酸、酪氨酸、苯丙氨酸、总黄酮含量在单株间差异均达到极显著水平(P < 0.01)。莽草酸含量变幅13.303 ~ 27.652 mg/g,均值为19.185 mg/g,其中排名前3 位的单株为31#、37#、40#,排名后3 位的单株是5#、4#、54#。色氨酸含量变幅2.909 ~ 6.954 mg/g,均值为4.614 mg/g,其中排名前3 位的单株为39#、29#、57#,排名后3 位的单株是49#、1#、4#。酪氨酸含量变幅1.441 ~ 4.535 mg/g,均值为2.938 mg/g,其中排名前3 位的单株为44#、29#、36#, 排名后3 位的单株是49#、45#、4#。苯丙氨酸含量变幅1.923 ~ 8.623 mg/g, 均值为4.824 mg/g, 其中排名前3 位的单株为15#、34#、55#, 排名后3 位的单株是57#、32#、2#。总黄酮含量变幅为12.942 ~ 44.162 mg/g,均值为21.431 mg/g,其中排名前3 位的单株为57#、37#、29#,排名后3 位的单株是4#、39#、15#。基于变异系数大小,上述莽草酸途径五个主要代谢物含量离散程度由大到小的顺序为苯丙氨酸(33.39%)、总黄酮(24.66%)、酪氨酸(21.89%)、莽草酸(17.35%)、色氨酸(17.34%)。
2.2.2 基于莽草酸途径主要代谢物含量的单株筛选
5 个主要代谢物含量的变异系数均超过了10%,即在单株间存在丰富的变异,筛选单一主要代谢物含量高的单株潜力大,但5 个主要代谢物含量高低的单株是不对应的,不能选出5 个主要代谢物含量均高的单株。参照李卫星等[13] 的方法,设定5 个主要代谢物含量均高于55 个单株对应指标均值的单株为高含量主要代谢物叶用单株选择标准,筛选出24#、27#、28#、35# 主要代谢物含量高的单株4 个。相反地,设定5 个主要代谢物含量均低于55 个单株对应指标均值的单株为低含量主要代谢物叶用单株选择标准,筛选出1#、2#、3#、10#、16#、42#、53#、56# 主要代谢物含量低的单株8 个。
2.3 叶产量性状和莽草酸途径主要代谢物含量的相关性分析
如表3 所示,就叶产量性状而言,单叶干质量分别与单叶面积、比叶干质量呈极显著正相关(P < 0.01);单叶面积比与叶干质量呈显著负相关(P < 0.05)。就莽草酸途径主要代谢物含量而言,色氨酸含量、酪氨酸含量均与总黄酮含量呈极显著正相关(P < 0.01),色氨酸含量与酪氨酸含量呈极显著正相关(P < 0.01),表现出显著的协同作用。考虑叶产量性状和莽草酸途径主要代谢物含量的相关性,单叶面积与莽草酸含量呈显著负相关(P < 0.05);比叶干质量分别与莽草酸含量、色氨酸含量呈极显著正相关(P < 0.01),与酪氨酸含量呈显著正相关(P < 0.05);单位枝长叶干质量分别与酪氨酸含量、总黄酮含量呈显著正相关(P < 0.05)。上述相关性为利用简单易测的叶产量性状预测单株中主要代谢物含量或高含量主要代谢物单株的早期选育提供了参考。
2.4 综合评价及单株筛选
2.4.1 主成分分析
主成分分析结果如表4 ~ 5 所示,经过主成分分析,将叶产量性状和莽草酸途径主要代谢物含量等9 项指标转成综合指标,基于累计贡献率大于80% 的选择原则提取前5 个主成分,其贡献率分别为28.159%、21.397%、17.540%、10.754%、7.871%,累计贡献率为85.722%,说明前5 个主成分基本代表了大部分叶产量性状和主要代谢物含量信息;基于特征值大于1 的选择原则提取前3 个主成分,贡献率分别为28.159%、21.397%、17.540%,累计贡献率67.097%。经比较提取前5个主成分与提取前3 个主成分,对供试单株的综合排名一致,因此确定前3 个主成分为叶用单株筛选的综合指标。
根据矩阵系数和标准化后的数据得到3 个主成分的得分函数表达式:
Z1=-0.012X1+0.460X2+0.636X3+0.310X4+0.415X5+0.860X6+0.842X7+0.096X8+0.438X9;
Z2=0.892X1+0.641X2-0.273X3+0.549X4-0.530X5-0.075X6+0.061X7-0.221X8-0.062X9;
Z3=0.258X1+0.572X2+0.472X3-0.408X4+0.386X5-0.150X6-0.247X7+0.350X8-0.664X9。
再以3 個主成分的方差贡献率计算每个主成分的权重,得到综合评价函数式:
F=0.420Z1+0.319Z2+0.261Z3。
如表5 所示,主成分综合得分排名前5 位的由高到低的单株为23#、24#、20#、29#、34#,同样排名后5 位的由低到高的单株为49#、1#、2#、43#、51#,其中排名前五的单株的单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量、莽草酸含量、色氨酸含量、酪氨酸含量、苯丙氨酸含量、总黄酮含量的均值分别比排名后五位的单株均值对应指标提高41.93%、99.39%、40.47%、53.87%、19.40%、44.87%、49.75%、27.79%、13.26%。进一步分析可知,基于叶产量性状与莽草酸途径主要代谢物含量等指标的综合评价,应重点考虑单叶干质量、单位枝长叶干质量2 个叶产量性状及色氨酸含量、酪氨酸含量2 个主要代谢物含量指标。
3 讨 论
王祖磊[7] 研究发现,银杏叶中莽草酸含量(4.13%)与相同提取方法的八角茴香莽草酸含量(4.06%)相当,可以考虑将其作为生产中八角茴香的补充或替代品。高产优质药用银杏选育和集约栽培已成为叶用银杏栽培的发展方向,并取得了明显进展。我国银杏分布范围广,种质资源丰富,但收集、评价研究还远远不够,基于莽草酸途径高代谢物含量的叶用银杏种质评价和筛选研究也未见报道。目前叶用银杏多采用实生繁殖,植株间变异大、良莠不齐,直接影响叶产量和品质。大量研究表明银杏叶产量及叶中类黄酮、萜内酯等活性成分在单株、家系、种源间存在显著或极显著差异[14-17]。一般情况下,变异系数大于10%,则认为种质间存在较大差异[18],本研究表明单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量等叶产量性状,叶中莽草酸、色氨酸、酪氨酸、苯丙氨酸及类黄酮等主要代谢物含量在单株间均呈显著(P < 0.05)或极显著性差异(P < 0.01),且变异系数均超过10%,即广泛的遗传变异为筛选高叶产量、莽草酸途径以及高主要代谢物含量的叶用单株提供了种质基础。如单叶面积、单叶干质量、比叶干质量、单位长度叶干质量最高的单株分别是16#、23#、32#、57#,分别比供试单株对应指标均值高47.42%、69.46%、37.216%、99.286%;莽草酸、色氨酸、酪氨酸、苯丙氨酸、总黄酮含量最高的单株分别是31#、39#、44#、15#、57#,分别比供试单株对应指标均值高44.13%、51.65%、54.34%、78.76%、106.07%,选择效果显著。
植物体内的生物活性物质含量常与表型密切相关,这些表型性状可作为间接选择的重要参考[19-20]。药用植物功能成分含量与表型性状的相关性受遗传与环境的互作影响,尤其因栽培环境的变化而缺乏规律性,从而给高产优质种质的筛选和培育带来了困难[21]。本研究供试55 个单株均釆自南京林业大学银杏资源圃,环境具有同质性,所以供试单株银杏叶产量性状与莽草酸途径主要代谢物含量的相关性则主要受遗传差异的影响。
本研究表明,单叶面积与莽草酸含量呈显著负相关;比叶干质量分别与莽草酸含量、色氨酸含量呈极显著正相关,与酪氨酸含量呈显著正相关;单位枝长叶干质量分别与酪氨酸含量、总黄酮含量呈显著正相关。上述相关性可以通过简单易测的叶产量性状指标预测主要代谢物含量,为高主要代谢物含量的单株早期选育提供了参考。
银杏叶产量及莽草酸途径主要代谢物含量双增的选育目标,对于叶用银杏的现代化加工利用产业化具有重要意义[1]。因此,叶用银杏单株的选育需要将多个叶产量指标及莽草酸途径主要代谢物含量结合起来,是提高药用银杏生物活性物质育种的有效策略[3-4]。基于供试55 个单株的主成分综合得分,排名前五的单株(23#、24#、20#、29#、34#)的单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量、莽草酸含量、色氨酸含量、酪氨酸含量、苯丙氨酸含量、总黄酮含量的均值分别比排名后五位的单株(49#、1#、2#、43#、51#) 均值分别提高41.93%、99.39%、40.47%、53.87%、19.40%、44.87%、49.75%、27.79%、13.26%,即排名前五的单株表现为叶产量及莽草酸途径主要代谢物含量均高,具有进一步推广区划和推广的潜力,为下一步的育种和栽培模式研究提供了重要的材料基础。进一步分析可知,基于叶产量性状与莽草酸途径主要代谢物含量等指标的综合评价,应重点考虑单叶干质量、单位枝长叶干质量2 个叶产量性状及色氨酸含量、酪氨酸含量2 个主要代谢物含量指标。以4 个叶产量性状均高于55 个单株对应指标均值为标准,筛选出叶产量高的单株7 个(20#、21#、23#、24#、32#、34#、36#),反之筛选出低叶产量单株11 个(1#、2#、9#、13#、17#、22#、25#、35#、37#、51#、56#);同理筛选出莽草酸途径主要代谢物含量高的单株4 个(24#、27#、28#、35#),主要代谢物含量低的单株8 个(1#、2#、3#、10#、16#、42#、53#、56#),为定向培育特异用途的专类园和莽草酸途径重要主要代谢物合成代谢研究提供了特异材料。本文仅对55 株具有叶用潜力的超级苗进行了莽草酸途径主要代谢物含量及叶产量性状评价,今后需要进一步扩大调查范围,更多发掘优良个体,并进行区域化试验为生产良种化提供优质种质资源。另外,银杏叶中莽草酸途径主要代谢物含量及各种代谢物比例是衡量银杏叶质量的主要指标,且在时间和空间上呈现一定的规律性变化[13,22],所以兼顾叶产量、主要代谢物含量及其比例的研究要提到日程上来。
4 结 论
1)银杏叶产量性状及主要代谢物含量的9 个指标在株间均呈显著或极显著差异,且变异系数均超过10%,在株间存在丰富遗传变异,具备筛选潜力。
2)单叶面积与莽草酸含量呈显著负相关;比叶干质量分别与莽草酸含量、色氨酸含量呈极显著正相关,与酪氨酸含量呈显著正相关;单位枝长叶干质量分别与酪氨酸含量、总黄酮含量呈显著正相关,为高叶产量或高含量主要代谢物单株的早期选育提供了参考。
3)基于主成分综合得分,排名前五的单株(23#、24#、20#、29#、34#)的单叶面积、单叶干质量、比叶干质量、单位枝长叶干质量、莽草酸含量、色氨酸含量、酪氨酸含量、苯丙氨酸含量、总黄酮含量的均值分别比排名后五位的单株(49#、1#、2#、43#、51#、)均值对应指标提高41.93%、99.39%、40.47%、53.87%、19.40%、44.87%、49.75%、27.79%、13.26%; 基于叶产量性状筛选出叶产量高的单株7 个(20#、21#、23#、24#、32#、34#、36#),反之筛选出低叶产量单株11 个(1#、2#、9#、13#、17#、22#、25#、35#、37#、51#、56#);基于叶多功能组分含量筛选出主要代谢物含量高的单株4 个(24#、27#、28#、35#),主要代谢物含量低的单株8 个(1#、2#、3#、10#、16#、42#、53#、56#),即基于叶产量性状、主要代谢物含量和主成分分析综合评价多层次筛选出特异单株,为定向培育特异用途的专类园及莽草酸途径主要代谢物代谢研究提供了材料。
参考文献:
[1] 辜夕容, 江亚男, 倪亚兰, 等. 叶用银杏的良种选育与定向培育研究进展[J]. 中草药,2017,48(15):3218-3227.
GU X R, JIANG Y N, NI Y L, et al. Research progress onbreeding and cultivation ofGinkgo biloba for leaf use in China[J].Chinese Traditional and Herbal Drugs,2017,48(15):3218-3227.
[2] 郁万文, 刘新亮, 曹福亮, 等. 不同银杏无性系叶药用成分差异及聚类分析[J]. 植物学报,2014,49(3):292-305.
YU W W, LIU X L, CAO F L, et al. Cluster analysis on the mainmedicinal components in differential leaves ofGinkgo clones[J].Chinese Bulletin of Botany,2014,49(3):292-305
[3] 曹福亮, 郁万文. 银杏丰产栽培实用技术[M]. 北京: 中国林业出版社,2011.
CAO F L, YU W W. Practical techniques for high-yieldcultivation of ginkgo[M]. Beijing: China Forestry Press,2011.
[4] 江德安, 李国元, 李顺文, 等. 叶用银杏品种、形态指标与产量相关性及选择[J]. 森林与环境学报,2004,24(2):169-171.
JIANG D A, LI G Y, LI S W, et al. Correlation and selectivity ofleaf-used ginkgo variety leaf form indicator and leaf output [J].Journal of Forest and Environment,2004,24(2):169-171.
[5] 许继业, 牟志刚, 刘国华, 等. 银杏半同胞家系叶主要功能性状及组分含量差异[J]. 经济林研究,2022,40(3):27-35.
XU J Y, MOU Z G, LIU G H, et al. Analysis of main functionaltraits and component content differences in leaves of halfsibfamilies ofGinkgo biloba[J]. Non-wood Forest Research,2022,40(3):27-35.
[6] 江晶潔, 刘涛, 林双君. 基于莽草酸途径微生物合成芳香族化合物及其衍生物的研究进展[J]. 生命科学,2019,31(5):430-448.
JIANG J J, LIU T, LIN S J. Research progress on the biosynthesisof aromatic compounds by microorganisms[J]. Chinese Bulletinof Life Sciences,2019,31(5):430-448.
[7] 王祖磊. 莽草酸新资源及其分离纯化方法的研究[D]. 杭州:浙江大学,2010.
WANG Z L. The research on new resources of shikimic acidand its isolation and purification[D]. Hangzhou: ZhejiangUniversity,2010.
[8] ZELAYA I A, ANDERSON J A, OWNE M D, et al. Evaluationof spectrophotometric and HPLC methods for shikimic aciddetermination in plants: models in glyphosate-resistant and-susceptiblecrops[J]. Journal of Agriculture Food Chemistry,2011,59(6):2202-12.
[9] 张静, 张志梅, 王晓宁, 等.1,2- 萘醌-4- 磺酸钠分光光度法测定苯丙氨酸[J]. 化学研究与应用,2014,26(6):868-871.
ZHANG J, ZHANG Z M, WANG X N, et al. Spectrophotometricdetermination of phenylalanine using sodium 1,2-naphthoquinone-4-sulfonate as a chromogenic reagent[J]. Chemical Research andApplication,2014,26(6):868-871.
[10] 赫敏. 应用人工神经网络结合遗传算法同时测定色氨酸、酪氨酸和苯丙氨酸[D]. 西宁: 青海师范大学,2014.
HE M. Application of artificial neural network and geneticalgorithm combine to the simultaneous determination of trp, tyrand phe[D]. Xining: Qinghai Normal University,2014.
[11] 徐澜, 安伟. 紫外分光光度法同时测定色氨酸和酪氨酸[J].光谱实验室,2011,28(5):2320-2323.
XU L, AN W. Simultaneous determination of tryptophan andtyrosine by ultraviolet spectrophotometry [J]. Chinese Journal ofSpectroscopy Laboratory,2011,28(5):2320-2323.
[12] 吴岐奎, 邢世岩, 王萱, 等. 叶用银杏种质资源黄酮和萜内酯类含量及AFLP 遗传多样性分析[J]. 园艺学报,2014,41(12):2373-2382.
WU Q K, XING S Y, WANG X, et al. Genetic diversity of leaf-usedGinkgo biloba germplasms based on flavonoids and ginkgolidescontents and AFLP markers[J]. Acta Horticulturae Sinica,2014,41(12):2373-2382.
[13] 李卫星, 甄珍, 周春华, 等. 银杏雄株叶片和花粉主要类黄酮成分含量分析[J]. 中国农业科学,2010,43(13):2775-2783.
LI W X, ZHEN Z, ZHOU C H, et al. Flavonoid content of the leavesand pollen of maleGinkgo biloba plants[J]. Scientia AgriculturaSinica,2010,43(13):2775-2783.
[14] 石福娟, 杨超杰, 陈秀芬, 等. 产地、树龄、采收期等因素对银杏叶中黄酮和萜内酯含量的影响[J]. 中国中药杂志,2022,47(15):4055-4065.
SHI F J, YANG C J, CHEN X F, et al. Effect of origin, tree age,and harvesting time on content of flavonoids and terpene lactonsinGinkgo folium[J]. China Journal of Chinese Materia Medica,2022,47(15):4055-4065.
[15] 许继业, 郁万文, 曹福亮, 等. 不同雄株银杏叶提取液抗氧化能力及主要功能成分含量差異[J]. 食品与发酵工业,2022,48(5):142-149.
XU J Y, YU W W, CAO F L, et al. The differential analysis ofantioxidant capacity and main functional components content ofleaf extraction from differentGingo biloba male plants[J]. Foodand Fermentation Industries,2022,48(5):142-149.
[16] 鞠建明, 钱士辉, 钱大玮, 等. 银杏半同胞家系种质资源质量的分析与评价[J]. 林业科技开发,2007(6):32-34.
JU J J, QIAN S H, QIAN D W, et al. Analysis and evaluation onidioplasmic resource ofGinkgo bilobas half sib[J]. Journal ofForestry Engineering,2007(6): 32-34.
[17] LU J K, XU Y, MENG Z L, et al. Integration of morphological,physiological and multi-omics analysis reveals the optimalplanting density improving leaf yield and active compoundaccumulation inGinkgo biloba[J]. Industrial Crops and Products,2021,172:114055.
[18] 蓝丽霞, 徐展宏, 孙操稳, 等. 青钱柳种质资源评价及其优良家系和单株筛选[J]. 林业科学研究,2022,35(5):42-51.
LAN L X, XU Z H, SUN C W, et al. Evaluation on germplasmresources ofCyclocarya paliurus and its oriented selection ofsuperior families and trees[J]. Forest Research,2022,35(5):42-51.
[19] 张恒, 申春晖, 陈锐帆, 等. 基于3 种数学方法的粤北油茶果实性状综合评价[J]. 中南林业科技大学学报,2022,42(11):71-79,208.
ZHANG H, SHEN C H, CHEN R F, et al. Comprehensiveevaluation of the fruit traits ofCamellia oleifera in northernGuangdong based on three mathematical methods[J]. Journalof Central South University of Forestry & Technology,2022,42(11):71-79,208.
[20] 陳永忠, 许彦明, 张震, 等. 油茶果实主要数量性状分析及育种指标体系筛选[J]. 中南林业科技大学学报,2021,41(3):1-9.
CHEN Y Z, XU Y M, ZHANG Z, et al. Analysis of fruit mainquantitative traits and selection of breeding index inCamelliaoleifera[J]. Journal of Central South University of Forestry &Technology,2021,41(3):1-9.
[21] 田力, 徐骋炜, 尚旭岚, 等. 青钱柳药用优良单株评价与选择[J]. 南京林业大学学报( 自然科学版),2021,45(1):21-28.
TIAN L, XU C W, SHANG X L, et al. Evaluation and selectionon superior individuals for medicinal use ofCyclocaryapaliurus[J]. Journal of Nanjing Forestry University (NaturalSciences Edition),2021,45(1):21-28.
[22] 韩晋, 郁万文, 曹福亮, 等. 基于叶和花粉中类黄酮含量的银杏雄性优株初选[J]. 经济林研究,2019,37(4):88-95.
HAN J, YU W W, CAO F L, et al. Preliminary selection ofsuperior maleGinkgo biloba plants based on flavonoid contentin leaves and pollen[J]. Non-wood Forest Research,2019,37(4):88-95.
[ 本文编校:李义华]

