磷对铝胁迫油茶芽苗初生根保护酶的影响
吕铭滔 龚海光 黄永芳 龚勇军

摘 要:【目的】研究不同浓度磷对铝胁迫下油茶芽苗初生根的生长和生理活性的影响,为磷缓解铝胁迫的生理机制和油茶耐铝特性提供了理论依据。【方法】以“岑软2 号”油茶种子为试验材料,采用水培实验设置了5个水平:全铝(Al,4 mmol/L Al)、全铝+ 低磷(P1,1 mmol/L P)、全铝+ 中磷(P2,2 mmol/L P)、全铝+高磷(P4,4 mmol/L P)以及无磷铝(CK)作为对照,在处理周期内的第0、1、3、5 和7 天分别测定不同处理下油茶芽苗初生根的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧阴离子自由基(O2-)理化性质指标,并每天测定生长长度,计算根相对生长率。【结果】Al 处理相对生长率为52.81%,根系SOD活性降低,O2- 含量升高,POD 和CAT 活性增加;P1 处理根相对生长率可达144.42%,SOD 活性显著高于P2、P4 和Al 处理组(P < 0.05),O2- 含量显著低于Al 处理组(P < 0.05),POD 和CAT 水平显著低于Al 处理组(P < 0.05);P2 处理根相对生长率在处理周期内均低于100%,POD 活性显著高于CK 处理组,SOD 活性显著低于CK 处理组,CAT 活性显著低于Al 处理组;P4 处理组中根相对生长率仅有27.32%,SOD 和CAT 活性受到抑制,POD 活性和O2- 含量升高。【结论】在4 mmol/L 铝胁迫的情况下,添加1 mmol/L 磷对油茶芽苗初生根的缓解作用更好。
关键词:普通油茶;磷元素;铝胁迫;初生根;生理活性
中图分类号:S794.4 文献标志码:A 文章编号:1003—8981(2023)03—0271—07
铝在土壤中通常以难溶性的硅酸盐或氧化铝形式存在,对植物和环境没有危害作用,但在酸性条件下,铝元素会以Al3+,Al(OH)2+ 和Al(OH)2+等形式存在,对植物产生毒害作用[1]。铝对植物的主要毒害部位是根系,会抑制根尖细胞生长发育和养分吸收,损害光合作用,最终导致植物细胞死亡[2]。铝胁迫会诱导活性氧(Reactive oxygenspecies,ROS)过度积累,使质膜过氧化损伤,细胞完整性被破坏[3],同时ROS 还作为一种信号分子,激活植物细胞的抗氧化机制[4]。在酸铝胁迫下,水稻根的超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX) 等活性随着铝浓度的增加而增加[5],栝楼根的SOD及CAT 的活性提高,过氧化物酶(Peroxidase,POD)活性无显著变化[6],六堡茶苗不同浓度铝胁迫分别对CAT 活性、POD 活性的有显著促进作用,SOD 对铝胁迫的反应程度弱于CAT 和POD[7]。
磷是植物生长发育所必需的大量元素之一,磷存在于核酸、脂质、核苷酸中,在生理代谢中起着重要作用[8]。缺磷会影响蛋白质合成,妨碍糖分运输,从而影响植株代谢受阻,抗逆性弱[9]。磷可以减轻铝和其他金属对植物的毒性症状[10],对于磷缓解铝胁迫的机制有多种猜测,有可能是磷在酸的作用下与铝离子形成复合物[11],抑制植物对铝离子的吸收;有可能是磷促进植物的生长发育,改善植物的营养状态[12];也有可能是磷提升植物的抗氧化氢酶活性,促进根系分泌有机物[13]。磷能提高菠菜在铝胁迫下的过氧化物酶活性,在一定程度上提高抗氧化防御能力,减轻铝对菠菜的毒害作用[14];亢亚超等[15] 研究发现施加磷处理组的观光木幼苗的总根表面积、根平均直径、总根长、根尖数、总根体积均高于未施加磷的处理组,表明磷能有效缓解铝胁迫对观光木幼苗的毒害作用。
油茶Camellia oleifera 是我国重要的木本油料植物,截至2022 年底,我国油茶栽培面积约467万hm2[16],主要分布在我国长江以南的酸性红壤区,高磷低磷成为限制油茶产量提升的主要因素之一。提高产量可以通过添加磷缓解铝胁迫下油茶的生长发育,磷能缓解铝胁迫对油茶叶片的影响[17-18],改善根系形态和促进根的生长发育[19],Qu 等[20]对磷缓解油茶幼苗铝胁迫的研究表明添加P 降低了Al 毒性下ROS 积累引起的膜脂过氧化反应。4 mmol/L 的铝会抑制油茶根系的生长,降低植株的生理活性[21],Zhou 等[22] 研究了低浓度磷对油茶受高浓度铝胁迫毒害作用的缓解效果,但对高浓度磷缓解铝胁迫的效果研究甚少。
因此,本研究以油茶芽苗为研究材料,研究不同浓度磷铝处理下,油茶芽苗初生根中保护酶的生理指标变化,再进一步阐明磷缓解油茶根系铝胁迫的机理,以填补高浓度磷缓解油茶铝胁迫下根系抗氧化物酶体系的空白。
1 材料与方法
1.1 试验材料
供试材料为“岑软2 号”半同胞家系的油茶芽苗。于2013 年10 月采自华南农业大学增城教学科研基地,选取优质油茶种子,催芽至种子初生根长到8 ~ 10 cm 时,转入预制溶液的中预培养72 h(溶液含0.5 mmol/L KCl,用0.5 mol/L HCl和0.5 mol/L NaOH 调节溶液pH 值至4.3)。
1.2 试验设计
设置P1、P2、P4、Al、CK( 空白对照) 共5 个处理,铝源为AlCl3·6H2O。Al 处理为将预培养的芽苗转入含有0.5 mmol/L KCl 和4 mmol/L 铝离子浓度的溶液中培养。P1、P2、P4 处理分别在Al 处理的基础上加入1、2、4 mmol/L 磷离子溶液进行培养。CK 处理将预培养的芽苗转入仅含有0.5 mmol/L KCl 的溶液中培养。每个处理3 次重复,调节pH 值至4.3,每隔2 d 调pH 值,一天24 h使用氧气泵加氧。处理后,0、1、3、5 和7 d 分别测定油茶的各项指标,包括:超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧阴离子自由基(O2-),并每天測定生长长度,计算根相对生长率。
1.3 指标测定
1.3.1 根相对生长率(Relative root elongation,RRE)
以CK 为对照,处理前分别做好标记,测量根长并记录,每天定时测其根长度,两天差值为根伸长量,胁迫时间为0、1、2、3、4、5、6、7 d,每个处理6 个重复。
1.3.2 SOD 活性测定
SOD 活性采用氮蓝四唑法[23] 测定,经处理后取油茶芽苗初生根用去离子水清洗,滤纸吸干水分后剪碎混匀,称取0.5 g 于研钵中加2 mL 蒸馏水研磨成匀浆,转移到10 mL 离心管中,用6 mL 蒸馏水分次洗涤研钵,转入离心管中低温放置。提取液于4 ℃,10 000 r/min 冷冻离心机离心20 min,上清液即为SOD 粗提液。加入反应试剂和核黄素后立即用双层黑色纸套遮光,全部试剂加完后摇匀,将所有试管置于4 支40 w 荧光灯显色(约2 500 ~ 3 000 lx),反应13 min,反应温度控制在25 ℃,反应结束后用黑色布遮盖试管终止反应。以暗中对照管作为空白对照调零,在560 nm 下测定反应液的光密度,记录测定数据。
1.3.3 POD 活性测定
POD 活性采用愈创木酚法[23],经处理后取油茶芽苗初生根用去离子水清洗,滤纸吸干水分后剪碎混匀,取初生根0.5 g 于预冷的研钵中,加入石英砂,再加入液氮研磨成粉状,加2 mL 100 mmol/L磷酸缓冲液在冰浴下研磨成匀浆,倒入10 mL 离心管中,2 mL 缓冲液冲洗研钵,转移到离心管中,重复3 次,总共加入8 mL PBS(100 mmol/L),震荡摇匀,待沉淀后离心10 min,上清液即为酶粗提液,转移到另一离心管,4 ℃保存。加入相应物质,水浴锅37 ℃预热3 min 后加入3 mL POD混合液,并开始计时,3 min 后迅速加入20% TCA终止反应,在470 nm 波长下测定吸光值。
1.3.4 CAT 活性测定
CAT 活性采用紫外吸收法[23]。经处理后取油茶初生根用去离子水清洗,滤纸吸干水分后剪碎混匀,取初生根0.5 g 于预冷的研钵中,加入石英砂,再加入液氮研磨成粉状,加2 mL 50 mmol/L磷酸缓冲液在冰浴下研磨成匀浆,倒入10 mL 离心管中,用2 mL缓冲液冲洗研钵,转移到离心管中,重复3 次,总共加入8 mL Pbs(50 mmol/L),震荡摇匀,待沉淀后离心10 min,上清液即为CAT粗提液,转移到另一离心管,4 ℃保存。每个处理3 个重复。加入1 mL 200 mmol/L 过氧化氢溶液,分光光度计在波长为A240 空白对照调零,每加一管立即在分光光度计下测定反应前后吸光值,反应时间为10 min。
1.4 数据分析
采用Microsoft Excel 2016 软件处理数据和作图,SPSS 24.0 软件进行多重比较(P < 0.05)。
2 结果与分析
2.1 磷对铝胁迫的缓解效果
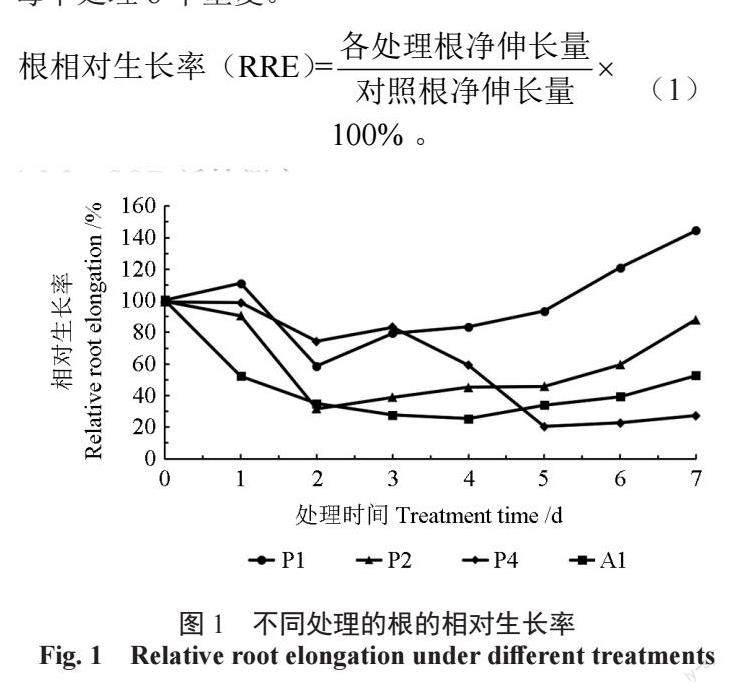
4 mmol/L 铝胁迫条件下,油茶初生根相对生长率逐渐下降,在第4 天降到最小值45.28%,随后略有上升,但相对生长率仍小于100%。P1 处理下,第1 天根相对生长率增加,高于100%,第2天降低到最低值,为58.68%,第3 天开始逐渐上升,在第6、7 天时,根相对生长率均大于100%,第7天达到最大值144.42%。P2 处理在第1、2 天,相对生长率显著下降,第3 天开始缓慢上升,直到第7 天,根相对生长率是88.15%,仍低于100%。P4 处理下根相对生长率逐渐降低,第7 天降到最低值27.32%。
2.2 磷对铝胁迫POD 活性
CK 处理在处理周期内POD活性无显著变化,呈增加—减少—增加变化,均低于其余处理。Al处理在第1 天时POD 活性迅速提高,第3 天后POD 活性随时间的增加而增加,与CK 处理之间差异在第5、7 天达到显著水平(P < 0.05),在第7 天达到最大值1.91 U·g-1·min-1。P1 处理与CK在处理周期中与CK 水平接近,无显著差异,说明P1 处理能够降低因Al 而升高的POD 活性,具有缓解Al 胁迫的能力。P2、P4 处理的POD 活性与Al 处理处于同一水平,无显著差异,与CK 相比,在第1 天,P4 显著高于CK,第3、5 天两者与CK 无显著差异,第7 天两者活性水平显著高于CK,说明P2、P4 处理对缓解Al 胁迫无显著作用。
2.3 磷对铝胁迫SOD 活性
CK 处理在整个处理周期内趋于稳定,无显著变化。在第1 天,4 个处理的SOD 活性均与CK处理有显著差异(P < 0.05)。Al 处理在第3、5、7 天的SOD 活性均低于CK 处理,其中在第1、5天有显著差异,说明Al 处理能显著降低普通油茶初生根的SOD 活性。P1 处理在第3、5、7 天均高于其余处理,在第5、7 天显著高于P4、Al 处理(P < 0.05),说明P1 处理能够缓解Al 胁迫对SOD 活性的作用,并提高SOD 活性。P2 和P4 处理在整个处理周期中,SOD 活性均低于CK 和Al处理,且随着时间增加,P2、P4 处理显著低于CK 处理,且P4 显著低于P2,说明当磷浓度大于2 mmol/L 时,随着磷浓度的增加,磷会对普通油茶初生根SOD 活性产生抑制作用。
2.4 磷对铝胁迫CAT 活性
Al 处理在处理周期内CAT 活性先增加后减少,在5 d 达到最大值1.14 U·g-1·min-1,均高于CK 处理,且在第1、5、7 天达到显著水平。P1 处理在处理周期内,CAT 活性与CK 相近,无显著性差异。P2 处理在处理周期内CAT 活性均低于CK 处理,但差异不显著。P4 处理第1 天高于CK 处理,第3、5、7 天均显著低于CK 处理,说明2 mmol/L 磷濃度以上随着磷浓度的增加,CAT 活性降低。
2.5 磷对铝胁迫超氧阴离子自由基含量
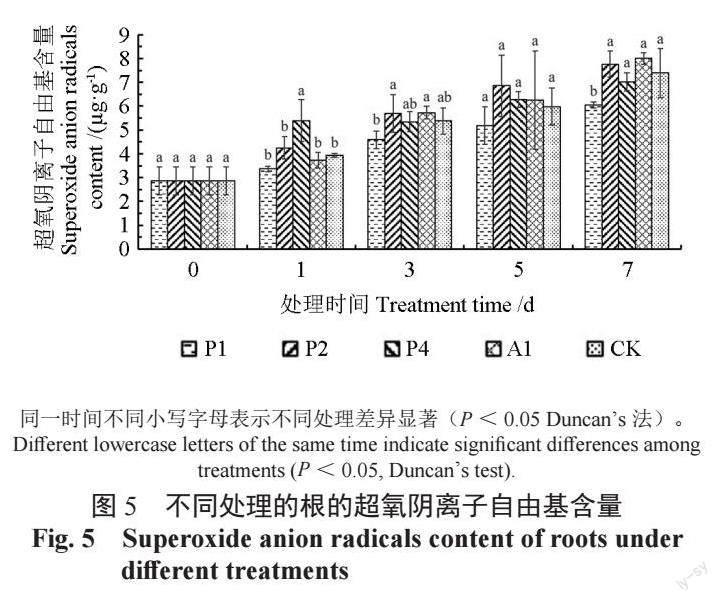
各处理的超氧阴离子自由基含量随处理时间的增加而上升。Al 处理总体上比CK 含量高,在第1 天时显著高于其余处理,P1 在整个处理周期内超氧阴离子自由基含量均低于CK 和Al,并在第7 天时达到显著水平。P2 处理超氧阴离子含量在整个处理周期内高于CK,但未达到显著水平。P4 处理下超氧阴离子自由基含量于第1 天显著高于CK,随着处理时间延长,含量逐渐下降,并于第7 天低于CK 处理。
3 讨 论
铝毒是植物在酸性土壤中生长受抑制的主要原因,植物受到铝胁迫时,最先受抑制的是根系的生长发育,进而影响植物对水分和营养的吸收能力,根系的生长情况是最易被观察到的现象,因此根长生长常被作为衡量植物所受铝胁迫程度的重要指标[24]。本研究发现铝胁迫能明显抑制油茶芽苗初生根的生长发育,且抑制程度随处理时间的增加而增加,这与栝楼受铝胁迫时结果相似[25],栝楼在300 μmol/L 铝胁迫下均能存活,但生长指标随胁迫时间的延长而不断下降,油茶虽是铝富集植物,但在4 mmol/L 浓度铝胁迫下相对生长率逐渐下降,表明4 mmol/L 浓度铝胁迫会对油茶造成毒害作用。4 mmol/L 磷和4 mmol/L 铝共同处理下的油茶芽苗初生根生长受抑制程度最高,相对生长率、SOD 及CAT 活性受到显著抑制,推测是高浓度磷铝离子形成协同作用,进一步加深对油茶芽苗的毒害作用。本研究发现低浓度磷能有效缓解铝胁迫对油茶芽苗初生根伸长的抑制作用,但磷浓度过高会抑制油茶芽苗初生根的伸长,与张文献等[26] 研究磷胁迫对大豆幼苗生长时发现的结果相似。在磷铝共同处理的条件下,相对生长率在第2 天时出现显著下降,随后缓慢上升,推测是油茶对磷铝处理的一种适应表现,从第3 天开始相对生长率和抗氧化酶活性逐渐稳定。本研究发现1 mmol/L 磷能使铝胁迫的油茶芽苗初生根相对生长率保持在CK 水平,相对生长率在第7 天超过100%,推测有可能与大豆根系生长同理[27],是因为低磷调控油茶初生根生长素的不均匀分布,促进根系生长,提高植株根冠比。
植物组织在代谢过程中可产生单线态氧(1O2)、过氧化氢(H2O2)、羟自由基(OH.-)、超氧阴离子自由基(O2-)等活性氧,活性氧化学性质不稳定,具有很强的氧化能力,植物体内活性氧浓度过度升高,会产生氧化损伤,从而引起细胞结构和功能的损坏[28],因此可以通过测定在铝胁迫下O2- 的含量,间接了解植物的抗性强弱或细胞组织的受损情况。何虎翼等[29] 对黑麦铝胁迫的研究发现,受铝胁迫的黑麦的O2- 产生速率增加,其结果与本实验中铝胁迫能导致油茶产生的O2- 增加,且产生的量随时间的增加而增多相似,猜测是铝胁迫下油茶芽苗初生根的SOD 活性受到抑制,O2- 大量积累导致SOD 代谢失衡。
植物在逆境条件下会通过调动一系列抗氧化物酶消除超氧阴离子带来的伤害。SOD、POD、CAT 都是植物体内重要的抗氧化酶,SOD 能将生物体内的超氧阴离子自由基转化成H2O2 和O2,而POD 和CAT 能将H2O2 转化成H2O 和O2,从而避免了超氧阴离子自由基对植物自身造成的伤害。在环境稳定的情况下,植物能维持的超氧阴离子自由基的产生和消除的动态平衡,轻度的铝胁迫能促进POD、SOD、CAT 活性增加,但重度铝胁迫却能抑制3 种酶的活性。在植物抗性机制中,POD 和SOD 等抗氧化酶活性变化可作为衡量抗胁迫的重要指标[30]。本研究中Al 处理下SOD 活性受到抑制,O2- 含量累积,POD 和CAT 活性与CK相比显著提高,这可能与不同无性系之间耐铝性有关[31],因而油茶在受到铝胁迫后,SOD 无法大量歧化O2-,导致植物受到毒害,从而影响芽苗初生根的生长发育,猜测是油茶芽苗对短期铝胁迫做出的适应性反应,SOD 是代謝活性氧的第一道防线,因此在大量活性氧参与反应下,酶活性降低,POD 和CAT 属于第二道防线,因此短时间内酶活性反而呈上升趋势,这与任智新等[32] 的研究相似,本研究中尚未发现酶活性急剧下降现象,可能是处理时间相对较短,后续需要延长处理时间,持续观察。试验中加入1 mmol/L 磷使O2- 含量显著下降,但当磷的浓度增加时,O2- 含量恢复到铝胁迫处理状态,CAT 活性呈下降趋势,这与前人研究高磷对黄瓜的胁迫作用结果相似[33],推测高浓度磷使得油茶从铝胁迫转移成磷胁迫并且活性氧消除能力小于活性氧产生能力[34]。本试验研究只探讨了油茶芽苗根系在磷铝处理下抗氧化酶系活性的变化,并未就油茶根系细胞中磷离子和铝离子含量、细胞壁结构、相对电导率等一系列抗胁迫反应进行研究,后续有待进一步深入研究。
4 结 论
高浓度磷或铝胁迫能够明显抑制油茶芽苗初生根的生长,降低3 种抗氧化酶的活性,从而减弱普通油茶抗逆性能力,超氧阴离子水平上升。磷可以有效缓解油茶芽苗铝胁迫下初生根的抑制作用,在4 mmol/L 铝胁迫的情况下,1 mmol/L 磷处理在相对生长率、SOD 活性、POD 活性、CAT活性、超氧阴离子方面均有一定的改善效果,表明低磷可以缓解铝胁迫,有效降低,能降低铝胁迫对POD 和CAT 活性影响,提高SOD 活性,降低超氧阴离子水平,但高磷会加重铝胁迫对油茶芽苗初生根生长的抑制作用。
参考文献:
[1] 孟磊, 艾如波, 林晗, 等. 土壤铝胁迫下内生真菌对千年桐幼苗光合作用的影响[J]. 中南林业科技大学学报,2023,43(3):40-49,72.
MENG L, AI R B, LIN H, et al. Effects of endophytic fungi on thephotosynthesis ofVernicia montana seedlings under soil aluminumstress[J]. Journal of Central South University of Forestry &Technology,2023,43(3):40-49,72.
[2] 黄丽媛, 刘珍, 贾胜波, 等. 钙对铝胁迫下油茶生长及生理特性的影响[J]. 广东农业科学,2023,50(2):1-10.
HUANG L Y, LIU Z, JIA S B, et al. Effects of calcium on thegrowth and physiological characteristics ofCamellia oleiferaunder aluminum stress[J]. Guangdong Agricultural Sciences,2023,50(2):1-10.
[3] 张虹, 胡华英, 夏丽丹, 等. 林木对铝的耐性机理研究进展[J]. 世界林业研究,2019,32(6):13-19.
ZHANG H, HU H Y, XIA L D, et al. Research progress inaluminum tolerance mechanisms of forest trees[J]. WorldForestry Research,2019,32(6):13-19.
[4] JONES D L, BLANCAFLOR E B, KOCHIAN L V, et al. Spatialcoordination of aluminium uptake, production of reactive oxygenspecies, callose production and wall rigidification in maizeroots[J]. Plant, Cell & Environment,2006,29(7):1309-1318.
[5] AWASTHI J P, SAHA B, PANIGRAHI J, et al. Redox balance,metabolic fingerprint and physiological characterizationin contrasting North East Indian rice for Aluminum stresstolerance[J]. Science Report,2019,9(8681).
[6] 王志超, 毛轩雯, 李春俣, 等. 硼铝互作对栝楼根系生理代谢的调控效应[J]. 环境科学学报,2023:1-14.
WANG Z C, MAO X W, LI C Y, et al. Regulatory effect ofboron-aluminum interaction on physiological metabolism ofTrichosanthes kirilowii Maxim.[J]. Acta Scientiae Circumstantiae,2023:1-14.
[7] 叶锦培, 李晓丽, 唐世斌, 等. 铝处理对六堡茶苗抗性生理和DNA 甲基化水平的影响[J]. 山东农业科学,2020,52(4):112-116.
YE J P, LI X L, TANG S B, et al. Effects of aluminum treatmenton resistance physiology and DNA methylation level of Liupaotea seedlings[J]. Shandong Agricultural Sciences,2020,52(4):112-116.
[8] 田江, 梁翠月, 陆星, 等. 根系分泌物调控植物适应低磷胁迫的机制[J]. 华南农业大学学报,2019,40(5):175-185.
TIAN J, LIANG C Y, LU X. Mechanism of root exudatesregulating plant responses to phosphorus deficiency[J]. Journalof South China Agricultural University,2019,40(5):175-185.
[9] 郝佳, 刘宇航, 殷洁, 等. 不同磷浓度对土壤理化性质及防风生长和药材品质的影响[J]. 华南农业大学学报,2022,43(3):59-67.
HAO J, LIU Y H, YIN J, et al. Effects of different phosphorusconcentrations on soil physicochemical property, growth andmedicinal materials quality ofSaposhnikovia divaricata[J].Journal of South China Agricultural University,2022,43(3):59-67.
[10] WANG X R, AI S Y, LIAO H. Deciphering interactions betweenphosphorus status and toxic metal exposure in plants andrhizospheres to improve crops reared on acid soil[J]. Cells,2023,12(3):441.
[11] 邵繼锋, 陈荣府, 董晓英, 等. 利用分根技术研究小麦铝磷交互作用[J]. 江苏农业学报,2016,32(1):78-83.
SHAO J F, CHEN R F, DONG X Y, et al. Aluminum-phosphorusinteraction in wheat grown in a split-root device[J]. JiangsuJournal of Agricultural Sciences,2016,32(1):78-83.
[12] 劉小玉, 付登强, 杨伟波, 等. 酸性土壤植物磷铝互作研究进展[J]. 现代农业科技,2014(8):182-183,195.
LIU X Y, FU D Q, YANG W B, et al. Research progress ofinteraction between aluminum and phosphorus in acidic coils[J].Modern Agricultural Science and Technology,2014(8):182-183,195.
[13] 朱美红, 吴韶辉, 刘鹏, 等. 铝胁迫下磷对荞麦根系和根边缘细胞抗性生理的影响[J]. 浙江农业学报,2009,21(3):264-268.
ZHU M H, WU S H, LIU P, et al. Effect of phosphorus on theresistance of roots and border cells to aluminum in buckwheat[J].Acta Agriculturae Zhejiangensis,2009,21(3):264-268.
[14] KARIMAEI M, POOZESH V, REZAEI A. Evaluation ofaluminum toxicity and phosphorus treatment on the physiologicaland biochemical traits of spinach (Spinacia oleracea L)[J].Scientia Horticulturae,2022,298:110981.
[15] 亢亚超, 潘陆荣, 王凌晖, 等. 磷对铝胁迫下观光木幼苗生长的缓解作用[J]. 山东农业科学,2020,52(6):71-76.
KANG Y C, PAN L R, WANG L H, et al. Alleviating effect ofexogenous phosphorus onTsoongiodendron odorum seedlinggrowth under aluminum stress[J]. Shandong AgriculturalSciences,2020,52(6):71-76.
[16] 谭晓风. 油茶分子育种研究进展[J]. 中南林业科技大学学报,2023,43(1):1-24.
TAN X F. Advances in the molecular breeding ofCamelliaoleifera[J]. Journal of Central South University of Forestry &Technology,2023,43(1):1-24.
[17] 戴秋月, 李孟南, 黄永芳, 等. 磷铝处理对2 种油茶光合参数和荧光参数的影响[J]. 经济林研究,2021,39(4):185-194.
DAI Q Y, LI M N, HUANG Y F, et al. Effects of phosphorus onphotosynthetic characteristics of twoCamellia under aluminumstress[J]. Non-wood Forest Research,2021,39(4):185-194.
[18] 渠心静, 陈铭, 廖皎, 等. 磷缓解油茶铝胁迫的叶片生理响应[J]. 中南林业科技大学学报,2021,41(7):62-71.
QU X J, CHEN M, LIAO J, et al. Physiological response of phosphorusalleviates aluminum stress in leaves ofCamellia oleifera[J].Journal of Central South University of Forestry & Technology, 2021,41(7):62-71.
[19] 艾佐佐, 袁军, 黄丽媛, 等. 磷对铝胁迫下油茶幼苗根冠比及根系形态的影响[J]. 江苏农业科学,2017,45(12):106-108.
AI Z Z, YUAN J, HUANG L Y, et al. Effects of phosphoruson root/shoot ratio and root morphology ofCamellia oleiferaseedlings under aluminum toxicity[J]. Jiangsu AgriculturalSciences,2017,45(12):106-108.
[20] QU X, ZHOU J, MASABNI J, et al. Phosphorus relievesaluminum toxicity in oil tea seedlings by regulating the metabolicprofiling in the roots[J]. Plant Physiology and Biochemistry,2020,152:12-22.
[21] HUANG L Y, YUAN J, WANG H, et al. Aluminum stress affectsgrowth and physiological characteristics in oil tea[J]. HortScience,2017,52(11):1601-1607.
[22] ZHOU J Q, AI Z Z, WANG H, et al. Phosphorus alleviatesaluminum toxicity inCamellia oleifera seedlings[J]. InternationalJournal of Agriculture & Biology,2019,21(1):237-243.
[23] 孙群, 胡景江. 植物生理学研究技术[M]. 咸阳: 西北农林科技大学出版社,2006.
SUN Q, HU J J. Research technology of plant physiology[M].Xianyang: Northwest A&F University Press,2006.
[24] FOY C D, CARTER T E, DUKE J A, et al. Correlation of shootand root growth and its role in selecting for aluminum tolerancein soybean[J]. Journal of Plant Nutrition,1993,16(2):305-325.
[25] 唐可, 娄赛炜, 倪晓菁, 等. 硼添加对铝胁迫下栝楼生长和生理的影响[J]. 生态学报,2023,43(7):2903-2914.
TANG K, LOU S W, NI X J, et al. Effects of exogenous boronon growth and physiology ofTrichosanthes kirilowii Maxim.under aluminum stress[J]. Acta Ecologica Sinica,2023,43(7):2903-2914.
[26] 张文献, 李增强, 胡亚丽, 等. 不同浓度磷胁迫对大豆幼苗生长及根系DNA 甲基化水平的影响[J]. 中国农业大学学报,2020,25(12):9-18.
ZHANG W X, LI Z Q, HU Y L, et al. Effects of differentconcentrations of phosphorus stresses on soybean (Glycine max L.)seeding growth and DNA methylation in root system[J]. Journalof China Agricultural University,2020,25(12):9-18.
[27] 刘国选, 陈康, 陆星, 等. 大豆GmPIN2b 调控根系响应低磷胁迫的功能研究[J]. 华南农业大学学报,2021,42(4):33-41.
LIU G X, CHEN K, LU X, et al. Function ofGmPIN2b insoybean regulating root response to low phosphorus stress[J].Journal of South China Agricultural University,2021,42(4):33-41.
[28] 袁云香. 濕地芦苇不同组织超氧阴离子产生速率及丙二醛含量[J]. 科学技术与工程,2019,19(11):40-43.
YUAN Y X. The production rate and malondialdehydecontent of different tissue superoxide anions in wetlandphrgmintes australis[J]. Science Technology and Engineering,2019,19(11):40-43.
[29] 何虎翼, 何龙飞, 黎晓峰, 等. 铝胁迫对黑麦幼苗活性氧系统的影响[J]. 麦类作物学报,2005(6):91-95.
HE H Y, HE L F, LI X F, et al. Effects of aluminum stress onreactive oxygen generation, lipid peroxidation and antioxidantenzyme activity in rye seedling[J]. Journal of Triticeae Crops,2005(6):91-95.
[30] 于姣妲, 夏丽丹, 殷丹阳, 等. 磷素对杉木幼苗耐铝性的影响机制[J]. 林业科学,2018,54(5):36-47.
YU J D, XIA L D, YIN D Y, et al. Effects of phosphorus onaluminum tolerance of Chinese fir seedlings[J]. Scientia SilvaeSinicae,2018,54(5):36-47.
[31] 徐圆圆, 陆明英, 蒋维昕, 等. 铝胁迫下不同耐铝型桉树无性系根和叶抗氧化特征的差异[J]. 浙江农林大学学报,2016,33(6):1009-1016.
XU Y Y, LU M Y, JIANG W X, et al. Al stress with lipidperoxidation and antioxidant enzyme activities in eucalyptus rootsand leaves[J]. Journal of Zhejiang A & F University,2016,33(6):1009-1016.
[32] 任智新, 史建楠, 何佳星, 等. 盐胁迫对青绿苔草生长及生理特性的影响[J]. 草地学报,2022,30(8):2045-2052.
REN Z X, SHI J N, HE J X, et al. Effects of salt stress on growthand physiological characteristics ofCarex leucochlora[J]. ActaAgrestia Sinica,2022,30(8):2045-2052.
[33] 刘伟, 樊文华, 刘奋武, 等. 施磷对镉胁迫下黄瓜苗期光合作用及抗氧化酶系统的影响[J]. 土壤通报,2022,53(3):596-604.
LIU W, FAN W H, LIU F W, et al. Effects of phosphorus onphotosynthesis and antioxidant enzyme system of cucumberseedlings under cadmium stress[J]. Chinese Journal of SoilScience,2022,53(3):596-604.
[34] 石婧, 刘东洋, 张凤华. 棉花幼苗对盐胁迫的生理响应与耐盐机理[J]. 浙江农业学报,2020,32(7):1141-1148.
SHI J, LIU D Y, ZHANG F H. Physiological response and salttolerance mechanism of cotton seedlings to salt stress[J]. ActaAgriculturae Zhejiangensis,2020,32(7):1141-1148.
[ 本文编校:李义华]

