基于流式量子点微球技术的甲乙型流感病毒抗原检测方法的建立和初步应用分析
夏成静,李宝花,郭燕妳,周小合,张润玲,牛英波[.深圳光明区人民医院(西)检验科,广东深圳 5806;.南京诺唯赞医疗科技有限公司,南京 0033]
呼吸道病毒引起的感染和防治是全世界普遍面临的公共卫生挑战。近几年发生的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)大流行,让全世界的公众和公共卫生机构、政策制定者更加重视呼吸道病毒引起的传染病[1-2]。由于不同呼吸道病毒及同一病毒不同亚型的治疗方式和防控措施可能不同,快速精确地鉴定这些病毒及其亚型不仅可以为疾病诊断、治疗提供充足的依据,也可为流行病学调查、疫情防控提供坚实的基础[3-4]。因此,寻找一种快速、灵敏、多重检测呼吸道病毒的方法是非常必要的。而液相蛋白芯片由于可以快速、高通量、平行化的检测多个病毒蛋白(抗原或抗体),在多重检测领域有着独特的优势[5-7]。液相蛋白芯片的核心原理是利用不同标记微球上联接的特异性分子去识别对应的检测物,因此如何制备信息种类丰富的编码微球成为此技术能否实现高通量、高灵敏、多重性检测的关键所在。目前,市场上的编码微球主要由Luminex,Bangs Laboratories 等欧美公司垄断生产,不仅售价高,而且需要昂贵的多通道检测仪器进行检测。而与传统染料相比,具有吸收光谱范围宽、激发荧光光谱窄、发光效率高、发光谱随粒径大小可调、光稳定性好等优点的量子点(quantum dot,QD)逐渐成为了液相芯片中研究最热的荧光编码粒子[8-12]。本研究拟开发一种针对甲型流感病毒(FluA)及乙型流感病毒(FluB)抗原的多重流式检测方法,利用量子点编码微球作为反应载体,建立基于流式量子点微球技术的甲乙型流感病毒抗原联检方法,为常见呼吸道病毒多重检测打下基础。
1 材料与方法
1.1 研究对象 随机收集中国科学院大学深圳医院(光明)西院区2022年5~8月门诊就诊的疑似甲乙型流感病毒感染咽拭子,随机选取81 例,其中男性43 例,女性38 例,年龄1~63 岁。患者样本均使用甲型/乙型抗原检测试剂盒(胶体金法)进行了流感病毒感染的临床诊断,并将剩余咽拭子样本冻存于-80℃。纳入标准:具有呼吸道病毒感染临床症状表现的患者。排除标准:采样前一个月内服用过抗流感药物者。本研究已通过中国科学院大学深圳医院(光明)伦理委员会评审通过。
1.2 仪器与试剂 流式细胞仪(Beckman 公司);实时荧光定量PCR 仪(Life Technologies 公司);酶标仪(BioTek 公司)。FluA/FluB 核蛋白(nucleoprotein,NP)抗原及其配对抗体对(南京诺唯赞医疗科技有限公司)。荧光编码微球(Bangslabs 公司);聚苯乙烯微球(苏州纳微科技股份有限公司);N-羟基硫代琥珀酰亚胺(N-hydroxysulfosuccinimide,sulfo-NHS),1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[N-(3-Dimethylaminopropyl)-N’-ethylcarbodiimide hydrochloride,EDC],2-吗啉乙磺酸(MES)均购自Sigma 公司;样本稀释液及清洗液由磷酸缓冲液、Tween-20 和牛血清清蛋白配制而成,所用试剂均购自上海阿拉丁生化科技股份有限公司;生物素标记试剂盒(Thermo fisher 公司);CdSe/ZnS 量子点纳米晶体(武汉珈源量子点技术开发有限责任公司);FITC donkey anti-mouse IgG(Jackson 公司);链霉亲和素-藻红蛋白染料(SA-PE,BD 公司);96 孔过滤板(Millipore 公司);qPCR 试剂及配套耗材(广州达安基因股份有限公司);甲/乙型流感病毒抗原检测试剂盒(胶体金法,广州万孚生物技术股份有限公司)。
1.3 方法
1.3.1 量子点编码微球检测体系构建
1.3.1.1 量子点编码微球制备:首先对聚苯乙烯微球进行溶胀,然后在溶胀体系中加入不同浓度的CdSe/ZnS 量子点对其进行荧光染色,染色完成后将微球从有机相溶胀体系中转移到水相保存体系中。通过调整量子点和聚苯乙烯微球的浓度比例,获得不同亮度的多峰量子点编码微球。由于聚苯乙烯微球表面具有羧基修饰,因而可以用于后续的抗体偶联。
1.3.1.2 抗体与微球的偶联:采用EDC/Sulfo-NHS方法活化羧基微球后再与FluA/FluB-NP 配对单抗进行偶联。具体步骤为:将106个微球使用50 mmol/L MES 缓冲液洗涤数次后,加入0.2mg sulfo-NHS,0.2mg EDC,迅速涡旋混匀,室温翻转孵育20min。对活化后的微球进行洗涤后,加入包被抗体,迅速涡旋混匀,室温翻转孵育2h。对偶联后的微球进行洗涤、浓度测定、产率计算、偶联确认。为了后续最优抗体对组合的筛选测试,将不同克隆号的FluA/FluB-NP 单抗(Clone:FluA6,FluA8,FluB15,FluB66,FluB79)均进行偶联。
1.3.1.3 生物素标记抗体的制备:按照Thermo fisher生物素标记试剂盒说明书进行抗体标记,使用酶标仪对生物素标记抗体进行浓度测定并通过HABA 分析法(harmonic analysis based on approximation,基于谐波分析的近似方法)测定结合在抗体上的生物素的浓度,计算生物素与抗体蛋白摩尔比(Biotin/Protein,B/P)。
1.3.2 FluA 和FluB 抗原单检的性能测试:基于量子点编码微球的FluA 和FluB 抗原多重检测方法的开发,需要先进行FluA 和FluB 单检方法的建立和验证,然后将该单检方法进行联检测试。单检测试主要包括以下步骤:①校准品的制备:将FluA/FluB 的NP 抗原母液以等比稀释的方式稀释为一系列浓度:1 000 000,250 000,62 500,15 625,3 906.3,976.6,244.1,61.0 和15.3pg/ml;②免疫反应:在96 孔过滤板中依次加入稀释液、校准品/样本、生物素标记的检测抗体、包被抗体偶联的捕获微球,避光震荡孵育2.5h 后,加入链霉亲和素-藻红蛋白(SA-PE),避光震荡孵育0.5h 后,使用真空抽滤装置进行抽滤,使用清洗液进行清洗后再次抽滤,使用清洗液将微球重悬收集等待上机测试;③上机与数据处理:使用流式细胞仪对各收集管进行上机采集数据,将获得的中值荧光强度(median fluorescence intensity,MFI)数据导入到Graphpad Prism 9.0 软件中进行分析;④以校准品的一系列MFI 值与校准品的浓度绘制校准曲线,利用校准曲线方程计算样本的浓度。单检方法的初步性能评估主要包括测量范围和交叉反应。通过观察不同浓度校准品在校准曲线上的分布,确定该方法针对FluA和FluB 抗原浓度的测量范围。
1.3.3 FluA 和FluB 抗原联检的性能测试:甲乙型流感病毒抗原联检测试,是在单检测试的基础上,在同一个反应体系中,直接加入FluA 和FluB 抗原的两种捕获微球以及FluA 和FluB 抗原的两种生物素标记的检测抗体,以同时促成FluA 和FluB 抗原检测夹心的分别形成,并最终通过编码微球作为信号传递媒介,在流式细胞仪上输出FluA 和FluB 微球的检测荧光信号,进而获得校准曲线和样本浓度的结果,见图1。参照相关文献的描述[12-13],对量子点微球的联检方法进行性能评估,包括检出限、测量范围、交叉反应。

图1 基于量子点编码微球的甲乙型流感病毒抗原多重检测的原理示意图
1.3.4 基于流式量子点微球技术的FluA 和FluB 联检平台对临床样本的验证和方法学比对:将-80℃保存的临床咽拭子样本放置在室温下解冻30min后,置入500μl 提取液中沿管壁旋转约10 次,使标本尽可能溶解入提取液中。将提取好的样本液一分为二,一份用于本方法进行抗原检测,另一份使用qPCR 进行核酸检测(具体操作严格按照仪器厂家和试剂说明书进行)。本方法以FluA 和FluB抗原检测的检出限作为阴阳性判断的临界值,与qPCR 检测的阴阳性结果进行对比,分析其临床灵敏度和特异度。
1.4 统计学分析 应用SPSS17.0 统计软件进行配对计数资料的Kappa 系数检验,P<0.05 为差异有统计学意义。当Kappa>0.75,表示一致性较强;0.75>Kappa >0.4 表示一致性一般;Kappa ≤0.4,表示一致性较弱。使用GraphPad Prism 9.0 软件绘制标准曲线,均使用五参数logistic 模型{Y=d+(a-d)/[1+(X/c)b]g}。两种方法的比对采用四格表形式进行统计,计算灵敏度和特异度。
2 结果
2.1 试剂原料制备 通过溶胀嵌入法,本研究制备了一组基于量子点编码的荧光微球。流式细胞仪分析结果表明荧光微球分群性能良好,见图2。理论上可以实现6 种分析物的同时检测。为了证明抗体偶联的可行性,使用上述制备的量子点编码微球分别与FluA-NP 和FluB-NP 单抗进行偶联,同时使用种属特异性的荧光标记抗体(FITC Donkey antimouse IgG)对偶联后的微球进行标记,对相关表征参数进行了测定,抗体偶联后的微球回收率>80%,和抗体偶联均匀度CV<25%,与以往报道的偶联结果一致[14-15]。生物素标记抗体的标记前后总体回收率为55%~70%,B/P 为4~6,这与文献报道的理想标效果相一致[16],证明这些试剂可以基本满足后续测试的需求。
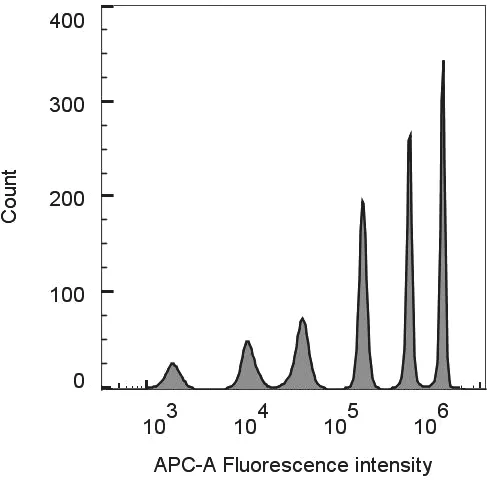
图2 6 种亮度的量子点编码微球的荧光强度直方图
2.2 FluA 和FluB 抗原单检的初步性能评估 在研究早期,为了探索FluA 和FluB 抗原单检技术可行性,先进行了量子点编码微球FluA/FluB 单检系统初步的性能建立,对抗体浓度、SA-PE 染料用量、孵育时间、孵育步骤等参数进行了优化,并对其测量范围、交叉反应等分析性能进行了初步研究。这些研究成果奠定了微球多重免疫检测法的技术基础。初步研究表明FluA 和FluB 的测量范围为15.3~250 000pg/ml。FluB 捕获微球在250 000pg/ml 的FluA-NP 抗原浓度下产生的交叉反应率为0.022%。FluA 捕获微球在250 000pg/ml 的IBVNP 抗原浓度下产生的交叉反应率为0.006%。量子点编码微球的单检系统检测FluA 抗原的空白限为10.5pg/ml,检测FluB 抗原的空白限为2.9pg/ml。上述结果表明该方法可以用于对FluA 和FluB 抗原进行同时检测。
2.3 FluA 和FluB 抗原联检的分析性能 在上述初步研究基础上,本研究建立了基于量子点编码微球的甲乙流病毒抗原的联检方法,并进行了系统的灵敏度、测量范围研究。图3所示为FluA 和FluB 抗原联检的校准曲线图。使用量子点编码微球的多重检测系统,检测FluA 抗原的检出限为26.1pg/ml,验证后的测量范围为15.3~250 000 pg/ml。检测FluB 抗原的检出限为10.7 pg/ml,验证后的测量范围为15.3~250 000 pg/ml。

图3 甲乙型流感病毒抗原流式荧光检测校准曲线
2.4 量子点编码微球的多重检测方法与qPCR 法结果比对 在上述分析性能研究的基础上,本研究开展了与qPCR 的FluA 和FluB 核酸检测结果的比对。收集的81 例样本中,qPCR 结果为54 例FluA阳性,Ct值在25.59~39.12 范围,27 例FluA 阴性,Ct值>40。基于量子点编码微球的FluA 抗原检测结果显示,31 例FluA 抗原阳性,浓度分布在33.8~83 019.1 pg/ml 区间,50 例样本FluA 抗原阴性,检出浓度小于26.1pg/ml。根据以上结果,两种方法一致性一般(Kppa 值为0.47,P<0.05)。以qPCR 结果为金标准,计算得到阳性符合率(灵敏度)57.4%,阴性符合率(特异度)100%,总符合率71.6%。优于目前临床常用的胶体金抗原检测试剂,如万孚的阳性符合率56.49%,阴性符合率99.75%(摘自试剂说明书)。在81 例样本检测中,qPCR 的FluB 阳性1 例,Ct值为36.5,此样本的多重方法检测结果也为阳性,FluB 抗原浓度为261.2 pg/ml,qPCR 检测其余80 例样本均为 FluB 阴性与多重方法结果一致,灵敏度和特异度均为100%。
3 讨论
本研究开发了针对甲型、乙型流感病毒抗原的量子点编码微球流式免疫检测方法,成功制备了多峰量子点编码微球、抗体偶联的编码微球、生物素标记抗体,对甲乙型流感病毒抗原检测的灵敏度、测量范围、交叉反应等分析性能进行了研究,确认了该联检方法可用于临床样本的测试,经与qPCR比较虽然灵敏度有所欠缺,但特异度好,并可以定量检测,最重要的是可以用于呼吸道病毒的多重检测,可以提高临床检测的效率和节约成本,同时也可以利用此平台对其他目标物进行多重检测,不仅可以为临床诊断、治疗应用提供依据,而且也可以为流行病学调查提供及时的数据。针对开发和测试过程中遇到的量子点渗漏、荧光强度波动等问题,通过对溶剂体系、保存条件、表面修饰的优化,获得了具有长期稳定性的量子点编码微球,这些问题也是长期以来困扰量子点临床使用的技术瓶颈,通过对这些技术的优化,有希望打开量子点作为荧光标记的临床应用之路。
在对81 例临床样本的测试中,利用此方法测得FluA 阳性样本31 例,阴性样本50 例。与qPCR结果比对,阴性符合率为100%,阳性符合率为57.4%。表明本方法可以有效避免假阳性结果的出现,但是对于假阴性结果,提示免疫检测方法与核酸检测方法在检测灵敏度上存在的固有差别[3,17-18],这得益于qPCR 扩增检出极低量的核酸序列的能力,也可能与此方法还需要不断进行条件优化以提高灵敏度有关。后续的条件优化可参考Luminex 多重微球的方案[19],通过减少微球和样品的初始孵育体积、增加初始孵育时间、减少与微球偶联的捕获抗体量来提高灵敏度,也可筛选具有更高亲和力的抗体作为捕获抗体或检测抗体来达到灵敏度提高的目的。另一方面,qPCR 是对病毒核酸序列的测定,对无活性病毒也可能产生阳性检测结果,也存在一定比例的假阳性。本研究建立的定量免疫学检测方法通过标准曲线的建立,可以定量的对活性病毒进行检测,可以更加有效地评估病毒的活性状态与病毒量的变化,并且有更少的假阳性结果,因而不仅在诊断,而且在判断病情严重程度和预后方面都有重要价值。此项研究的另一个背景是,采用的临床样本是已经进行了一次提取液洗脱的咽拭子样本进行的二次洗脱液,因而其检测结果相对于qPCR 可能存在更大可能的假阴性,与第一次洗脱后用胶体金免疫法检测相比,此方法也超过了胶体金免疫法的灵敏度和特异度,也证明了此方法的优越性,后续的研究工作中,需要对真实的咽拭子样本的抗原浓度进行评价,以获得更加完整的性能研究数据。同时由于FluB 阳性样本数量过少,此方法对FluB 的灵敏度评价有待获取更多阳性标本进行验证,但特异度与PCR 比较也达到100%,与FluA 一致,证明了此方法在多重检测方面的可行性。此方法最大的优势是可以利用流式检测平台对呼吸道病毒进行多重检测,也是我们下一步研究的方向。
总之,本研究证明了使用量子点纳米晶体嵌入的编码微球进行甲乙型流感病毒联检的可行性,此后将继续致力于多种呼吸道病毒的多重免疫检测方法的开发,并借助量子点纳米晶体编码微球的独特优势,开发成可以用于即时检测的快速诊断技术平台,不仅用于即时检验(POCT)的临床诊断,甚至可以使家庭使用场景成为现实,让呼吸道病毒快速检测更加经济、易用、普及。

