不同管理模式下茶园土壤真菌群落特征及其功能预测
候 宁, 金 强, 刘旭阳, 李先德, 林少颖, 张永勋, 王维奇,①
(1. 福建师范大学 湿润亚热带生态-地理过程教育部重点实验室, 福建 福州 350117; 2. 中国农业科学院农业经济与发展研究所, 北京 100081)
茶树〔Camelliasinensis(Linn.)O. Ktze〕为热带及亚热带重要的叶用经济作物[1],与其他经济作物相比,其代谢旺盛,对土壤养分需求存在差异[2]。茶树品种‘铁观音’(‘Tieguanyin’)主产于福建省,大多分布于闽南一带,其中以福建安溪的‘铁观音’最负盛名[3]。2022年安溪铁观音茶文化系统被联合国粮农组织(FAO)认定为全球重要农业文化遗产(GIAHS),因此,探究符合茶树特别是‘铁观音’生长的养分资源利用的管理模式十分必要。
真菌群落作为指示土壤质量和健康状况的重要指标,其组成及多样性对环境变化高度敏感[4-7],不同的管理模式和轮作方式均可能对其产生影响[8-10],充分认识真菌群落特征并预测其功能对土壤的健康和稳定具有重要意义[11-12]。已有研究主要集中于农田管理模式(施肥方式、种植制度和耕作模式等)对经济作物产量的影响,土壤生态方面的研究也有所涉及。刘蕾等[13]研究发现不同轮作模式下土壤丛枝菌根真菌群落组成主要受土壤pH值的驱动;Culumber等[8]研究发现秸秆覆盖管理模式促进了有机果园土壤养分含量、微生物生物量和酶活性的提高。不同施肥模式对土壤真菌群落特征影响的相关研究亦有报道。例如:丁建莉等[14]研究发现长期配施有机肥和无机肥能够有效改善真菌群落结构,降低真菌丰度并增加其多样性。综合已有研究发现,关于不同管理模式对土壤微生物群落影响的研究存在不同的结论,有学者认为保护性耕作措施对微生物活性及群落结构均有积极影响[15],也有学者认为常用农业生态系统管理方法会导致土壤养分迅速矿化和流失,并对土壤微生物生物量、酶活性和生物过程产生不利影响[16-17]。因此,管理模式优化的相关研究亟待展开,特别是在茶园这一独特的生态系统下,研究不同管理模式下茶园土壤真菌群落特征将有助于维持其土壤质量和真菌群落功能多样性。
本研究在福建安溪铁观音茶文化系统全球重要农业文化遗产地,通过安溪茶园田间试验,借助新一代高通量测序技术对不同管理模式下茶园土壤真菌群落特征及其功能类群进行了研究,并对土壤理化指标与土壤真菌群落的关系进行了分析,以期为生态茶园管理模式的选择提供科学依据,同时为其他经济林木的种植管理提供一定参考。
1 研究区概况和研究方法
1.1 研究区概况
研究区位于福建省安溪县城厢镇古山村茶叶种植区(东经118°11′、北纬25°13′),该区域属亚热带海洋性季风气候,年均温19 ℃~21 ℃,年降水量1 600~1 900 mm,无霜期260 d[18]。供试菜园中种植茶树品种‘铁观音’。 采样点海拔271 m,土壤类型为红壤。研究区为有机肥茶树种植示范点,施用的有机肥为南安市鸿盈天然有机肥公司生产的宝大牌水溶性有机肥〔m(N)∶m(P2O5)∶m(K2O)=1.0∶0.3∶0.3〕,施肥量3.75 t·hm-2,在春茶期和夏茶期以沟施的方式进行施肥。
该区域茶园管理模式主要有常规管理(M1)、间作套种管理(M2)和配套现代技术管理(M3)3种。M1模式的茶树栽种于2004年,行距1.5 m、株距0.5 m,采用人工开沟覆土施肥,自然降水和人工浇水相结合的灌溉模式,以及人工除草、修剪和土壤翻整等常规管理方式;M2模式茶园在M1模式茶园的基础上于2012年套种龙眼(DimocarpuslonganLour.),龙眼行距5 m、株距3 m,每公顷套种约750株,施肥模式、灌溉模式等管理方式同M1模式;M3模式茶园在M1模式茶园的基础上于2016年配套了现代滴灌、声控驱虫以及释放捕食螨等技术,采用自然降水和滴灌相结合的灌溉模式。3种管理模式样地中茶树株龄均为17 a。
1.2 方法
1.2.1 土壤样品采集和前处理 根据代表性、典型性和一致性原则,每个管理模式设置3个重复样方(面积5 m×5 m),共计9个样方。于2019年5月春茶采收期后进行土壤样品采集,使用取土器采集茶树树冠边缘垂直下方0~20 cm土层的茶树根际土壤,采用四分法混合取样,每个样方的采样量约1 kg。将杂质和植物残体从土壤中剔除,取部分鲜土样装入无菌自封袋,置于便携式保温箱带回实验室,于-20 ℃冰箱保存,用于土壤真菌群落组成及相对丰度的测定;剩余鲜土样带回实验室,自然风干后研磨,过孔径2 mm筛,常温保存,用于土壤理化指标测定。
1.2.2 土壤理化指标测定 将超纯水和土样以质量比2.5∶1.0混合,振荡30 min后静置,使用Starter 300 pH计(美国Ohaus公司)测定土壤pH值;使用2265FS电导计(美国Spectrum公司)测定土壤电导率;分别采用环刀法和烘干法测定土壤容重和含水量[19];采用Elementar Vario MAX土壤碳氮元素分析仪(德国Elementar公司)测定土壤全碳(TC)和全氮(TN)含量;采用HClO4-H2SO4法[20]消煮,并使用Skalar Analytical SAN++连续流动分析仪(荷兰Skalar公司)测定土壤全磷(TP)含量。据此计算C/N比(即全碳和全氮含量的比值)、C/P比(即全碳和全磷含量的比值)和N/P比(即全氮和全磷含量的比值)。
1.2.3 DNA提取以及PCR扩增和测序 采用Illumina HiSeq高通量测序技术对土样中真菌群落的α多样性及结构进行测定分析[21]。
采用CTAB法[22]提取土样的基因组DNA,使用质量体积分数2%琼脂糖凝胶电泳检测DNA样品的纯度和浓度,取适量DNA样品于离心管中,使用无菌水稀释至1 ng·μL-1。以稀释后的基因组DNA为模板,根据选择的测序区域,使用husion®High-Fidelity PCR Master Mix with GC Buffer(美国New England Biolabs公司)和高效高保真酶(美国New England Biolabs公司)进行PCR,扩增引物为ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)以及ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)。扩增体系总体积30 μL,包括2×Phusion Master Mix 15 μL,2 μmol·L-1Prime 3 μL,1 ng·μL-1gDNA 10 μL,超纯水2 μL。扩增程序:98 ℃变性10 s、50 ℃退火30 s、72 ℃延伸30 s,30个循环;72 ℃延伸5 min。
根据PCR产物浓度进行等量混样,充分混匀后使用质量体积分数2%琼脂糖凝胶电泳纯化PCR产物,切割目的条带,使用SanPrep柱式DNA胶回收试剂盒〔生工生物工程(上海)股份有限公司〕回收[23]。使用TruSeq®DNA PCR-Free Sample paration Kit建库试剂盒〔生工生物工程(上海)股份有限公司〕构建DNA文库,进而通过Qubit和Q-PCR法[24]定量,检测合格后使用Miseq PE300/NovaSeq PE250平台(美国Illumina公司)测序。
1.3 数据处理和统计分析
使用Microsoft EXCEL 2010软件计算原始数据的平均值及标准差。使用IBM SPSS Statistics 22软件进行LSD多重比较和Pearson相关性分析,其中Pearson相关性分析选取真菌群落中相对丰度前30的属[25]进行分析。使用Origin 2021软件进行多尺度的相对丰度分析以及α多样性(包括Richness指数、Shannon指数、Simpson指数、Chao1指数和ACE指数)分析,并使用软件中的主成分分析(principal component analysis,PCA)插件进行β多样性分析。使用Canoco 5.0软件对真菌门和属水平的相对丰度[25]与土壤理化指标进行典范对应分析(canonical correlation analysis, CCA)。使用FUNGuild微生态工具对土壤真菌的功能类群进行环境功能预测。
2 结果和分析
2.1 不同管理模式下茶园土壤理化指标的比较
结果(表1)显示:常规管理(M1)、间作套种管理(M2)和配套现代技术管理(M3)模式下茶园多数土壤理化指标存在显著(P<0.05)差异。M1模式下土壤pH值、容重、C/N比、C/P比和N/P比总体高于M2和M3模式,其中,土壤pH值与M2和M3模式差异显著,且M2模式显著高于M3模式,而C/P比和N/P比仅与M2模式差异显著。M2模式下土壤电导率、含水量以及全碳、全氮和全磷含量高于M1和M3模式,其中,土壤电导率与M1模式差异显著,含水量与M3模式差异显著,全磷含量与M1和M3模式差异显著。说明不同管理模式下茶园土壤理化指标有明显差异。

表1 不同管理模式下茶园土壤理化特征
2.2 不同管理模式下茶园土壤真菌群落多样性分析
2.2.1 土壤真菌群落α多样性分析 结果(表2)显示:常规管理(M1)、间作套种管理(M2)和配套现代技术管理(M3)模式下茶园土壤真菌群落的Richness指数、Shannon指数、Simpson指数、Chao1指数和ACE指数均无显著差异。M1模式下的Richness指数、Chao1指数和ACE指数高于M2和M3模式;Shannon指数和Simpson指数与M3模式接近,但高于M2模式。总体上看,M1模式下茶园土壤真菌群落的多样性较高。
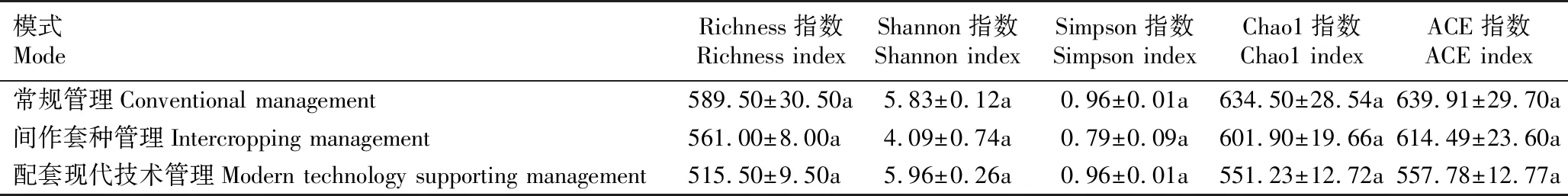
表2 不同管理模式下茶园土壤真菌群落α多样性分析1)
2.2.2 土壤真菌群落β多样性分析 主成分分析结果(图1)显示:M1模式的重复样本在图中分布在不同象限,且距离较远;M2和M3模式的重复样本在图中各自分布同一象限,且距离均较近。说明M1模式的重复样本间土壤真菌群落组成相似性较低,而M2和M3模式的重复样本间土壤真菌群落组成相似性较高。
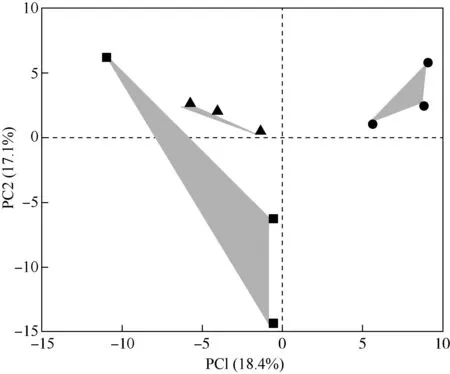
: 常规管理Conventional management; : 间作套种管理Intercropping management; : 配套现代技术管理模式Modern technology supporting management. 图中相同图标代表同一模式的重复样本,括号内百分数为该主成分的贡献率 The same icons represent replicate samples of the same mode, and the percentages in brackets represent contribution rate of the principal component.
2.3 不同管理模式下茶园土壤真菌群落组成分析
2.3.1 门水平相对丰度及差异分析 结果(表3)显示:常规管理(M1)、间作套种管理(M2)和配套现代技术管理(M3)模式下茶园土壤真菌门存在差异。M1和M3模式下子囊菌门(Ascomycota)的相对丰度均最高,分别为36.68%和61.49%;其次是担子菌门(Basidiomycota),相对丰度分别为18.42%和16.46%。M2模式下被孢霉门(Mortierellomycota)的相对丰度最高(59.30%),其次是子囊菌门(11.28%)。总体上看,不同管理模式下子囊菌门、被孢霉门和担子菌门较为丰富,且M3模式下子囊菌门的相对丰度明显高于M1和M2模式。
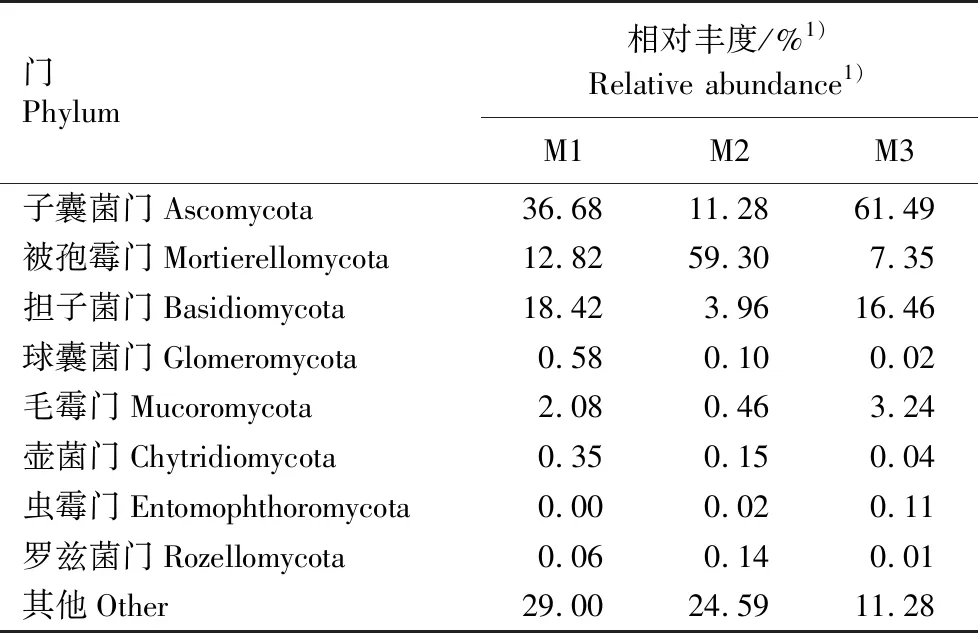
表3 不同管理模式下茶园土壤真菌门的相对丰度
2.3.2 属水平相对丰度及差异分析 结果(表4)显示:M1、M2和M3模式下茶园土壤真菌属存在差异。M1模式下被孢霉属(MortierellaCoem.)的相对丰度最高(10.56%);其次是原隐球菌属(SaitozymaX. Z. Liu, F. Y. Bai, M. Groenew. et Boekhout)和黄丝曲霉属(TalaromycesC. R. Benj.),相对丰度分别为8.74%和8.28%。M2模式下被孢霉属的相对丰度也最高(11.34%);其次是原隐球菌属和镰刀菌属(FusariumLink ex Fr.),相对丰度分别为1.76%和1.06%。M3模式下毛壳菌属(ChaetomiumKunze)的相对丰度最高(20.86%);其次是原隐球菌属和青霉属(PenicilliumLink),相对丰度分别为15.06%和10.59%。总体上看,M3模式下毛壳菌属、原隐球菌属和青霉属的相对丰度明显高于M1和M2模式。
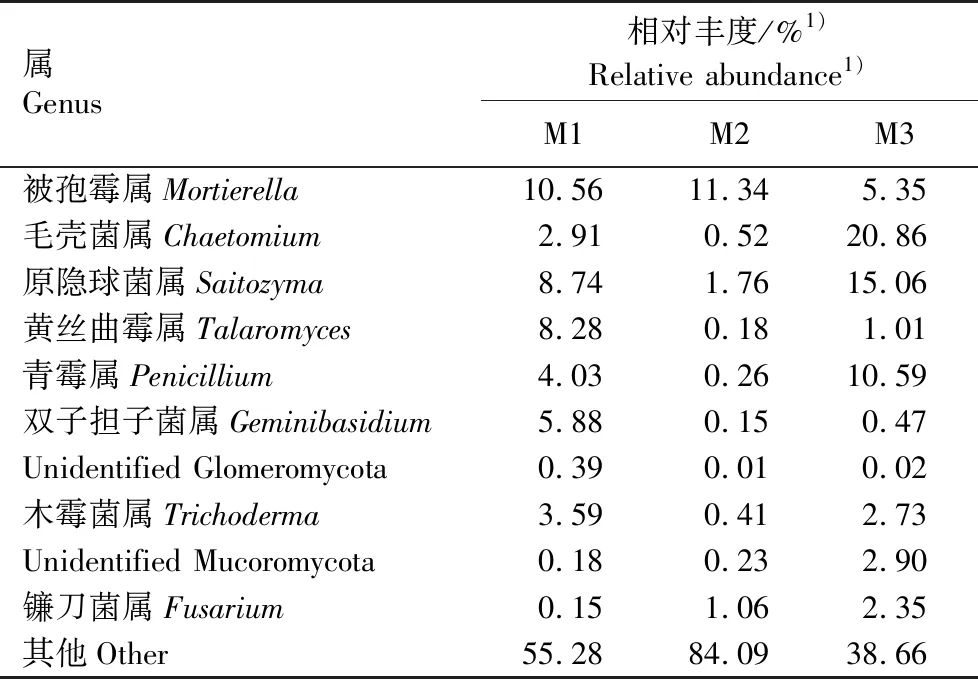
表4 不同管理模式下茶园土壤真菌属的相对丰度
2.4 茶园土壤真菌群落相对丰度与理化指标的关系
2.4.1 Pearson相关性分析 茶园土壤真菌主要属的相对丰度与土壤理化指标的相关性分析见表5。结果显示:土壤容重与蕉孢壳属(DiatrypeFr.)和绿僵菌属(MetarhiziumSorokīn)的相对丰度呈显著(P<0.05)负相关;土壤全氮含量与木霉菌属(TrichodermaPers.)的相对丰度呈显著负相关,与腐质霉属(HumicolaTraaen)的相对丰度呈显著正相关。
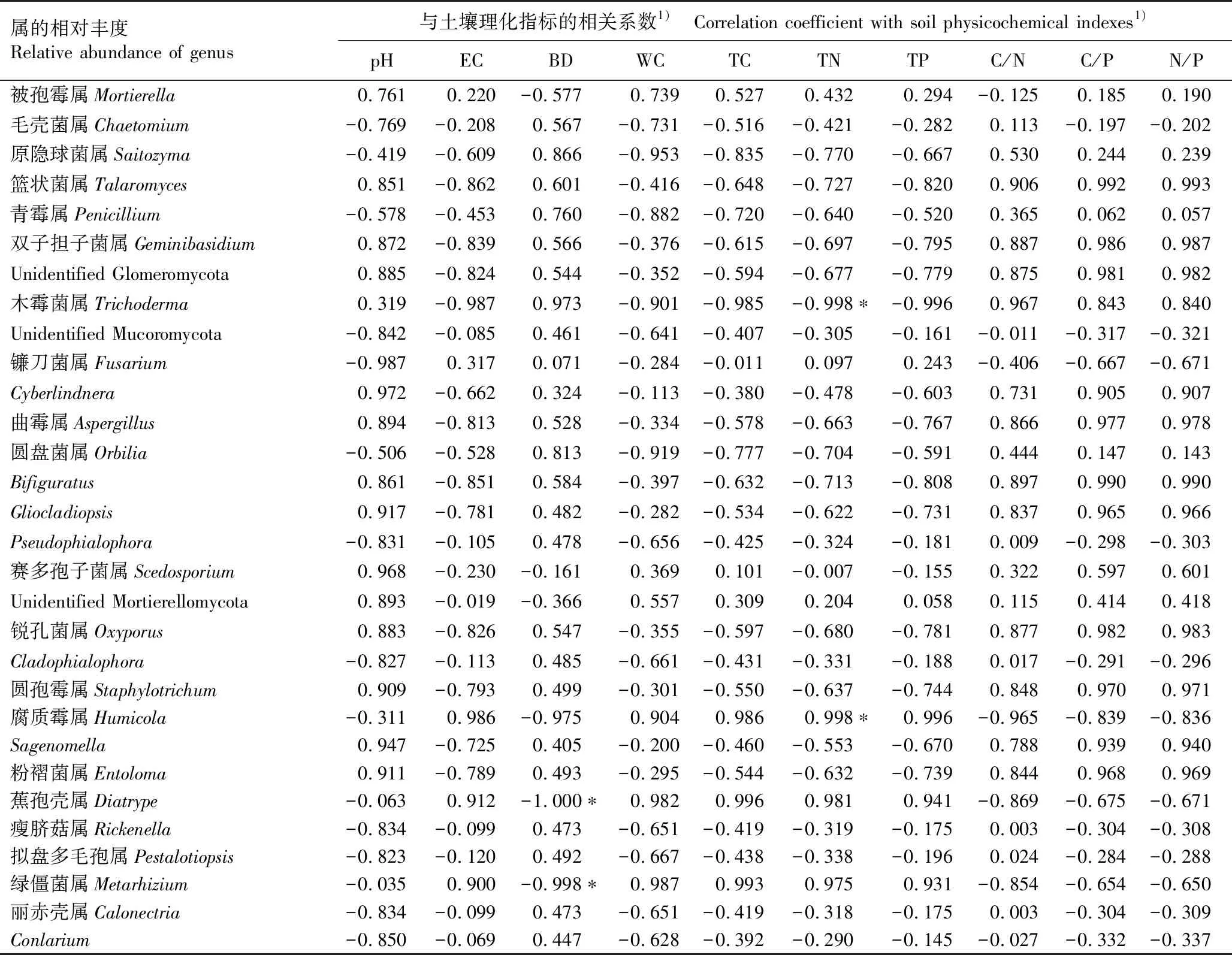
表5 茶园土壤真菌主要属的相对丰度与土壤理化指标的相关性分析
2.4.2 典范对应分析(CCA) 茶园土壤真菌群落门、属的相对丰度与土壤理化指标的CCA排序图见图2。结果显示:从门水平上看,土壤C/N比、全磷含量、含水量和容重是影响茶园土壤真菌群落的主要因子,其中,C/N比主要影响子囊菌门和担子菌门的相对丰度,且均呈正相关;全磷含量主要影响子囊菌门和担子菌门的相对丰度,且均呈负相关;含水量主要影响被孢霉门和罗兹菌门(Rozellomycota)以及子囊菌门和担子菌门的相对丰度,且与前二者均呈正相关,与后二者均呈负相关;容重主要影响子囊菌门和担子菌门的相对丰度,且均呈正相关。从属水平上看,土壤C/P比、N/P比和pH值是影响茶园土壤真菌群落的主要因子,其中,C/P比和N/P比主要影响unidentified Glomeromycota和原隐球菌属的相对丰度,且与前者均呈正相关,与后者均呈负相关;pH值主要影响木霉菌属、原隐球菌属和镰刀菌属的相对丰度,且与前二者均呈正相关,与后者呈负相关。
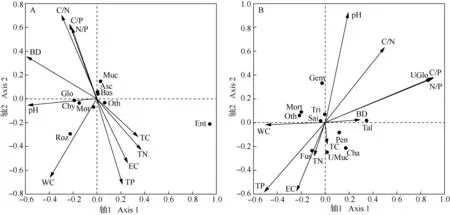
pH: pH值pH value; BD: 容重Bulk density; EC: 电导率Electric conductivity; WC: 含水量Water content; TC: 全碳含量Total carbon content; TN: 全氮含量Total nitrogen content; TP: 全磷含量Total phosphorus content; C/N: C/N比C/N ratio; C/P: C/P比C/P ratio; N/P: N/P比N/P ratio. Asc: 子囊菌门的相对丰度Relative abundance of Ascomycota. Mor: 被孢霉门的相对丰度Relative abundance of Mortierellomycota; Bas: 担子菌门的相对丰度Relative abundance of Basidiomycota; Glo: 球囊菌门的相对丰度Relative abundance of Glomeromycota; Muc: 毛霉门的相对丰度Relative abundance of Mucoromycota; Chy: 壶菌门的相对丰度Relative abundance of Chytridiomycota; Ent: 虫霉门的相对丰度Relative abundance of Entomophthoromycota; Roz: 罗兹菌门的相对丰度Relative abundance of Rozellomycota. Mort: 被孢霉属的相对丰度Relative abundance of Mortierella Coem.; Cha: 毛壳菌属的相对丰度Relative abundance of Chaetomium Kunze; Sai: 原隐球菌属的相对丰度Relative abundance of Saitozyma X. Z. Liu, F. Y. Bai, M. Groenew. et Boekhout; Tal: 黄丝曲霉属的相对丰度Relative abundance of Talaromyces C. R. Benj.; Pen: 青霉属的相对丰度Relative abundance of Penicillium Link; Gem: 双子担子菌属的相对丰度Relative abundance of Geminibasidium H. D. T. Nguyen, N. L. Nick. et Seifert; UGlo: Unidentified Glomeromycota的相对丰度Relative abundance of unidentified Glomeromycota; Tri: 木霉菌属的相对丰度Relative abundance of Trichoderma Pers.; Fus: 镰刀菌属的相对丰度Relative abundance of Fusarium Link ex Fr.; UMuc: Unidentified Mucoromycota的相对丰度Relative abundance of unidentified Mucoromycota. Oth: 其他门(属)的相对丰度Relative abundance of other phyla (genera).
2.5 不同管理模式下茶园土壤真菌群落FUNGuild功能预测
不同管理模式下茶园土壤真菌群落FUNGuild功能预测见表6。结果显示:除未指定功能真菌外,常规管理(M1)模式下未定义腐生真菌较多,相对丰度为41.07%;其次是寄生真菌-未定义腐生真菌,相对丰度为8.75%;其余功能类群真菌均较少,相对丰度均低于1%。除未指定功能真菌外,间作套种管理(M2)模式下未定义腐生真菌较多,相对丰度为14.11%;其次是寄生真菌-未定义腐生真菌和植物病原-土壤腐生-木腐生真菌,相对丰度分别为1.77%和1.06%;其余功能类群真菌均较少,相对丰度均低于1%。配套现代技术管理(M3)模式下未定义腐生真菌最多,相对丰度为32.40%;其次是粪腐生-未定义腐生-木腐生、寄生真菌-未定义腐生、植物病原-土壤腐生-木腐生和植物病原真菌(未指定功能真菌除外),相对丰度分别为20.86%、15.08%、2.35%和1.18%;其余类群真菌均较少,相对丰度均低于1%。总体上看,未定义腐生真菌在3种模式下均较多;与M1和M2模式相比,M3模式下粪腐生-未定义腐生-木腐生和寄生真菌-未定义腐生真菌呈现明显富集现象。
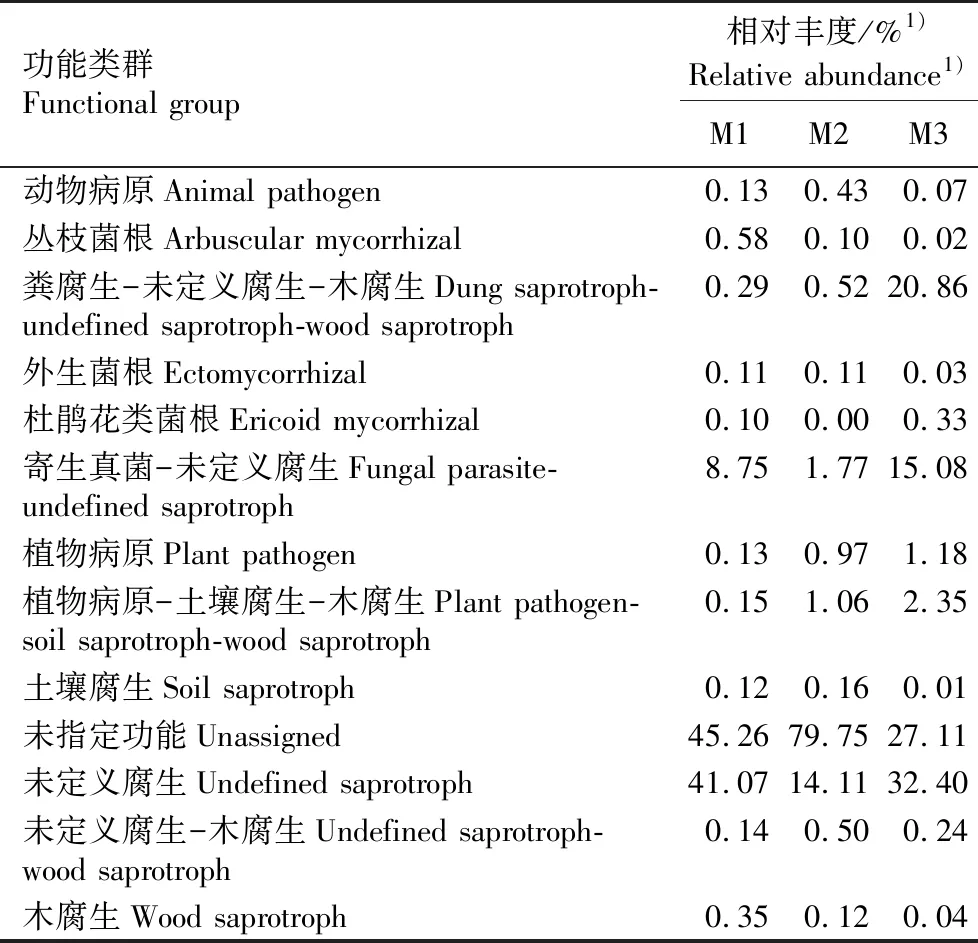
表6 不同管理模式下茶园土壤真菌群落FUNGuild功能预测
3 讨 论
3.1 不同管理模式对茶园土壤真菌群落多样性及组成的影响
本研究中,常规管理(M1)模式下茶园土壤真菌群落Richness指数、Shannon指数、Simpson指数、Chao1指数和ACE指数总体高于间作套种管理(M2)和配套现代技术管理(M3)模式,土壤真菌群落组成相似性低于M2和M3模式,但3种模式间的α多样性指数均无显著差异,多样性较为相似,主要是由于3种模式所处自然环境和试验期气候条件较为相似。在门水平上,总体来看不同管理模式下茶园土壤中子囊菌门、被孢霉门及担子菌门的相对丰度均较高,与喀斯特地貌[26]和云南普洱茶园[27]土壤真菌的研究结果相似,可能是因为以上菌门具有较强的环境适应性。从这3种主要菌门的相对丰度来看,3种茶园管理模式存在一定差异,子囊菌门这类腐殖真菌的相对丰度在M3(61.49%)模式下要明显高于M1(36.68%)和M2(11.28%)模式,这可能是由于子囊菌门作为土壤有机质的主要分解者[28],对环境条件的变化具备较强的适应性和菌群竞争能力[29],同时M3模式下土壤中养分(碳、氮、磷)含量居中,也为子囊菌门提供了适宜的生长环境,从而增加了其相对丰度。担子菌门在3种管理模式下均有分布,这与其能够实现远距离传播并优化原有的土壤微生物生存环境有关[30]。此外,在属水平上,M3模式下毛壳菌属的相对丰度明显高于M1和M2模式,且M3模式下动物病原真菌的相对丰度较低,这主要是因为毛壳菌属作为土壤有益菌,能够抵抗土壤及土壤动物中的病原体,并产生木聚糖酶和纤维素分解酶等多种生物活性物质[31]。
3.2 不同管理模式下土壤理化特征对土壤真菌群落的影响
不同真菌群落对土壤理化指标响应程度存在差异[32],且不同土壤理化指标对土壤真菌群落的影响不同,如pH值影响真菌群落的生物量、活性和组成[33];容重影响茶园土壤通气性和孔隙度、根系穿透阻力以及根系的生长和发育状况[32],并间接通过上述因子影响真菌活性。典范对应分析(CCA)结果显示:从门水平上看,土壤C/N比、全磷含量、含水量和容重是影响茶园土壤真菌群落门水平的主要因子,其中,C/N比与子囊菌门和担子菌门的相对丰度均呈正相关,说明这2种菌门更适应较高碳富集和较低氮养分供应的环境[34]。从属水平上看,土壤C/P比、N/P比和pH值是影响茶园土壤真菌群落属水平的主要因子,其中,pH值与木霉菌属和原隐球菌属的相对丰度均呈正相关,与镰刀菌属的相对丰度呈负相关,这可能与镰刀菌属真菌更适应茶园偏酸性的土壤环境有关[35]。本文中,间作套种管理(M2)模式下土壤全氮含量最高、配套现代技术管理(M3)模式下居中、常规管理(M1)模式下最低,而M2模式下木霉菌属的相对丰度最低、M3模式下居中、M1模式下最高,这可能与土壤全氮含量与木霉菌属的相对丰度呈显著负相关有关,也可能是由于木霉菌属与相对丰度较高的毛壳菌属相互拮抗有关[36]。
3.3 不同茶园管理模式下土壤真菌功能比较
通常情况下,土壤真菌的丰度越高,其功能型物种越多,从而有利于维系生态系统结构和功能的稳定性[12]。本研究中,与常规管理(M1)和间作套种管理(M2)模式相比,配套现代技术管理(M3)模式下粪腐生-未定义腐生-木腐生和寄生真菌-未定义腐生真菌呈现明显富集现象,这有利于茶园土壤中有机质分解[32]。Hannula等[37]认为,真菌在保持作物产量的同时能够增加土壤固碳潜力,可通过提升真菌功能多样性改善茶园土壤食物网结构及生态系统平衡。van der Heijden等[38]在对树根外生菌根系统的研究中也印证了这一观点。外生菌根真菌在好氧环境中相对丰度更高,外生菌根真菌的生长也会进一步提高茶树固碳释氧功能[39]。本文中,外生菌根真菌在3种不同模式下均有分布,但相对丰度较低,这可能是3种管理模式下土壤全碳含量低于南方地区土壤碳含量[40]的原因之一。此外,与M1和M2模式相比,M3模式下杜鹃花类菌根的相对丰度较高,该类真菌功能类群有助于茶树抵御极端气候[41]。基于此,相对于M1和M2模式,在现代滴灌、声控驱虫以及释放捕食螨等系列技术协同下的M3模式能够更好地协调保护茶园植被,维持茶园土壤微生物多样性及有益真菌功能类群的平衡,保障茶园土壤健康和可持续生产。
4 结 论
不同管理模式对茶园土壤真菌群落多样性及功能类群的影响存在差异,子囊菌门、被孢霉门和担子菌门是不同管理模式茶园土壤真菌的优势菌门。M3模式下,子囊菌门的相对丰度明显高于M1和M2模式,毛壳菌属、原隐球菌属和青霉属的相对丰度明显高于M1和M2模式,粪腐生-未定义腐生-木腐生和寄生真菌-未定义腐生真菌呈现明显富集现象。C/N比、全磷含量、含水量和容重是茶园土壤真菌群落门水平的主要影响因子,C/P比、N/P比和pH值是茶园土壤真菌群落属水平的主要影响因子。综合分析结果认为,现代滴灌、声控驱虫以及释放捕食螨等系列技术协同下的M3模式有利于维持茶园土壤真菌多样性及其功能的发挥。

