肺原发SMARCA4 缺陷型未分化肿瘤1 例*
谢文英,戴飘飘,薛会红,嘎米,杨明,李文军,夏俊杰
621000 四川 绵阳,绵阳市第三人民医院·四川省精神卫生中心 呼吸与危重症医学科
胸部SMARCA4 缺陷型未分化肿瘤(SMARCA4-deficient undifferentiated tumor,SMARCA4-UT)是一种罕见的胸部恶性肿瘤,好发于有吸烟史的中青年男性,组织病理学上常显示未分化或横纹肌样表型,分子角度上存在SMARCA4/BRG1表达缺失。SMARCA4 参与基因的表达、分化和转录等多种生物学功能的调控,从而影响肿瘤的发生和进展[1-3]。2021 年《WHO 胸部肿瘤分类(第5 版)》中,将其与睾丸核蛋白癌(nuclear protein in testis carcinoma,NUT)一起归为其他上皮性肿瘤[1]。这类肿瘤恶性程度高、侵袭性强、预后差,中位生存时间为4~7 个月,对传统的放、化疗不敏感,暂无相关靶向治疗药物,少量的个案报道免疫治疗对该肿瘤可能有效,但目前仍缺乏较多的临床研究。随着基因检测的广泛应用,越来越多的SMARCA4-UT 被确诊,如何精准识别该肿瘤并给予有效治疗,是目前临床亟需解决的问题。本文报道1 例肺原发的SMARCA4-UT,经过放化疗及免疫治疗等综合治疗后取得较好预后。
1 病例资料
患者,男,51 岁,因“气促伴胸痛、咯血1 周余”于2022 年6 月入院,查体未见明显异常。吸烟史20 余年,每天20 支。肿瘤标志物:CEA 7.73 ng/mL,NSE 19.51 ng/mL。胸部CT 示:(1)左肺上叶尖后段见团块影,浅分叶,大小约3.7 cm ×4.5 cm × 3.3 cm,包绕支气管,CT 值约37 HU,增强扫描约中度强化,邻近胸膜增厚粘连;左肺门见软组织肿块,最大截面约4.2 cm × 4.5 cm,边界不清,病灶包绕左肺门区血管及支气管,左主支气管变窄,增强扫描病灶不均匀强化,见斑片状弱强化区;以上提示肿瘤性病变伴左肺门淋巴结转移可能大;(2)双肺细支气管炎征象,双肺肺气肿;双肺散在少许慢性炎性病变,部分纤维灶,双肺下叶胸膜下见少许间质性改变(图1A)。PET/CT 示:左肺上叶尖后段纵膈旁肿块(局部与邻近纵膈胸膜粘连并与主动脉弓局部分界不清楚),左肺门区多发淋巴结肿大,FDG 代谢均异常增高,结合病史,符合周围型肺癌伴纵膈胸膜浸润、左肺门淋巴结转移(图2)。头颅增强MRI 示:未见确切异常强化结节、肿块影。超声镜下探及10L、11L 组淋巴结明显肿大,不均匀回声,血供丰富;左上叶开口处黏膜粗糙,局部隆起呈新生物样改变,左固有上叶尖段闭塞;于左上叶开口处、10L+11L 组淋巴结行穿刺活检。我院病理结果:左肺上叶开口、10L+11L,活检小组织,查见癌,恶性程度高。免疫组化示:肿瘤细胞PCK(+),CD56(-),SyN(-),CgA(小灶+),TTF-1(-),P40(-),LCA(-),SSTR-2(-),CD20(-),Ki67 约85%(+),倾神经内分泌癌可能,但由于目前免疫组化不支持,请结合临床。华西医院病理会诊结果:免疫组化示BRG1(-,缺失)、PCK(-)、CgA(部分+)、CD56(个别+)、RB(部分缺失)、desmin(-)、P53(个别阳性)、Ki67 约80%~90%(+),结合组织学形态,病理诊断:恶性肿瘤,免疫表型示BRG1 蛋白缺失,考虑为SMARCA4基因缺陷的未分化肿瘤(图3)。
目前腹腔镜技术已经广泛应用于普通外科各种常规手术以及腹腔肿瘤治疗中,特别是“达芬奇”机器人手术系统的引入,使得外科手术的精度和技术完全超越人类双手的能力,从而拓宽了微创手术的应用[1]。
我总认为张恨水不够成熟。你看看包办的老婆,嫌弃人家丑,却还是生了两个孩子。我是赞同文如其人的,因为文学有思想,思想会通过行为表现出来。文学史上人格不错的,文学成就一般较高。

图1 胸部CT 对比Figure 1.Comparison of Chest CT Images
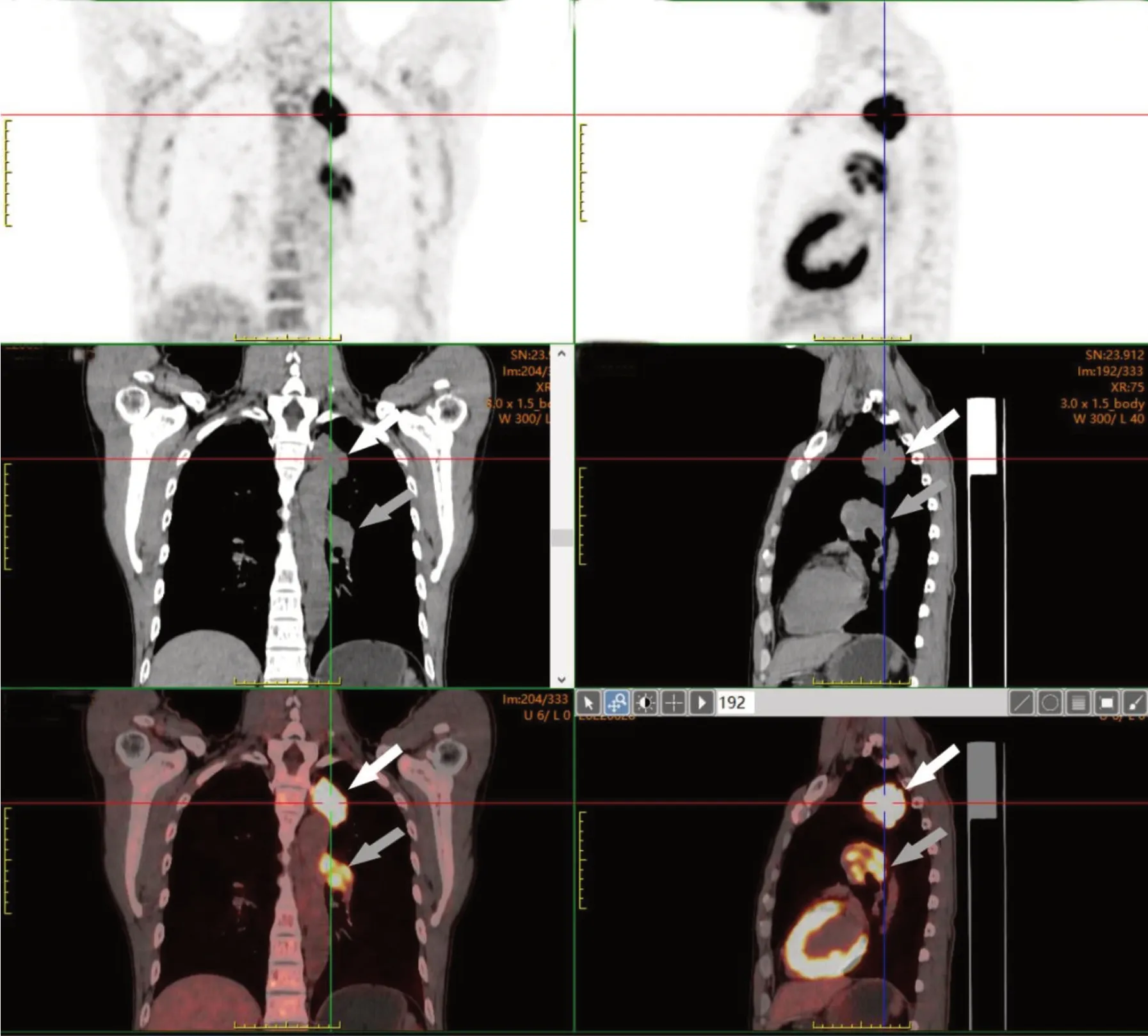
图2 患者PET/CT 影像资料Figure 2.PET/CT Images of the Patient
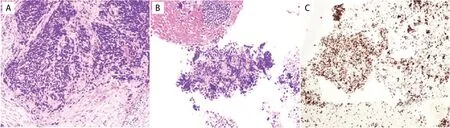
图3 患者病理结果Figure 3.Pathological Results of the Patient
患者诊断为左肺SMARCA4 缺陷型胸部未分化肿瘤cT4N1M0 IIIA 期。综合北京大学肿瘤医院及华西医院肿瘤科会诊意见,考虑先在全身治疗的基础上寻求局部治疗机会,再根据NGS 和PD-L1 检测结果,决定是否加用靶向或者免疫治疗药物。患者及家属拒绝继续行NGS 和PD-L1 检测,故排除相关禁忌后,于2022 年7 月至8 月,行2 个周期化疗+免疫(依托泊苷 160 mg d1~3 +卡铂 500 mg d1 +信迪利单抗200 mg d1,q3w)诱导治疗。根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST) 1.1 版,肿瘤得到明显缓解,疗效判定为部分缓解(partial remission,PR)(图1B)。院内进行多学科会诊后,胸外科认为仍无法行手术治疗,故于2022 年9 月开始行同步放化疗,化疗及免疫治疗方案同上,共2 个周期,针对肺部病灶放疗方案为pGTV: 60 Gy/30 F/30 d,pCTV:50 Gy/25 F/25 d。同步放化疗后,肿瘤疗效评定为维持PR(图1C);后继续2 个周期化疗+免疫(方案同上)巩固治疗,肿瘤疗效评定为维持PR(图1D);6 个周期化疗结束后,继续予以免疫单药维持治疗(信迪利单抗200 mg d1,q3w)。2023 年3 月8 日随访时,疗效仍维持PR(图1E)。截止末次随访时(2023 年11 月6 日),维持治疗已达10 月余,复查病灶稳定,无进展生存时间(progression-free survival,PFS)已达15 个月。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
2 讨 论
胸部SMARCA4-UT 需与以下疾病相鉴别:(1)上皮样肉瘤:四肢末端多见,表现为结节或斑块,软组织肿块、溃疡、疼痛、感觉异常、肌肉萎缩等,大多可见INI-1 失表达;(2)横纹肌肉瘤:多见于婴幼儿及青少年,形态多样,常见典型的横纹肌细胞,免疫组化Desmin、MyoD1、Myoglobin 多阳性;(3)黑色素瘤:多发生于皮肤及黏膜,常有色素沉着,形态多样,伴核偏位的横纹肌样细胞, HMB-45、Melan-A、S-100、SOX10 阳性;(4)恶性间皮瘤:常见于中老年人,呈上皮样瘤细胞,免疫组化标记WT-1 和Calretinin 可鉴别。上述肿瘤中均不存在BRG1 缺失,也可作为其鉴别的主要依据[14-16];(5)SMARCA4 缺陷型非小细胞肺癌(SMARCA4-deficient non-small cell lung cancer,SMARCA4-dNSCLC):其与胸部SMARCA4-UT 属于不同的实体瘤,两者临床表现、预后、组织学及免疫组织化学具有显著差异[4,11,13],SMARCA4-dNSCLC 镜下可见分化好的腺癌或鳞状细胞癌形态,BRM、Claudin-4 表达常阳性,SOX2、SALL4阳性率仅为10%~15%[17-18]。该患者存在明确的BRG1 蛋白缺失,为肺原发肿瘤,但是缺乏典型的上皮结构,故排除以上相关鉴别诊断。
胸部SMARCA4-UT 组织学上由弥漫性片状不粘连、大而圆的上皮样细胞组成,染色质呈泡状,核仁突出,细胞核相对一致,偶见轻度异型性细胞,可能存在少量横纹肌样细胞,不存在典型的上皮结构(如腺或鳞状分化)。该疾病存在SMARCA4基因突变或者SMARCA4/BRG1 蛋白缺失或严重降低,这是确诊的必要条件;另外大多伴有SMARCA2/BRM染色缺失,可表达CD34、SOX2 或SALL4,肿瘤CK常呈局灶性、弱阳性或完全阴性,Claudin-4 呈阴性或局灶阳性[11,13]。研究显示,多数患者缺乏EGFR、ALK、ROS1基因突变[14]。本例患者组织学特征表现为未分化癌,未见非小细胞癌成分,免疫表型示BRG1 蛋白缺失,患者自身原因未再进行基因检测,因SMARCA4基因突变或者SMARCA4/BRG1 蛋白缺失均可作为确诊胸部SMARCA4-UT 的依据,故考虑为肺原发的胸部SMARCA4-UT。
胸部SMARCA4-UT 好发于有重度吸烟史的青年至中年男性,无明显地域和种族倾向。其恶性程度高、侵袭性强、预后差,中位生存时间为4~7 个月。表现为纵膈、肺门、肺或胸膜的压迫性肿块,分界不清,常包饶临近组织,背景多为吸烟所致的肺气肿或间质性疾病;较早出现淋巴结、肝脏、肾上腺等远处脏器转移。患者可出现呼吸困难、胸背部疼痛等相关临床表现[4,11-13]。本例患者为中年男性,主要表现为气促、胸痛、咯血,有重度吸烟史;原发病灶位于左肺上叶尖后段,邻近纵膈胸膜粘连,与主动脉弓局部分界不清,伴左肺门淋巴结转移,存在吸烟相关的肺损伤,如肺气肿、肺大疱、间质性肺病的背景改变,因此类疾病症状和影像学缺乏特异性,故需进一步通过病理、免疫组化及基因检测等手段明确诊断。
2015 年Loarer 等[4]首次报道了SMARCA4缺失的胸腔肉瘤。后来陆续有研究发现在其他肿瘤中也存在SMARCA4基因突变,如胃肠道未分化/横纹肌样癌、卵巢高血钙型小细胞癌、肺癌、鼻腔/鼻窦的未分化癌、子宫肉瘤[5],通过这些文献发现,SMARCA4缺失的各种肿瘤具有一些相似的特征,并且肿瘤预后更差,预示着这是一类以基因改变为特征的肿瘤[4-11]。2021 年5 月国际癌症研究机构出版的《WHO 胸部肿瘤分类(第5 版)》提出了“胸部SMARCA4 缺陷型未分化肿瘤”,与NUT 癌一起被归为“肺的其他上皮性肿瘤”[1]。
总之,胸部SMARCA4-UT 发病罕见,组织病理学特点复杂,准确识别和诊断较为困难,因此实际工作中,对于低分化、诊断不明的肺癌建议加做SMARCA4基因测序或BRG1 免疫组化。该肿瘤预后差,首选手术、放疗、化疗等综合治疗方式,但疗效欠佳,将来免疫治疗、靶向治疗可能成为新的精准有效的治疗方案,但需要更多的研究来证实。
天然气水合物中主要成分为甲烷,故又称为甲烷水合物。其主要分布在陆地永久冻土带和海底沉积物中,由于冻土区和海底沉积层的地质条件复杂,开采条件苛刻,进行现场水合物的取芯较为困难,容易破坏冻土区及海底生态环境。且水合物赋存的环境多为多孔介质,因此,目前学者们在实验室内开展了多孔介质环境下水合物的生成实验。
胸部SMARCA4-UT 恶性程度高,预后差,主要治疗方式为手术切除,但对于中晚期患者,传统的放、化疗效果不佳。随着基因检测的广泛应用,有关SMARCA4-UT 的报道也日益增多,如何精准识别该肿瘤并给予有效治疗,是目前临床亟需解决的问题。针对免疫治疗,Takada 等[19]报道了1 例SMARCA4缺失型胸腔肉瘤,PD-L1 表达约60%,给予帕博利珠单抗作治疗后,取得了显著PR 缓解。Naito 等[20]报道1 例SMARCA4-dNSCLC,PD-L1 表达阴性,给予纳武利尤单抗四线治疗,疾病控制大于14 个月。Schoenfeld 等研究[21]发现,在4 813 例NSCLC 患者中,有8%为SMARCA4突变型;而在转移性NSCLC患者中,患者携带SMARCA4突变与较短的总生存期相关,使用免疫检查点抑制剂治疗与SMARCA4缺失型患者的结局改善相关。因此推测,SMARCA4缺失型患者可能对免疫治疗更为敏感。靶向治疗方面,胸部SMARCA4-UT 通常缺乏EGFR、ALK、ROS1等常见驱动基因的突变。EZH2(Enhancer of Zeste Homology 2)是一种组蛋白甲基转移酶,研究发现,BRG1 和EZH2 具有遗传拮抗性,同时EZH2 抑制剂还可以下调SMARCA4-UT 的增殖活性[22]。EZH2或为胸部SMARCA4-UT 的治疗提供新的可能和研究方向[23]。此患者因自身原因未进行PD-L1 表达的检测,临床上使用化疗+免疫治疗+局部放疗的方法,取得了较好的疗效,PFS 已达15 个月,目前仍在免疫单药维持治疗中,病情稳定,本报道中的生存时间明显高于既往研究所示,为将来胸部SMARCA4-UT 的治疗提供一定的参考作用。
传统的数字广播电视体系历经多年的发展,其运行模式是高可靠性和高安全性的,为整个数字电视产业的发展奠定了坚实可靠的基础。广电的IP化不仅仅是用IP链路代替SDI链路,它的前景是能够享受到IT产业带来的红利、新的广告模式、新的业务模式、新的传输途径,能够满足群众日益增长的文化需求,这才是IP产业的发展给广电带来诸多益处。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

