腹膜后巨大副神经节瘤1 例并文献复习
王羿伟,朱 涛,方登攀*
(江汉大学 a.医学部,湖北 武汉 430056;b.附属医院泌尿外科,湖北 武汉 430015)
嗜铬细胞瘤(pheochromocytoma,PHEO)是起源于肾上腺髓质嗜铬细胞的内分泌肿瘤,储存和分泌儿茶酚胺,包括肾上腺素、去甲肾上腺素及多巴胺。而起源于肾上腺外交感或副交感神经嗜铬细胞的PHEO 称为副神经节瘤(paraganglioma,PGL)。PGL 是一种临床上少见的神经内分泌肿瘤,且有恶性潜能,体内多部位均可发生,其诊治上有较大难度。江汉大学附属医院在2020 年7 月收治了1 例腹膜后巨大副神经节瘤患者,现报告如下。
1 临床资料
患者男性,69 岁,因“检查发现腹膜后肿瘤10 年余”于2020 年7 月6 日入院。患者10 年前行健康体检CT 检查时发现左腹部有一直径约7 cm 肿块,在外院行手术治疗,因术中触碰肿瘤时血压急剧升高而行开关手术。10 年来患者无明显不适,定期复查CT 提示肿块逐渐增大,未行特殊治疗,平素无明显症状,但触碰到左上腹部肿块时有头晕及一过性血压升高。否认高血压、心脏病史,否认脑血管疾病,否认糖尿病等病史。入院查体:T 36.5 ℃,P 80 次/min,R 19 次/min,BP 128/86 mmHg,左上腹部可扪及直径约15 cm 的类圆形肿块,质地中等,边界尚清,无压痛。2020 年7 月7 日清晨空腹查血,血常规:血红蛋白127 g/L↓,红细胞压积39.4%↓。凝血功能:D-二聚体1.48 mg/L↑,纤维蛋白降解产物9.6 mg/L↑。血生化:空腹葡萄糖6.12 mmol/L↑,血钾正常。血浆皮质醇水平及节律正常,血浆肾素-血管紧张素-醛固酮正常。血浆去甲肾上腺素浓度4.3 nmol/L(正常参考值0.3~2.8 nmol/L),血浆肾上腺素浓度850 pmol/L(正常参考值170~520 pmol/L)。
2020 年7 月6 日腹部CT 平扫+增强:①左侧腹膜后巨大囊实性占位(直径约13 cm);②左侧肾盂及输尿管上段积水(见图1)。腹膜后MRI:①左侧腹膜后巨大囊实性占位病变(9.5 cm ×12.5 cm×12.5 cm),结合病史,考虑异位嗜铬细胞瘤可能,其他待排。②左侧输尿管向左后方迂曲走行并及左侧泌尿系积水(见图2)。2020 年7 月7 日腹主动脉CTA:左侧腹膜后巨大囊实性占位,其前部供血动脉始于肠系膜下动脉,其前部供血动脉始于左肾动脉分支。
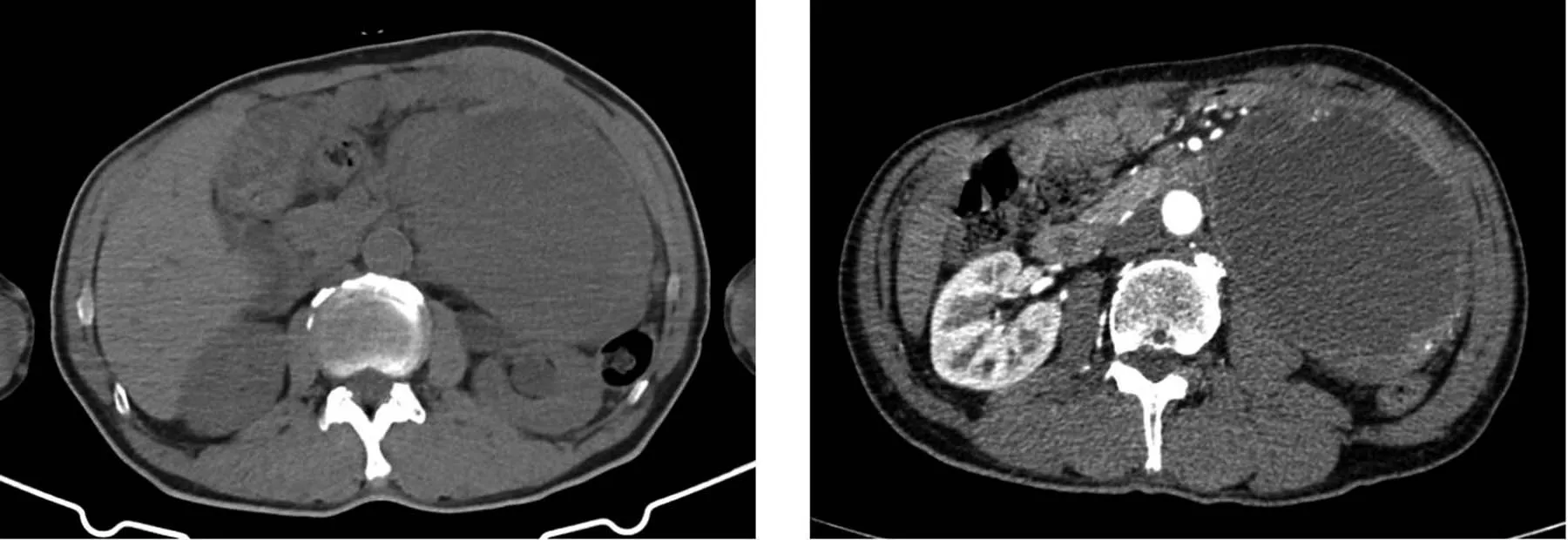
图1 腹部CT 平扫及增强Fig.1 Abdomen plain and enhanced CT scan
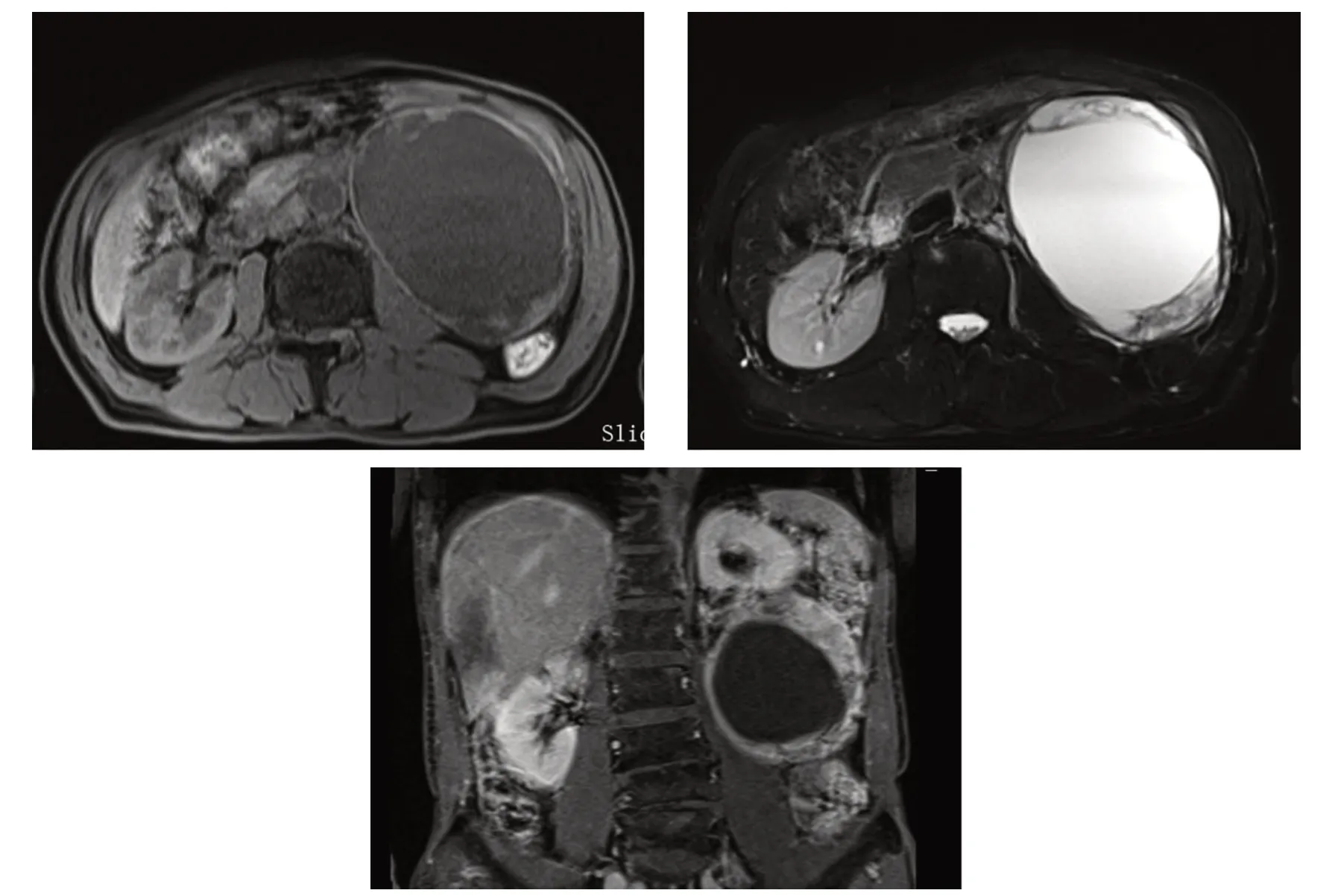
图2 腹部MRI、T1WI 及T2WIFig.2 Abdomen MRI,T1WI,and T2WI
患者于术前3 周(2020 年7 月7 日)开始口服特拉唑嗪片,2 mg/次,每天2 次,扩容补液,每天1 000 mL,晶体胶体配比1∶1。术前10 天(2020 年7 月17 日)口服特拉唑嗪片加至2 mg/次,每天3 次,扩容补液,每天2 000 mL,晶体胶体配比1∶1,直至手术当天。入院后血压一直维持在(100~136)/(70~84)mmHg,心率60~84 次/min。
于2020 年7 月27 日在全麻下行手术治疗,患者取平卧位,取左侧肋弓下斜切口长约18 cm,依次切开皮肤及皮下各层直至腹膜。见腹腔内广泛粘连带,分离后打开左侧结肠旁沟,见肿瘤大小约13 cm,肿瘤表面可见扩张迂曲的血管,肿瘤前方与降结肠及肠系膜粘连,内侧与腹主动脉及腰大肌筋膜粘连。分离时挤压肿块,血压升高至230/120 mmHg,暂停手术8 分钟,麻醉医师处理后血压降至正常,再行手术后未见血压明显波动。将左侧输尿管从肿瘤表面分离出来予以保护。分离肿瘤内侧时见肿瘤供应血管较多,分离难度大,出血明显,予以输血。逐步分离结扎肿瘤滋养血管,继续沿肿瘤表面分离,彻底分离并切除肿瘤,术野彻底止血,置引流管。
患者手术顺利,术中挤压肿块时血压有急剧上升,失血约2 500 mL,术后第7 天(2020 年8 月3 日)病理检查结果:副神经节瘤。免疫组化染色结果显示:嗜铬颗粒蛋白A(CgA)、突触载体蛋白(Syn)、神经元特异性烯醇化酶(NSE)、广谱细胞角蛋白(PCK)、细胞S-100 蛋白均为阳性,Ki-67 为15%。肿瘤组织及血液标本基因检测:检出HRAS-p.Q61R 突变,提示可能对MEK 抑制剂敏感,未发现靶向治疗药物敏感性明确相关的突变,未发现有临床意义的胚系致癌基因变异,PD-L1 表达阳性(TPS 值为3%,CPS 值为3)。术后恢复可,术后第8 天(2020 年8 月4 日)出院。术后3 个月及1 年返院复查,患者无特殊不适,心率血压正常。
2 讨论
2.1 临床表现
副神经节瘤与肾上腺内嗜铬细胞瘤同来源于神经节组织,可发生于全身各个部位,位于交感神经干旁,头颈部、腹膜后主动脉和下腔静脉旁较多见。其典型的临床表现有高血压、头痛、大汗和心悸等,严重者可致高血压危象、心力衰竭、心源性猝死等[1]。本例患者肿瘤就位于腹膜后腹主动脉旁,患者平素虽未有明显高血压征象,但触及左上腹肿块及在两次术中触及肿块,患者血压均有明显升高,符合副神经节瘤表现。
2.2 定性诊断
血或尿的儿茶酚胺测定仍然是PHEO/PGL 目前临床上最主要的定性诊断手段。由于肿瘤释放儿茶酚胺入血具有波动性,在分泌低水平时检测血或尿的儿茶酚胺激素,可能导致较高的假阴性率,血儿茶酚胺诊断敏感性及特异性分别为84%和81%,尿儿茶酚胺测定分别为86% 和88%[2]。然而,儿茶酚胺在肿瘤内部的代谢是持续不断的,代谢产物甲氧基肾上腺素类物质是持续释放入血的,因此测定甲氧基肾上腺素类物质浓度诊断PHEO/PGL 有更高的敏感性和特异性,分别为99%和89%,尿甲氧基肾上腺素测定分别为97%和69%[2]。本例患者血浆去甲肾上腺素浓度以及血浆肾上腺素浓度均有升高。因此,对于PHEO/PGL 的诊断,目前主张检查血或尿甲氧基肾上腺素及甲氧基去甲肾上腺素浓度,最近的证据证明了血浆检测在诊断特异性及敏感性方面优于尿液检测[3]。
2.3 定位诊断
CT 和MRI 是临床上PHEO/PGL 最常用的定位诊断手段。肿瘤的典型表现为不均质、T2WI 高信号、瘤内出血、明显强化及缓慢廓清。不典型影像表现包括均质、轻中度强化、快速廓清、钙化及含细胞内脂质[4]。而对于本病例所示的巨大肿瘤,常以囊性为主。超过80% 的PHEO/PGL 肿瘤(CT 85.98%,MRI 80.56%)不均质(包括囊实性和囊性为主)[5]。123I-间碘苄胍(123I-MIBG)功能显像诊断PHEO 和PGL 的敏感性、特异性分别为85%~88%、70%~100% 和56%~75%、84%~100%,而且有助于早期发现转移灶[6]。对于体积大于5 cm 的肿瘤,由于其多病灶及其转移的可能,建议在手术前进行全身CT 或MRI 或放射性核素显像检查[7]。本例患者术前腹部CT 及MRI 均提示:左侧腹膜后巨大囊实性占位病变,考虑异位嗜铬细胞瘤可能。术前PET/CT 常用于转移性PHEO/PGL 的诊断,并可应用于术后的随访。荟萃分析显示[8]:镓-68 标记生长抑素受体类似物PET/CT(68G-DOTA-SSA PET/CT)的灵敏度最高(93%),其次为二羟基-18 氟苯丙氨酸(18F-DOPA)PET/CT(80%),18F 氟脱氧葡萄糖(18F-FDG)PET/CT 的灵敏度最低(74%)。
2.4 手术治疗
手术切除是非转移性PHEO/PGL 首选的治疗方法。随着医学的发展与进步,手术死亡率已逐步下降至3%以下[9]。充分的术前准备、术中处理、术后监测及治疗对于取得PHEO/PGL 手术治疗的成功非常重要。术前用α-肾上腺素能受体阻断剂进行充分的血压控制,防止手术期间发生严重的心血管事件至关重要。研究[10]认为,术中血压骤升的风险与肿瘤体积大小密切相关。因此,对于本例患者术前3 周开始应用α-肾上腺素能受体阻断剂特拉唑嗪以及扩容补液,且在术前10 天调整α-肾上腺素能受体阻断剂特拉唑嗪及补液量,以确保手术过程顺利。对不能行肿瘤手术切除的患者,α-肾上腺素能受体阻断的应用也可以减轻激素症状并防止儿茶酚胺过量引起的并发症[11]。对于手术风险较高的非转移性病例,也可考虑放疗,虽不能治愈,但可改善预后[12]。对于转移性病例,如果可行应建议进行肿瘤切除术,以减轻儿茶酚胺过量或肿瘤侵袭引起的心血管和其他症状,并可增强其他治疗的效果[13]。对于已经转移的病例,原发性肿瘤的手术切除也能提高患者生存率及时间[14-15]。
2.5 放射性核素治疗
转移性PHEO/PGL 的最佳治疗方法是131I-MIBG 放射性核素治疗,该疗法优先推荐用于生长缓慢的131I-MIBG 阳性的转移性PHEO/PGL[16-17]。在对243 例PHEO/PGL 患者接受131IMIBG 治疗的17 项研究的荟萃分析中,3%的患者完全缓解,27%的患者部分缓解,52%的患者病情稳定[18]。在其中两项研究中,接受131I-MIBG 治疗的患者的平均无进展生存期(PFS)分别为23.1 个月和28.5 个月[18]。
2.6 化疗
对于进展迅速的转移性PHEO/PGL 推荐使用环磷酰胺、长春新碱和达卡巴嗪进行化疗(CVD 方案)。在一项大规模的荟萃分析中,CVD 导致4%转移性PHEO/PGL 患者完全缓解,37%部分缓解,14%的患者病情稳定[19]。在其中两项研究中报告了肿瘤无进展生存时间,分别为20 个月和40 个月[19]。CVD 方案已被证明对SDHB 相关PHEO/PGL 特别有效[20],对于术后进行CVD 辅助化疗是否有益,目前还没有研究证据。
2.7 基因组学
近年来,随着临床遗传学等基础学科研究的进展,对PHEO/PGL 基因组学的研究进入了一个崭新阶段。目前已确认有19 种易感基因通过胚系或体细胞变异导致PHEO/PGL 发生[21],主要与von Hippel-Lindau(VHL)基因、转染期间重排(rearranged during transfection,RET)基因、1 型神经纤维瘤病(neurofibromatosis type 1,NF1)基因、琥珀酸脱氢酶(succinic dehydrogenase,SDH)B 和D 基因突变相关。针对不同的基因表型及疾病表型,靶向治疗也在PHEO/PGL 的治疗中展现出较好的前景[22]。目前已在进行临床实验的主要有:抗血管生成剂、HIF 抑制剂、mTOR 抑制剂、DNA 去甲基化剂、DNA 烷基化剂。对于本病例,对患者肿瘤组织以及血液标本进行基因检测,检测出HRAS-p.Q61R 突变,提示可能对MEK 抑制剂敏感,但未发现靶向治疗药物敏感性明确相关的突变及有临床意义的胚系致癌基因变异。H-Ras 作为MAPK 和PI3K 等信号通路的上游介质,在促增殖和抗凋亡中发挥重要作用。COSMIC 数据库暂未报道HRAS 基因突变在嗜铬细胞瘤和副神经节瘤中的发生率。
2.8 预后
PHEO/PGL 病理形态良恶性之间并无明显界限,不能仅凭其病理形态对其良恶性进行诊断,需要找到它对周围组织的侵袭性或者转移的证据,才能证明它为恶性。需要强调的是,所有PHEO/PGL 病史的患者都有复发的风险及转移的可能性[7,23]。因此,对于所有PHEO/PGL 病史的患者,建议至少随访10 年[7,24];对于高危患者(种系突变,年龄<20 岁,肿瘤大小≥5~6 cm,对于SDHB 携带者肿瘤大小≥3~3.5 cm)和所有PGL 患者,建议终生进行严密的复查[7,24]。肿瘤大小与预后密切相关,所以对于本例所示的巨大肿瘤需严密随访。

