黄铁矿在CO2气氛下非等温氧化转化及动力学分析
黄 芳,况怡婷,张立麒,米 铁,辛善志,刘晓烨
黄铁矿在CO2气氛下非等温氧化转化及动力学分析
黄 芳1,况怡婷1,张立麒2,米 铁1,辛善志1,刘晓烨1
(1. 江汉大学环境与健康学院工业烟尘污染控制湖北省重点实验室,武汉 430056;2. 华中科技大学能源与动力工程学院煤燃烧国家重点实验室,武汉 430074)
针对煤中常见含铁矿物黄铁矿在富氧燃烧典型气氛下转化特性,通过同步热分析结合烟气分析研究了黄铁矿在CO2气氛下的转化行为.结果发现,黄铁矿在CO2气氛下主要经历5个失重阶段且均为吸热过程,首先是黄铁矿颗粒表面硫脱除的起始热解段(相界面反应,=1/2),活化能低于其在N2气氛下近30kJ/mol,为220.27kJ/mol,随后裂解成磁黄铁矿(三维扩散,=1/2)活化能与其在N2(177.27kJ/mol)下接近为178.1kJ/mol;温度高于690℃,随着升温磁黄铁矿缓慢失硫,CO2逐渐参与磁黄铁矿转化且释放SO2和CO;820~1150℃经历双峰失重峰阶段,820~1020℃,氧化气体产物SO2大量生成且在约1000℃达到体积浓度峰值;最后1020~1150℃,坩埚中残留物大量与CO2持续氧化反应失重形成SO2和CO,坩埚中形成复杂物相体系,铁硫化物和铁氧化物共存(或共融).CO2参与黄铁矿产物转化失重阶段活化能分别为180.94kJ/mol、229.69kJ/mol和243.46kJ/mol,动力学机制均为成核与生长(=1).
黄铁矿;非等温;CO2;氧化转化;动力学
我国煤炭中硫含量变化范围从0.02%至10.48%,煤变质程度越高硫含量越高,中高硫煤的保有储量占比高达9.9%,高硫煤中,绝大多数以无机硫铁矿为主[1].黄铁矿(FeS2)是煤中主要含硫无机矿物,是煤粉燃烧锅炉受热面粘污、积灰及结渣的重要来源之一[2-3],同时也是含硫(SO)污染气体排放重要来 源[4].在煤利用(热解、气化、燃烧)过程中,黄铁矿转化受到许多研究人员的关注[5-11].富氧燃烧技术因大规模商业化优点,其烟道气流中CO2含量可达90%以上,是燃煤电厂碳捕集与储存(CCS)最佳可行性技术[12-14].富氧燃烧中,纯氧气和循环烟气(CO2为主要气体)携带煤粉进入锅炉燃烧,与传统空气燃烧有极大差别[15];富氧燃烧气氛,CO2含量较高,因此煤中含铁及含钙类矿物转化受到了关注,对随着煤燃烧共转化的黄铁矿影响也较大[16-19].
黄铁矿转化包含两个重要部分,含铁物相转化及硫演化.对黄铁矿转化,CO2有着极为重要的化学作用[4-5,17,20-22],CO2会参与黄铁矿转化过程.黄铁矿在CO2中分解速度比其在N2中快[23].Aylmore和Lincoln[24]在CO2气氛中研磨黄铁矿,发现在研磨中黄铁矿会直接与CO2反应形成磁黄铁矿、CO和SO2.前期工作[25]发现CO2会参与黄铁矿热解转化,形成含氧物相(铁氧化物、SO2及CO等).在一系列研究中,lv等[20-22]发现,CO2化学参与黄铁矿转化形成磁黄铁矿、SO2、CO和COS,且能参与磁黄铁矿进一步转化形成方铁矿、CO和SO2,接着继续参与方铁矿转化形成磁铁矿、CO和SO2,最后参与磁铁矿转化形成赤铁矿和CO.Bhargava等[26]利用在线X射线衍射仪(in situ XRD)以10℃/min升温速率研究黄铁矿在CO2下物相变化情况,磁铁矿及赤铁矿在700℃左右形成.Wu等[17]在高温沉降炉实验研究中发现,相较于N2气氛,CO2及O2能加速黄铁矿热解和氧化.Mayoral等[9]也发现CO2参与黄铁矿转化,首先形成磁黄铁矿然后形成铁氧化物,且转化各个阶段均为吸热过程.Yang等[5]采用密度泛函理论(DFT)模拟计算了黄铁矿在CO2中温度800 ℃情况下S的演化,发现吸附于黄铁矿颗粒表面的CO2分子分解成CO分子和活性表面O原子,可以为SO2的形成提供氧源,CO能剥离黄铁矿颗粒表面一个晶格硫原子生成COS,显示CO2与黄铁矿有着强烈的相互作用.lv等[20,22]研究了CO2中黄铁矿热解成磁黄铁矿的动力学机制,认为收缩核模型和三维扩散能描述这个过程;研究方铁矿(FeS)在CO2中氧化形成铁氧化物的动力学机制,认为三维扩散能描述这个 过程.
综上所述,研究黄铁矿在CO2下转化大部分基于等温条件下的转化[5,17,20-21,25],在非等温条件下的转化研究较少且基本围绕着含铁物相形成进行分析,对于黄铁矿转化非等温过程中气体释放特性研究较少.本文以程序升温结合尾气分析,研究黄铁矿在CO2气氛下转化(尤其是氧化)行为,同时分析转化过程动力学.本研究可以为富氧燃烧条件下黄铁矿转化行为提供一定理论指导.
1 实验样品和方法
1.1 实验样品
黄铁矿矿石为长宽高约为15mm的正六面体,在实验室进行破碎,然后进行筛分,将样品筛分为45~75μm粒径段,放入干燥皿储存备用.对样品进行了成分及物相分析,如表1所示,XRF分析显示样品中元素Fe及S质量占比高达97.29%,Si占比为2.71%,XRD衍射分析发现,样品衍射峰几乎都是FeS2晶相特征峰,峰型尖锐,衍射强度也高,样品中黄铁矿结晶度高,含量也高[10].
表1 黄铁矿样品成分及矿物分析

Tab.1 Elemental and mineral analysis of pyrite sample
1.2 实验仪器及方法
实验装置采用德国耐驰STA-449F3同步热重分析仪,测试温度范围由室温至2000℃,升温速率0~50℃/min,天平分辨率0.1μg,DSC分辨度小于1μW,仪器配置2路吹扫气和1路保护气.
采用氧化铝坩埚,样品质量为9.7~10.3mg,气氛为N2和CO2,流量为100mL/min,升温速率为10℃/min,加热样品至1300℃,采集样品质量随温度、时间等的变化.在CO2气氛下,考察了升温速率变化对样品热转化行为影响.热重实验中,在同等条件下进行了空白实验,样品进行了两次平行实验.
在固定管式炉中通入N2(或CO2)气体,并且以10℃/min升温速率加热样品至1300 ℃,同时将管式炉中尾气与烟气分析仪相连,分析烟气中气体成分及浓度,N2气氛下烟气分析未采集到气体信号.
1.3 动力学分析
由反应动力学相关原理,黄铁矿分解速率可表 示为
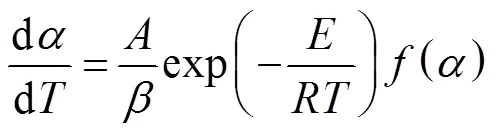
对于非定温情况,热解气化反应动力学的积分形式可以写成如下方程:
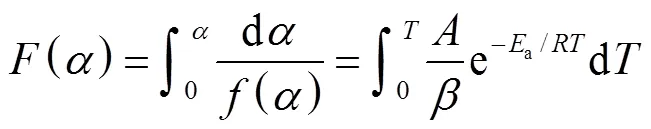

表2 反应机理和机理函数积分形式

Tab.2 Integral form of reaction mechanism and mecha-nism function
2 结果与讨论
2.1 黄铁矿非等温转化热重分析
黄铁矿分别在N2和CO2气氛下升温速率为10℃/min热转化曲线如图1所示.图1(a)失重曲线显示,温度高于约420℃,黄铁矿样品进入大量裂解失重阶段,DTG曲线也相应地出现一个肩峰及明显主失重峰.肩峰峰顶温度在N2及CO2气氛下都为497.8℃,主失重峰峰顶温度分别为608.9℃(N2气氛)和612.1℃(CO2气氛).样品大量热解为吸热过程,DSC曲线(图1(c))显示此温度下明显有吸热峰,结合尾气释放特性,这一过程在约690℃完成.在N2气氛下,随着温度继续升高,样品缓慢失重,DSC曲线存在一个缓慢吸热过程,这一过程持续至约1120℃,TG曲线开始出现明显失重且直至实验结束失重仍未停止,图1(c)显示此失重过程也为吸热过程.在CO2下,随着温度升高(690℃以后),样品缓慢失重,这一过程持续至约820℃;随后样品进入较明显失重阶段,从DTG曲线看到,这一阶段有双峰失重峰,其中一个峰顶温度为997.8℃,另一个为1090.3℃,样品在约1150℃结束失重,温度继续升高,样品基本维持恒重.在CO2气氛下,图1(c)曲线显示大量裂解后,样品继续吸热在990 ℃左右出现一个明显吸热峰伴随着1100℃左右微弱吸热肩峰,说明双峰失重过程也是吸热过程.DSC曲线(图1(c))显示,在CO2气氛下,样品1150℃后依然经历明显吸热过程且直至实验结束仍未停止.
对比黄铁矿在N2及CO2气氛下的转化热重曲线发现,样品从室温至1300℃程序升温过程中,其在两种气氛下转化行为有差别,尤其在CO2气氛下黄铁矿转化行为更加复杂[4-5,17,20-26],从图1(d)转化率曲线可以看到,由于CO2可能参与黄铁矿热解产物进一步转化,导致样品转化率曲线与其在N2下差别较为明显.在热分析曲线和转化率曲线中,针对N2及CO2气氛下黄铁矿样品热转化行为及转化路径差别的进一步分析,本文将在2.3节进行深入探讨.
2.2 升温速率影响
黄铁矿在CO2气氛下随着升温速率变化(10 ℃/min,20℃/min,30℃/min)热转化曲线如图2所示.从图中可以看到,随着升温速率升高,样品失重曲线(图2(a))向高温区移动.在较低升温速率(10 ℃/min)时,样品在约1150℃后基本恒重,而随着升温速率增加,样品在高温下恒重温度升高(20℃/min约1190℃),当升温速率增加至30℃/min,样品在高温下一直失重未停止.图2(b)中DTG曲线显示失重率曲线随升温速率增加向高温区移动,从曲线中可以清楚看到黄铁矿在CO2气氛下转化的几个明显失重峰,热解肩峰及主峰,随后较高温度下黄铁矿与CO2反应的双峰失重峰,在这里可以明显看到高温下双峰失重峰随着升温速率增加,变成非常明显失重肩峰及主峰.从图2(c)的DSC曲线也可以看到,样品在整个升温过程为吸热过程,且随着升温速率增加,样品吸热峰基本向高温区移动.从图2(d)转化率曲线可以明显看到升温速率较低情况下,样品转化率在较低温度就达到100%,随着升温速率增加,转化率曲线向高温区移动.样品同步热分析及转化率曲线随着升温速率改变主要是因为样品颗粒内较低的热交换.较低升温速率导致黄铁矿颗粒受热过程缓慢而有利于黄铁矿颗粒内部热量交换[30-32],增加升温速率瞬时热能增加导致样品最大裂解率增加从而样品释放更多挥发性气体,实验结束后样品残留量减少[30].
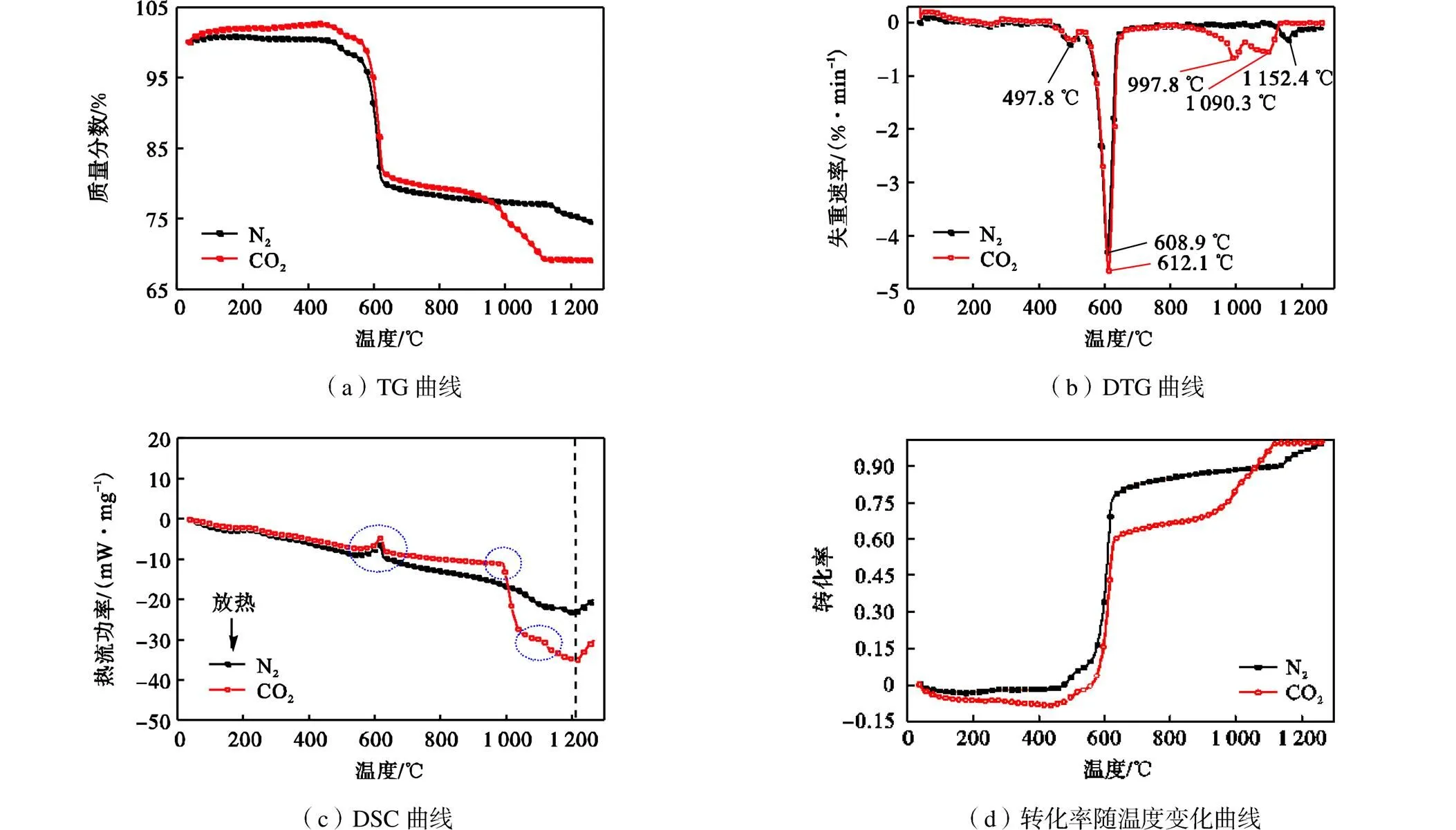
图1 黄铁矿转化同步热分析曲线及转化率分析

图2 升温速率对黄铁矿在CO2下的热解转化影响
2.3 黄铁矿在非等温过程中转化路径分析
黄铁矿在整个受热过程各转化阶段失重量如表3所示,可以看到黄铁矿样品在N2及CO2气氛下热解,阶段1失重质量分数分别为2.24%及1.95%,阶段2的失重质量分数分别为18.99%及19.74%.在温度约420~690℃范围内,样品主要发生表面颗粒中硫蒸发(阶段1)和样品大量热解(阶段2).阶段1时(420~540℃),在N2气氛下形成的硫蒸气(S2)流出炉内并大部分凝结于反应器出口处,而在CO2中,图3(a)的烟气分析中可以看到在这个阶段有微量SO2释放.阶段2是黄铁矿大量热解阶段,在氮气中主要发生如下反应[33],黄铁矿热解形成磁黄铁矿.
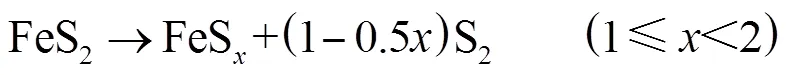
从失重量可以算出在N2气氛下,阶段2后数值为1.2.在CO2气氛下,阶段2后数值为1.19,其不仅发生裂解反应(4),同时极少量硫蒸气与CO2反应生成SO2而被烟气分析仪检测出来,图3(a)中可以看到在约600℃时SO2有个明显释放峰,即如反应(5)所示[20,25],此反应是黄铁矿在CO2气氛下转化温度低于690℃以及SO2主要来源.
表3 黄铁矿热转化失重各阶段失重量

Tab.3 Mass loss of pyrite transformation at various stages

在N2气氛下,随后(阶段3)磁黄铁矿颗粒表面形成的硫蒸气随着不断流出的气流而被带离反应物表面,部分磁黄铁矿(FeS)继续缓慢失硫而形成硫含量更低的磁黄铁矿(FeS,其中趋于1),随着样品中硫进一步脱除,方铁矿(FeS)生成,可以看到这一阶段非常缓慢,反应(6)[3,33]可以描述这一过程.在N2气氛下,样品转化阶段3(690~1120℃)失重量只有2.06%.由图1(a)看到,在N2气氛下,样品紧接着进入一个明显的失重过程(阶段4),且这一失重过程直至实验结束仍未停止(1120~1267℃),此段失重质量分数2.57%.如果样品颗粒周围的硫蒸气分压继续降低,方铁矿便会继续脱去硫而分解形成元素Fe,反应(7)[3,33]可以描述这一过程.

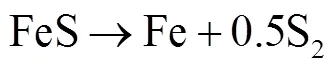

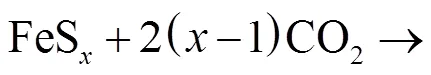

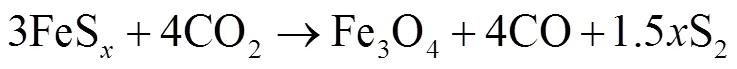



(a)CO和SO2体积分数随温度变化曲线


图3 黄铁矿在CO2气氛下热解气体释放特性
Fig.3 Gaseous products evolution of pyrite trans-formation in CO2atmosphere



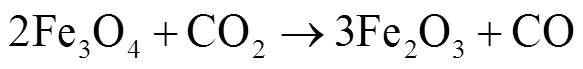

综上分析,黄铁矿在CO2气氛下非等温转化路径概括如图4所示.在CO2气氛下,黄铁矿在程序升温中首先热解成磁黄铁矿,随后磁黄铁矿缓慢脱硫且少量表面颗粒与CO2反应氧化形成SO2和CO气体,温度继续升高,坩埚中残留物大量与CO2反应氧化形成较大量SO2和CO,温度继续升高至1000℃,释放SO2和CO体积分数达到峰值,随后坩埚中残留物与CO2持续反应,SO2和CO持续释放.
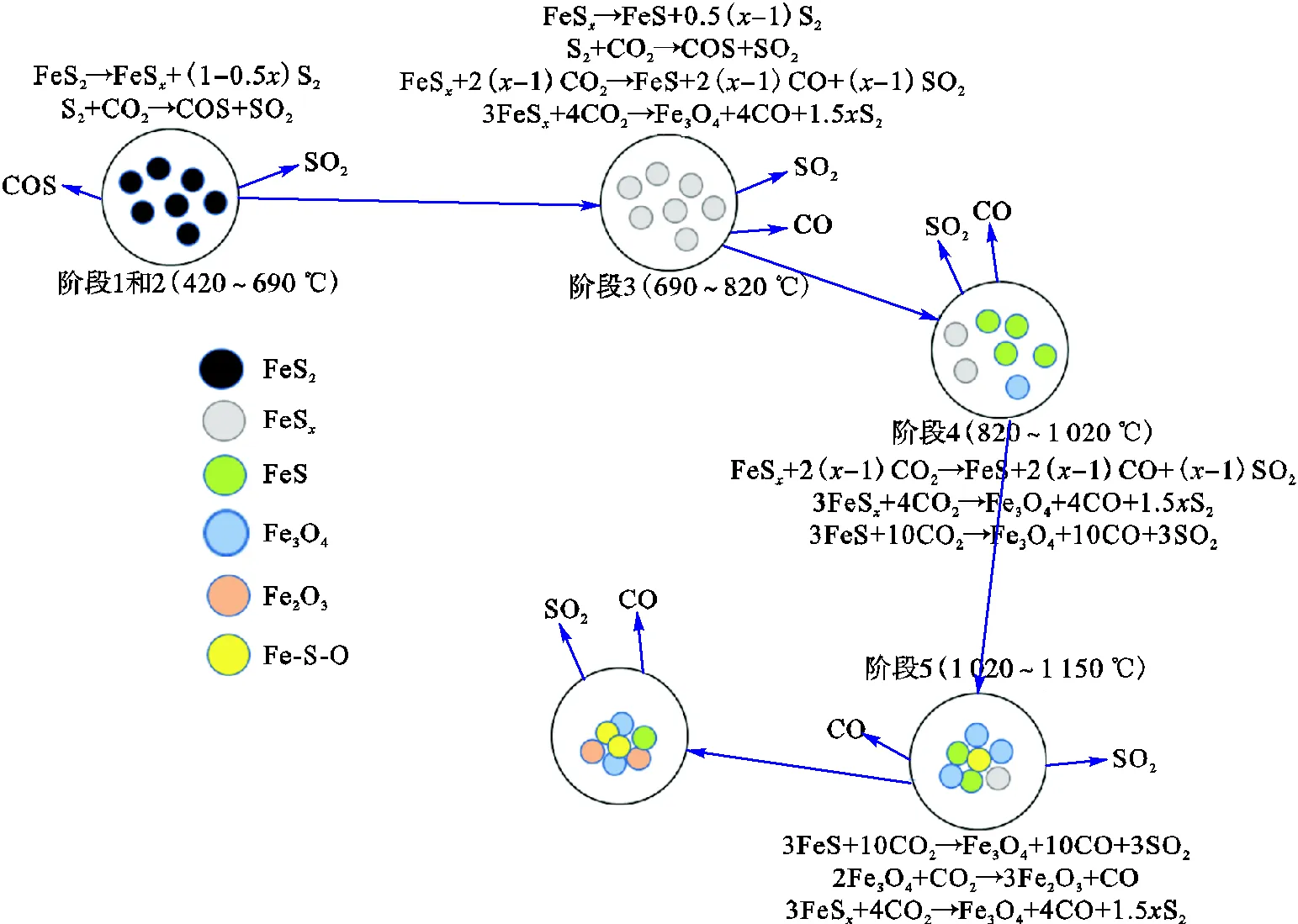
图4 黄铁矿在CO2气氛下非等温氧化转化路径
2.4 动力学分析
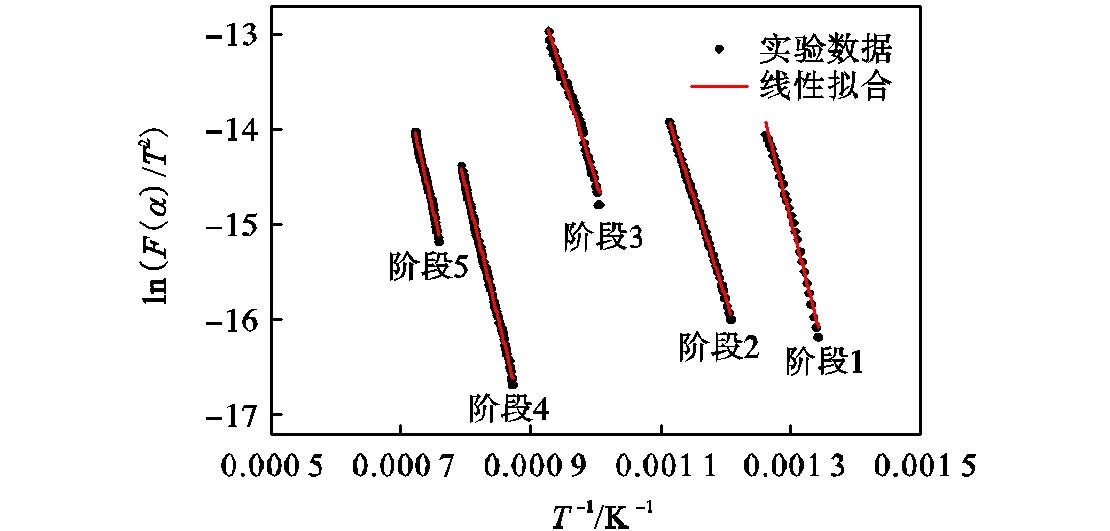
对样品在N2及CO2气氛下从室温升至1300℃热转化过程进行动力学分析,将动力学反应机理函数和实验数据进行拟合后得到相关系数最接近于1的反应机理为最终机理函数.图5显示了样品在N2及CO2气氛下热裂解转化主要失重阶段实验数据线性拟合曲线,发现在N2及CO2气氛下热解各个阶段得到拟合曲线线性相关性较好且覆盖了每个阶段绝大部分过程.

(a)N2气氛
(b)CO2气氛
图5 黄铁矿在N2及CO2气氛下热转化各阶段线性拟合曲线
Fig.5 Linear fitting curves of pyrite transformation in N2and CO2atmospheres
黄铁矿样品在N2及CO2气氛下转化各个阶段反应机理函数及相应动力学参数见表4.阶段1动力学机制为相界面反应(=1/2),阶段2动力学机制为三维扩散(=1/2).而在大量裂解反应后热转化失重阶段,N2及CO2气氛下动力学反应模型均为随机成核与生长机制模型(=1),这个模型物理意义主要为,样品分解反应最初发生在某些晶格缺陷点,然后这些相邻近产物聚集成一个新物相的核,接着核周围分子继续在核上发生反应;反应物不断消失,新物相不断生长和扩展,直至整个固相分解完毕[36-37].可以发现样品大量裂解成磁黄铁矿后,即使产物会与CO2反应而氧化分解转化,其动力学反应机制模型不会变化.
表4 黄铁矿热转化过程中动力学参数分析

Tab.4 Dynamic parameter analysis of pyrite thermal transformation
从表4中可以看到,阶段1黄铁矿样品在CO2气氛下(样品表面颗粒脱硫)活化能为220.27kJ/mol,而N2气氛下活化能为247.53kJ/mol,在CO2气氛下,样品此阶段反应活化能比在N2气氛下低,说明黄铁矿在CO2气氛下更易热解转化,这与Lv等[20]的研究发现一致.阶段2两种气氛下样品热转化活化能较为接近,分别为177.27kJ/mol(N2气氛)和178.10kJ/mol(CO2气氛),即这一阶段形成产物磁黄铁矿及硫蒸气且硫蒸气在产物体系中扩散是主要控制步骤[3,34].随后,在N2气氛下样品分解经历漫长的脱硫形成低硫硫化铁,这一阶段表观活化能最小,最后便是低硫硫化铁在高温下继续分解形成单质铁和硫蒸气,这一阶段活化能最大高达292.61kJ/mol.而在CO2气氛下,样品大量热解为磁黄铁矿后,缓慢脱硫失重阶段CO2气体不断参与产物热解(氧化)反应,阶段3(690~820℃)失重转化表观活化能为180.94kJ/mol,随后温度升高,坩埚中样品大量与CO2反应转化(氧化)连续失重,失重阶段活化能也在增加,分别为229.69kJ/mol及243.46kJ/mol.
3 结 论
本文针对煤中常见含铁矿物黄铁矿样品在富氧燃烧典型气氛CO2下的非等温热转化行为开展了深入分析及研究,主要结论如下:
(1)在CO2下,黄铁矿一般在约420 ℃开始大量热解,420~690℃大量裂解形成磁黄铁矿(FeS1.19),690~820℃缓慢失硫,生成少量SO2及CO,随后经历820~1150℃双峰失重峰热解(氧化)过程,释放大量气体产物SO2及CO.
(2)相较于黄铁矿在N2气氛下热转化,其在CO2下热转化更复杂,热解成磁黄铁矿后,气氛中的CO2进入产物体系反应形成新物相,坩埚中固相产物复杂,形成铁氧化物和硫化铁多物相共存(或共融),磁黄铁矿(或低硫硫化铁)与CO2反应形成气体产物SO2和CO,并随温度升高气体产物释放浓度增加,在1000℃达到峰值,高于1150℃,坩埚中样品在反应过程中达到了质量相对恒定而不失重状态.
(3)在CO2气氛下,升温速率增加,导致黄铁矿整个热转化曲线向高温区移动.黄铁矿在起始裂解阶段,其在CO2气氛下转化表观活化能更低,CO2有利于黄铁矿在起始阶段热解转化.
[1] 唐跃刚,贺鑫,程爱国,等. 中国煤中硫含量分布特征及其沉积控制[J]. 煤炭学报,2015,40(9):1977-1988.
Tang Yuegang,He Xin,Cheng Aiguo,et al. Occur-rence and sedimentary control of sulfur in coals of China [J].,2015,40(9):1977-1988(in Chinese).
[2] Brink H M T,Eenkhoorn S,Hamburg G. A mechanistic study of the formation of slags from iron-rich coals[J].,1996,75(8):952-958.
[3] Hu Guilin,Dam-Johansen K,Wedel S,et al. Decom-position and oxidation of pyrite[J].,2006,32(3):295-314.
[4] Yang Yingju,Liu Jing,Liu Feng,et al. Comprehen-sive evolution mechanism of SOformation during pyrite oxidation[J].,2019,37(3):2809-2819.
[5] Yang Yingju,Liu Jing,Wang Zhen,et al. CO2-mediated sulfur evolution chemistry of pyrite oxidation during oxy-fuel combustion[J].,2020,218:75-83.
[6] Zhao Huiling,Bai Zongqing,Guo Zhenxing,et al. In situ study of the decomposition of pyrite in coal during hydropyrolysis[J].,2021,154(13):105024.
[7] Wang Haiyan,Tan Bo,Shao Zhuangzhuang,et al. Influence of different content of FeS2on spontaneous combustion characteristics of coal[J].,2020,288(9):119582.
[8] Srinivasachar S,Helble J J,Boin A A,et al. Mineral behavior during coal combustion(1):Pyrite transforma-tions[J].,1990,16(4):293-302.
[9] Mayoral M C,Andres J M,Izpuierdo M T,et al. Pyr-rhotite deposition through thermal projection to simulate iron sulphide slagging in oxyfuel combustion[J].,2012,101:197-204.
[10] Huang Fang,Xin Shanzhi,Mi Tie,et al. Study of pyrite transformation during coal samples heated in CO2atmosphere[J].,2021,292(3):120269.
[11] Jassim E,Benson S A,Bowman F M,et al. The influ-ence of fragmentation on the behavior of pyrite particles during pulverized coal combustion[J].,2011,92(5):970-976.
[12] Zheng Chuguang,Liu Zhaohui,Xiang Jun,et al. Fun-damental and technical challenges for a compatible de-sign scheme of oxyfuel combustion technology[J].,2015,1(1):139-149.
[13] Duan Lunbo,Li Lin,Liu Daoyin,et al. Fundamental study on fuel-staged oxy-fuel fluidized bed combustion [J].,2019,206:227-238.
[14] Xu M X,Wu H B,Wu Y C,et al. Design and evalua-tion of a novel system for the flue gas compression and purification from the oxy-fuel combustion process[J].,2021,285:116388.
[15] Chen L,Yong S Z,Ghoniem A F. Oxy-fuel combus-tion of pulverized coal:Characterization,fundamen-tals,stabilization and CFD modeling[J].,2012,38(2):156-214.
[16] Sheng Changdong,Li Jun,Li Yi,et al. Transforma-tion behaviors of excluded pyrite during O2/CO2combus-tion of pulverized coal[J].,2010,5(2):304-309.
[17] Wu Jianqun,Yu Dunxi,Yu Xin,et al. High-temperature transformation of pyrite in CO2:Effects of residence time and the presence of O2[J].,2021,38(4):5493-5500.
[18] Huang Fang,Zhang Liqi,Yi Baojun,et al. Effect of H2O on pyrite transformation behavior during oxy-fuel combustion[J].,2015,131:458-465.
[19] Yu D,Yu X,Wu J,et al. A comprehensive review of ash issues in oxyfuel combustion of coal and biomass:Mineral matter transformation,ash formation,and deposition[J].2021,35:17241-17260.
[20] Lv Weizhi,Yu Dunxi,Wu Jianqun,et al. The chemi-cal role of CO2in pyrite thermal decomposition[J].,2015,35(3):3637-3644.
[21] Lv Weizhi,Yu Dunxi,Wu Jianqun,et al. A mechanis-tic study of the effects of CO2on pyrrhotite oxidation[J].,2017,36(3):3925-3931.
[22] Lv Weizhi,Yu Dunxi,Wu Jianqun,et al. A kinetic study on oxidation of ferrous sulfide(FeS)in mixtures of CO2and H2O[J].,2017,36(2):2173-2180.
[23] de Oliveira E M,Oliveira C M D,Sala M,et al. Thermal behavior of pyrite in the CO2and N2atmosphere for obtaining pyrrhotite:A magnetic material[J].,2018,21(6):20170244.
[24] Aylmore M G,Lincoln F J. Mechanochemical milling-nduced reactions between gases and sulfide minerals (Ⅰ):Reactions of SO2with arsenopyrite,pyrrhotite and pyrite[J].,2000,309(1-2):61-74.
[25] Huang Fang,Zhang Liqi,Yi Baojun,et al. Transfor-mation pathway of excluded mineral pyrite decomposi-tion in CO2atmosphere[J].,2015,138:814-824.
[26] Bhargava S K,Garg A,Subasinghe N D. In situ high-temperature phase transformation studies on pyrite[J].,2009,88(6):988-993.
[27] Liu Ke,Yuan Zhangfu,Shi Chunhong,et al. Effect of CaO-SiO2-FeO slag system on coal gasification reaction in CO2-Ar atmosphere and kinetic analysis[J].Journal of CO Utilization,2022,56:101850.
[28] Li Chung-Hsung. An accurate integral approximation formula for kinetic analysis of nonisothermal data[J].,1986,31(6):1036-1038.
[29] Vyazovkin S,Burnham A K,Criado J M,et al. IC-TAC kinetics committee recommendations for perform-ing kinetic computations on thermal analysis data[J].,2011,520(1-2):1-19.
[30] Kim S S,Ly H V,Kim J,et al. Thermogravimetric characteristics and pyrolysis kinetics of Alga Sagarssum sp. biomass[J].,2013,139:242-248.
[31] Kaur R,Geta P,Jha M K,et al. Pyrolysis kinetics and thermodynamic parameters of castor(Ricinus commu-nis)residue using thermogravimetric analysis[J].,2018,250:422-428.
[32] 史 航,靳立军,魏宝勇,等. 大柳塔煤及显微组分在不同气氛下的热解行为[J]. 煤炭学报,2019,44(1):316-322.
Shi Hang,Jin Lijun,Wei Baoyong,et al. Pyrolysis behavior of Daliuta coal and its macerals under different atmospheres[J].,2019,44(1):316-322(in Chinese).
[33] Tomeczek J,Palugniok H. Kinetics of mineral matter transformation during coal combustion[J].,2002,81(10):1251-1258.
[34] Fegley B,Lodders K,Treiman A H,et al. The rate of pyrite decomposition on the surface of Venus[J].,1995,115(1):159-180.
[35] Li Yi,Wu Hongwei. Ash cenosphere from solid fuels combustion(Part 1):An investigation into its formation mechanism using pyrite as a model fuel[J].,2012,26(1):130-137.
[36] 郑 瑛,陈小华,周英彪,等. CaCO3分解机理和动力学参数的研究[J]. 华中科技大学学报(自然科学版),2002,30(12):86-88.
Zheng Ying,Chen Xiaohua,Zhou Yingbiao,et al. The decomposition mechanism of CaCO3and its kinetics parameters[J].(),2002,30(12):86-88(in Chinese).
[37] 张保生,刘建忠,周俊虎,等. 粒度对石灰石分解动力学影响的热重实验研究[J]. 中国电机工程学报,2010,30(2):50-55.
Zhang Baosheng,Liu Jianzhong,Zhou Junhu,et al. Experimental study on the impaction of particle size to limestone decomposition kinetics by thermogravim-etry[J].,2010,30(2):50-55(in Chinese).
Non-Isothermal Oxidation Transformation and Kinetics of Pyrite in CO2
Huang Fang1,Kuang Yiting1,Zhang Liqi2,Mi Tie1,Xin Shanzhi1,Liu Xiaoye1
(1. Hubei Key Laboratory of Industrial Fume and Dust Pollution Control,School of Environment and Health,Jianghan University,Wuhan 430056,China;2. State Key Laboratory of Coal Combustion,School of Energy and Power Engineering,Huazhong University of Science and Technology,Wuhan 430074,China)
To investigate the transformation behavior of pyrite under typical oxy-fuel combustion atmosphere,the transformation behavior of pyrite in CO2atmosphere was studied by simultaneous thermal analysis and flue gas analysis. The results showed that the pyrolysis of pyrite can be mainly divided into five weight loss stages in CO2atmosphere,all of which were endothermic processes. The activation energy of the initial pyrolysis stage (phase interface reaction,=1/2) of sulfur removal on the surface of pyrite particles was 220.27kJ/mol in CO2atmosphere,which was about 30kJ/mol lower than that in N2atmosphere. Then,the pyrite was mainly decomposed into pyrrhotite (three-dimensional diffusion,=1/2),and the activation energy was 178.1kJ/mol (177.27kJ/mol in N2). When the temperature was raised above 690℃,the solid products continued to lose sulfur slowly,and CO2gradually participated in the conversion of solid products to release SO2and CO. At 820—1150℃,the sample experienced bimodal weight loss peak stage. At 820—1020℃,the oxidizing gas SO2was generated in large quantities and reached the maximum volume concentration at about 1000℃. At the temperature between 1020—1150℃,a large amount of residue in the crucible continuously reacted with CO2to generate SO2and CO,and a complex phase system was formed in the crucible,in which iron sulfides and iron oxides co-existed (or formed eutectic mixtures). The activation energies of the mass loss stages of pyrite decomposition products reacting with CO2are 180.94kJ/mol,229.69kJ/mol and 243.46kJ/mol,respectively,and the kinetic mechanisms are nucleation and growth (=1).
pyrite;non-isothermal;CO2;oxidation transformation;kinetics analysis
TQ534
A
1006-8740(2024)01-0082-09
2022-10-14.
国家自然科学基金资助项目(51706085);湖北省教育厅高校中青年创新团队资助项目(T201420);江汉大学“四新”专项基金资助项目(2022SXZX05).
黄 芳(1984— ),女,博士,讲师,huangfang5869684@126.com.
米 铁,男,博士,教授,mitie1999@163.com.
(责任编辑:隋韶颖)

