茶黄素通过调节Wnt/β-catenin 和Hedgehog 信号通路对HepG2细胞增殖和凋亡的影响
郭永木,苏亚勇,刘双平,王丽惠,徐成润
[中国人民解放军联勤保障部队第九〇九医院(厦门大学附属东南医院)感染科,福建 漳州 363100]
目前,原发性肝癌严重威胁人民的生命和健康[1]。由于肝癌的发生发展是一个复杂的过程,治疗方法也呈多样化。越来越多的研究表明,中医药在治疗癌症方面有明显优势,可降低癌症的复发率,提高患者的生存质量[2]。茶黄素(theaflavins)是从红茶或绿茶中提取的一类天然产物,具有抗炎、抗菌、抗病毒、降脂、抗突变、抗肿瘤和调节免疫细胞功能等药理作用,尤其在多种肿瘤中如胃癌、肺癌、结直肠癌、前列腺癌及乳腺癌等显示抗肿瘤活性,一度被认为是癌症新药研发的新方向[3−5]。本研究通过细胞实验探讨茶黄素通过调控Wnt/β-catenin和Hedgehog 信号通路对HepG2 细胞增殖和凋亡的影响,旨在阐明茶黄素在HepG2 细胞中的调控机制,为其抑制肝细胞癌的基础研究提供实验依据。
1 材料与方法
1.1 材料
肝癌HepG2 细胞购于上海酶研生物科技有限公司;茶黄素(质量分数≥98%,BP1384)购于成都普瑞法生物技术有限公司(批号:BP1384);CCK-8 试剂盒购于Dojindo Molecular Technologies 公司(批号:CK04-11);GAPDH(批号:P04406,36 kDa)、Ki67(批号:E9PVX6,351 kDa)、PCNA(批号:P12004,31 kDa)、cleaved caspase-3(批号:P42574,32 kDa)、caspase-3(批号:P42574,32 kDa)、cleaved caspase-9(批号:P55211,46 kDa)、caspase-9(批号:P55211,46 kDa)、GLi1(批号:P08151,150 kDa)、SMO(批号:Q99835,86 kDa)、β-catenin(批号:P35222,92 kDa)、c-myc(批号:P01106,49 kDa)和Cyclin D1(批号:P24385,34 kDa)均购于美国Proteintech Group 公司;PTch1(批号:ab53715,161 kDa)购于美国Abcam 公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒(批号:88-8102-72)购于美国ThermoFisher 公司;SYBR Premix Ex TaqTM(批号:DRR081A)试剂盒购于日本TaKaRa公司。
1.2 方法
1.2.1 细胞培养 在含10%(φ)胎牛血清、100 u/mL青霉素和100 mg/mL链霉素的RPMI 1640培养基中加入肝癌HepG2 细胞,并将细胞培养瓶放置在37 ℃、5%(φ)CO2浓度条件的细胞培养箱中,进行恒温培养。
1.2.2 CCK-8 试验检测HepG2 细胞活性 筛选对数生长期的肝癌HepG2 细胞,将细胞培养瓶中的肝癌HepG2 细胞进行稀释,取5×104个/L 细胞接种于96孔板中,用0、2.5、5、10、20、40、80、160、320 μmol/L的茶黄素分别进行处理,每个浓度设置3个平行孔,然后分别培养24、48、72 h。培养不同时间段后,向每孔加入10 μL CCK-8 溶液,在37 ℃条件下孵育1 h。最后,在450 nm 波长下测量各孔吸光度值(A),以0 μmol/L 茶黄素作为对照组,计算细胞活性。HepG2 细胞存活率=(实验组A 值/对照组A值)×100%。取3次实验平均值计算存活率。
1.2.3 实验分组 根据细胞活性实验结果,筛选对数生长期的肝癌HepG2细胞,将肝癌HepG2细胞进行稀释,细胞浓度调整为5×104个/mL,用0、20、40、80 μmol/L 的茶黄素分别培养24 h。实验分为4 组:空白对照组(不给予任何药物处理)、茶黄素低剂量(20 μmol/L)组、茶黄素中剂量(40 μmol/L)组和茶黄素高剂量(80 μmol/L)组。
1.2.4 流式细胞术检测HepG2 细胞凋亡 筛选对数生长期的肝癌HepG2 细胞,将细胞培养瓶中的肝癌HepG2 细胞进行稀释,取5×104个细胞接种于6孔板,培养过夜。分别添加20、40、80 μmol/L 的茶黄素,孵育24 h 后,然后使用不含乙二胺四乙酸(EDTA)的胰蛋白酶收集细胞,依次加入5 μL Annexin Ⅴ-FITC 溶液和10 μL PI 溶液,室温避光孵育30 min,流式细胞仪(美国贝克曼,DxFLEX)检测细胞凋亡。
1.2.5 实时荧光定量PCR(qRT-PCR)检测mRNA 相对表达量 取经茶黄素(0、20、40、80 μmol/L)处理并培养24 h 的肝癌HepG2 细胞,用Trizol 裂解液裂解细胞,然后提取总RNA。按照qRT-PCR试剂盒说明书,将总RNA 逆转录为cDNA,并制备50 μL 反应体系,用于DNA 扩增。荧光定量PCR 仪(美国Bio-Rad 公司,CFX9 real-time PCR 仪)检测mRNA 的相对表达量,PCR 反应条件:首先是95 ℃预变性5 min,然后是95 ℃变性10 s,60 ℃退火30 s,以上进行35 个循环处理。用2−ΔΔCt法分析GLi1、SMO、PTch1、β-catenin、c-myc 和Cyclin D1 的mRNA 相对表达量[6],取3 次实验平均值计算结果。
1.2.6 Western blot 检测蛋白表达量 将RIPA 裂解缓冲液与蛋白酶抑制剂按照100∶1 的体积比混合,加入茶黄素处理(0、20、40、80 μmol/L 处理并培养24 h)后的肝癌HepG2 细胞中,置于冰块中,裂解30 min,12 000 r/min 离心10 min,离心后,去掉上清液,收集细胞总蛋白,最后采用BCA 试剂盒测定蛋白浓度。将收集的蛋白质样品通过SDS-PAGE进行分离,然后进行转膜,用现配置的5%脱脂牛奶在室温下封闭2 h,然后用TBST 清洗液清洗膜,每次3 min,共3 次。根据说明书,加入对应浓度GAPDH、Ki67、PCNA、cleaved caspase-3、caspase-3、cleaved caspase-9、caspase-9、GLi1、SMO、PTch1、β-catenin、c-myc和Cyclin D1的一抗,在4 ℃的条件下孵育过夜,再TBST缓冲液,每次3 min,共3次;然后加入对应浓度的二抗,在室温条件下孵育2 h,再TBST缓冲液,每次3 min,共3次。最后在避光的条件下,加入ECL发光染色,使用凝胶成像仪(美国Bio-Rad 公司,ChemiDocM)进行分析,用TotalLab 2.0进行灰度计算,GAPDH为内参,计算目的蛋白相对表达量,取3次实验平均值计算结果。
1.2.7 数据分析 采用SPSS 20.0统计学软件进行统计处理。所有结果用均数±标准差()表示,采用单因素方差分析进行多组间比较,LSD-t法进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 茶黄素对肝癌HepG2细胞活性的影响
如图1 所示,随着茶黄素浓度的增加,肝癌HepG2 细胞活性显著下降;在相同茶黄素浓度下,随着培养时间增加,肝癌HepG2 细胞活性显著下降。培养24 h,茶黄素浓度为<80 μmol/L 时,肝癌HepG2 细胞活性>70%。因此,本研究选取浓度为20、40、80 μmol/L的茶黄素进行后续研究。
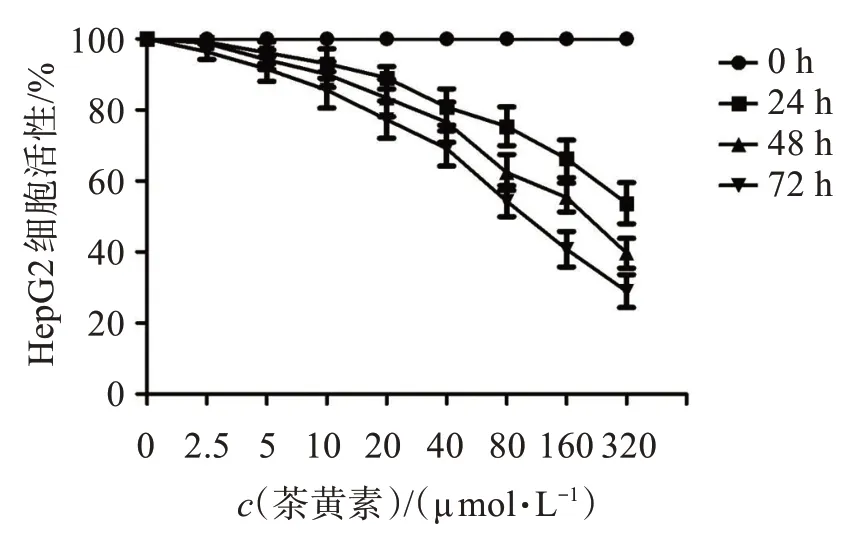
图1 茶黄素对肝癌HepG2细胞活性的影响Figure 1 Effect of theaflavins on HepG2 cell activity
2.2 茶黄素对肝癌HepG2细胞增殖的影响
如图2所示,克隆形成实验结果显示,与空白对照组相比,茶黄素显著抑制肝癌HepG2 细胞的增殖,其中茶黄素浓度为40 μmol/L和80 μmol/L,差异有统计学意义(P<0.05,P<0.01)。Western blot结果显示,随着茶黄素浓度增加,Ki67 和PCNA 蛋白的表达量显著下调。
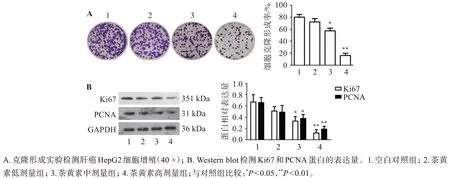
图2 茶黄素对肝癌HepG2细胞增殖的影响Figure 2 Effect of theaflavins on HepG2 cell proliferation
2.3 茶黄素对肝癌HepG2细胞凋亡的影响
如图3所示,在流式细胞术实验中,与空白对照组相比,茶黄素显著诱导肝癌HepG2 细胞的细胞凋亡,其中茶黄素浓度为40 μmol/L和80 μmol/L,差异具有统计学意义(P<0.05,P<0.01)。Western blot结果显示,随着茶黄素浓度增加,cleaved caspase-3 和cleaved caspase-9蛋白的表达量显著上调。

图3 茶黄素对肝癌HepG2细胞凋亡的影响Figure 3 Effect of theaflavins on HepG2 cell apoptosis
2.4 茶黄素对Hedgehog信号通路的影响
如图4 所示,qRT-PCR 结果显示,随着茶黄素浓度增加,GLi1、SMO 和PTch1 mRNA 相对表达量显著降低。Western blot结果显示,随着茶黄素浓度增加,GLi1、SMO和PTch1蛋白的表达量显著下调。
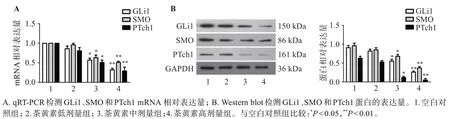
图4 茶黄素对Hedgehog信号通路的影响Figure 4 Effect of theaflavins on Hedgehog signaling pathway
2.5 茶黄素对Wnt/β-catenin信号通路的影响
如图5 所示,qRT-PCR 结果显示,随着茶黄素浓度增加,β-catenin、c-myc和Cyclin D1 mRNA相对表达量显著降低。Western blot结果显示,随着茶黄素浓度增加,β-catenin、c-myc 和Cyclin D1 蛋白的表达量显著下调。
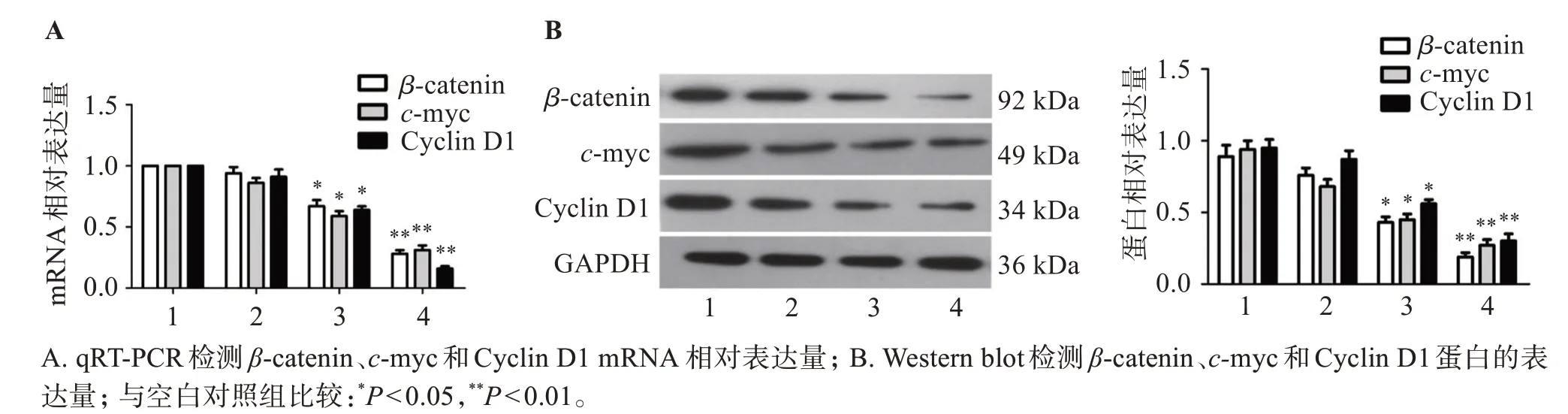
图5 茶黄素对Wnt/β-catenin信号通路的影响Figure 5 Effect of theaflavins on Wnt/β-catenin signaling pathway
3 讨论
原发性肝癌具有较高的发病率和致死率,是全世界最为常见的恶性肿瘤之一[7]。近年来,随着人们生活、工作等方式的改变、饮食结构的变化以及老年化加剧,导致肝癌的发病率逐年上升。目前可用于治疗肝癌的手段为局部治疗(手术、消融、栓塞、放疗)和系统治疗(靶向治疗、免疫治疗、化疗),这些方法能显著改善患者生存期和提高患者生活质量,但仍存在局限性,即肝癌治愈率、患者5年生存率普遍较低,因此探索治疗肝癌的研究仍然任重道远,需要进一步寻找更为有效的治疗策略[8−9]。近年来,大量研究证实了茶黄素的生物活性、药用价值及其保健功能[10],即其能够促进肿瘤细胞凋亡、诱导肿瘤细胞有丝分裂阻滞并调节肿瘤免疫,以及通过调节PI3K/AKT、MAPK、NF-κB、JAK/STAT、Hedgehog及Wnt/β-catenin等信号通路抑制肿瘤发生和生长[4]。
研究表明,Wnt/β-catenin 和Hedgehog 信号通路在组织生长发育的调控中发挥重要作用[11]。其中Hedgehog(Hh)通路通常在哺乳动物的胚胎发育、纤毛运动、肿瘤发生过程中被激活,主要包括3个家族成员及配体Sonic hedgehog(SHh)、Indian hedgehog(IHh)和Desert hedgehog(DHh),12-跨膜受体PTch1 和PTch2,7-跨膜G 蛋白偶联受体Smoothened(SMO),转录因子GLil、GLi2 和GLi3[12−13]。研究发现,经过茶黄素处理后,GLi1、SMO 和PTch1 mRNA相对表达量以及蛋白表达量均显著下调,表明茶黄素能抑制Hedgehog 信号通路从而调控肝癌HepG2细胞的增殖和凋亡。另外,Wnt/β-catenin 通路中核心蛋白为β-catenin 蛋白,是Wnt 的效应器[13]。在本研究中,经过茶黄素处理后,β-catenin mRNA 相对表达量以及蛋白表达量均显著下调,表明茶黄素能抑制Wnt/β-catenin 信号通路从而调控肝癌HepG2细胞的增殖和凋亡。研究发现,GLil 是转录激活因子,它可以诱导内源性卷曲相关蛋白1(secreted frizzled-related protein-1,SFRP-1),使SFRP-1 表达量增加。SFRP1 是Wnt 信号通路的负调控因子,Hedgehog 通路可通过上调SFRP1 的表达量抑制Wnt信号通路相应蛋白的表达量[14]。已证明典型的Hedgehog 信号通过诱导Cyclin D1 和c-myc基因在细胞增殖中起重要作用,当细胞膜上的PTch1 与配体配对结合后可以激活Hedgehog 信号通路,诱发GLi2 转录因子的表达,继而影响到GLi1、Bcl-2、c-Flip、Cyclin D1、c-myc 及VEGF 靶基因的表达,从而激发肿瘤细胞增殖[15−16]。在细胞增殖过程中,细胞周期中重要调控蛋白Cyclin D1能加快细胞从G1期进入S期,缩短细胞增殖周期的时间,导致细胞过度增殖,因此该通路被认为是肝癌治疗的重要靶点[15−16]。本研究结果表明,经茶黄素处理后,c-myc和Cyclin D1 mRNA 相对表达量和蛋白表达量显著下调;克隆形成实验结果显示,茶黄素能显著抑制肝癌HepG2 细胞的增殖,并且显著下调Ki67 和PCNA 蛋白的表达量。Wnt/β-catenin 信号通路参与了HCC在内恶性肿瘤上皮间质转化,并影响癌细胞增殖、凋亡、迁移和侵袭,是肝癌发生发展的最重要的信号通路之一[13,17]。流式细胞实验结果显示,茶黄素显著诱导肝癌HepG2细胞的细胞凋亡,并且显著上调cleaved caspase-3和cleaved caspase-9蛋白的表达量。
综上所述,本研究表明茶黄素可以抑制肝癌HepG2 细胞增殖、促进HepG2 细胞凋亡,其作用机制可能是通过调控Wnt/β-catenin 和Hedgehog 信号通路来实现的,未来仍需进一步深入验证该调控机制,以期实现茶黄素辅助治疗肝癌的临床应用。

