β‐1,3‐葡聚糖内切酶合成、制备及应用研究进展
方炯浩,刘瑜,吴宇箫,段涛,陈杰,肖湲,周林
(1.广东药科大学生命科学与生物制药学院/广东省药物新剂型重点实验室与广东省局部精准药物递药制剂工程技术研究中心,广东 广州 510006;2.广东丸美生物技术股份有限公司,广东 广州 510700)
β-葡聚糖是一种非淀粉多糖,由D-葡萄糖通过β‐糖苷键连接形成。β-葡聚糖包括热凝胶多糖、裂褶多糖、大麦β-葡聚糖以及酵母β-葡聚糖等,广泛存在于酵母、真菌、细菌、海藻和谷物中,不同来源的β-葡聚糖的线性结构和分支组成存在差异[1]。β-葡聚糖一般由β‐1,3 糖苷键构成,并含有不同数量的β-1,4 和β-1,6 糖苷键;而纤维素仅由β-1,4 糖苷键形成,因此β-葡聚糖一般不包括纤维素[2]。研究表明,β-葡聚糖能够改善身体的健康状况和预防慢性疾病,对糖尿病、肥胖、癌症、高胆固醇血症等都具有一定的预防和治疗作用[3],但目前大多数的β-葡聚糖因为分子量过大导致水溶性低,影响其生产工艺和生物活性,限制了β-葡聚糖在食品医药健康产业中的应用[4−6]。
β-葡聚糖酶是一类能降解β-葡聚糖的水解酶的总称,根据其水解多糖中糖苷键的位置,可以分为内切葡聚糖酶和外切葡聚糖酶。主要包括内切和外切β‐1,3‐葡聚糖酶、β‐1,3(4)-葡聚糖酶、内切和外切β-1,4-葡聚糖酶。其中β‐1,3-葡聚糖酶是负责β-葡聚糖分解的主要酶。内切β‐1,3‐葡聚糖酶随机对β-1-3糖苷键进行切割,最终产物主要为低聚β-葡聚糖,而外切β‐1,3‐葡聚糖酶则从多糖的非还原端进行切割,最终产物主要为葡萄糖[7]。目前已发现的β-葡聚糖主要通过β‐1,3 糖苷键构成主链,利用β-1,3-葡聚糖内切酶能够大量制备低分子量葡聚糖,因此β-1-3葡聚糖内切酶是制备低分子量葡聚糖的关键酶。β‐1,3-葡聚糖内切酶的生产方法主要有微生物发酵法与提取分离法。提取分离法是直接从动物或植物中提取,但效率较低,且酶学性质不稳定,难以进行分离纯化,因此目前较为常用的方法是微生物发酵法。该方法能够对微生物进行基因修饰,从而提高酶活性及稳定性,且制备的β-葡聚糖酶的纯度高,有利于大规模生产[8]。但目前β‐1,3‐葡聚糖内切酶仍存在酶活性不高、表达量低等问题,生产成本居高不下,限制了其大规模的应用。如何通过β-葡聚糖酶高效制备低分子量β-葡聚糖及其生物活性的研究成为解决问题的关键。因此,以下主要针对β‐1,3-葡聚糖内切酶的相关研究及其进展进行介绍。
1 β-1,3-葡聚糖内切酶的合成调节
在通常情况下,β-葡聚糖酶的产量受到相应的合成机制的调控,如果要大幅度提高酶产量,可以利用基因改造等手段进行高产菌株的构建,或是在酶的发酵生产过程中,通过添加诱导物、控制阻遏物浓度、添加产酶促进剂等,其中控制阻遏物浓度和添加诱导剂可以通过抑制阻遏蛋白的表达,最终提高β-葡聚糖酶的产量(图1)。具体来说,研究人员通过对核糖体结合位点(ribosomebinding site,RBS)序列进行优化后,获得了β‐1,3‐葡聚糖内切酶表达水平较高的枯草芽孢杆菌(Bacillus subtilis),这是因为RBS 是翻译起始和蛋白质表达的关键控制元件,RBS 序列的优化能够提高β-葡聚糖酶的产量[9−10]。此外,添加某些碳源或金属离子作为诱导剂或调节剂能够调节酶的合成,提高酶的产量[11],Adeoyo 等[12]研究了钠、钾、锌、锰、钴等金属离子对真菌产内切葡聚糖酶的影响,发现添加钠离子和钾离子的培养基能有效提高内切葡聚糖酶的分泌,而钴离子则会显著降低其分泌,这表明添加金属离子将对代谢调控的作用机制产生影响,其中部分金属离子能够作为提高内切葡聚糖酶分泌的产酶促进剂,但具体的机制尚不明确。

图1 提高β‐葡聚糖酶产量的措施Figure 1 Measures for increase of β-glucanase yield
2 β-1,3-葡聚糖内切酶的制备
目前,通过从自然界中大量筛选的方法获得更多具有高酶活性和稳定性的β-葡聚糖酶以及高产的菌株是一种有效的办法,但因其低产率、低酶活性等原因,具有一定的局限性,利用基因修饰、异源表达以及固定化方法能够获得高稳定性、高酶活性的β-1,3-葡聚糖内切酶,也是目前科研人员较为常用的方法。结合现有研究归纳,图2 列出了目前β-葡聚糖酶的主要研究方向[13−39]。
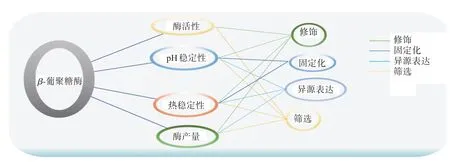
图2 β‐葡聚糖酶的主要研究方向Figure 2 Main research directions of endo-β-1,3 glucanase
2.1 β-1,3葡聚糖内切酶的来源及筛选
通过对大分子葡聚糖的降解或修饰,能够明显改善葡聚糖的溶解性和提高生物活性[40]。传统的低分子量β-葡聚糖生产方法主要是对葡聚糖β-糖苷键进行物理、化学和酶降解。通过降解的方法得到的产物,其基本结构单元并未发生改变,只是聚合度发生了变化,因而生物活性也未被破坏[41]。利用β-葡聚糖的酶法生物降解具有较高的专一性,能够选择性地切断糖苷键,反应条件较为温和,是一种较为理想的生产低分子量葡聚糖的方法,具有较高的研究和应用价值。表1列举了10种不同微生物来源的β-1,3-葡聚糖内切酶,介绍了其分子量大小、切割的糖苷键类型、不同底物以及对应的酶活性。目前,通过从自然界中筛选性能优良的生物菌株是获得具有高产量、高活性和热稳定性β-1,3-葡聚糖内切酶的一种重要手段。在大自然这种独特而复杂的进化环境中,野生菌株的筛选始终是不可或缺的。
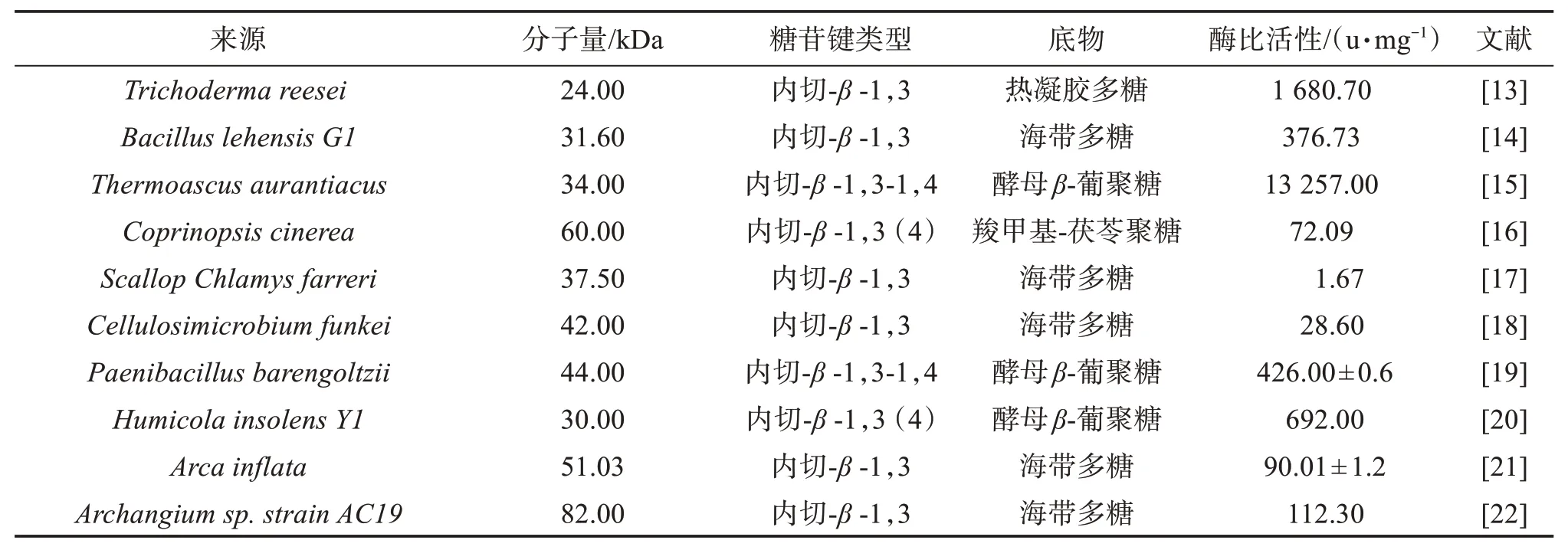
表1 不同微生物来源的β-葡聚糖酶的酶学特性Table 1 Enzyme properties of β-glucanase from different sources
2.2 β-1,3-葡聚糖内切酶的修饰
基因修饰和化学修饰是目前较为有效的酶改造方法,通过改变β-葡聚糖酶的编码序列或在蛋白质结构中引入不同的基团,在一定程度上能提高β-葡聚糖酶的活性、pH 稳定性和耐热性,从而提高其利用率,降低酶的使用成本。Gao 等[23]利用易错PCR 方法对β‐1,3‐葡聚糖酶基因BGN13.1a进行突变,并将突变后的基因导入宿主菌株。筛选出的突变酶具有更高的pH 稳定性和耐热性,以热凝胶多糖为底物时,其酶活性提高了1.15 倍。Miao 等[24]利用从极端嗜热古细菌(Hyperthermophile)得到的C2模块插入到内切β-1,4-葡聚糖酶CMCase-I 蛋白的N 端或C 端,产生C2-CMCase-I,CMCase-I-C2 和C2-CMCase-I-C2。研究发现,C2-CMCase-I在50°C时活性减少一半所需时间是野生型CMCase-I 的1.53 倍,这是因为C2-CMCase-I 产生了一个新的β折叠结构,从而增强了酶的耐热性。Lee JM 等[25]则通过将碱基序列上特定的氨基酸替换为疏水基团,实现β-葡聚糖酶活性和热稳定性的提高。研究人员将赖氨酸(Lys)和丙氨酸(Ala)或亮氨酸(Leu)进行替换后,经过热力学和动力学参数的比较,发现突变型酶相比野生型酶在酶活性和热稳定性都有不同程度的提高(图2)。
2.3 β-1,3-葡聚糖内切酶的异源表达
天然途径获得β-葡聚糖酶,产量通常较低。通过在合适的微生物宿主中进行异源表达β-葡聚糖酶,可以显著提高其产量,有利于降低生产成本,并推动其工业化应用。 例如,Borshchevskaya 等[26]从短小芽孢杆菌(Bacillus pumilus Meyer and Gottheil)提取了一个内切β-l,3(4)-葡聚糖酶的基因bgl1,并以毕赤酵母为宿主进行表达。不仅提高了产量,还使重组蛋白bgl1 的活性和稳定性都有较大提高。Gao 等[27]在绵羊瘤胃微生物群中分离出2 个新的葡聚糖酶基因IDSGluc5-26 和IDSGluc5-37,通过大肠杆菌进行异源表达后,其中IDSGLUC5-26在酸性条件下表现出相当大的稳定性,IDSGLUC5-37 对大麦β-葡聚糖表现出比原菌株更高的活性。Zhou 等[28]同样以毕赤酵母(Pichia pastoris)为异源宿主,将从炭疽杆菌(Bacillus anthracis)分离得到的β-葡聚糖酶基因CoCel5A进行异源表达。研究发现,内切葡聚糖酶CoCel5A在55°C 温度下具有更高的热稳定性。上述研究表明,通过异源宿主的代谢表达后,不仅能够提高β-葡聚糖的产量,还能在一定程度上提高酶的活性和热稳定性,因此宿主菌株的选择也十分重要(图2)。
目前,常用的异源宿主细胞包括大肠杆菌(Escherichia coli)和毕赤酵母,其中毕赤酵母是目前最为成功的真核蛋白表达系统之一,具备高效启动子、翻译后的修饰能力、高分泌效率、低培养成本、成熟的发酵工艺和易于扩大培养等优点,适合用于工业化生产[29]。然而,构建高效的底盘宿主细胞仍存在4 个主要的挑战,包括基因生产模块的识别,如何选择最合适的宿主细胞进行改造,重建和优化复杂的代谢网络以及如何高效分泌所需产品[30]。因此,今后的研究重点将集中在如何筛选和优化异源表达宿主及其培养条件,构建高效的β-葡聚糖酶表达系统也将会是研究的重点。总之,随着对异源表达机制的研究深入,人们必将找到更加有效的方法来提高β-葡聚糖酶的产量,优化其催化性能,从而实现β-葡聚糖酶产业化应用。
2.4 β-1,3-葡聚糖内切酶的固定化
酶的固定化技术是指通过物理或化学的方法将游离酶束缚在一定空间或固定在不溶性载体上,从而限制游离酶自由流动并使其能长时间发挥催化作用,同时可以进行回收利用的一种生物技术[31]。而酶降解方法具有一些不利的缺点,包括对苛刻的环境条件敏感、再生以及再循环过程中的困难。固定化能够帮助酶克服恶劣条件,并在工业生物技术领域发挥重要的作用[32−33]。固定化β-葡聚糖酶,可以提高其稳定性、催化效率和可重复使用性。此外,固定化β-葡聚糖酶还能在不同反应条件下的应用,并以高催化活性工作,减少酶促降解过程的预算,从而提高其应用范围和效率[34−35]。华承伟等[36]利用环氧型SEPABEADS EC 载体对β‐1,3‐葡聚糖酶进行共价固定化后,与游离酶相比,热稳定性和pH值稳定性均有明显提高。El-Shora等[37]则使用卡拉胶和壳聚糖进行交联固定化,不仅稳定性有了提高,而且便于回收重复利用。研究人员还利用固定化的β-葡聚糖酶制备低分子量的大麦β-葡聚糖,而且在重复利用10次之后,其酶活性仍具有初始酶活的42%[38]。以上实验证明,固定化β-葡聚糖酶在低分子量葡聚糖的生产上有着巨大的优势,能够有效解决β-葡聚糖酶的重复利用的问题,产生可观的经济效益(图2)。此外,随着酶固定化的纳米载体、金属有机骨架材料以及定向修饰固定技术的发展[39],β-葡聚糖酶的工业化应用获得了巨大的机会,也成为当前科学家研究的热点领域。
3 β-1,3-葡聚糖内切酶在低分子量葡聚糖制备中的应用
目前,β‐1,3‐葡聚糖内切酶已经在食品、农业等领域都有了较为广泛的应用,包括对果蔬进行抗真菌处理、制备酵母原生质体、清除生物被膜以及制备低分子量葡聚糖[42]。低分子量葡聚糖因其具有抗氧化及抗肿瘤等生物活性,而受到各国科研学者的广泛关注。
3.1 低分子量β-葡聚糖的研究现状
目前尚无关于低分子量葡聚糖的明确定义。根据现有文献报道,与分子量达到十万、百万级别的葡聚糖相比,低分子量葡聚糖的分子量通常在几百或几千Da之间[43−44]。根据我国2016版《战略性新兴产业重点产品和服务指导目录》指出,微生物多糖是生物行业中重要的开发产品。低分子量葡聚糖的生物活性目前是研究的热点,不同分子量的β-葡聚糖具有不同的生物活性,在许多领域有着广泛的应用。图3总结了低分子量葡聚糖的多种生物活性及其在不同领域的应用。例如裂褶多糖(schizo‐phyllan,SPG)是一种非离子型的水溶性高聚葡萄糖,以1,3-β-D‐吡喃葡萄糖单元为主链,β-1,6 糖苷键为支链。 在高分子量时,SPG 具有极高的黏度,抑制了其生物活性,而低分子量的SPG 具有明显的免疫调节活性,相较于高分子量SPG,低分子量的SPG 能更显著地促进人体特异性免疫反应和相关细胞因子的释放[45−46]。此外,不同分子量的葡聚糖对人体健康状态产生不同的影响[47]。例如,不同分子量的燕麦β-葡聚糖会导致粪便中胆汁酸含量的变化,高分子量的燕麦β-葡聚糖会增加粪便中胆汁酸的含量,而低分子量的则相反。粪便中胆汁酸过多是腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)的发病机制之一,显然,低分子量的燕麦β-葡聚糖对于维护肠道健康具有积极意义[48−49]。此外,低分子量β-葡聚糖还具有抗氧化性、保湿、抗肿瘤、抗菌等[50−51]生物活性,已经逐步应用于日用品、化妆品、生物医药、农业肥料等领域,成为研究的热点领域。通过降解法得到的低分子量β‐1,3‐葡聚糖具有独特的生理生化活性而吸引了各国研究人员的广泛关注。
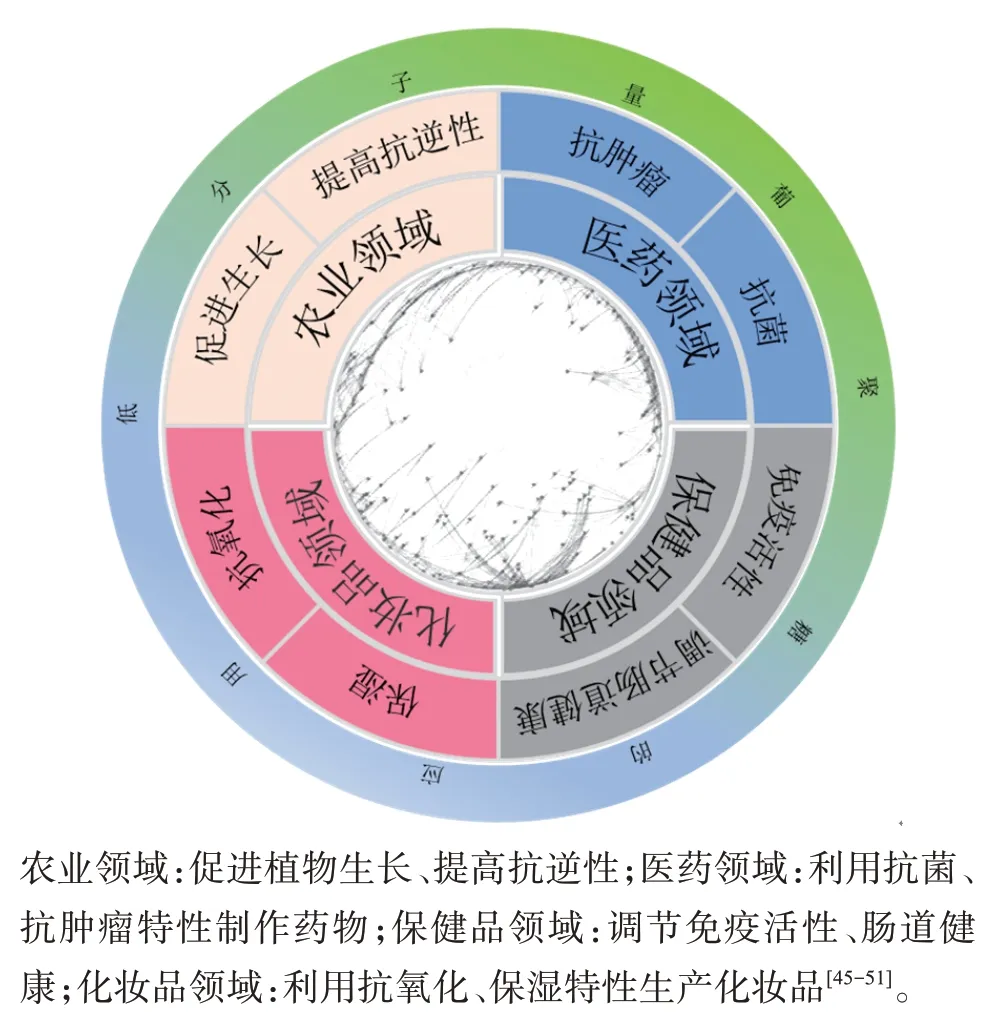
图3 低分子量葡聚糖在不同领域的应用Figure 3 Application of low molecular weight glucan in different fields
3.2 低分子量葡聚糖的制备方法
目前,国内外制备低分子量葡聚糖的研究主要集中在物理、化学和酶降解方面。物理降解一般通过超声或其他物理条件对高分子的葡聚糖溶液进行处理,从而获得低分子量的葡聚糖。例如,Liang等[52]通过超声的方式获得了较低分子量的热凝胶多糖,并显著提高了其溶解度。但物理降解法产率相对较低,生产成本较高,难以进行大规模生产[4]。化学降解则使用盐酸、硫酸以及过氧化氢等试剂[53−54],通过断裂糖苷键的方式得到低分子量葡聚糖。研究人员将酵母β-葡聚糖溶于45%的硫酸溶液中,经过3 h 的酸处理后,得到了低分子量的酵母β-葡聚糖,并提高了其水溶性[55]。由于化学降解通常需加入强酸、强碱或强氧化性的化学溶剂使分子间的糖苷键断裂,在过程中会产生大量的有机废液,造成环境污染,也不利于工业化生产。在另一项研究中,Duan 等[56]则利用酶降解的方法将海带多糖进行水解,获得了分子量在360~900 Dal 的低分子量海带多糖。酶降解是利用发酵获得的多糖或直接使用多糖粉末制成水溶液,然后加入β-葡聚糖进行水解,经过分离提纯等一系列步骤后,最终完成低分子量葡聚糖的制备(图4)。酶解法具有温和高效及低污染的特点,但其制备的工艺还有待进一步优化,产生更大的经济效益。
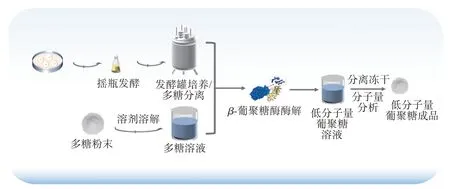
图4 低分子量葡聚糖制备的一般流程Figure 4 General procedures for the preparation of low molecular weight glucan
3.3 低分子量葡聚糖的酶解法制备工艺优化
酶解反应是现阶段制备低分子量葡聚糖的较为理想方法。但通过单一菌株发酵产生多糖后,再利用β-葡聚糖解进行酶解制备寡糖的方法往往效率低。由于葡聚糖的水不溶性,水解酶无法充分发挥作用然而,微生物共培养的出现很大程度上为这些问题提供了解决方案。共培养是指2 个或2 个以上不同有机体在自然或合成培养基中共同生长的一种生物系统[58]。通过共培养发酵,能在产生高分子β-葡聚糖的体系中,同时由另一种微生物产生β-葡聚糖酶来对前者进行酶解,这既能够有效克服直接利用酶水解多糖时效率不高的问题,同时还能在一定程度上降低生产成本、简化操作和缩短生产周期等。 例如,Wu 等[59]将能够分泌内切β‐1,3-葡聚糖酶的哈茨木霉(Trichoderma ha.zianum)分别与分泌硬葡聚糖的齐整小核菌(Sclerotium rolfsii)以及分泌裂褶多糖的裂褶菌(Schizophyllum commune Fr.)进行共培养,成功建立了利用哈茨木霉的共培养体系,最终得到了分子量为850~2 000 Da 的低分子量硬葡聚糖和分子量为850~2 500 Dal 的低分子量裂褶多糖。Gao 等[60]则将来自哈茨木霉的内切β‐1,3‐葡聚糖酶基因通过毕赤酵母进行表达,然后与能产生热凝胶多糖的农杆菌(Agrobacterium)建立共培养体系,当毕赤酵母和农杆菌的接种比(菌种含量或浓度)为2∶1 时,在7 L 发酵罐中达到的最高产率达到了18.77 g/L,并且得到了分子量为500~1 700 Da的低分子量热凝胶多糖。
与传统生产工艺相比,共培养发酵步骤相对简单且效率更高,有望能够取代传统的生产步骤。然而,目前共培养发酵还存在一些问题,例如两种微生物的接种比例、接种时间以及底物是否适合多种微生物的生长共培养等[61−62]。而且系统的微小变化可能会改变整个微生物系统的行为,破坏协同平衡的稳定状态,导致产品损失[63]。这需要更加灵敏的实时监控设备,例如尝试使用拉曼光谱生物过程分析系统监控发酵进程。另外,可以利用合成生物学和代谢工程的方法对所需要的共培养菌株进行修饰,以提高它们个体的能力以及对底物的利用[61]。
4 展望
综上所述,低分子量的β-葡聚糖因其独特的生理活性,受到了越来越多科研人员的关注。然而,生产过程中存在的各种问题严重限制了其工业化生产和商业化。在低分子量葡聚糖的工业化生产中,酶解法具有温和、高效以及不污染环境等特点,展现出独特的优势。因此,开发具有高酶活性、高热稳定性和高pH 耐受性的β-葡聚糖酶成为解决问题的关键。目前,β-葡聚糖酶的产酶菌株的筛选和β-葡聚糖酶基因的修饰和异源表达都取得了一定的进展。采用酶的理性设计和定向进化能够为高活性的β‐1,3-葡聚糖酶的制备奠定基础,因为催化口袋中氨基酸的结构改变可能增强酶与底物的相互作用,从而间接提高了β‐1,3‐葡聚糖酶的活性。此外,Cas9 技术与合成生物学的结合为β‐1,3-葡聚糖酶在宿主菌中增强表达提供了强大的助力。由于酵母、枯草芽孢杆菌等表达系统可使β‐1,3-葡聚糖酶胞外分泌,将更利于β‐1,3-葡聚糖酶分离纯化,提高葡聚糖酶的产量。然而,这仍然不能满足医药化工等多个领域应用的需求。可以预期,随着合成生物学、系统生物学、基因组学以及代谢工程等技术的发展,对β-葡聚糖酶代谢调控机制的研究将进一步深入,低分子量葡聚糖的生产技术将取得实质性突破。

