清化肠饮对结肠炎相关结直肠癌小鼠及其肠道屏障功能的影响
危水香 张歆 王晗 曾玲静 黄凯伦 游玲娜 吴异兰






〔摘要〕 目的 觀察清化肠饮对结肠炎相关结直肠癌(colitis-associated colorectal cancer,CAC)小鼠及其肠道屏障功能的影响。方法 将40只C57BL/6小鼠随机均分为空白组、模型组、清化肠饮组、阳性对照组。除空白组外,其余组均用氧化偶氮甲烷(azoxy?鄄methane,AOM)/葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)联合诱导建立CAC小鼠模型,清化肠饮组给予清化肠饮灌胃剂量为1.8 g/(kg·d);阳性对照组给予柳氮磺吡啶混悬液0.45 g/(kg·d);空白组给予等量无菌生理盐水灌胃。均干预8周。观察并记录小鼠一般情况、体质量、疾病活动指数(disease activity index,DAI)及肿瘤长度;采用HE染色法观察小鼠结直肠组织病理变化;采用Western blot法检测小鼠结直肠组织中闭合蛋白-1(Claudin-1)、咬合蛋白(Occludin)、带状闭合蛋白-1(ZO-1)蛋白表达水平。结果 模型组出现便血、脱肛等情况。与空白组相比,模型组、清化肠饮组、阳性对照组小鼠DAI评分明显升高(P<0.05或P<0.01)。与空白组相比,模型组、清化肠饮组、阳性对照组小鼠结直肠长度均缩短(P<0.01或P<0.05);与模型组比较,清化肠饮组与阳性对照组结直肠长度增长(P<0.01)。HE病理结果显示,模型组腺体高级别管状腺瘤形成,清化肠饮组存在低级别腺瘤和高级别瘤变。与空白组相比,模型组小鼠结直肠肿瘤组织中Claudin-1蛋白表达升高(P<0.01),Occludin、ZO-1蛋白表达水平降低(P<0.01);与模型组相比,清化肠饮组、阳性对照组Claudin-1蛋白表达水平降低(P<0.01),清化肠饮组、阳性对照组Occludin、ZO-1蛋白表达水平升高(P<0.05或P<0.01)。与清化肠饮组相比,阳性对照组Claudin-1蛋白表达水平降低(P<0.01),Occludin、ZO-1蛋白表达水平升高(P<0.01)。结论 清化肠饮可抑制CAC,其机制可能与改善肠道炎症反应、调节肠道屏障功能相关。
〔关键词〕 清化肠饮;结肠炎相关结直肠癌;肠道屏障;闭合蛋白-1;咬合蛋白;带状闭合蛋白-1
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.01.003
Effect of Qinghuachang Drink on mice with colitis-associated colorectal cancer and Intestinal barrier function
WEI Shuixiang1, ZHANG Xin2, WANG Han3, ZENG Lingjing1, HUANG Kailun1, YOU Lingna1, WU Yilan1*
1. Fujian University of Chinese Medicine, Fuzhou, Fujian 350122, China; 2. Clinical Skills Teaching Center, Fujian
University of Chinese Medicine, Fuzhou, Fujian 350122, China; 3. Department of Oncology, Fujian Medical University
Union Hospital, Fuzhou, Fujian 350001, China
〔Abstract〕 Objective To observe the effects of Qinghuachang Drink (QHCD) on the mouse model of colitis-associated colorectal cancer (CAC) and its intestinal barrier function. Methods Forty C57BL/6 mice were randomized into blank group, model group, QHCD group, and positive control group. Except for blank group, the rest groups were induced to establish a CAC model by azoxymethane (AOM)/dextran sulfate sodium salt (DSS). QHCD, positive control, and blank groups were given QHCD 1.8 g/(kg·d), sulfasalazine suspension 0.45 g/(kg·d), and the equal volume of sterile saline by gavage, respectively, for 14 d in succession. The general condition, body mass and disease activity index (DAI) of mice were observed and recorded; HE staining was used to observe the pathological changes in the colorectal tissue of mice; Western blot was used to determine the protein expression levels of Claudin-1, Occludin, ZO-1 in the colorectal tissue. Results The mice of model group had bloody stool and rectal prolapse. After intervention, the condition of mice in QHCD group was improved and the DAI score decreased (P<0.05 or P<0.01). The pathological results of HE showed that high-grade tubular adenomas formed in model group, and low-grade adenomas and high-grade neoplasia were present in QHCD group, indicating that QHCD could alleviate intestinal inflammation and delay the progression of canceration. Compared with blank group, the protein expression level of Claudin-1 in the colorectal tissue of mice in model group was higher (P<0.01), while the protein expression levels of Occludin and ZO-1 were lower (P<0.01); compared with model group, the protein expression level of Claudin-1 in the colorectal tissue of mice in both QHCD and positive control groups decreased (P<0.01), while the protein expression levels of Occludin and ZO-1 increased (P<0.05). Conclusion QHCD can inhibit CAC, and the mechanism may be related to alleviating intestinal inflammatory response and regulating intestinal barrier function.
〔Keywords〕 Qinghuachang Drink; colitis-associated colorectal cancer; intestinal barrier; Claudin-1; Occludin; ZO-1
炎癥性肠病(inflammatory bowel disease,IBD)是一组慢性非特异性肠道炎症性疾病,具有易复发、难治愈等特点。近年,我国IBD发病率呈现逐年上升趋势[1-2]。研究发现,与一般人群相比,IBD患者发生结直肠癌的风险显著增加[3]。目前,IBD的发病机制尚未完全明确,但研究发现机体肠道菌群失调,使得有害微生物增加,破坏肠道屏障,诱发炎症反应[4],长期患有IBD的患者更易发生结直肠癌[5],又称结肠炎相关结直肠癌(colitis-associated colorectal cancer,CAC)。
肠道屏障是抵御病原微生物进入机体的重要防线,肠道屏障功能障碍可能与紧密连接结构受损密切相关[6],Claudin、Occludin、ZO蛋白家族为紧密连接蛋白的主要组成结构。其中,咬合蛋白(Occludin)是第一个被人们发现定位于紧密连接的跨膜蛋白[7],为构成肠道屏障完整及调节通透性的重要分子蛋白。带状闭合蛋白-1(ZO-1)可与Occludin蛋白末端连接,相互作用维持肠道屏障的通透性与完整性[8]。闭合蛋白-1(Claudin-1)蛋白失调,可改变肠上皮细胞分化,并促进结肠炎发展,损害肠道修复能力[9]。因此,保护肠道屏障,促进肠道黏膜愈合,对治疗IBD患者、预防癌变至关重要。
IBD基本病机为湿热蕴结,气血不和[10]。当湿热久郁不化,则湿热蕴毒,癌毒内生。清化肠饮源于张景岳《景岳全书·新方八阵》中的清化饮。国医大师杨春波结合福建地理特点及饮食习惯,基于清化饮加减化裁,创制清化肠饮。清化肠饮具有清热化湿、散瘀止血之效,主要由仙鹤草、黄连、地榆炭、豆蔻等中药组成。临床观察发现,清化肠饮治疗IBD不良反应少,疗效显著[11]。
本研究通过氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)建立CAC小鼠模型,探讨清化肠饮对肠道屏障功能及抑制CAC的作用机制,为临床推广应用清化肠饮治疗CAC,提供实验依据。
1 材料
1.1 实验动物
SPF级C57BL/6小鼠40只,雄性,6~8周,体质量18~22 g,购于上海斯莱克实验动物有限责任公司[合格证书SCXK(沪)2022-004],饲养于福建中医药大学实验动物中心SPF级动物房,每笼5只,每只小鼠用耳号进行标记。依据国家标准啮齿类动物饲料常规饲养,保持环境清洁,专用饲料,自由摄食、饮水,每日给予12 h光照时间,室内温度(22±2) ℃,相对湿度50%~60%。每日更换饮水、添加饲料,隔日更换一次垫料。本研究已通过福建中医药大学实验动物伦理管理委员会审定(伦理编号:FJTCM IACUC 2022052)。
1.2 药物及制备
清化肠饮组成:仙鹤草20 g,茯苓20 g,地榆炭15 g,薏苡仁15 g,茵陈10 g,炒白扁豆10 g,佩兰10 g,赤芍10 g,姜厚朴6 g,豆蔻5 g,黄连3 g。中药饮片购自福建中医药大学附属第二人民医院中药房,制备成全成分中药配方颗粒剂。颗粒剂加入煮沸的蒸馏水,充分搅拌,根据给药剂量进行浓缩,置于4 ℃冰箱保存备用。阳性对照组采用柳氮磺吡啶,研磨成粉末状后,用网筛过滤颗粒,加入蒸馏水,置于4 ℃冰箱保存备用。
1.3 主要试剂及仪器
氧化偶氮甲烷(azoxymethane,AOM)(美国Sigma-Aldrich公司,批号:A5486);葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)(上海翌圣生物科技股份有限公司,批号:60316ES60);Occludin蛋白抗体(武汉博士德生物工程有限公司,批号:BM4832);Claudin-1蛋白抗体(武汉三鹰生物技术有限公司,批号:28674-1-AP)、ZO-1(武汉三鹰生物技术有限公司,批号:21773-1-AP);柳氮磺吡啶肠溶片(上海信谊天平药业有限公司,批号:H310209557)。
JXFTPRP-48型研磨机(上海净信实业发展有限公司);JID-17R型冷冻离心机(广州吉迪仪器有限公司);DYCP-31DN型电泳仪(北京六一生物科技有限公司);ND-100c型紫外可见分光光度计(杭州米欧仪器有限公司)。
2 方法
2.1 构建CAC小鼠模型及分组
本实验采用10 mg/kg AOM与2% DSS联合建立CAC模型[12-13]。C57BL/6雄性小鼠适应性喂养1周,采用随机数字表法分为空白组、模型组、清化肠饮组、阳性对照组,每组10只。剔除死亡或造模失败小鼠,按只数最少组,每组均随机抽取6只。除空白组外,其余3组第1周第1日进行腹腔注射10 mg/kg AOM;空白组同时给予等量生理盐水腹腔注射。第2周开始给予2% DSS自由饮用7 d,蒸馏水自由饮水14 d,3周为一个循环,共3个循环,9周,整个实验共11周。清化肠饮组饮用DSS 7 d后,开始灌胃,依据人与动物按体表面积折算的等效剂量比值进行计算[14]。临床上,清化肠饮用量以12 g/d来计算,成人剂量为0.2 g/(kg·d),计算出20 g小鼠剂量为1.8 g/kg。灌胃体积为0.1 mL/10 g,调整药物浓度为0.18 g/mL,得出小鼠清化肠饮灌胃剂量为1.8 g/(kg·d)。同理,按成人每日用量3 g,计算得出阳性对照组给予柳氮磺吡啶混悬液0.45 g/(kg·d)灌胃;空白组给予等量无菌生理盐水灌胃。
2.2 小鼠一般情况、体质量与疾病活动指数(disease activity index,DAI)评估
每日于同一时间点,观察小鼠的精神活动状态、皮毛光泽情况、饮食及大便形状等情况,每周固定时间测量并记录小鼠的体质量。计算DAI评分。DAI=(体质量指数+大便性状指数+便血指数)/3[15],总分范围为0~12分。根据状态进行赋分:体质量下降0%,大便性状正常,粪便隐血试验呈阴性,各计0分;体质量下降6%~10%,大便性状松散,粪便隐血试验呈阳性,各计2分;体质量下降大于15%,水样腹泻,肉眼血便,各计4分。
2.3 小鼠结直肠组织病理观察
小鼠禁食不禁水12 h后,摘取眼球取血后,脱颈处死,沿腹中线打开腹腔,剪取回盲部至结直肠末端的肠段,用4 ℃预冷的生理盐水清洗肠道,测量肠道长度。用眼科剪刀沿长轴方向剖开肠腔,置于白色背景下观察是否有肿瘤生成并拍照。取小鼠结直肠组织,置于10%甲醛溶液固定,石蜡包埋,切片,HE染色,置于显微境下进行病理学检查,观察各组结直肠组织癌变情况,并得出病理检查报告。
2.4 小鼠结直肠组织Claudin-1、Occludin、ZO-1蛋白表达检测
采用Western blot法检测小鼠结直肠组织Claudin-1、Occludin、ZO-1蛋白表达水平。取适量冻存小鼠结直肠组织,剪碎研磨,采用BCA蛋白定量试剂盒检测蛋白浓度,后电泳、转膜,加入含5%脱脂奶粉进行封闭后,4 ℃过夜孵育一抗,TBST洗涤(3次,10 min/次),孵育二抗室温2 h后,再次洗涤(3次,10 min/次)进行显色,该实验重复3次,以GAPDH为内参进行条带灰度值分析。
2.5 统计学方法
采用SPSS 26.0进行数据统计分析,符合正态分布的计量资料采用“x±s”表示,多组间比较采用单因素方差分析。重复测量资料,符合正态分布,方差齐时采用重复测量方差分析;不符合正态分布,采用非结构化的广义估计方程,统计图经GraphPad Prism 8.0绘制。以P<0.05表示差异具有统计学意义。
3 结果
3.1 清化肠饮对小鼠一般情况、DAI评分的影响
空白组小鼠毛色黝黑有光泽,精神状态正常,食物摄入量、饮水量均正常,无腹泻及便血情况发生。喂养DSS期间,模型组、清化肠饮组、阳性对照组小鼠均出现萎靡蜷缩,毛色稀疏欠光泽,食物摄入量与饮水量均有所减少。除空白组外,其余3组在DSS喂养3 d后,小鼠出现腹泻、便血,部分小鼠后期出现脱肛现象。
实验过程中,空白组小鼠体质量随时间稳步增加。模型组、清化肠饮组、阳性对照组小鼠在DSS喂养期间的第2、5、8周,与空白组小鼠相比,体质量均下降(P<0.01);在3轮循环中,恢复蒸馏水饮用的第3、6、9、10周,模型组、清化肠饮组、阳性对照组小鼠体质量上升,与空白组相比,3组小鼠体质量差异有统计学意义(P<0.05或P<0.01);与模型组相比,清化肠饮组与阳性对照组体质量差异无统计学意义(P>0.05)。详见图1。
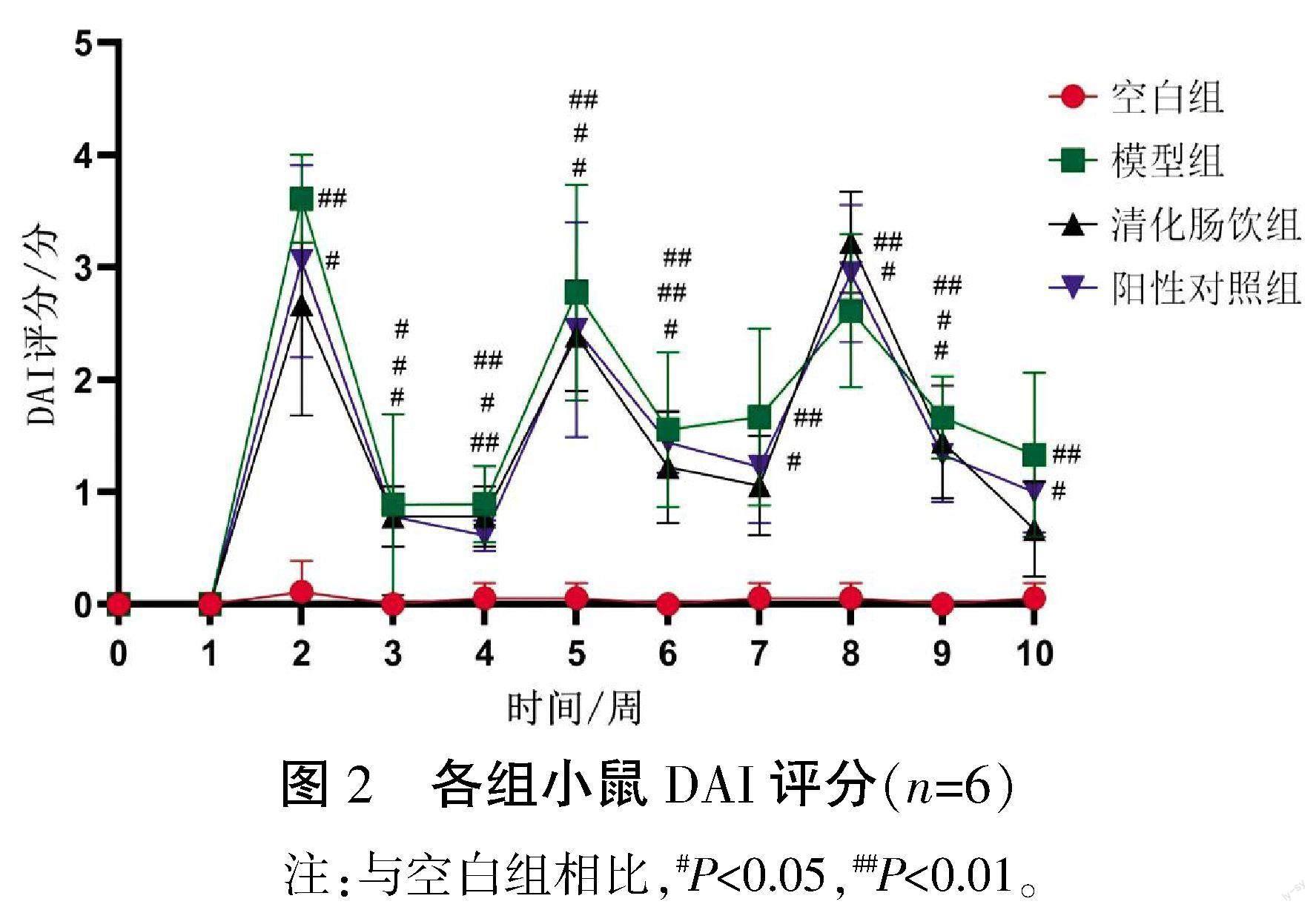
实验过程中,DAI评分结果显示:在3轮循环中,自由饮用DSS后,3组小鼠DAI评分均明显升高,经药物干预后,DAI评分逐渐下降。第2至10周,与空白组相比,模型组、清化肠饮组、阳性对照组小鼠DAI评分明显升高(P<0.05或P<0.01);与模型组相比,清化肠饮组、阳性对照组DAI评分差异无统计学意义(P>0.05)。详见图2。
3.2 清化肠饮对小鼠肿瘤生成及肠道长度的影响
除空白组外,其余3组小鼠可见肿瘤在肠道内以大小不一的息肉状向肠腔内突出隆起;与模型组相比,清化肠饮组与阳性对照组小鼠肿瘤数量减少。详见图3。
与空白组相比,模型组、清化肠饮组、阳性对照组小鼠结直肠长度均缩短(P<0.01或P<0.05);与模型组相比,清化肠饮组與阳性对照组结直肠长度增长(P<0.01);与清化肠饮组相比,阳性对照组结直肠长度增长(P<0.05)。详见图4。
3.3 清化肠饮对小鼠结直肠组织形态的影响
空白组小鼠结肠各层结构清晰,无明显异常,上皮细胞排列紧密,腺体及杯状细胞未见减少。与空白组相比,模型组小鼠周边腺体伴息肉样增生,腺体高级别管状腺瘤形成,伴可疑黏膜内腺体癌变,腺体背靠背,并融合成筛状,炎性细胞浸润,细胞失去极性,细胞核深染,伴异型。与模型组相比,清化肠饮组与阳性对照组癌变形成稍有减缓,形成低级别腺瘤。清化肠饮组周边腺体伴息肉样增生,杯状细胞增生,伴高级别瘤变,腺体背靠背,细胞核深染,拉长,略呈笔杆状。详见图5。
3.4 清化肠饮对小鼠结直肠组织Claudin-1、Occludin、ZO-1蛋白表达的影响
与空白组相比,模型组小鼠结直肠肿瘤组织中Claudin-1蛋白表达升高(P<0.01),Occludin、ZO-1蛋白表达水平降低(P<0.01);与模型组相比,清化肠饮组、阳性对照组Claudin-1蛋白表达水平降低(P<0.01),Occludin、ZO-1蛋白表达水平升高(P<0.05或P<0.01);与清化肠饮组相比,阳性对照组Claudin-1蛋白表达水平降低(P<0.01),Occludin、ZO-1蛋白表达水平升高(P<0.01)。详见图6、表1。
4 讨论
CAC是IBD最为严重的并发症之一,其发病过程呈现为“炎症-不典型增生-癌变”[16],防止IBD癌变是降低CAC发生率的有效方式之一。目前,IBD的西医药物治疗有一定的不良反应,费用较为昂贵[17-18],中医学在防治IBD的实践中积累了丰富的经验,也发挥了至关重要的作用[19]。
大腸湿热证为结直肠癌临床最常见的证型之一。大多数医家认为IBD病因为脾气亏虚,外加感受外邪等,使得脾虚酿湿生热,下注肠道,湿热互结,损伤肠络,而湿热久郁不化致湿热毒蕴,最终导致癌毒内生[20-21]。因此,清热化湿法为防治结直肠癌的主要治法之一。清化肠饮包括仙鹤草、茯苓、地榆炭、薏苡仁、茵陈、炒白扁豆、佩兰、赤芍、姜厚朴、豆蔻、黄连11味中药。仙鹤草、地榆炭收敛止血,黄连清热燥湿、泻火解毒为君药;赤芍活血凉血,豆蔻与姜厚朴理气共为臣药;茵陈清热化湿,佩兰芳香化湿,薏苡仁、炒白扁豆、茯苓健脾化湿,加强主药祛湿作用为佐使药。全方共奏清热化湿、散瘀止血之效。研究发现,清化肠饮联合灌肠Ⅲ号方可有效治疗溃疡性结肠炎,促进黏膜愈合[22]。本研究探讨清化肠饮对CAC小鼠炎癌反应及肠道屏障的影响。
本研究采用AOM/DSS联合应用构建CAC小鼠模型。该方案具有造模时间短、稳定性较强,且发病机制与人类相似等特点,是研究结直肠炎癌转化适合的模型方案[23]。为降低小鼠死亡率,本研究依据相关文献及预实验调节DSS浓度[24]。结果显示,造模后,小鼠出现萎靡、腹泻、血便及脱肛情况,解剖后发现肿瘤生成,表明该浓度可刺激小鼠发生炎症反应,促进炎癌转化。研究发现,清化肠饮可抑制促炎因子分泌,抑制核因子kB信号通路激活[25]。本研究结果显示,清化肠饮干预后,可改善小鼠结直肠长度缩短情况,降低DAI评分,且HE分析显示炎性浸润减轻。对各组小鼠结直肠进行肉眼观察及病理分析,发现模型组肿瘤明显,HE显示已形成高级别腺瘤,伴黏膜内腺体癌变,清化肠饮组存在低级别腺瘤伴高级别瘤变。以上结果表明清化肠饮可有效减轻肠道炎症反应,延缓癌变进展。
结肠炎发展过程中,刺激免疫细胞,从而释放大量促炎细胞因子,进一步触发免疫反应,损害上皮细胞紧密连接蛋白表达,破坏肠道上皮屏障[26]。细胞间紧密连接结构是肠道屏障功能的重要组成部分,由Occludin、Claudin和ZO-1等跨膜蛋白组成。紧密连接结构的异常改变,使得肠道通透性增强,屏障功能被破坏,将进一步促进促炎因子释放,炎症反应持续,引起癌变[27-28]。Occludin具有维持细胞间通透性,保持肠上皮细胞和紧密连接结构的保护作用。ZO-1是肠上皮细胞间的重要连接蛋白,对相邻细胞间的渗透,细胞增殖、分化及生长等具有重要作用。在正常肠道上皮中,Claudin-1参与维持上皮细胞极性,调节肠道屏障通透性,对人体肠道屏障具有保护功能[29]。研究发现,Claudin-1在IBD中表达上调,且炎性因子可诱导Claudin-1,促进肿瘤生长[30]。随着癌变的发展,其蛋白表达逐渐上调,在结直肠癌中呈现高表达[31]。ZO-1、Occludin蛋白在结直肠癌小鼠中呈现低表达[32]。ZO-1、Occludin蛋白表达上调,可抑制肿瘤的侵袭与增殖[33]。研究表明,清化肠饮可通过上调紧密连接蛋白Occludin、ZO-1的表达,恢复肠道黏膜屏障功能,抑制肠道炎症反应的发生发展[34]。研究结果与上述结果保持一致,清化肠饮干预后,Claudin-1的表达水平降低,Occludin、ZO-1的表达水平升高,表明清化肠饮可调节肠道紧密连接蛋白表达,从而促进肠道屏障功能恢复。
综上所述,清化肠饮可改善CAC小鼠模型结肠炎症状,延缓癌变进展,可能是通过调节小鼠肠道屏障中Claudin-1、Occludin、ZO-1紧密连接蛋白的表达,一定程度上恢复肠道屏障功能及完整性,抑制CAC的发展。前期研究表明,清化肠饮可有效治疗溃疡性结肠炎[22]。本研究为清化肠饮临床防治CAC提供了实验依据,并初步探讨其可能的机制,而清化肠饮对CAC的临床疗效及具体作用机制仍需进一步验证。
参考文献
[1] RAY K. The changing epidemiology of IBD[J]. Nature Reviews Gastroenterology & Hepatology, 2017, 14(12): 690.
[2] KAPLAN G G, WINDSOR J W. The four epidemiological stages in the global evolution of inflammatory bowel disease[J]. Nature Reviews Gastroenterology & Hepatology, 2021, 18(1): 56-66.
[3] WEIMERS P, ANKERSEN D V, LOKKEGAARD E, et al. Occurrence of Colorectal Cancer and the Influence of Medical Treatment in Patients With Inflammatory Bowel Disease: A Danish Nationwide Cohort Study, 1997 to 2015[J]. Inflammatory Bowel Diseases, 2021, 27(11): 1795-1803.
[4] ZHENG J Y, SUN Q R, ZHANG J W, et al. The role of gut microbiome in inflammatory bowel disease diagnosis and prognosis[J]. United European Gastroenterology Journal, 2022, 10(10): 1091-1102.
[5] BOPANNA S, ANANTHAKRISHNAN A N, KEDIA S, et al. Risk of colorectal cancer in Asian patients with ulcerative colitis: A systematic review and meta-analysis[J]. The Lancet Gastroenterology & Hepatology, 2017, 2(4): 269-276.
[6] CAPALDO C T, POWELL D N, KALMAN D. Layered defense: How mucus and tight junctions seal the intestinal barrier[J]. Journal of Molecular Medicine, 2017, 95(9): 927-934.
[7] FURUSE M, HIRASE T, ITOH M, et al. Occludin: A novel integral membrane protein localizing at tight junctions[J]. The Journal of Cell Biology, 1993, 123(6 Pt 2): 1777-1788.
[8] 谭 悦, 郑长清. 紧密连接蛋白occludin、ZO-1在溃疡性结肠炎中的表达及其临床意义[J]. 现代药物与临床, 2018, 33(7): 1803-1808.
[9] GOWRIKUMAR S, AHMAD R, UPPADA S B, et al. Upregulated claudin-1 expression promotes colitis-associated cancer by promoting β-catenin phosphorylation and activation in Notch/p-AKT-dependent manner[J]. Oncogene, 2019, 38(26): 5321-5337.
[10] 甄建华, 黄光瑞. 溃疡性结肠炎中医病名、病因、病机的古今比较和回顾[J]. 环球中医药, 2019, 12(8): 1286-1289.
[11] 陈锦团, 柯 晓, 傅肖岩, 等. 清化湿热为主治疗湿热型溃疡性结肠炎的临床研究[J]. 中国中西医结合消化杂志, 2009, 17(4): 256-258.
[12] 安 靜, 李晓宁, 赵博琛, 等. 当归超临界提取物对AOM/DSS诱导的小鼠炎症相关性结直肠癌的化学预防作用[J]. 中国中药杂志, 2014, 39(7): 1265-1269.
[13] OH N S, LEE J Y, KIM Y T, et al. Cancer-protective effect of a synbiotic combination between Lactobacillus gasseri 505 and a Cudrania tricuspidata leaf extract on colitis-associated colorectal cancer[J]. Gut Microbes, 2020, 12(1): 1785803.
[14] 阮叶萍. 药理学实验[M]. 杭州: 浙江大学出版社, 2022: 137.
[15] TAJASUWAN L, KETTAWAN A, RUNGRUANG T, et al. Inhibitory effect of dietary defatted rice bran in an AOM/DSS-induced colitis-associated colorectal cancer experimental animal model[J]. Foods, 2022, 11(21): 3488.
[16] LUO X, ZHENG Y, BAO Y R, et al. Potential effects of fructus aurantii ethanol extracts against colitis-associated carcinogenesis through coordination of Notch/NF-κB/IL-1 signaling pathways[J]. Biomedicine & Pharmacotherapy, 2022, 152: 113278.
[17] 张娇娇, 张 帆, 余星星, 等. 溃疡性结肠炎发病机制及中西医治疗研究进展[J]. 辽宁中医药大学学报, 2021, 23(1): 70-74.
[18] AL-BAWARDY B, SHIVASHANKAR R, PROCTOR D D. Novel and emerging therapies for inflammatory bowel disease[J]. Frontiers in Pharmacology, 2021, 12: 651415.
[19] 王奇瑞, 邵 菁. 中药方剂通过维持肠道菌群稳态治疗炎症性肠病的最新进展[J]. 中国中药杂志, 2022, 47(22): 5997-6004.
[20] 田 琳, 林翠丽, 孙月明, 等. 从湿热理论辨析炎-癌转化机制[J]. 北京中医药大学学报, 2021, 44(3): 215-220.
[21] 袁嘉嘉. “炎—癌转化”的病因病机及防治策略研究[D]. 南京: 南京中医药大学, 2016.
[22] 张 歆, 方文怡. 清化肠饮联合灌肠Ⅲ号方治疗湿热型溃疡性结肠炎33例[J]. 福建中医药, 2018, 49(4): 10-12.
[23] 苗晋鑫, 宋韶鹤, 李秀敏. 结直肠癌小鼠模型研究进展[J]. 中国实验动物学报, 2020, 28(2): 267-272.
[24] SCHEPELMANN M, KUPPER N, GUSHCHINA V, et al. AOM/DSS induced colitis-associated colorectal cancer in 14-month-old female balb/C and C57/Bl6 mice-a pilot study[J]. International Journal of Molecular Sciences, 2022, 23(9): 5278.
[25] KE X, HU G H, FANG W Y, et al. Qing Hua Chang Yin inhibits the LPS-induced activation of the IL-6/STAT3 signaling pathway in human intestinal Caco-2 cells[J]. International Journal of Molecular Medicine, 2015, 35(4): 1133-1137.
[26] VANCAMELBEKE M, VERMEIRE S. The intestinal barrier: A fundamental role in health and disease[J]. Expert Review of Gastroenterology & Hepatology, 2017, 11(9): 821-834.
[27] 娄文静, 刘冬妍. 肠道紧密连接跨膜蛋白研究进展[J]. 实用药物与临床, 2019, 22(11): 1214-1219.
[28] LONG A G, LUNDSMITH E T, HAMILTON K E. Inflammation and colorectal cancer[J]. Current Colorectal Cancer Reports, 2017, 13(4): 341-351.
[29] 金秀盈, 张建东, 仲立新. 紧密连接蛋白1和血管内皮生长因子C在结肠癌组织中的表达及其意义[J]. 中国肛肠病杂志, 2022, 42(11): 5-7.
[30] ZHU L G, HAN J, LI L, et al. Claudin family participates in the pathogenesis of inflammatory bowel diseases and colitis-associated colorectal cancer[J]. Frontiers in Immunology, 2019, 10: 1441.
[31] GOWRIKUMAR S, PRIMEAUX M, PRAVOVEROV K, et al. A claudin-based molecular signature identifies high-risk, chemoresistant colorectal cancer patients[J]. Cells, 2021, 10(9): 2211.
[32] 李倩倩, 陳 沉, 刘晓涵, 等. 纤维素对结直肠癌小鼠肠道屏障功能及炎症指标影响[J]. 青岛大学学报(医学版), 2021, 57(3): 445-449.
[33] ZHU D H, ZHOU J P, ZHAO J B, et al. ZC3H13 suppresses colorectal cancer proliferation and invasion via inactivating Ras-ERK signaling[J]. Journal of Cellular Physiology, 2019, 234(6): 8899-8907.
[34] FANG W Y, ZHAO P L, SHEN A L, et al. Effects of Qing Hua Chang Yin on lipopolysaccharide-induced intestinal epithelial tight junction injury in Caco-2 cells[J]. Molecular Med?鄄icine Reports, 2021, 23(3): 205.

