灯盏花素调节lncRNA NEAT1/miR-9-5p/SLC26A2 轴抑制哮喘模型小鼠气道炎症
王香英 魏金凤 田小辉 盛美玲 许如菊
哮喘是目前最常见的气道炎症性疾病之一,据中国肺健康研究报告(CPH)显示,我国成年人哮喘的总体患病率为4.2%[1]。灯盏花素是从传统中草药灯盏花中提取的类黄酮物质[2],能有效抑制哮喘而且无显著毒副作用[3],在过往研究中灯盏花素也被发现可以调节多种疾病的炎性环境[4]。本研究旨在研究灯盏花素对哮喘小鼠气道炎症反应的影响,并探讨相关分子机制。现报道如下。
1 材料与方法
1.1 实验动物 6~8 周雄性C57BL/6J 小鼠15 只,体质量(20±2)g,购买并饲养于杭州医学院实验动物中心,实验动物生产许可证号:SCXK(浙)2019-0002,实验动物使用许可证号:SYXK(浙)2019-0011。小鼠饲养于温度(23±2)℃,相对湿度45%~55%,12 h 明暗交替环境下,自由获取食物和水。动物护理和实验按照浙江省实验动物中心实验动物福利伦理委员会批准的协议进行操作(伦理批号:ZJCLA-IACUC-20040152)。
1.2 试 剂 灯盏花素购于昆明龙津药业股份有限公司(批号HB20190601)。NEAT1 荧光探针及Fluorescent in situ Hybridization 试剂盒(批号C10910)购自广州RiboRio 公司。MiniBEST 通用RNA 提取试剂盒(批号9767)、PrimeScript RT Master Mix 反转录试剂盒(批号RR036Q)、荧光定量PCR SYBR Premix Ex Taq(批号RR820B)购自日本Takara 公司。miRNA first-strand cDNA synthesis super-mix试剂盒(批号AT351-01)购自北京全式金公司。BCA蛋白检测试剂盒(批号A53225)、兔抗SLC26A2 一抗(批号PA5-110385)及氢氧化铝(批号21645-51-2)购自美国ThermoFisher Scientific 公司。上样缓冲液(批号P0015L)购自上海Beyotime Biotechnology 公司。白介素(IL)-5(批号EK0408)、IL-13(批号EK0425)、IL-17(批号EK0431)和人干扰素-γ(INFγ)(批号EK0375)酶联免疫吸附(ELISA)检测试剂盒购自广州BOSTER Technology 公司。Anti-Ovalbumin IgE(mouse)ELISA Kit(批号500840)购自美国Cayman Chemical 公司。苏木素-伊红(HE)染色试剂盒(批号G1120PI3K)及PBS 缓冲液(批号P1022)均购自北京索莱宝公司。OVA(批号138831-86-4)购自美国Sigma-Aldrich 公司。兔抗SLC26A2(批号ab308625)和GAPDH 一抗(批号ab9485)及异硫氰酸荧光素偶联的二抗IgG(批号ab6717)均购自英国abcam 公司。合成引物购自中国生工生物工程(上海)股份有限公司。
1.3 主要仪器 酶标仪(型号:VarioskanTMLUX)购自上海Thermo Labsystems 公司。显微镜(型号:AX10 imager A2)购自德国Carl Zeiss MicroImaging公司。蛋白电泳及转印系统(型号:Bio-Rad 1658033)购自美国伯乐公司。多重实时荧光定量PCR 仪(型号:Bio-Rad CFX384)、ECL 显影仪(型号:ChemiDoc XRS+System)购自美国伯乐公司公司。
1.4 方 法
1.4.1 哮喘模型小鼠构建及药物处理 按照随机数字表法,将小鼠随机数字表法分为三组:PBS 组(对照组)、OVA 组(哮喘模型组)、灯盏花素药物处理OVA 组(灯盏花素组),每组5 只。模型构建[5]:哮喘模型组及灯盏花素组小鼠分别在0、7、14 d 腹腔注射20 μg OVA 并加0.5 mg 氢氧化铝初步致敏。在第21 天开始鼻内滴饲40 μg OVA 刺激哮喘,每周3 次,持续6 周。给药方案:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1次,连续7 d;对照组及哮喘模型组小鼠则使用等体积0.9%生理盐水进行灌胃处理。末次给药24 h 后,脱颈处死小鼠,收集支气管肺泡灌洗液(BALF)以及肺组织以备后续实验。
1.4.2 肺组织HE 染色以及PAS 染色 在对各组动物模型处理48 h 后收集小鼠左侧肺叶组织。用HE染色测定组织差异浸润细胞数。炎性浸润细胞根据浸润程度分别用1、2、3、4 分进行评分[6]。用PAS 染色测定组织中杯状细胞的分布和数量。根据气道上皮中杯状细胞的百分比,使用改良的五点评分系统对杯状细胞增生程度进行量化:0 级(无杯状细胞)、1级(<25%)、2 级(25%~50%)、3 级(51%~75%)和4 级(>75%)[7]。
1.4.3 ELISA 实验 各组小鼠动物模型处理48 h 后收集BALF。使用商品化试剂盒测定BALF 中IL-5、IL-13、IL-17 和IFN-γ 的水平。血清OVA 特异性IgE 使用Anti-Ovalbumin IgE(mouse)ELISA kit 进行检测。使用酶标仪在450 nm 处检测吸光度。
1.4.4 BALF 细胞学检测 使用Wright-Giemsa 染液对细胞进行染色并在显微镜下对细胞进行计数。针对于总细胞数、中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞,在计数时从显微镜下选择5 个视野进行计数。
1.4.5 荧光原位杂交实验 针对于NEAT1 在肺组织中的荧光原位杂交实验,cy3-标记的NEAT1 探针被合成后。根据Fluorescent in situ Hybridization Kit的说明书进行RNA 荧光原位杂交实验。使用AX10 imager A2 显微镜进行可视化。
1.4.6 实时荧光定量PCR 实验(qRT-PCR) 我们使用MiniBEST 通用RNA 提取试剂盒提取总RNA。使用PrimeScript RT MasterMxi 试剂盒反转录cDNA。进一步地,miRNA 的反转录cDNA 使用miRNA first-strand cDNA synthesis super-mix 试剂盒。使用SYBR Premix Ex Taq 试剂进行qRT-PCR 实验。使用Applied Biosystems 7900 real-time PCR system进行检测。SLC26A2 和NEAT1 的表达水平以GAPDH 作为内参。miR-9-5p 的表达水平以U6 作为内参。SLC26A2 引物序列:F:5'-TTCCTGTCTTTGCTCCTCCGTAAG-3';R:5'-GTTCACTTCCAATCACTGCTGCTC-3'。NEAT1 引物序列:F:5'-AAGCAGATGGCACCAGGAGATATG -3';R:5' -TTCACTGTGTAGGCGTCAACCG-3'。MiR-9-5p 引物序列:F:5'-GAGCGCGTCTTTGGTTATCTAGC -3';R:5' -ATCCAGTGCAGGGTCCGAGG-3'。GAPDH 引物序列:F:5'-GGCAAATTCAACGGCACAGTCAAG-3';R:5'-TCGCTCCTGGAAGATGGTGATGG-3'。U6 的引物为:F:5'-CTCGCTTCGGCAGCACA -3';R:5' -AACGCTTCACGAATTTGCGT-3'。使用2-ΔΔCt方法计算相对表达量结果。
1.4.7 免疫印迹分析(Western blot) 实验 对于Western blot 实验,使用BCA 蛋白检测试剂盒测定蛋白质的浓度。将一定量的蛋白与上样缓冲液混合,煮沸15 min 在SDS-PAGE 电泳后转移到PVDF 膜上。用一抗检测印迹。一抗包括SLC26A2 和GAPDH。4 ℃过夜孵育一抗,二抗孵育90 min。通过化学发光法(ECL)检测蛋白表达,以GAPDH 为内参。
1.5 统计学方法 应用Graphpad Prism 8.0(GraphPad Software,美国)软件对实验结果进行统计学分析,每组实验重复3 次,符合正态分布的计量资料以均数±标准差(±s)表示,两组或多组间比较采用独立样本t 检验或单因素方差分析。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 灯盏花素抑制哮喘模型小鼠BALF 中炎性细胞的数量 与对照组小鼠比较,哮喘模型组BALF 中炎性总细胞数、中性粒细胞及巨噬细胞数量均显著升高(P<0.01)。而饲喂灯盏花素则会抑制哮喘模型小鼠上述炎性细胞数量(P<0.05 或P<0.01),见表1。
表1 灯盏花素抑制哮喘模型小鼠BALF 中炎性细胞的数量(×104/mL,±s)

表1 灯盏花素抑制哮喘模型小鼠BALF 中炎性细胞的数量(×104/mL,±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;BALF 为支气管肺泡灌洗液;与对照组比较,aP<0.01;与哮喘模型组比较,bP<0.05,cP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555炎性总细胞17.71±3.14 68.32±7.25a 52.10±7.59b中性粒细胞0.72±0.15 5.50±0.58a 4.21±0.54b巨噬细胞2.70±0.61 13.02±1.04a 3.61±0.28c淋巴细胞4.13±0.53 23.07±2.90a 9.52±1.23c嗜酸性粒细胞1.63±0.22 22.13±2.21a 8.87±1.33c
2.2 灯盏花素调节哮喘模型小鼠肺组织形态 HE结果显示,与对照组比较,哮喘模型组小鼠组织的上皮细胞明显脱落、平滑肌增生、气道壁增厚而炎性细胞浸润程度显著升高(P<0.01)。与哮喘模型组比较,灯盏花素组小鼠的组织平滑肌增生及炎性细胞浸润程度均得到改善(P<0.01)。PAS 结果显示,与对照组比较,哮喘模型组小鼠组织中气道黏液分泌增多,杯状细胞增生,PAS 评分升高(P<0.01)。相对于哮喘模型组,灯盏花素组小鼠组织气道黏液减少,杯状细胞减少,PAS 评分降低(P<0.01)。见图1,表2。

图1 各组小鼠肺组织形态观察及炎性细胞浸润评估(HE 染色,PAS 染色,×400)
表2 灯盏花素抑制哮喘模型小鼠组织学评分(分±s)

表2 灯盏花素抑制哮喘模型小鼠组织学评分(分±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;PAS 为过碘酸雪夫染色;与对照组比较,aP<0.01;与哮喘模型组比较,bP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555炎性细胞浸润程度评分0.26±0.04 2.49±0.25a 1.46±0.15b PAS 评分0.26±0.08 2.24±0.16a 0.58±0.07b
2.3 灯盏花素抑制哮喘模型小鼠血清IgE 水平并调节BALF 炎症因子水平 与对照组比较,哮喘模型组小鼠的血清IgE 及BALF 中IL-5、IL-13、IL-17 水平均显著提高(P<0.05 或P<0.01),而IFN-γ 水平显著下降(P<0.01)。灯盏花素则会显著抑制血清IgE 及BALF 中IL-5、IL-13、IL-17 水平而促进IFN-γ 水平(P<0.05 或P<0.01),见表3。
表3 灯盏花素对哮喘模型小鼠血清IgE 和BALF 中炎症因子水平的影响(±s)

表3 灯盏花素对哮喘模型小鼠血清IgE 和BALF 中炎症因子水平的影响(±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;IL-5 为白细胞介素5;IL-13 为白细胞介素13;IL-17 为白细胞介素17;INF-γ 为干扰素γ;与对照组比较,aP<0.05,bP<0.01;与哮喘模型组比较,cP<0.05,dP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555血清IgE(IU/mL)1.02±0.08 3.52±0.32b 1.83±0.14d IL-5(pg/mL)54.56±3.35 154.48±9.27b 78.25±4.44d IL-13(pg/mL)79.18±3.34 96.86±6.45a 59.34±5.32d IL-17(pg/mL)73.32±4.15 185.24±7.24b 125.60±5.88d INF-γ(pg/mL)84.76±2.91 48.46±3.81b 65.48±4.49c
2.4 灯盏花素抑制哮喘模型小鼠肺组织中lncRNANEAT1 的表达 使用qRT-PCR 和荧光原位杂交实验检测了各组小鼠肺组织中NEAT1 的表达情况。结果发现,哮喘模型组小鼠肺组织中NEAT1 的表达显著上调(P<0.01),而灯盏花素则显著抑制哮喘模型小鼠肺组织中NEAT1 的表达(P<0.01)。见表4,图2。
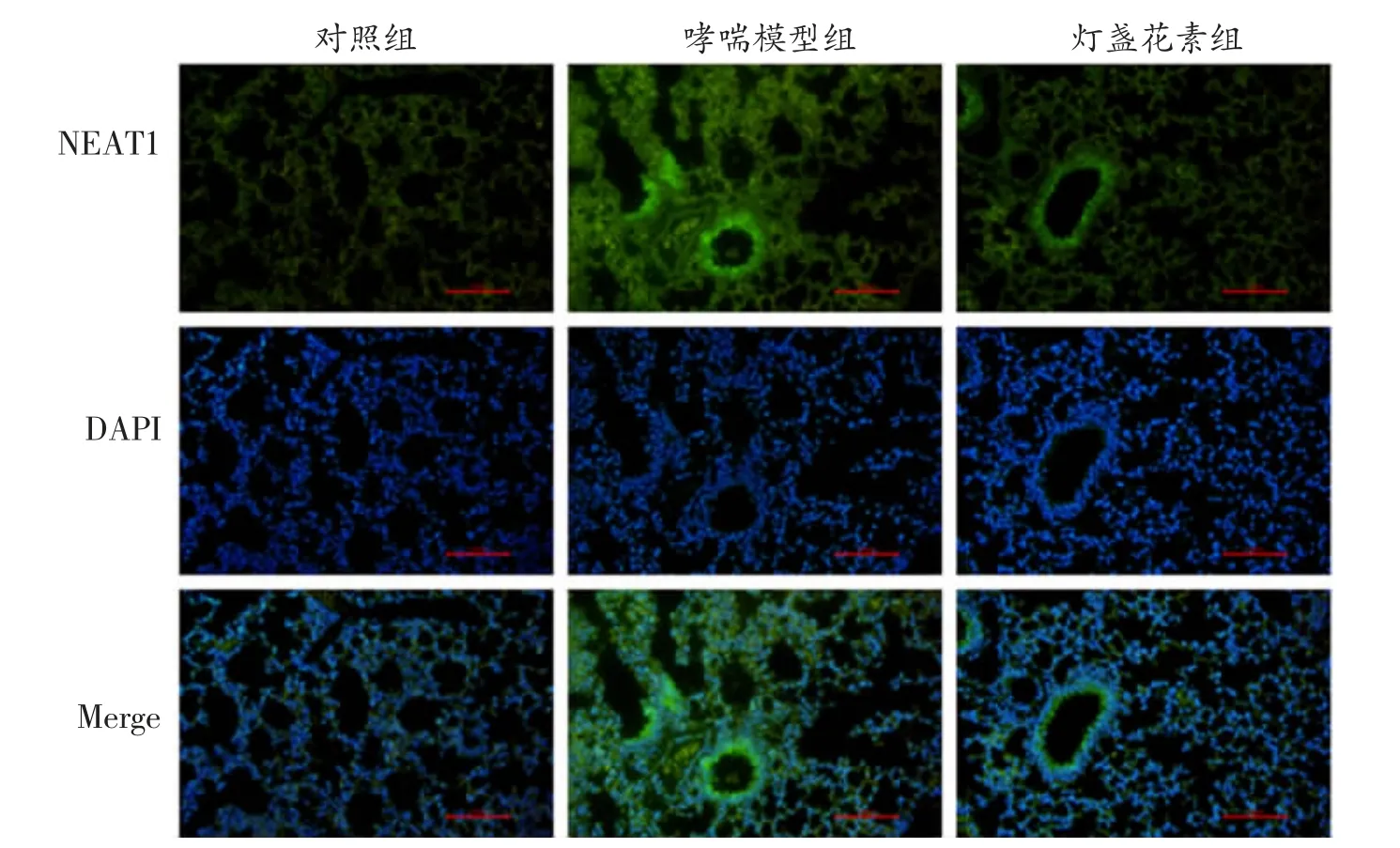
图2 灯盏花素抑制哮喘模型小鼠肺组织中lncRNA-NEAT1 的表达(荧光原位杂交,×200)
表4 灯盏花素对哮喘模型小鼠肺组织lncRNA-NEAT1表达的影响(±s)

表4 灯盏花素对哮喘模型小鼠肺组织lncRNA-NEAT1表达的影响(±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;与对照组比较,aP<0.01;与哮喘模型组比较,bP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555 NEAT1 相对表达量1.00±0.15 3.96±0.32a 1.82±0.28b
2.5 灯盏花素促进哮喘模型小鼠肺组织miR-9-5p表达并抑制SLC26A2 表达 通过表达量检测发现,哮喘模型组小鼠肺组织中miR-9-5p 的表达相对于对照组显著下调(P<0.01),而灯盏花素则会促进哮喘肺组织中miR-9-5p 的表达(P<0.01)。SLC26A2 的表达趋势则与miR-9-5p 相反,其在哮喘模型组小鼠中高表达而在灯盏花素组小鼠肺组织中显著低表达(P<0.05 或P<0.01)。见表5-6、图3。
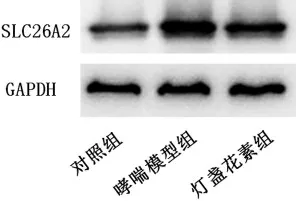
图3 灯盏花素对哮喘小鼠肺组织SLC26A2 蛋白表达的影响注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水
表5 灯盏花素对哮喘模型小鼠肺组织中miR-9-5p和SLC26A2 mRNA 表达的影响(±s)

表5 灯盏花素对哮喘模型小鼠肺组织中miR-9-5p和SLC26A2 mRNA 表达的影响(±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;与对照组比较,aP<0.01;与哮喘模型组比较,bP<0.05,cP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555 miR-9-5p 相对表达量1.00±0.09 0.48±0.07a 0.67±0.06b SLC26A2 mRNA 相对表达量1.00±0.08 3.91±0.32a 2.00±0.23c
表6 灯盏花素对哮喘模型小鼠肺组织中SLC26A2 蛋白表达的影响(±s)

表6 灯盏花素对哮喘模型小鼠肺组织中SLC26A2 蛋白表达的影响(±s)
注:灯盏花素组小鼠在哮喘模型构建完成后使用10 mg/kg 灯盏花进行灌胃处理,每天1 次,连续7 d;对照组和哮喘模型组小鼠灌胃等量生理盐水;与对照组比较,aP<0.01;与哮喘模型组比较,bP<0.01
组别对照组哮喘模型组灯盏花素组鼠数555 SLC26A2 蛋白相对表达量0.87±0.09 1.50±0.10a 1.08±0.12b
3 讨 论
目前多种衍生药物被证实对于治疗哮喘小鼠气道炎症反应具有良好的作用。例如传统中药剑花提取物被发现可以抑制过敏性哮喘小鼠模型的气道炎症反应[8];人参皂苷Rg3 也被发现对于改善哮喘小鼠气道炎症及氧化应激反应具有很好的效果[9]。作为从灯盏花提取物的关键成分,灯盏花素已被证实对于呼吸性相关疾病的治疗有一定效果[10]。在一项灯盏花素治疗支气管哮喘的临床研究中,研究者也发现使用灯盏花素针粉剂对患者进行治疗不仅有明显的疗效而且没有明显的副作用[11]。本研究从气道炎症反应出发明确灯盏花素对哮喘模型小鼠气道炎症的抑制作用及其分子机制。
在哮喘发展的过程中炎症因子及炎症细胞的变化是反映疾病进展的重要指标之一。为了深入研究灯盏花素对哮喘发展过程的影响,本研究首先建立了OVA 诱导的哮喘模型小鼠,随后从多个指标角度进探索。研究结果证明,灯盏花素处理后小鼠BALF中的炎性细胞总数、中性粒细胞数、巨噬细胞数、淋巴细胞数、嗜酸性粒细胞数均显著下降;肺组织中炎性细胞浸润水平和PAS 评分均显著下降;血清IgE以及BALF 中炎性因子的表达均显著降低。这些结果表明灯盏花素对哮喘发作过程中小鼠气道炎症反应具有一定的抑制作用。灯盏花素的主要成分黄芪素被证明可以抑制肺纤维化发生中核因子κB(NFκB)/NOD 样受体热蛋白结构域相关蛋白3(NLRP3)介导的炎症反应[12]。在肝损伤及心肌损伤发生过程中,灯盏花素也会抑制其炎症反应的产生并促进炎性细胞的凋亡[4,13]。而本研究的结果进一步在哮喘模型上证明了灯盏花素对于气道炎症反应的抑制作用。
在本团队既往的研究中发现lncRNA NEAT1/miR-9-5p/SLC26A2 轴在体外细胞模型中会调节哮喘发生中炎症相关因子的表达[14]。在这一信号轴中NEAT1 已经被发现可以调节多种miRNA 进而促进气道平滑肌细胞这一哮喘模式细胞的炎症反应及炎性因子的水平[15-16]。有研究发现,灯盏花素在其他疾病中会抑制NEAT1 的表达[17]。为了探究灯盏花素在调节哮喘气道炎症过程中是否会改变这一信号轴的表达,我们研究也在小鼠肺组织中进行了表达检测。结果发现,灯盏花素会显著抑制小鼠肺组织NEAT1和SLC26A2 的表达,而miR-9-5p 则会显著上调。该结果从分子机制角度阐释了灯盏花素可能通过调节lncRNA NEAT1/miR-9-5p/SLC26A2 信号轴抑制哮喘气道炎症。综上所述,本研究基于OVA诱导的哮喘小鼠模型明确了灯盏花素给药后对小鼠气道炎症的影响及潜在的分子调控信号轴。研究结果表明,灯盏花素能抑制炎性因子的水平及炎症反应的发展。在分子机制方面,灯盏花素能显著调节与炎症因子相关的 lncRNA NEAT1/miR -9 -5p/SLC26A2 信号轴基因的表达。与此同时,本研究也存在一定的不足。首先,关于灯盏花素调节哮喘这些炎性症状其他的分子机制还需要通过多种手段进行深入研究。其次,关于灯盏花素与lnc RNA NEAT1/miR-9-5p/SLC26A2 信号轴在哮喘小鼠体内具体的分子互作机制也需要在未来的研究中进行更多的指标检测及实验探索。

