大黄鱼ATG5基因的分子特征及促进病毒增殖的作用
魏祖运, 王 珊, 李婉茹, 王胜蓝, 陈玉红,母尹楠, 陈新华
(福建农林大学海洋学院,福建省海洋生物技术重点实验室,福建 福州 350002)
自噬(autophagy)广泛存在于真核细胞中,是细胞自我保护、存活、更新、物质再利用和维持体内平衡的重要机制[1-2]。自噬的基本过程包括双层膜结构自噬体的形成、自噬体与溶酶体融合和自噬体降解[3]。自噬体形成过程受到多种基因的调控,这些基因被称为自噬相关基因(autophagyrelated gene,ATG)[4]。到目前为止,已经在酵母中鉴定了30多种自噬特异性调控基因,其中ATG5作为自噬泛素化过程的调节基因,在自噬体形成早期发挥重要作用[5]。ATG5可以结合ATG12和多聚蛋白ATG16形成ATG12-ATG5-ATG16复合物,该复合物有利于自噬小体的延伸[6-7]。ATG5复合物还能够与自噬囊泡膜结合,促进LC3 (ATG8)向自噬囊泡聚集[8]。ATG5蛋白水平的升高或降低直接影响自噬通路,敲低ATG5能特异性地阻断自噬体的形成[9-10]。
自噬作为细胞维持自稳定的一种自我保护机制,在病毒复制过程中发挥重要作用。已有研究报道,病毒感染会导致自噬体积累,并利用自噬体的双层膜状结构作为“病毒工厂”[11]。受小鼠(Mus musculus)肝炎病毒(mouse hepatitis virus,MHV)感染的细胞,自噬体的双层膜中可以检测到病毒成分,病毒RNA在双层膜小泡上完成了复制和转录[12]。目前,关于自噬在鱼类病毒感染中的功能研究仍相对较少。传染性鲑鱼贫血症病毒(infectious salmon anaemia virus,ISAV)感染会诱导大西洋鲑(Salmo salar)细胞发生自噬,利用3-甲基腺嘌呤抑制自噬显著抑制了ISAV的复制,说明自噬对于ISAV复制具有促进作用[13]。Liu等[14]研究发现,鲤春病毒血症病毒(spring viremia of carp virus,SVCV)感染增强了宿主细胞的自噬活性,而自噬促进了宿主细胞中SVCV增殖。然而,也有研究报道自噬发挥抗病毒作用,例如雷帕霉素诱导的自噬抑制了鲤上皮瘤(epithelioma papulosum cyprini,EPC)细胞内传染性造血器官坏死病毒(infectious haematopoietic necrosis virus,IHNV)的复制和细胞外病毒的产生,而使用抑制剂阻断自噬过程则加剧了病毒感染效应,说明自噬在IHNV感染中发挥抗病毒作用[15]。
大黄鱼(Larimichthys crocea)是我国重要的海水经济鱼类,随着大黄鱼养殖业的快速发展,由病毒、细菌和寄生虫引发的疾病频繁暴发,给大黄鱼产业造成了巨大的经济损失[16-17]。因此,解析大黄鱼应对病原感染的免疫应答机制将有助于制定有效的病害防治措施。本研究克隆并鉴定了大黄鱼ATG5(LcATG5)基因,研究了LcATG5在正常大黄鱼组织和免疫细胞中的表达水平及该蛋白对鱼类病毒增殖的影响,本能实验为阐明ATG5在鱼类病毒感染中的功能及其机制提供了基础数据。
1 材料与方法
1.1 实验材料
实验用大黄鱼体长(21.0 ± 1.8) cm,体重(105.0 ± 13.5) g购自宁德市富发水产有限公司,将随机挑选的大黄鱼置于3 t养殖桶中适应性养殖10 d,水温为25 °C左右,使用增氧设备不间断曝气,每天早晚各换水1次。采集健康大黄鱼的血液、鳃、脑、头肾、皮肤、肌肉、脾脏、肝脏、胃、心脏、肠等组织或器官立即置于液氮中速冻,保存于−80 °C超低温冰箱备用。本研究获得了福建农林大学实验动物管理和使用伦理委员会批准(PZCASFAFU2019019),实验过程中操作人员严格遵守福建农林大学伦理规范,并按照福建农林大学伦理委员会制定的规章制度执行。
1.2 细胞与病毒
取健康大黄鱼的头肾组织,置于70 μm细胞滤网上轻轻研磨,用含1%肝素钠的磷酸盐缓冲溶液(PBS)冲洗制成细胞悬液,再将细胞悬液添加到34%/51% Percoll溶液上,4 °C,650 ×g离心30 min。离心后,吸取中间细胞层,使用L-15培养基洗涤3次,再使用5 mL L-15培养基重悬细胞,按照每孔2.0 × 106个细胞接种到6孔板,28 °C 培养2 h,分别收集悬浮的原代淋巴细胞和贴壁的原代巨噬细胞。将研磨后制成的细胞悬液加到51% Percoll溶液上,4 °C,650 ×g离心30 min,收集离心管底部的大黄鱼原代粒细胞。
大黄鱼头肾细胞系(LYCK)和EPC细胞保存于本实验室,使用L-15细胞培养基(含10% FBS)进行培养,培养温度为28 °C[18]。SVCV原液保存于本实验室。
1.3 LcATG5基因克隆
从大黄鱼基因组数据库中查找到LcATG5基因的编码序列,根据预测序列设计引物LcATG5-F和LcATG5-R(表1),用于扩增LcATG5基因的开放阅读框(ORF)。以大黄鱼脾脏总RNA反转录得到的第一链cDNA为模板,使用EasyPfu DNA聚合酶(北京全式金生物技术有限公司)进行PCR扩增,反应体系∶cDNA模板1 μL,EasyPfu 1 μL,上下游引物(10 μmol/L)各1 μL,dNTP Mix 4 μL,10× PCR Buffer 5 μL,无菌水 37 μL;反应条件∶95 °C 预变性5 min;95 °C 变性30 s,56 °C 退火30 s,72 °C 延伸1 min,30个循环∶72 °C延伸5 min。PCR产物回收后与载体pMD20-T连接后,转化大肠杆菌(Escherichia coli) DH5α,挑取阳性克隆进行测序。

表1 引物信息Tab. 1 Primer information
1.4 生物信息学分析
从NCBI (http://www.ncbi.nlm.nih.gov/)数据库中检索了其他物种ATG5的氨基酸序列(表2),再使用NCBI中的BLAST工具进行氨基酸序列一致性分析。使用DNAMAN 8.0软件进行氨基酸多序列比对,并使用BOXSHADE进行着色。使用Simple Modular Architecture Research Tool (SMART)分析蛋白结构域。使用MEGA6.0软件的邻接法(Neighborjoining)构建系统进化树。
1.5 LcATG5在大黄鱼组织和免疫细胞中的表达分析
提取上述组织、器官或免疫细胞的总RNA,反转录cDNA为模板,利用针对LcATG5基因的特异性引物RT-LcATG5-F和RT-LcATG5-R(表1),并以大黄鱼β-actin基因作为内参基因,进行荧光定量PCR反应,检测LcATG5在健康大黄鱼组织、器官和免疫细胞中的表达水平。荧光定量PCR反应体系∶2×SYBR Green I 10 μL,上下游引物(10 μmol/L)各0.1 μL,cDNA模板0.2 μL,无菌水9.6 μL。反应条件∶95 °C 预变性2 min,95 °C 变性15 s,57 °C 退火20 s,72 °C 延伸20 s,共40个循环。LcATG5的相对表达水平采用2−△△CT方法计算[19],并用SPSS 18.0软件进行统计学分析。
将分离的大黄鱼头肾原代巨噬细胞、淋巴细胞和粒细胞以及LYCK细胞接种于6孔板内(2.0×106个/孔),28 °C培养3 h后,使用终浓度为50 μg/mL的poly(I:C)(Sigma-Aldrich,美国)刺激细胞,无菌PBS处理的细胞作为对照,分别于刺激后4、8、12、24和48 h收集细胞,再利用荧光定量PCR分析LcATG5的表达变化。
1.6 蛋白质免疫印迹
将LcATG5的ORF序列插入到真核表达载体pcDNA3.1(Invitrogen,美国)的EcoR I和KpnI两个酶切位点之间,得到重组质粒pcDNA3.1-LcATG5。将EPC细胞(1×106个/孔)接种于6孔板后过夜培养,再使用Fugene HD转染试剂(Promega,美国)将2 μg重组质粒pcDNA3.1-LcATG5或对照质粒pcDNA3.1转染EPC细胞,24 h后收集细胞,使用细胞裂解缓冲液(碧云天生物技术,中国)裂解细胞,4 °C,14000×g离心15 min,收集上清液。上清内蛋白经15% SDS-PAGE电泳后,转移到聚偏氟乙烯(PVDF)膜上,室温下在含有5%(质量体积比)脱脂奶粉的TBST缓冲液中封闭1 h,再与小鼠抗6×His标签的单克隆抗体(1∶2000;Thermo Fisher,美国)孵育1 h,使用TBST缓冲液洗涤3次,然后与辣根过氧化物酶(HRP)标记的羊抗鼠IgG(H+L)多克隆抗体(1∶4000;Thermo Fisher,美国)孵育1 h,TBST缓冲液洗涤后,最后使用化学发光检测试剂(NCM Biotech,中国)进行显色。
1.7 病毒感染实验
将EPC细胞(1×106个/孔)接种于6孔板后过夜培养,使用Fugene HD转染试剂将2 μg重组质粒pcDNA3.1-LcATG5或pcDNA3.1转染EPC细胞,24 h后,每孔加入1 mL 106TCID50/mL SVCV感染细胞,1 h后移除病毒,加入含10%胎牛血清的L-15培养基培养细胞。分别于感染后12和24 h在显微镜下观察细胞病变效应,并使用含1%结晶紫的溶液对细胞进行染色;同时于感染后24 h收集细胞培养上清检测病毒滴度,于感染后12 和24 h收集细胞提取总RNA,采用荧光定量PCR检测SVCV糖蛋白基因(SVCV- G)、基质蛋白基因(SVCV- M)和磷蛋白基因(SVCV- P)的表达水平,内参为鲤β-actin基因。
2 结果
2.1 大黄鱼ATG5基因的分子特征与进化分析
LcATG5(GenBank登录号∶XM_027287056.1)的ORF全长为828个核苷酸,编码275个氨基酸的蛋白质(图1),其预测分子量为32.32 ku,理论等电点为5.7。与其他物种ATG5氨基酸序列相似,LcATG5含有1个高度保守的APG5结构域(第79~270位氨基酸),并具有典型的泛素连接酶特征,包括2个泛素样结构域(ubiquitin-like domain),分别位于第16~105位和第185~273位氨基酸,1个富螺旋结构域(helix-rich domain;第121-171位氨基酸)和1个保守的钙蛋白酶切割位点(calpain cleavage site;第188~196位氨基酸;图2)。此外,LcATG5序列中还发现了与ATG12结合的位点Lys149(图2)。序列一致性分析发现,LcATG5与其他鱼类ATG5序列的一致性较高,约为86.18%~98.55%,但是与哺乳类、两栖类、爬行类和鸟类同源基因的一致性相对较低,为80.43%~81.52%(表2)。系统进化分析显示,鱼类ATG5聚成一簇,远离两栖类、鸟类和哺乳类组成的分支,其中LcATG5与棘头梅童鱼ATG5的亲缘关系最近(图3)。

图1 大黄鱼ATG5核苷酸与氨基酸序列特征“*”表示终止密码子,灰色阴影指示保守的APG5结构域。Fig. 1 The nucleotide and amino acid sequence characteristics of LcATG5Terminational codon is indicated by “*” and APG5 domain is shaded by gray.

图2 大黄鱼ATG5与其他物种ATG5氨基酸序列比对序列上方的箭头指示ATG5保守的结构域,包括2个泛素样结构域(ubiquitin-like domain)和1个富螺旋结构域(helix-rich domain)。黑色虚线方框指示钙蛋白酶裂解位点(calpain cleavage)。黑色三角▲标出的赖氨酸残基为ATG12偶联位点。Fig. 2 Alignment of ATG5 amino acid sequences from L. crocea and other vertebratesArrows above the sequences represent the conserved domains of ATG5, including two ubiquitin-like domains and a helix-rich domain. The calpain cleavage site is boxed by black dotted line and a lysine residue as the conjugation site for ATG12 is indicated by ▲.

图3 邻接法构建的ATG5系统进化树Fig. 3 Neighbor-joining phylogenetic tree constructed based on ATG5 amino acid sequences
2.2 LcATG5在大黄鱼不同组织和细胞中的表达特征
LcATG5在所有检测的组织或器官中均有表达,在血液中表达量最高,在脾脏中表达量最低(图4-a)。此外,LcATG5在所检测的免疫细胞中也都有表达,相对表达水平最高的细胞是原代粒细胞,其次是原代淋巴细胞和LYCK细胞,最低的是原代巨噬细胞(图4-b)。Poly(I:C)刺激后,LcATG5在这4种免疫细胞中的转录水平都发生了显著上调,在LYCK细胞和原代淋巴细胞中的表达量都是在处理后12 h达到峰值,分别是对照组的3.93和1.43倍(图5-a,c);LcATG5在原代巨噬细胞中的表达量从刺激后12 h开始上调,在48 h达到峰值,是对照组的1.57倍(图5-b),而其在原代粒细胞中的表达量在12 h达到峰值,是对照组的2.73倍(图5-d)。

图4 LcATG5在大黄鱼组织/器官和免疫细胞中的表达模式(a) LcATG5在大黄鱼组织/器官中的表达谱。1. 血液,2. 肌肉,3. 肠,4. 鳃,5. 脑,6. 心脏,7. 肝脏,8. 皮肤,9. 胃,10. 头肾,11. 脾脏;(b) LcATG5在大黄鱼免疫细胞中的表达谱。1. 原代头肾粒细胞,2. 原代头肾淋巴细胞,3. 大黄鱼头肾细胞系(LYCK),4. 原代头肾巨噬细胞。Fig. 4 Expression profiles of LcATG5 in tissues/organs and immune cells(a) Relative expression levels of LcATG5 transcripts in different tissues of L. crocea. 1. blood, 2. muscle, 3. intestine, 4. gills, 5. brain, 6. heart, 7. liver, 8.skin, 9. stomach, 10. head kidney, 11. spleen; (b) relative expression levels of LcATG5 in immune-related cells of L. crocea 1. primary head kidney granulocytes, 2. primary head kidney lymphocytes, 3. L. crocea head kidney cell line (LYCK), 4. primary head kidney macrophages.
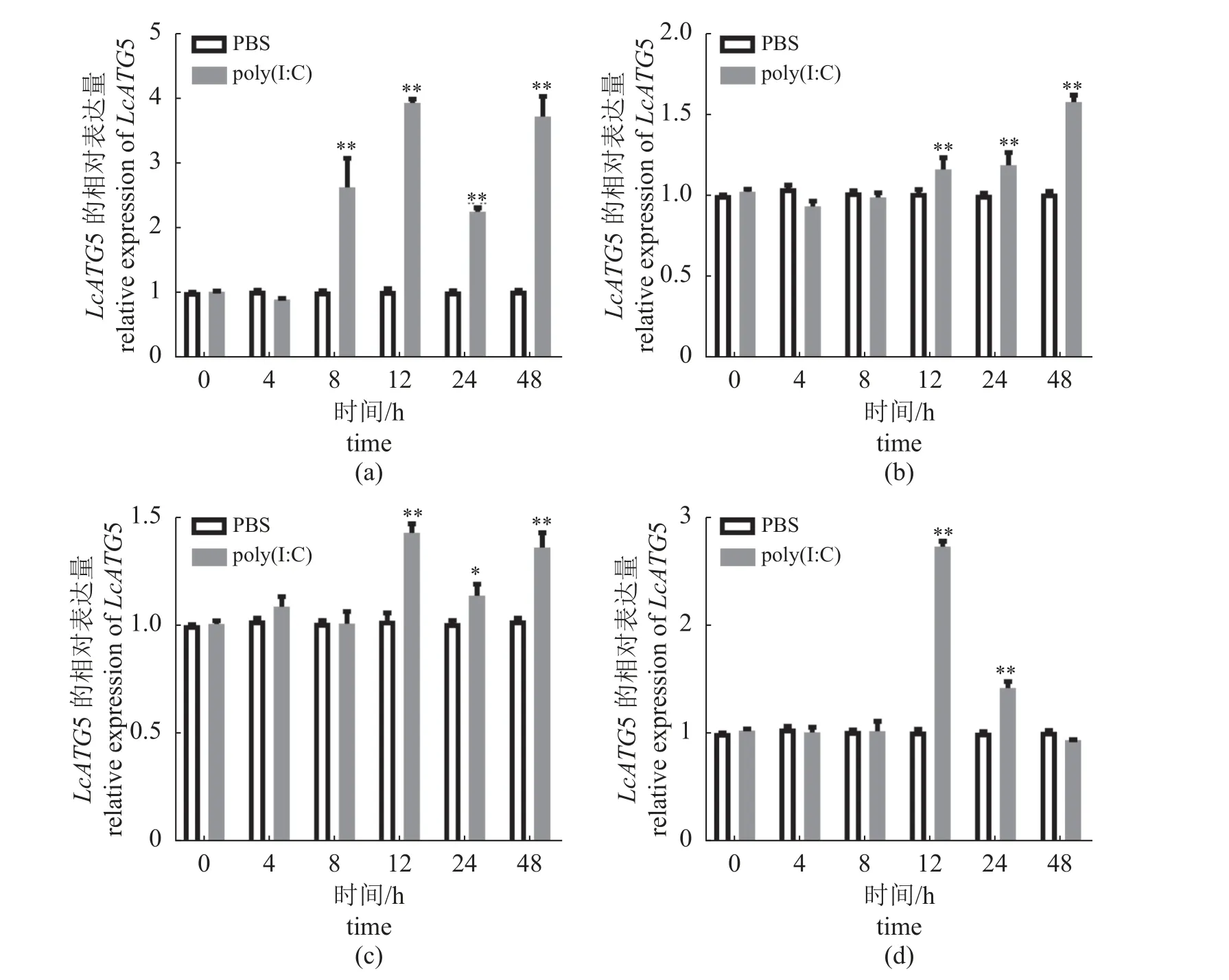
图5 Poly (I:C) 刺激后免疫细胞中LcATG5的表达水平变化使用终浓度为50 μg/mL poly (I:C) 分别刺激大黄鱼头肾细胞系(a)、原代巨噬细胞(b)、原代淋巴细胞(c)和原代粒细胞(d);*. P< 0.05,**. P <0.01。Fig. 5 Expression changes of LcATG5 in immune cells after stimulation with poly (I:C)L. crocea head kidney cell line (a), primary macrophages (b), primary lymphocytes (c), and primary granulocytes (d) were treated with poly (I:C) at a final concentration of 50; *. P < 0.05, **. P < 0.01.
2.3 LcATG5过表达促进SVCV病毒的复制
为了确定LcATG5在病毒感染过程中的作用,我们在EPC细胞中过表达LcATG5,然后使用SVCV感染EPC细胞,检测LcATG5过表达对SVCV复制的影响。结果显示,在EPC细胞中能够检测到LcATG5蛋白表达 (图6-a),SVCV感染12和24 h 后,LcATG5的表达水平显著上调(图6-b);过表达LcATG5的EPC细胞中的细胞病变效应(CPE)明显多于对照组(图7-a),并且细胞经结晶紫染色后也显示出相似的结果(图7-b);同时过表达LcATG5的EPC细胞培养上清液中SVCV滴度为1013.82TCID50/mL,显著高于对照组109.27TCID50/mL(图7-c),细胞内SVCV标志基因SVCV-G、SVCVM和SVCV-P的表达水平也显著高于对照组,在24 h时分别是对照组的13.83、15.72和11.39倍(图7-d~f)。上述结果表明,LcATG5促进了EPC细胞中SVCV的复制。

图6 LcATG5在EPC细胞中表达水平分析(a)蛋白免疫印迹分析LcATG5在EPC细胞中表达情况,1. 对照,2. LcATG5,下同;(b)荧光定量PCR检测SVCV感染EPC细胞12和24 h后 LcATG5的转录水平。Fig. 6 Expression level of LcATG5 in EPC cells(a) Western blotting was used to detect the overexpression of LcATG5 in EPC cells, 1. control, 2. LcATG5, the same below; (b) the expression level of LcATG5 genes was detected in EPC cells at 12 and 24 h post-infection by real-time PCR.
3 讨论
自噬是广泛存在于真核细胞内的一种溶酶体依赖性降解途径,在维持细胞存活、更新、物质再利用和内环境稳定中起着重要作用。自噬在病毒感染过程中也发挥着重要作用,可以将细胞质内的病毒颗粒转运到溶酶体,利用溶酶体清除病毒,也可以将病毒转运给细胞内感受器或MHCⅡ类分子激活先天性或适应性免疫应答[20]。自噬在病毒感染中的作用具有双重性,一方面自噬能够降解入侵的病毒,另一方面有些病毒能够利用自噬的过程进行复制、增殖[21],这取决于病毒和细胞的类型以及细胞所处环境[11,22]。目前关于自噬和自噬相关基因(ATG)在鱼类病毒感染过程中报道还相对较少。我们前期的研究发现,大黄鱼自噬相关基因Beclin-1通过诱导自噬或负调控I型干扰素反应促进病毒复制[23]。本研究从大黄鱼中克隆了ATG5基因(LcATG5),其ORF全长为828个核苷酸,编码一个含有275个氨基酸的蛋白质,具有1个保守的APG5结构域和典型的泛素连接酶特征,包括2个泛素类结构域和1个富螺旋结构域,这三个结构域相互作用形成凹槽,再与ATG16氨基端的螺旋结构结合[6]。LcATG5序列中还包含1个calpain切割位点,其基序与草鱼和斑马鱼的相同,该位点经过calpain选择性剪切,ATG5可在该位点分割成两种形式,分别作为分子开关引导细胞进入自噬或凋亡[24]。此外,与黄颡鱼(Pelteobagrus fulvidraco)ATG5结构类似,LcATG5存在保守的Lys-149,能够与ATG12的Gly-186偶联,这是自噬小体形成的关键步骤[25]。系统进化分析显示,LcATG5与其他鱼类ATG5处于硬骨鱼类分支中,表明本研究克隆得到的LcATG5确实为ATG5的同源基因,并且LcATG5与棘头梅童鱼ATG5的序列一致性最高,为98.55%。综上结果表明LcATG5在进化过程中保留了保守的结构特征,也预示了其功能的保守性。
LcATG5在所有检测的组织或器官中呈组成型表达,这种组成型表达模式在其他鱼类,如石斑鱼、黄颡鱼和草鱼中都有报道,说明自噬是在鱼体内是一个普遍的过程,可能与各个组织的生理功能密切相关。进一步比较分析发现,LcATG5在大黄鱼血液中的表达量最高,在脾脏中的表达量最低,这与石斑鱼、黄颡鱼和草鱼中报道的结果明显不同,石斑鱼和黄颡鱼ATG5都是在脑组织中的表达量相对较高[26-27],而草鱼ATG5的表达量在鳃组织中相对较高,在中肾部位表达量较低[28],上述结果表明,不同鱼类中ATG5的组织分布模式存在明显差异,可能是由于鱼种差异或生存环境不同导致的。此外,LcATG5基因在原代巨噬细胞、淋巴细胞和粒细胞以及LYCK细胞中也均有表达,提示LcATG5可能参与大黄鱼免疫应答过程。
ATG5启动双膜囊泡形成是自噬过程的重要步骤,ATG5在病毒复制过程中的功能在哺乳类中已经被证实[29]。目前在鱼类中的研究相对较少,赤点石斑鱼神经坏死病毒(RGNNV)和石斑鱼虹彩病毒(SGIV)感染后,石斑鱼ATG5的转录水平显著升高[26];病毒类似物poly (I:C) 刺激24 h,草鱼CIK细胞中ATG5的表达水平也显著上调[28]。在本研究中,poly (I:C) 处理后,LcATG5在大黄鱼4种免疫细胞中的表达水平均显著上升,表明鱼类ATG5可能在病毒感染过程中发挥作用。进一步研究发现,过表达LcATG5可显著增加了SVCV感染引起的CPE现象,同时感染细胞培养上清液中SVCV滴度和细胞内SVCV标志基因的表达水平均显著升高,表明LcATG5促进了SVCV病毒在EPC细胞中复制。已有研究报道,过表达石斑鱼ATG5促进RGNNV和SGIV复制,草鱼ATG5显著抑制草鱼呼肠孤病毒(GCRV)感染后IFN-I的表达。因此,实验推测鱼类病毒可能利用ATG5参与形成的双膜囊泡进行复制,并且ATG5通过抑制I型干扰素反应影响鱼类的抗病毒免疫应答。
4 结论
综上所述,本研究从大黄鱼中鉴定出一个ATG5基因,其在所有检测的组织、器官和免疫细胞中呈组成型表达,同时poly(I:C) 刺激显著上调了免疫细胞中LcATG5的表达水平。功能研究发现,过表达LcATG5能够促进EPC细胞中SVCV增殖,但是具体机制有待明确。这些研究结果将为深入研究自噬和自噬相关基因在鱼类病毒感染过程中的作用及机制奠定了基础。
(作者声明本文无实际或潜在的利益冲突)

