云南切梢小蠹雄性内生殖器形态与精子超微结构
鲁国艳,张梦蝶,张艳琳,杨 斌,李宗波
(西南林业大学生物多样性保护学院 云南省森林灾害预警与控制重点实验室,云南 昆明 650224)
生殖是昆虫种群延续和繁荣的重要手段,主要分为有性生殖(Sexual reproduction)和孤雌生殖(Parthenogenesis)两大类,特别是前者,其两性配子的结合不仅直接决定昆虫种群内驱动力,而且对于“整合”害虫的各项治理措施具有重要的参考意义[1-2]。云南切梢小蠹(Tomicus yunnanensis)隶属于鞘翅目 ( Coleoptera)、 象虫科(Curculionidae)、小蠹亚科(Scolytinae),是我国西南地区云南松松林的毁灭性害虫[3]。自上世纪80 年代爆发危害以来,该蠹虫迄今已导致大于15 万公顷的云南松林死亡,且持续向四川、贵州、西藏等地区蔓延扩散[4]。与其它树皮小蠹相比[3,5],云南切梢小蠹具有两个典型的危害特征,即蛀梢期和蛀干期。前者是新羽化的成虫离开繁殖树(Natal tree),重新寻找健康的松树,并蛀入嫩梢取食,借以补充营养,完成生殖系统的发育成熟;后者是性成熟的个体,则会选择树势衰弱的云南松,按照自上至下的方式蛀入树干产卵、繁殖后代,此时会阻断树木水分和营养物质输送,导致树木死亡[3,6-7]。
如何使云南切梢小蠹有虫不成灾,基于害虫种群区域性生态调控的系统策略是关键,这就需要研究影响云南切梢小蠹种群波动和灾变的内在因子,而这与云南切梢小蠹的生殖系统、繁殖行为及其制约因素直接相关。云南切梢小蠹是一夫一妻制(Monogamy)的婚配模式,一生仅交配一次(少数姊妹种例外),可产卵60~80 粒[3,5,7],考虑到高效的种内信息通讯模式[8-9]和独特的隐蔽式生活[3],加之与真菌、细菌以及病毒的协同共生[5],使其能够有效地克服树木的多元抗性,侵入寄主树木取食、繁殖,从而维持其种群密度的相对稳定。当前,在明确云南切梢小蠹卵巢和发育进度的条件下,有必要对其雄性生殖系统的形态、组成及其精子结构进行详细的研究。另外,目前已报道的小蠹亚科昆虫有6 056 种[5],但仅有山松大小蠹(Dendroctonus monticolae)[10]、咖啡果小蠹(Hypothenemus hampei)[11]、华山松大小蠹(D. armandi)[12]、克里角梢小蠹(Trypophloeus klimeschi)[13]和长林小蠹(Hylurgus ligniperda)[14-15]、法吉枝小蠹(Ernoporus fagi)和常春藤吻道小蠹(Kissophagus hederae)[16]的雄性生殖系统和精子进行过研究,而不同物种之间又存在着广泛的变异[14,16]。如雄虫生殖系统一般由精巢、储精囊、附腺、输精管和射精管组成,但咖啡果小蠹没有附腺[11];再如精子结构,一般包括细胞核、9 + 9 + 2 式轴丝和一个似壶嘴状的管胞[16],但华山松大小蠹存在一个特有的海绵体[12]。因此,本研究以云南切梢小蠹雄虫为研究对象,应用光学显微镜和透射电镜技术观察雄性内生殖器形态与精子超微结构,以期为深入理解云南切梢小蠹的种群动力与害虫生态调控提供依据。
1 材料与方法
1.1 试虫的获取与鉴定
根据云南切梢小蠹生活史及其本课题组的林间观察[3,17],于2021 年10、12 月和2022 年3 月,分别从曲靖市沾益区九龙山林场(103°7'15″ E,25°0'35″ N)采集嫩梢和树干内的云南切梢小蠹成虫,带回实验室进行分类和性别鉴定[18]。按照采集时间段,这些雄虫被分为两类,一类是性器官已开始发育的成虫,包括性成熟者,直接从松梢内剥取;另一类是性器官未发育的雄虫,来自于树干内已经羽化1 d 的成虫,主要识别特征是淡黄褐色的体色以及鞘翅末端2/3 处的黑色斑块[17]。最后,将分类好的雄虫暂时放入4 ℃冰箱内保存待用,保存时间不超过3 d。
1.2 雄虫精巢的解剖与形态观察
从冰箱内取出鉴定好的云南切梢小蠹,将其固定于蜡盘内,并置于蔡氏体视镜(Stereo Discovery V20)下解剖。解剖时,用镊子沿腹部末端向胸部方向依次撕掉体壁,滴上生理盐水,使其浸泡整个腹部,随后用昆虫针挑动精巢,切断气管和微气管,将整个精巢从腹部拉出,并清理残留在精巢表面的脂肪体和油脂。清理完毕后,将其移至载玻片,并用体视镜对生殖系统各器官的形态、颜色、质地等进行观察和拍照。每个类别每次解剖10~20 头雄虫。
1.3 光学显微镜
为了测定成熟精子的大小,将新解剖出来的储精囊置于0.1 mol·L-1磷酸缓冲液(PBS,PH 7.2)中,并迅速将其移动到一张干净的载玻片上,戳破后使精子流出。接着,用蓝色荧光染料Hoechst 33258染色液(10 ug·mL-1)染色60 s,经3 次PBS 液冲洗涤后,用盖玻片覆盖。最后,将玻片置于奥林巴斯荧光显微镜(BX-51)下,用340~488 nm波长进行观察,并使用奥林巴斯DP72 相机拍照。
1.4 透射电子显微镜
挑取性成熟成虫的储精囊,经PBS 冲液漂洗5 次后(20 min·次-1),将其保存在2.5%多聚甲醛-戊二醛固定液中,室温条件下固定1.5 h,后经PBS 漂洗(5 次,20 min·次-1)和酒精梯度脱水( 30%、 50%、 70%、 80%、 90%, 1 次,10 min·次-1;无水乙醇,3 次,20 min·次-1),再进入3∶1、1∶1 和 1∶3 的乙醇/Epon 812 树脂以及纯Epon 812 树脂中,依次孵化2、4、12 和24 h,最后再置入纯Epon 812 树脂中,并在30 和60 ℃烘箱中聚合24 h。经半薄定位后,用莱卡超薄切片机(EM UC7)进行切片,切片厚度约为70 nm,随后将切片收集在300 目铜网内,经2%醋酸双氧铀(染色8 min)和4%柠檬酸铅(染色10 min)双重染色后,用日立透射电子显微镜(JEM-1 400 plus)对其进行观察和拍照。
1.5 形态鉴定与数据分析
参照Aslam[15]、Burrini[16]和Gao 的[13]的方法,对雄性内生殖系统及其精子结构进行鉴定和描述,并用图像处理软件ImageJ(Version 1.57c,http://imagej.nih.gov/ij)测量各器官长、宽、直径等指标,每一指标重复测定10~20 次,并用非参检验Kruskal-Wallis Test 对比各器官的发育差异性分析,所有数据分析均在开源平台Rstudio(R Version 4.2.2, https://cran.r-project.org/)中完成。
2 结果与分析
2.1 雄性生殖系统的形态、组成与发育
云南切梢小蠹雄性内生殖系统位于第4 腹板下方,由1 对精巢(Testes)、2 对管状附腺(Tubular accessory glands)、1 对多管状腺体(Multilobulated accessory glands)、1 对储精囊(Seminal vesicles)、1 对输精管(Deferent ducts)和1 根射精管(Ejaculatory duct)组成,其中精巢和多管状腺体为椭球形,其它器官为长管状;射精管末端开口于第8 腹节的末端,即与外生殖器相连接,而各器官表面均分布有大量的气管和微气管(图1A)。在内生殖器发育过程中(图1B~D;表1),新羽化1 d 的成虫,即性未发育者,其精巢及其附腺均为无色透明状,各管状体体纤细,几乎不膨大,未发现有精子(图1B);待发育至10 月,此时卵巢和多管状腺体的表面呈现淡黄色,各管状体为乳白色,管壁明显膨大、增厚,最典型特征是储精囊内有大量精子存在,预示着性器官已基本成熟(图1A、C),占比约为总体的36.7%(N=15);12 月份时,最大的变化是精巢和多管状腺体为橘黄色,储精囊内亦出现大量的精子,而其它器官仅是略微的膨大(图1D),这些个体占比约为88.9%(N=45)。

表1 云南切梢小蠹雄虫的内生殖器组成、形态及发育变化 Table 1 Shape and size of parts of the male genital organs of Tomicus yunnanensis adults.

图1 云南切梢小蠹雄性生殖系统及其发育动态Fig. 1 Male reproductive system and its deveopmental dynamics in the Tomicus yunnanensis adults
2.2 精巢结构
每一个精巢均由单层结构的精囊膜(Scrotal membrane)包裹,内部含有20 根精巢小管(Testiculartubules),精巢小管外形呈梨形,横切面显示其有一个大型的细胞核,可计数的精子数量为403 ± 20 个(图2),说明每个精巢小管可育512 个(29)精细胞。

图2 云南切梢小蠹雄虫精巢的横切面Fig. 2 Transverse section of the testicular tubules in the Tomicus yunnanensis adults
2.3 精子形态与超微结构
成熟精子的外形呈线状,长度为170.1 ± 39.1 μm(N=16),不聚集成束,呈游离状,包括头部和尾部两部分(图1A、图3)。其中,头部为针状,平均长度23.5 ± 3.4 μm,中部宽1.6 ± 0.4 μm;尾部细长,略微卷曲,末端处突然收缩变细,平均长度为127.9 ± 23.1 μm,中部宽1.4 ± 0.2 μm,占整个长度的75.2%。
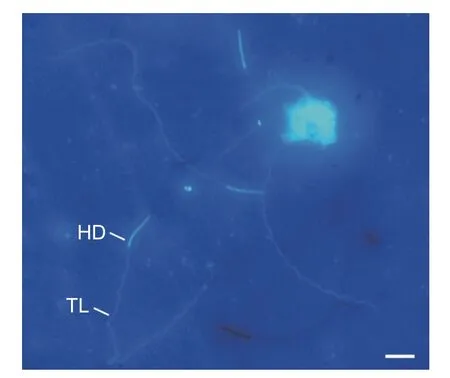
图3 云南切梢小蠹雄虫成熟精子的荧光染色特征Fig. 3 Epifluorescent characteristics of muture sperm of Tomicus yunnanensis treated with Hoechst 33258
2.3.1 头部形态与结构 从超薄切片上看,精子头部可明显区分为顶体复合体和细胞核两部分(图4A、B)。顶体复合体外形似一个帽子,长度仅有1 μm,由3 层非均质物质组成:顶体前腔基质、顶体腔和顶体(图4C~E)。顶体前腔电子密度非常低,近乎透明状,包裹在顶体腔前端的外延物周围;顶体腔具有较高的电子密度,外形为h-型,腔内含有一个丝状的顶体;顶体的电子密度与顶体腔类似,其直径约为77.0 ± 9.0 nm,几乎充满整个顶体腔。

图4 云南切梢小蠹精子头部的超微结构Fig. 4 Ultrastructural images of sperm head in the Tomicus yunnanensis adults
细胞核是电子密度最深的区域,为圆柱形,被一层薄的核膜包围,是头部最长的区域(约为总长度95.8%)。在核的前端,其外形似椭圆形,与顶体紧密相连,此处是核半径最大的区域,约为0.77 ±0.14 μm;在末端处,其逐渐变细,呈现出一个内陷的凹面,凹面内部含有中心粒,中心粒末端则以颗粒状嵌入细胞核内,而其它区域则为同质的电子致密区,中心粒基部位于大线粒体衍生物和小线粒体衍生物端部之间,并与轴丝相连接(图4B、F~G)。
2.3.2 尾部形态与结构 从精子的横切面和纵切面来看(图5A、B),云南切梢小蠹精子尾部由1 根9 + 9 + 2 式微管、2 个线粒体衍生物、1 对管胞、1 个海绵体以及1 个中心体衍生物组成。其中,微管是由位于远端中心粒的末端发出,包括位于中心的2 条平行的中心微管和外围的9 条纤维组成,而9 条纤维又可分为附属微管和微管双联体两类,附属微管位于中间,微管双联体则位于最外围,并呈双环状环绕中心微管,各微管的直径相似(18.47~27.66 nm,p=0.79),微管与微管之间则以微管连接物加以连接,进而形成了典型的9 +9 + 2 式微管结构(图5C、D)。线粒体衍生物则有大线粒体衍生物和小线粒体衍生物之分,大线粒体衍生物起源于细胞核凹面的顶点处,直径约为0.59 ± 0.26 μm;小线粒体衍生物则源于轴丝与中心粒后端的顶点处(图4B),直径约为0.28 ±0.04 μm,两者以螺旋形式围绕着轴丝(图5B、D),且大、小线粒体内壁均有发达的嵴,嵴之间的间距约为47.6 nm,预示着两者是精子运动最重要的供能器官。管胞是由一类嗜锇物质组成,位于轴丝两侧,且与之大致平行,外形呈角状或三角形,而在左侧管胞下方,则与中心体衍生物相连。中心体衍生物外形类似壶嘴状,也被称为壶嘴状衍生物(like-puff expansions),其构成物质与大、小线粒体衍生物类似(图5D)。另外,在大、小线粒体螺旋交界处,特别是小线粒体上方,通常会观察到海绵体和囊泡(图5B、C、E)。

图5 云南切梢小蠹精子尾部的超微结构Fig. 5 Ultrastructural images of sperm tail in the Tomicus yunnanensis adults
从精子尾部的起点至末尾,构成尾部的各细胞器均会逐渐减小,呈不对称状,主要贡献者是中心体衍生物、大线粒体衍生物以及小线粒体衍生物。另外,这些细胞器向尾部末端方向则会逐渐消失(图5E~H),如尾部2/3 处,小线粒体衍生物会首先消失,接着是右侧管胞和左侧管胞(图5E),至尾部3/4 处时,仅剩下大线粒体衍生物(图5F);到达尾部4/5 处时,大、小线粒体衍生物和1 对管胞均消失不见,而微管连接物也会开始消融(图5G);待到达尾部尾端,微管双连体首先消失,接着是附属微管和微管双联体,直至剩下一层薄薄的核膜(图5H)。
3 讨论
3.1 云南切梢小蠹内生殖器组成与发育
内生殖器是昆虫孕育和保护雄配子的重要器官[19]。云南切梢小蠹雄性内生殖器由1 对精巢、2 对管状附腺、1 对多管状腺体、1 对储精囊、1 对输精管和1 根射精管组成,整体形态上与鞘翅目多食亚目昆虫较为相似,但内生殖器组成、位置、数量等方面亦有不同[14,20]。以扁甲系(Cucujiformia)昆虫为例:郭公虫(Eurymetopum maculatum)(郭公虫总科,郭公虫科)的每个精巢均有6 个生精小管,侧面附腺末端分叉,且长度明显短于中间附腺,而Isohydnocera aegra仅有1 对附腺,腺体基部膨胀、延伸[21];花绒寄甲(Dastarcus helophoroides)(扁甲总科,穴甲科)的精巢为狭长的管状,有5 对附腺,1 对来源中胚层,4 对源于外胚层,均为极度延伸的管状腺体[22];喙尾琵甲(Blaps rhynchopetera)(拟步甲总科,拟步甲科)的精巢非常发达,附腺位于两侧精巢的中央处,且端部向内螺旋弯曲成管状[23],而黄粉虫(Tenebrio molitor)则有1 对管状腺和1 对豆状腺;椰心叶甲(Brontispa longissima)(叶甲总科, 铁甲科)、 莲草直胸跳甲(Agasicles hygrophila)(叶甲总科,叶甲科)以及同属于天牛科的桑天牛(Apriona germari)、云斑白条天牛(Batocera lineolata)和星天牛(Anoplophora chinensis)的腺体均为细长管状,但椰心叶甲的附腺会卷曲成团状,而不同种类的天牛附腺着生位置明显不同[24-26];长足大竹象(Cyrtotrachelus buqueti)(象虫总科,象虫科)仅有1 对发达的管状腺,与输精管一同汇入射精管[27],林小蠹族(Hylurgini)的华山松大小蠹[12]和克里角梢小蠹[13]均有2 对管状腺和1 对多管状腺(或称为环腺),储精囊均位于输精管和多管状腺体之间,但小蠹族(Scolytini)的咖啡果小蠹的储精囊位于射精管和附腺之间[11]。目前,在已研究过的扁甲系昆虫中,其腺体均为管状附腺,结合已知的附腺功能(如精液产生、精子成熟、交配栓形成等)以及本研究观察到云南切梢小蠹附腺上皮细胞基部含有大量的似髓一样的包体(图1C),推测这种腺体可能有助于精子在雌虫生殖腔内存活和成功受精[19]。另外,在光学显微镜下,也发现性成熟的云南切梢小蠹管状腺能够产生大量的乳白色分泌物,而多管状腺则是一些透明性物质(图1C、D),这可能暗示这两种腺体的功能有差别,这特别需要进一步的研究。
作为输精管膨大而形成的囊状结构,储精囊的形态和位置也有多样性[14,19]。在本文研究中,云南切梢小蠹储精囊与其它鞘翅目昆虫一样,均为膨大的球状结构,左右各1 个,外表皮为单层结构,缺少角质层,其应起源于中胚层,这一点与已经证实的华山松大小蠹及其它鞘翅目昆虫类似[12,14],但与亲缘关系较远的膜翅目、双翅目和长翅目昆虫明显不同[28]。另一方面,作为临时储存精子的场所,源于中胚层的特征意味着储精囊没有分泌功能,但在超薄切片中,能够观察到一些精子核存在于外表皮中(图2A),说明外表皮具有精子吞噬功能(Spermiophagic activity)[19,29],这种现象也在捻翅目技须捻翅科[30]、直翅目蝗科和螽斯科[31]以及膜翅目蜜蜂科[29]的昆虫中发现。但是,目前并不清楚这种吞噬功能的发生机制和起源,一些学者认为其在保护精子质量方面有作用[32]。
云南切梢小蠹雄虫内生殖器的发育是一个逐步成熟的过程,通常需要取食3~6 个嫩梢,耗时4.5~9 个月[3,7],这与本文在10 月解剖雄虫即发现有36.7%的个体储精囊内已有大量精子的结果是一致的(图1C)。另一方面,云南切梢小蠹种群的精巢的发育并不一致,如10 月达到性成熟的仅有36.7%,12 月会达到88.9%,这应该与梢内的蛀食时间、坑道长度、枝梢营养状况、环境温度以及小蠹虫本身发育状况等因素密切相关[3,7],特别是环境温度。根据蛀梢习性[3],云南切梢小蠹主要从4~6 月出现在繁殖场所附近的林木树冠上,而此时云南各地区已逐渐进入夏季,温度相对较高,是雄性内生殖器官的快速增殖期(表1),达到发育成熟的明显标志就是精巢出现淡黄色,最重要就是储精囊内可见到成熟的精子。李丽莎等[33]报道云南切梢小蠹可在3 月份蛀入树干,但基于本研究对云南切梢小蠹精巢发育进度的观察,此时精巢不具备产生精子的能力,这很可能是其躲避低温而做出的一种行为适应性机制。另外,云南切梢小蠹性成熟的发育进程与雌虫是高度一致的,且同样受到低温胁迫的影响[7],即在性成熟后仍会在树梢内蛀食,随蛀食时间的延长,其精巢和储精囊会进一步膨胀,说明这会提高它的繁殖适合度[34],待出现冬季低温时,雌、雄虫即会开始蛀干。因此,下一步利用雌、雄虫生殖系统发育的一致性,结合不同地区环境温度进行云南切梢小蠹种群的预测预报,将有利于“整合”而形成区域特色的害虫管理生态工程[1,2,5]。
3.2 云南切梢小蠹精子形态与结构
对于鞘翅目昆虫来说,位于进化树基部的物种通常比位于端部的物种能够产生更多的精子数,通常每个生精小管可产生精子数量为16~512(即24~29)个,多数情况为256 个[19-20,35]。如跳甲科中的最原始物种Forsteritasp.产生256 个,最进化的Oedionychina 亚族仅有16 个,而其它物种可见到32 个、64 个以及128 个[36];象虫科的玉米象(Sitophilus zeamais)和米象(S. Oryzae)均为256 个,而棉铃象甲(Anthonomus grandis)却高达512~797 个[37]。在本研究中,云南切梢小蠹每个生精小管可产生512(29)个精子,反映了云南切梢小蠹是鞘翅目昆虫中较为原始的,这与小蠹亚科昆虫,如华山松大小蠹、克里角梢小蠹、法吉枝小蠹、常春藤吻道小蠹等保持一致[12-13,16]。作为一个生殖细胞,昆虫精子在长度、形态、卷曲、簇状、包被等方面具有广泛的多样性,这与异配生殖起源(Isogamous origin)有关[19]。当前,已有70 多种鞘翅目昆虫的精子被研究过,发现摩耶山步甲(Carabus maiyasanus shigaraki)精子最短,仅有67 μm[19],而双斑郭公虫(Divales bipustulatus)精子最长,达到了10 000 μm[38]。对于云南切梢小蠹,其精子长度为170.1 μm,应归属于较短类型的精子,但也明显长于华山松大小蠹(85 ± 11.3 μm)和克里角梢小蠹(76.7 ± 1.8 μm)。根据Jamieson[20]的发现:昆虫精子具有高度的种间特有多样性(Species-specific diversity),考虑到小蠹虫隐蔽性的生活方式及其婚配模式,说明较短的精子可能有利于其求偶和受精成功[19-20]。
在精子结构方面,云南切梢小蠹精子与多数象虫科昆虫相似[10-13,16,19,39],包括:1)3 层的顶体复合体;2)两个等大的管胞;3)类似壶嘴状的管胞;4)两个大小不等、充满晶体的线粒体衍生物;5)典型的9 + 9 + 2 式轴丝,但也有其独特特征,如云南切梢小蠹的顶体前腔基质不明显、单一的中心粒以及精子尾部线粒体衍生物过渡处的海绵体和囊泡。一般认为,顶体的主要功能在于受精过程中发生形态与生理变化,进而获得动能,使精子能够顺利穿过卵子的放射冠、透明带等接近卵膜,到达卵的细胞质后完成精子与卵子的融合[40]。但云南切梢小蠹的顶体复合体非常短,特别是顶体前腔基质仅为一层薄的透明状物质,这可能会影响精子的获能能力,从而影响受精率[11]。当然,较短的精子长度可能会减少这种负面效应。云南切梢小蠹的顶体为丝状的亚结构,这一点与布鲁缨甲(Bumburu brunnea)较为类似,可能在精子与卵子相遇和受精过程中起到骨架的功能[41],而顶体腔为“h-型”,与法吉枝小蠹和常春藤吻道小蠹的锥体型差别较大[16],但与亲缘较近的克里角梢小蠹和华山松大小蠹相似,说明顶体腔可作为推断系统发育的一个参考指标[12-13,19-20,42]。Baccetti 认为管胞具有ATP 酶和UTP 酶活性,这与云南切梢小蠹由高密度的嗜锇性物质组成的特性相一致,可能有益于维持精子的运动[42]。另外,类似壶嘴状的中心体延伸物是象虫科昆虫典型特征,也存在于叶甲科昆虫中[43],Name[39]认为这种囊泡状膨胀物是鞘翅目昆虫精子的特有结构,在维持鞭毛稳定性方面具有作用。线粒体衍生物是精子尾部最显著的特征,无论是大线粒体衍生物还是小线粒体衍生物,其内部均充满不透明的晶体和嵴,嵴的方向垂直于线粒体的纵轴而平行排列(图5C),大、小线粒体衍生物以螺旋形式围绕着轴丝,但小线粒体衍生物延伸至尾部末端后,即会逐渐消失,但在一些叶甲科昆虫中,尾部线粒体衍生物则是大小一致,且呈对称分布[43]。嵴结构是与能量代谢直接相关的,能够进一步转化形成类晶体,这类晶体普遍发现于大、小线粒体衍生物中,特别是大线粒体衍生物中最为明显,这可能赋予精子一定的弹性,有利于精子的机械运动[44-45]。此外,从前端至末尾的连续切片来看,云南切梢小蠹精子尾部各细胞器逐渐消失,依次是管胞、小线粒体衍生物、大线粒体衍生物以及轴丝的不同微管,且消失过程中会有大量的囊泡填补这些空缺,显示出精子末端的机械运动是一种被动的、无规律的震颤形式。海绵体是另一个特别需要关注的特征,它仅在精子发育末期和成熟精子中有观察到,且主要位于精子尾部前端2/3 处的位置,这与华山松大小蠹仅位于顶点[12]、甜果螨(Carpoglyphus lactis)[46]的膜状聚集成束以及元塞蛩蠊(Galloisiana yuasai)[47]的膜质囊等差别较大。根据海绵体的着生位置,Miller[48]认为它是头部与尾部的分割点(Tail separation),即尾部的开始位置。但海绵体分布于云南切梢小蠹尾部的大部分区域,且会向外膨胀形成“凸点”,说明海绵体不应作为一种分割标识,而具有缓冲精子机械运动力、保护精子的功能[19,45]。
4 结论
(1) 云南切梢小蠹雄性内生殖器由1 对精巢、2 对管状附腺、1 对多管状腺体、1 对储精囊、1 对输精管和1 根射精管组成,与象虫科小蠹亚科昆虫较为类似,但多管状附腺的形态与位置存在种间差异;可以以精巢和多管状腺体呈淡黄色作为云南切梢小蠹性成熟的判断标准,特别是储精囊内出现精子。
(2) 云南切梢小蠹的精子为线状,长170.1 ±39.1 μm,分为头部和尾部两部分,其中头部包括1 个3 层的顶体复合体和1 个圆柱状的细胞核,尾部由2 个大小不等的线粒体衍生物、2 个似壶嘴状的管胞和1 个典型的9 + 9 + 2 式轴丝组成,各细胞器的形态高度分化,且管胞、小线粒体衍生物、管胞、大线粒体衍生物由前向后逐渐消失,可为研究小蠹亚科与象虫科的系统发育提供参考依据。

