温州市食源性小肠结肠炎耶尔森氏菌毒力基因分布及遗传多样性研究
谢爱蓉,李 毅,楼辉煌,谢中必,章乐怡,胡玉琴,吴跃进
小肠结肠炎耶尔森氏菌为广泛分布于环境、动物和食物中的人兽共患肠道致病菌。人感染后主要表现为胃肠道症状,多具有自限性。但是也可引起如心内膜炎、反应性关节炎、组织脓肿等一系列严重的并发症,甚至引起败血症导致死亡[1]。为进一步了解食源性小肠结肠炎耶尔森氏菌致病性及遗传进化多样性,本研究对温州市市售食品及腹泻病人中分离出的小肠结肠炎耶尔森氏菌进行全基因组测序,分析其毒力基因携带情况,应用多位点序列分型(multi-locus sequence typing,MLST)、核心基因组多位点序列分型 (core genome multilocus sequence typing,cgMLST)对菌株进行分子分型,为温州市食源性小肠结肠炎耶尔森氏菌的风险评估和溯源提供基础数据。
1 材料与方法
1.1 菌株来源 2020年3月至2021年11月,分离自温州市市售相关食品样本菌株64株;2021年3月至2022年3月,分离自温州市食源性疾病主动监测哨点医院就诊患者(符合食源性疾病腹泻病例定义)的粪便或肛拭标本菌株7株,共计71株小肠结肠炎耶尔森氏菌。所有菌株均经VITEK 2 Compact 全自动细菌鉴定及药敏分析系统及基质辅助激光解析电离飞行时间质谱仪(MALDI-TOF MS)鉴定。
1.2 主要仪器与试剂 VITEK 2 Compact全自动细菌生化鉴定及药敏分析系统(法国BioMérieux),基质辅助激光解析电离飞行时间质谱仪(德国Bruker),生化鉴定试剂购自青岛海博生物科技有限公司,小肠结肠炎耶尔森氏菌分型血清采用丹麦SSI诊断血清和日本生研株式会社分型血清,微量细菌定量(MIC)药敏试剂购自美国 Thermo公司,药敏试验质控菌株大肠埃希氏菌ATCC 25922购自中国工业微生物菌种保藏管理中心,细菌基因组 DNA 提取试剂盒购自天根生化科技有限公司。
1.3 方 法
1.3.1 生物、血清分型 参照文献[2]按照生化反应的不同进行生物分型。采用玻片凝集法,进行血清分型(O∶1,2、O∶3、O∶5、O∶8、O∶9血清型),同时设生理盐水作为对照。
1.3.2 药物敏感试验 采用微量肉汤稀释法进行药敏试验,包括9类20种抗生素,即氨苄西林/舒巴坦(Ampicillin-sulbactam,AMS)、头孢吡肟(Cefepime,FEP)、头孢噻肟(Cefotaxime,CTX)、头孢西丁(Cefoxitin,CFX)、头孢他啶(Ceftazidime,CAZ)、氨曲南(Aztreonam,AZM)、亚胺培南(Imipenem,IMI)、美罗培南(Meropenem,MEM)、庆大霉素(Gentamicin,GEN)、阿米卡星(Amikacin,AMI)、卡那霉素(Kanamycin,KAN)、四环素(Tetracycline,TET)、多西环素(Doxycycline,DOX)、米诺环素(Minocycline,MIN)、环丙沙星(Ciprofloxacin,CIP)、左氧氟沙星(Levofloxacin,LEV)、萘啶酸(Nalidixic acid,NAL)、复方新诺明(Trimethoprim-sulfamethoxazole,SXT)、磺胺异噁唑(Sulfisoxazole,Sul)、氯霉素(Chloramphenicol,CHL),结果判断、质量控制参考美国临床和实验室标准化协会(The Clinical and Laboratory Standards Institute,CLSI)抗微生物药物敏感性试验执行标准[3]进行。
1.3.3 全基因组测序及生物信息学分析
1.3.3.1 基因组测序 刮取适量新鲜菌落,参照DNA提取试剂盒说明书提取DNA,委托杭州微数生物科技有限公司进行全基因组测序。具体流程如下:采用Nanodrop及琼脂糖凝胶电泳对DNA进行浓度、纯度及完整性检测后,用酶切法DNA建库试剂盒构建文库,随后在Illumina NovaSeq 6000 PE150平台上进行全基因组测序。
1.3.3.2 生物信息学分析 用FastQC软件对测序数据进行质量控制,然后利用国家致病菌识别网高性能生物计算数据处理终端中基因组数据分析软件进行de novo 组装、拼接。通过细菌基因组分析平台fIDBAC(http://fbac.dmicrobe.cn/)提交序列数据获得毒力基因,并参考病原菌毒力因子数据库VFDB(http://www.mgc.ac.cn)。将序列提交至Enterobase在线分析平台(http://enterobase.warwick.ac.uk),进行多位点序列分型(MLST)和核心基因组多位点序列分型(cgMLST)。MLST分析参考McNally七基因方案:aarF、dfp、galR、glnS、hemA、rfaE、speA,获得ST型,cgMLST采用MSTree V2算法并以GrapeTree进行可视化。
2 结 果
2.1 表型分型结果 71株小肠结肠炎耶尔森氏菌中,生物1A型67株,生物2型2株,生物3型和4型各1株。生物血清分型,除34株(47.9%,34/71)血清未定型(UN)菌株外,以1A/O∶5生物血清型占比最高(29.6%,21/71),其次为1A/O∶8生物血清型(16.9%,12/71),详见表1。其中食品中检出1株4/O∶3菌株,而腹泻病人检出1株3/O∶3菌株。

表1 不同来源小肠结肠炎耶尔森氏菌生物/血清型结果Tab.1 Bioserotype distribution of Yersinia enterocolitica from different sources
2.2 药物敏感试验结果 所有菌株对GEN、MIN、SXT敏感。对FEP、CTX、CAZ、AZM、IMI、MEM、AMI、KAN、TET、DOX、CHL敏感率达95.8%~98.6%。CFX耐药率最高达39.4%(28/71),其次为CIP、NAL、Sul,耐药率介于22.5%~25.4%,见表2。45 株菌株对至少1种抗生素耐药,呈现 16种耐药谱,其中多重耐药率为 5.6%(4/71),腹泻病人分离株未发现多重耐药菌株。有1株菌株对6类11种抗生素耐药。

表2 小肠结肠炎耶尔森氏菌药物敏感试验结果Tab.2 Susceptibility test results of Yersinia enterocolitica
2.3 主要毒力基因 71株菌株共检出16种耶尔森氏菌主要毒力因子,包含126个毒力基因,详见图1。其中与鞭毛相关基因(flg、flh、fli、che、mot)多达49个,其次为Ⅲ 型分泌系统(TTSS)相关基因有37个。71株菌株均携带鞭毛相关基因,所有O∶8血清型菌株均含有O抗原相关基因galE和gmd。根据毒力基因携带情况,可见菌株YERS1025和YERB1001聚为一类,均携带TTSS相关基因、TTSS效应蛋白相关基因以及ail、psaA、yadA、ystA等基因。菌株YERS2012和YERS2070聚为一类,均携带Ysa TTSS相关基因,而缺失pla、yplA基因。而各菌株对Yst1 Ⅱ型分泌系统(T2SS Yst1)相关基因携带情况有所差别。
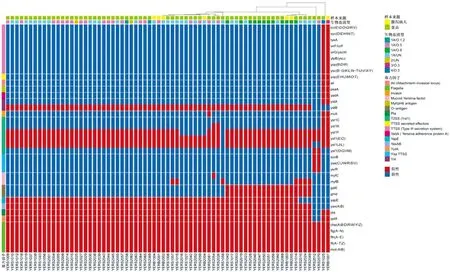
图1 小肠结肠炎耶尔森氏菌毒力基因分布分层聚类热图Fig.1 Hierarchically clustered heatmap of the virulence gene distribution of Yersinia enterocolitica
2.4 遗传多样性分析 67株生物1A型菌株包含35种ST型,2株生物2型菌株均为ST296型,生物3/O∶3型、4/O∶3型菌株分别为ST429型、 ST18型,详见图2。所有ST型中ST3型最常见,占31.6%(12/38),其次为ST304型,占13.2%(5/38)。71株菌株经cgMLST分析,发现有70种CT型,除具有相同ST型的菌株外,其余菌株无明显基因型簇形成。其中ST656型及ST726型,即包含食品分离株,也包含腹泻病人分离株,且菌株间等位基因差异数均<10。据HC1490聚类,分为3个小分支,即HC1490_2、HC1490_10和HC1490_152 。其中菌株YERS1025和YERB1001属于HC1490_2分支,菌株YERS2012和YERS2070属于HC1490_152分支,其余菌株均为HC1490_10分支。

注:使用Enterobase HierCC层次聚类法进行聚类分析,每个节点圆圈的大小与菌株数量成正比,圆圈内的数字代表ST型,圆圈的颜色代表生物血清型,不同颜色的阴影表示HC1490聚类分型,标记★为腹泻病人分离株。图2 小肠结肠炎耶尔森氏菌cgMLST最小生成树图Fig.2 Minimum spanning tree of Yersinia enterocolitica cgMLST profiles
3 讨 论
小肠结肠炎耶尔森氏菌根据生化反应结果的不同,可以被分为 1A、1B、2、3、4、5 型共 6 种生物型。根据 O抗原多糖反应,小肠结肠炎耶尔森氏菌可分为70余种血清型[2]。本次研究结果显示,温州市食源性小肠结肠炎耶尔森氏菌以生物1A型为主,占94.4%(67/71),生物血清型则以1A/O∶5占比最高,其次为1A/O∶8型,与我国其他地区食品检出的优势型别基本一致[4-5]。
71株小肠结肠炎耶尔森氏菌对20种抗菌药物中的 14种抗菌药物的敏感率达到 95.8%以上,说明大部分种类的抗菌药物对小肠结肠炎耶尔森氏菌具有显著的抗菌作用。研究中发现,菌株对头孢西丁耐药率达39.4%,低于国内相关报道[6-7],可能是因为不同地区、不同的食品类别及人群小肠结肠炎耶尔森氏菌的抗菌药物敏感性存在差异。同时,调查发现仍有5.6%的菌株表现为多重耐药,且其中 1株菌株对 6类 11种抗生素耐药,在文献[8-9]亦报告此类菌株,说明小肠结肠炎耶尔森氏菌中耐多种抗菌药物的“超级细菌”已有所显现,需引起关注。
本次研究中,71株菌株经注释获得了16种126个毒力基因。所有菌株均携带鞭毛相关基因,这些鞭毛相关基因(flg、flh、fli、che、mot) 在细胞侵袭、生物被膜形成、趋化机制以及动力中发挥着重要作用[10-11]。但各菌株携带Yst1 Ⅱ型分泌系统相关基因的情况不一,据悉所有耶尔森氏菌属都至少具有一种T2SS(Yst1、Yst2),Yst1可能对小肠结肠炎耶尔森氏菌的致病性和环境生存适应性发挥双重作用[12]。我们还发现有两株菌株携带染色体编码的Ⅲ型分泌系统——Ysa TTSS,其对上皮 M 细胞的早期感染和侵袭很重要,其他方面知之甚少[12-13]。生物1A型因其缺乏pYV毒力质粒和染色体上的某些毒力基因,被认为是非致病型。pYV质粒编码完整的TTSS、耶尔森氏菌外膜蛋白 (Yop) 和耶尔森氏菌粘附素 (YadA)[14]。小肠结肠炎耶尔森氏菌通过TTSS将 Yops递送到宿主细胞的胞质中,破坏宿主细胞信号通路并触发预编程的代谢连锁反应,导致细胞凋亡[15];yadA编码粘附素Yad A,介导细胞粘附,诱导宿主细胞反应如细胞因子产生、自身凝集和血清抗性[16]。染色体毒力基因包括ail、psaA、ystA、invA等[14]。ail编码Ail 的外膜蛋白,介导宿主细胞的附着和侵袭,以及血清抗性[14-16];psaA编码主要的纤维亚基,包裹细菌表面,促进对肠细胞的粘附[16];yst编码热稳定性内毒素,ystA会导致肠粘膜损伤,导致人类腹泻[11,17];invA基因编码侵袭素 Inv(跨膜蛋白),通过“拉链”入侵机制,将细菌内化到上皮细胞中[15-16]。值得关注的是,我们研究中的2株菌株——食品分离 1株4/O∶3菌株和腹泻病人分离1株3/O∶3菌株,携带上述毒力基因,为典型的致病性菌株。而据报道,4/O∶3型菌株为欧洲国家引起人食物中毒最常见的生物血清型[18],3/O∶3型则为我国5岁以下儿童感染小肠结肠炎耶尔森氏菌的主要血清型[19],因此我们需要警惕此类毒力菌株引起本地食物中毒暴发的风险。
本次研究中67株生物1A型菌株包含35种ST型、66种CT型,显示了生物1A型菌株的遗传多态性。同时,我们发现温州市食源性小肠结肠炎耶尔森氏菌以ST3型最为常见,此型亦是生物1A型流行最广泛的ST型[11]。EnteroBase 数据库具有数据量大、分辨率高、认可度高的特点,而其基于cgMLST的HierCC 层次聚类法,对缺失基因进行了优化,大大提高了分析的精确度。我们以HC1490对温州市食源性小肠结肠炎耶尔森氏菌进行cgMLST聚类分析,结果显示分离株以HC1490_10分支为主,而2株致病性菌株——3/O∶3型与4/O∶3型菌株分属HC1490_2分支,这与相关文献报告一致[20],HC1490_10与生物1A型紧密相关,而HC1490_2与生物3、4、5型有较强相关性[20]。此外,我们还发现部分食品分离株与腹泻病人分离株等位基因差异数<10,提示菌株间亲缘关系密切,但遗憾的是,没有相关流行病学信息用以证明他们之间的关联性。今后可进行更广泛的食品和腹泻患者的调查,收集更多的流行病学信息,并深入分析菌株之间的关联性,以便更好地预防和控制食源性小肠结肠炎耶尔森氏菌病的暴发,提升食品安全监管效果。
利益冲突:无

