伪狂犬病病毒gH糖蛋白在哺乳动物细胞中的表达及其免疫原性
喻晓航,刘一宁,丁彦彬,罗烨,方琪,郑金,余兴龙
1.湖南农业大学动物医学院,湖南长沙 410128;
2.湖南兀邦生物科技有限公司,湖南长沙 410128
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的多种家畜和野生动物以发热、奇痒及脑脊髓炎为特征的急性传染病。在PRV 的诸多感染宿主中,以猪的感染率和发病率最高,病毒可潜伏于三叉神经节或骶神经节造成潜伏感染,使病猪长期带毒,难以根除[1]。该病曾是严重威胁全球养猪业发展的主要传染病之一,但在欧、美等国家20 世纪90 年代启动根除计划后,已无PR疫情。我国主要使用弱毒活疫苗对PR 进行防控,目前我国PR 的流行已不再严重,可进入净化阶段,而疫病净化的后期,一般主张不再接种具有感染性的活疫苗,而应接种灭活苗或基因工程亚单位疫苗。
PRV属于疱疹病毒科(Herpesviridae)疱疹病毒α-亚科成员,为双股DNA病毒,基因组大小约150 000 bp,至少含有75 个开放阅读框[2]。在PRV 已鉴定的11种糖蛋白中,gB、gD、gH、gL 和gK 是病毒复制所必需的糖蛋白[3],目前已知的PRV 保护性抗原有gB、gC和gD[4-6],大多数PRV 亚单位疫苗的研发以这3 种抗原为主[7-9],但至今尚无可供应用的基因工程亚单位疫苗,因此仍需继续研究。gH 是病毒感染细胞所必需的糖蛋白[10],其保守性较好[11],在病毒入侵细胞后与gL形成二聚体促进膜融合[12]。PRV在缺失gH后,难以在细胞上产生有效的感染[13]。因此,gH也可能存在诱导动物免疫保护应答并作为亚单位疫苗的潜质,而至今尚无gH的免疫保护性研究。为此,本研究利用哺乳动物细胞表达gH 抗原,制备PRV-gH 重组亚单位疫苗,并评估新型疫苗的免疫保护效果。
1 材料与方法
1.1质粒、细胞及病毒 pIRES-neo3 真核表达载体、悬浮驯化的HEK-293F细胞和PRV-XiangA 毒株[14]均由湖南农业大学分子生物与免疫学实验室保存;大肠埃希菌Top10 感受态(G6015)细胞购自上海昂羽生物技术有限公司。
1.2实验动物 SPF 级ICR 小鼠16 只,雌性,4 周龄,体质量18 ~22 g,购自湖南斯莱克景达实验动物有限公司,动物合格证号:430727220100703443。本实验以科研为目的对小鼠进行养殖和使用,并按照中华人民共和国《实验动物管理条例》进行动物实验。
1.3主要试剂SteadyPure病毒DNA/RNA 提取试剂盒购自湖南艾科瑞生物工程有限公司;引物和高保真I5-MIX 购自北京擎科生物科技有限公司;去内毒素质粒大提试剂盒(DP117)购自天根生化科技(北京)有限公司;Ni Focurose 6FF(TED)介质购自武汉汇研生物科技股份有限公司;HRP 标记的山羊抗鼠IgG(ab6789)和山羊抗猪IgG(ab6911)均购自英国Abcam 公司;TMB 底物和终止液均购自美国KPL 公司;转染试剂PEI MAX(24765-1)购自美国Polysciences 公司;OPM-293 CD05 无血清培养基购自上海奥浦迈生物科技股份有限公司;SuperSignal West Pico PLUS ECL显色液购自美国Thermo Fisher公司;DMEM购自美国Gibco公司;BCA蛋白浓度测定试剂盒(P0012)购自上海碧云天生物技术有限公司;MontaniedTmISA 201 VG购自法国Seppic公司。
1.4gH基因的扩增及重组表达质粒的构建 根据跨膜区预测网站(https://dtu.biolib.com/DeepTMHMM)预测结果,去除gH(GenBank:KF711986.1)氨基酸序列的跨膜区(C-端42 aa),并设计克隆引物。引物序列如下:gH-fp:5′-GGAATTCGCCACCATGCCCGCGTCGTCCGTGCG-3′(阴影部分为Kozak序列,下划线部分为EcoRⅠ酶切位点),gH-rp:5′-CGGATCCTTAGTGGTGGTGGTGGTGGTGCACGGGCGCGAGCCGCGTCG-3′(阴影部分为His-标签,下划线部分为BamHⅠ酶切位点),引物由北京擎科生物科技有限公司合成。用DNA 提取试剂盒提取PRV-XiangA 毒株基因组,以其为模板,利用上述引物扩增gH基因序列。使用高保真MIX,反应条件为:98 ℃预变性5 min;98 ℃变性15 s,61 ℃退火15 s,72 ℃延伸40 s,共35 个循环;72 ℃再延伸5 min。按常规方法将PCR 产物克隆于pIRES-neo3载体EcoRⅠ和BamHⅠ之间,构建重组表达质粒pIRES-gH,并送北京擎科生物科技有限公司测序验证。将测序验证正确的重组表达质粒转化至大肠埃希菌Top10 感受态细胞中,接种于200 mL 氨苄青霉素抗性(终浓度为100 µg/mL)的LB 培养基中放大培养,37 ℃摇菌培养12 h。用无内毒素试剂盒提取质粒并测定浓度,于-20 ℃保存备用。
1.5目的蛋白的诱导表达及鉴定 从液氮中取出已悬浮驯化的HEK-293F 细胞,按常规方法复苏,经3 次传代,细胞状态良好时进行转染。参照洪坡等[15]转染与表达PDGFR-β/Fc 蛋白的最佳条件,将重组表达质粒pIRES-gH转染至HEK-293F 细胞中,并悬浮培养5 d。取细胞表达上清,进行Western blot 鉴定:样品经12% SDS-PAGE 后转移至PVDF 膜(280 mA,40 min),用5% BSA 配制的封闭液4 ℃封闭过夜;加入猪血清[16](PRV中和效价为1∶256,长沙市某规模猪场提供,1∶100 稀释),37 ℃孵育2 h;加入HRP 标记的山羊抗猪IgG(1∶12 000 稀释),37 ℃孵育1 h;ECL显色液显色。
1.6重组蛋白的纯化 收集培养5 d 的100 mL 细胞上清,参照罗烨等[17]亲和层析方法纯化蛋白,并进行12%SDS-PAGE鉴定。其中纯化介质为Ni Focurose 6FF(TED);平衡液为Bingding Buffer(20 mmol/L Tris-HCl,20 mmol/L NaCl,pH 8.0);洗脱液为不同咪唑浓度(100、200、500 mmol/L)的Bingding Buffer。BCA蛋白定量试剂盒测定纯化的gH蛋白浓度。
1.7动物分组及免疫 将gH 抗原与ISA 201 VG 佐剂按1∶1混合后充分乳化制备成亚单位疫苗,疫苗中gH抗原含量为10µg/mL。将16只ICR小鼠随机分为2组:实验组和对照组,每组8只,实验组小鼠经大腿外侧肌肉注射100µL gH亚单位疫苗,对照组免疫等量佐剂。初次免疫后5 和8 周各加强免疫1 次,并分别于初次免疫后4、7、10 周经眼球内眦静脉采血,分离血清,于-20 ℃保存。
1.8免疫小鼠血清抗体的检测
1.8.1特异性抗体 采用间接ELISA法,按常规方法进行[17]。其中gH 抗原包被量为200 ng/孔;待检血清按1∶100稀释;HRP标记的山羊抗鼠IgG(ab6789)按1∶12 000稀释。一抗和二抗的孵育时间均为30 min,底物孵育时间为15 min,酶标仪测定终点滴定的吸光度值(A450)。
1.8.2中和抗体 取初次免疫后10 周的血清样本,于56 ℃热灭活30 min,设3 组平行对照,由于小鼠血清量少,从8 倍开始稀释,稀释后的血清按常规方法进行中和试验[16]。
1.9小鼠攻毒保护试验 第3 次采血2 d 后,使用PRV-XiangA 毒株(1.5×104TCID50)对小鼠进行滴鼻攻毒,每日观察小鼠发病及死亡情况,小鼠一旦发病,会在24 h内死亡。小鼠从发病到死亡一般经历4个阶段:①鼻部红肿,饮欲食欲增加;②鼻部瘙痒并挠出血,精神兴奋;③瘙痒面积扩大至面部,被毛凌乱;④精神沉郁并濒临死亡。
1.10统计学分析 使用GraphPad Prism 8 软件two-way ANOVA对实验数据进行统计学分析,数据采用均值± 标准差(±s)表示,以P<0.05 为差异有统计学意义。
2 结果
2.1PRVgH基因扩增产物及重组质粒的鉴定gH基因PCR 扩增产物经1%琼脂糖凝胶电泳分析,可见1 976 bp的特异片段,大小与预期一致,见图1。重组表达质粒pIRES-gH经测序鉴定,与目的序列一致。

图1 PRV gH基因PCR扩增产物电泳图Fig.1 Electrophoretic profile of PCR amplification products of PRV gH gene
2.2表达产物的鉴定 Western blot 分析显示,在相对分子质量约75 000 处可见gH 蛋白特异性表达条带,而gH 的氨基酸序列相对分子质量只有68 000,表明PRV gH 蛋白成功在哺乳动物细胞中表达并进行了糖基化修饰,且与PRV阳性血清反应信号较强,反应原性良好。见图2。

图2 表达产物的Western blot鉴定Fig.2 Western blotting of expression product
2.3纯化产物的鉴定 12%SDS-PAGE 分析显示,收集的细胞上清纯化后,在相对分子质量约75 000 处可见明显的gH 蛋白特异性条带,见图3。经BCA 蛋白定量试剂盒测定,100 mL培养上清中含625µg gH蛋白。

图3 纯化产物的SDS-PAGE鉴定Fig.3 SDS-PAGE profile of purified product
2.4免疫小鼠血清抗体效价
2.4.1特异性抗体 对照组血清的A450为0.07,s为0.008,经计算,临界值(+3s)为0.094。根据临界值判断,初次免疫后所有实验组小鼠血清gH 抗体均为阳性,A450平均值达1.1;加强免疫后,实验组小鼠血清gH 抗体水平显著升高,7 和10 周平均A450分别为2.6 和2.75,显著高于4 周(t分别为10.34 和10.38,P均<0.000 1),7 与10 周比较,差异无统计学意义(t=1.037,P>0.05)。
2.4.2中和抗体 初次免疫后10周,对照组小鼠血清中无中和抗体;而实验组小鼠血清均产生中和抗体,效价在1∶12 ~1∶256之间,有3只小鼠效价为1∶48。
2.5小鼠攻毒保护试验 对照组小鼠平均发病时间为53 h,并全部发病死亡;实验组小鼠平均发病时间为63 h,死亡一半,免疫保护率为50%(4/8)。见图4。
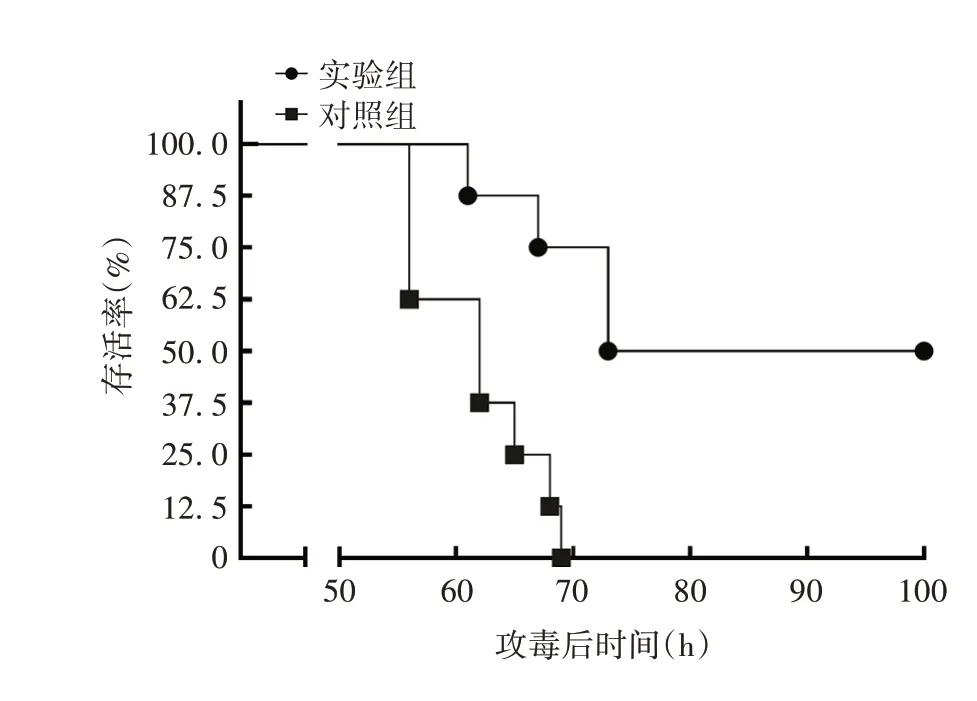
图4 小鼠攻毒后生存曲线Fig.4 Survival curve of mice after challenge
3 讨论
膜融合是囊膜病毒感染和进入细胞的关键,PRV 囊膜蛋白融合机制需要蛋白gB 和gH/gL 复合体的参与[12],虽然gH/gL 复合物在疱疹病毒膜融合中的作用尚不明确,但已有研究表明,gH 囊膜蛋白对PRV 进入靶细胞是必需的[10]。在动物体内,gH 对于PRV穿透三叉神经的一级神经元以及向二级神经元的局部扩散和跨神经元转移也是必不可少的,其支配着鼻腔黏膜的交感和副交感神经通路[18],因此,gH诱导的免疫应答对控制以呼吸道传播为主的PRV感染可能有特别作用。
在前人的研究中,主要使用杆状病毒、腺病毒或哺乳动物表达系统表达了PRV 的gB、gD 和gC 抗原,并发现gB 与gD 为最优保护性抗原[4-9],而至今尚无对gH 抗原免疫保护性的研究。本研究使用的ISA 201 VG水包油包水型(W/O/W)佐剂在不少兽用疫苗研究性试验中被采用,该佐剂表现出较好的抗原递呈能力,能快速引起免疫应答,产生高水平的抗体,并延长抗原在体内停留时间[19-21]。为了确保小鼠有足够的gH抗体产生,本研究采用3次免疫,为了充分发挥佐剂使抗原停留体内时间较长的特性,1次免疫和2 次免疫间隔时间较长,为5 周,2 次免疫后,小鼠抗体水平较1次免疫后明显升高,但3次免疫后抗体上升幅度不大。为了避免采血过量对小鼠免疫应答造成影响,同时参考前人免疫实验结果,即动物免疫前期中和抗体效价较低[22-23],本研究仅第3次采血量较多以进行中和抗体效价测定,结果显示,所有经gH免疫的小鼠均产生了中和抗体。使用PRV-XiangA毒株攻毒后,小鼠只要发病就会死亡。最终,gH免疫组小鼠存活一半,保护率为50%,且死亡小鼠平均发病时间为63 h;而对照组小鼠平均发病时间更短(为53 h),且所有小鼠均死亡。
在ZHANG 等[5]的研究中,亚单位疫苗gB、gC 和gD免疫鼠中和抗体效价分别可达1∶8 ~1∶16、1∶4 ~1∶8 和1∶32 ~1∶64;在LI 等[24]的研究中,亚单位疫苗gB与gD免疫鼠中和抗体效价分别可达1∶32 ~1∶64 和1∶64 ~1∶128。而本研究中gH 免疫小鼠所产生的平均中和抗体效价为1∶64 ~1∶128,与前人研究中亚单位疫苗产生的中和抗体效价相近。同时,在上述研究中,gB、gD和gC疫苗保护效力分别可达100%、50% ~87.5%和50%,本实验初步研究也达到了50%的保护率。本研究后续将优化抗原使用量、免疫程序以及筛选更合适的佐剂,以提高其免疫保护效果。
本研究使用哺乳动物表达系统表达的PRV-gH重组蛋白可诱导小鼠产生有效的特异性中和抗体,降低小鼠PRV 攻毒后的死亡率。这是首次对gH 抗原免疫保护性研究,同时也表明gH 蛋白具有作为PRV 亚单位疫苗的潜力。本研究为研制安全高效的PRV 亚单位疫苗提供了不同的候选抗原,为我国PR的防控与净化提供了新的手段。

