不同地面覆盖方式下新郁葡萄果皮黄酮转录组和代谢组联合分析
户金鸽,白世践,陈 光,蔡军社
(新疆维吾尔自治区葡萄瓜果研究所,新疆鄯善 838200)
0 引 言
【研究意义】新郁葡萄是以红地球自然杂交单珠E-42-6为母本,里扎马特为父本杂交选育而成的鲜食葡萄,椭圆形,果皮紫红色,平均单粒质量11.6 g,果肉较脆,味酸甜,可溶性固形物16%~19%,耐贮运性较好,适应性较强[1]。在新疆吐鲁番市新郁葡萄成熟季节正值夏季高温,造成果实着色不均或过深,影响了果实的外观品质。黄酮类化合物作为植物和水果等自身产生的一类次生代谢物质[2-3],能赋予植物红色、黄色、橙色、紫色以及蓝色等多种颜色[4],是园艺植物重要的农艺性状,是判断果实成熟、外观品质的重要指标之一[5]。【前人研究进展】地面覆盖技术具有改良土壤结构、蓄水保墒、调节微域生态环境等生态功能[6]。地面覆盖可显著降低空气温湿度及土壤温度,提高果实总酸含量、可溶性固形物和还原糖含量、花色苷、酚类物质和单宁含量等外在品质和内在品质[7-9],调节果实糖酸比及酿酒葡萄香气物质的积累[10]。代谢组学是将生物体作为一个动态整体,与转录组学、蛋白质组学等数据结合分析更能直接、真实反映机体本身的变化水平[11]。黄酮合成途径主要包括苯丙氨酸代谢途径、类黄酮合成代谢途径以及各种花青素的合成等[12],所涉及的结构基因主要有苯丙氨酸解氨酶(PAL,14个成员)、查尔酮合成酶(CHS,35个成员)、黄烷酮3′羟化酶(F3′H,6个成员)、黄烷酮3′5′羟化酶(F3′5′H,13个成员),调节基因主要有MYB、bHLH、WD40、WKRY、bZIP、BBX[13]。与类黄酮合成关系密切的13个基因中,肉桂酸-4-羟化酶(C4H)、查尔酮合成酶(CHS)、花青素合成酶(ANS)、花青素还原酶(ANR)和类黄酮O-甲基转移酶(FOMT)基因的表达量较高,类黄酮 3′-羟化酶(F3′H)、类黄酮 3′,5′-羟化酶(F3′5′H) 和黄酮醇合成酶(FLS)基因的表达量则相对较低[14],而在黄秋葵花和果荚转录发现,3-黄烷酮羟化酶(F3H)、二氢黄酮醇-4-还原酶(DFR)在黄秋葵花中表现上调效应,类黄酮 3′,5′-羟化酶(F3′5′H)、花青素还原酶(ANR)、 无色花色素还原酶(LAR)在黄秋葵果荚中表现显著上调效应,花青素合酶(ANS)、花青素3-O-葡糖基转移酶(GT)则分别在花和果荚中均有上调或下调效应[15],与葡萄黄酮代谢相关的许多基因及转录因子在冬季果和夏季果中表达不一致,冬季果中上调表达[16]。【本研究切入点】关于黄酮类化合物转录组和代谢组的研究很多,但关于不同地面覆盖方式下鲜食葡萄果皮黄酮转录组和代谢组的相关研究报道较少。需分析不同地面覆盖方式下新郁葡萄果皮黄酮转录组和代谢物含量的差异。【拟解决的关键问题】以7年生新郁葡萄为试材,以清耕栽培为对照,分别进行行间铺设园艺地布和行间生草栽培两种地面覆盖方式处理,从分子生物学和代谢组学水平研究不同地面覆盖方式下为黄酮的合成调控机制,为新郁葡萄高效优质栽培提供新模式。
1 材料与方法
1.1 材 料
1.1.1 葡 萄
试验于2021年在新疆维吾尔自治区葡萄瓜果研究所进行。以2015年种植生长势一致的鲜食葡萄新郁为试材,东西行向,株行距1.5 m×5.0 m,顺行龙干+(V+水平)叶幕管理,叶幕高度160 cm,果穗结果高度140 cm,单面叶幕长180 cm,新梢间距统一设置为15 cm,单穗果粒数为80粒左右,田间统一水肥管理及病虫害综合防控。
试验共设有2种地面覆盖方式:(1)行间铺设园艺地布覆盖(F),(2)生草栽培覆盖(S),以清耕栽培(Clean tillage)为对照(Q)。2021年5月20日在新郁葡萄行间种植马齿苋(S),待马齿苋完全覆盖地面时(2021年6月16日),在新郁葡萄行间铺设黑色园艺地布(F),每处理约300 m2,3次重复。待果实达到该品种生理成熟时,从果穗的上、中、下三个部位(清耕Q-1、Q-2、Q-3,园艺地布F-1、F-2、F-3,生草栽培S-1、S-2、S-3)采集样品约1 000 g,立即带回实验室,迅速剥取3 g果皮,每处理重复3次,共9份样品。用锡纸包裹后置于液氮中,随后将样品置于-80℃冰箱内冷冻保存,用于转录组和代谢组测定。
1.1.2 试 剂
甲醇(色谱纯),Merck;乙腈(色谱纯),Merck;甲酸(色谱纯),Sigma-Aldrich;标准品大于98%,MCE(70%甲醇配制,10 mmol/L)。
1.2 方 法
1.2.1 代谢物提取
称取20 mg样本粉末加入10 μL浓度为4 000 nmol/L的内标混合工作液和500 μL 70%的甲醇溶液,超声提取30 min,4℃条件下12 000 r/min离心5 min,吸取上清液,用0.22 μm滤膜过滤样品,并保存与进样瓶中用于LC-MS/MS分析。试验委托武汉迈特维尔生物科技有限公司完成。
1.2.2 LC-MS/MS进行代谢组分及数据处理
数据采集仪器系统包括超高效液相色谱(Ultra Performance Liquid Chromatography, UPLC)和串联质谱(Tandem Mass Spectrometry,MS/MS)。
液相条件:(1)色谱柱:Waters ACQUITY UPLC HSS C18柱(1.8 μm,100 nm×2.1 mm i.d.);(2)流动性:A相为超纯水(加入0.05%的甲酸),B相为乙腈(加入0.05%的甲酸);(3)流速0.35 mL/min;柱温40℃;进样量2 μL。(4)洗脱梯度:0 min A/B为90∶10(V/V), 1 min A/B为80∶20(V/V),9 min A/B为30∶70(V/V),12.5 min A/B为5∶95(V/V),13.5 min A/B为5∶95(V/V),13.6 min A/B为90∶10(V/V),15 min A/B为90∶10(V/V)。
色谱条件:点喷雾离子源(Electrospray Ionization,ESI)温度550℃,正离子模式下质谱电压5 500 V,负离子模式下质谱电压-4 500 V,气帘气(Curtain Gas,CUR)35 psi。在Q-Trap6500+中,每个离子对时根据优化的去簇电压(Declustering Potential,DP)和碰撞能(Collision Energy,CE)扫描检测。
采用Analyst 16.3软件处理质谱数据。横坐标为检测的保留时间(Time,min),纵坐标为离子检测的离子流强度(Intensity,cps)。将检测到的所有样本的积分峰面积比值代入标准曲线线性方程进行计算,得到实际样本中该物质含量。
样本中黄酮的含量(nmol/g)
=C×V/1 000 000/m.
式中,C:样本的积分峰面积比值代入标准曲线得到的样本浓度值(nmol/L);V:提取时所用溶液的体积(μL);m:称取的样本质量(g)。
1.3 数据处理
1.3.1 转录组分析
RNA提取后用琼脂糖凝胶电泳分析RNA的完整性及是否存在DNA污染,Qubit 2.0荧光仪检测RNA浓度,Agilent 2100生物分析仪检测RNA完整性后对文库的insert size 进行检测,insert size符合预期后进行下一步试验。
样品经文库构建和文库质检合格后,用Illumina HiSep平台测序,将测序结果与参考基因组(http://plants.ensembl.org/Vitis_vinifera/Info/Index)进行序列比对,进行功能注释。采用EPKM(Fragments Per Kilobase of transcript per Million fragments mapped)统计分析。将|log2Fold Change|>=1,且FDR(False Discovery Rate)<0.05作为差异基因的筛选条件。
1.3.2 转录组和代谢组联合分析
将代谢组和转录组数据结果利用GO注释、WEGO软件进行功能分类统计,对筛选出来的差异基因与差异代谢物进行联合分析。
2 结果与分析
2.1 不同地面覆盖方式下新郁葡萄果皮转录组测序
2.1.1 测序质量
研究表明,共获得63.26 G测序数据,各样品的总碱基数均达到6.26 G以上,碱基质量超过Q30的比例均高于91.57%,GC含量均高于44.16%,测序组装精度高,符合分析要求,可用于后续分析。表1
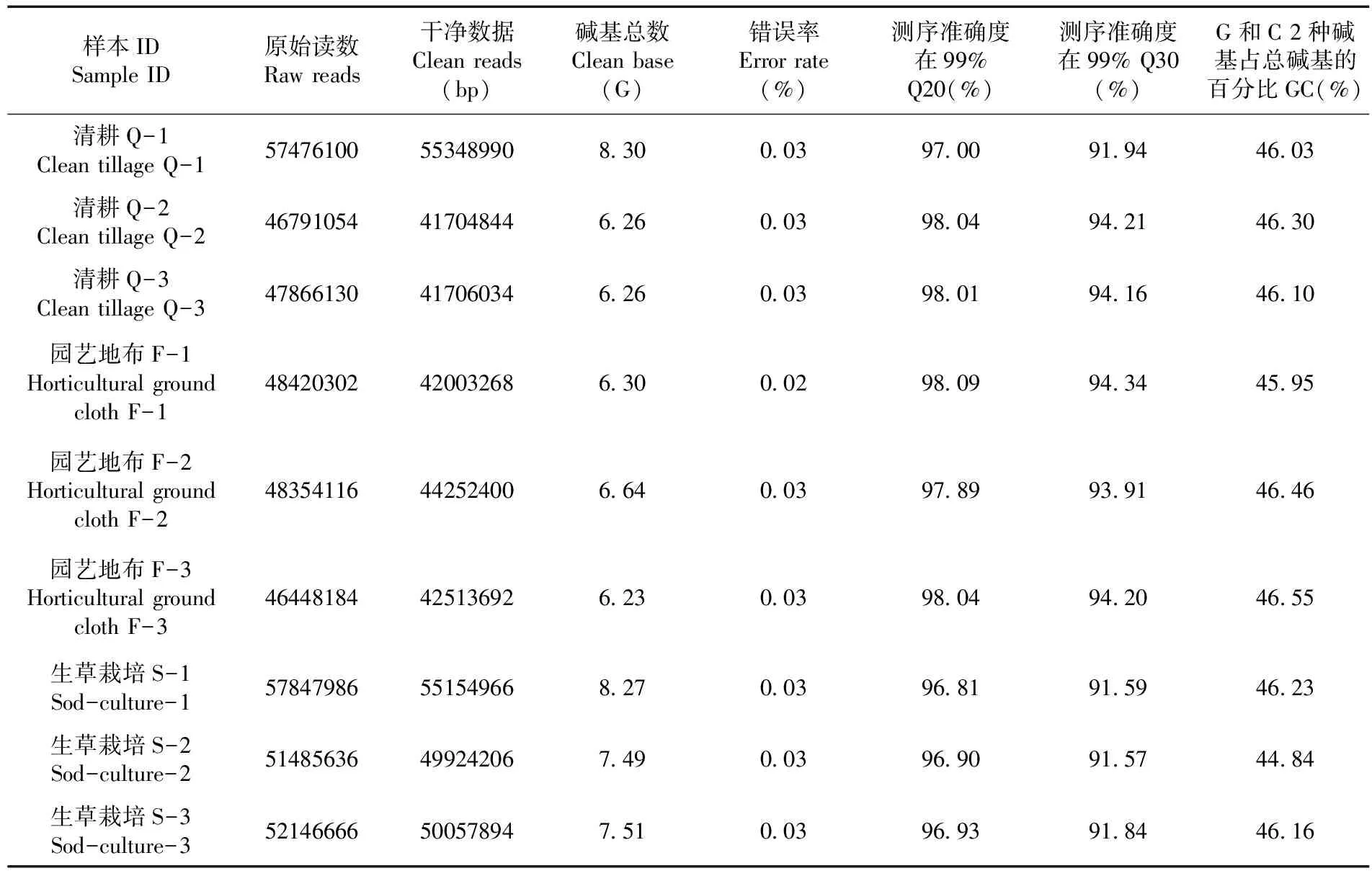
表1 不同地面覆盖方式转录组测序质量变化
2.1.2 不同地面覆盖方式下葡萄果皮黄酮差异基因
研究表明,新郁葡萄经园艺地布和生草栽培处理后,园艺地布覆盖处理的葡萄果皮中共找到587个表达差异显著的基因,其中上调基因317个、下调基因270个;生草栽培的葡萄果皮中共找到177个表达差异显著的基因,其中上调基因56个、下调基因121个。表2
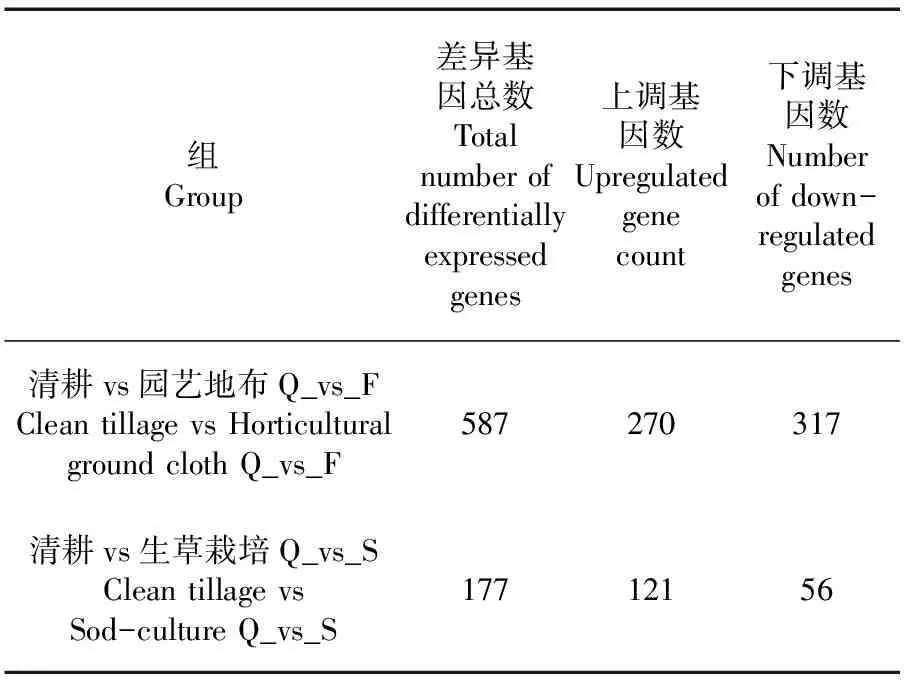
表2 差异基因数量
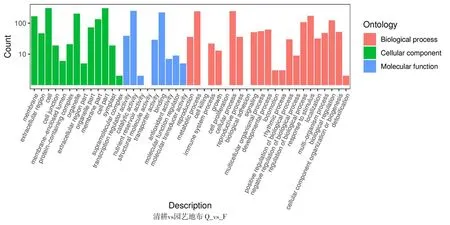
2.1.3 差异表达基因GO分类和功能富集
研究表明,16 969个基因得到了功能注释,其中差异基因得到功能注释最多的是对照与园艺地布,共364个。园艺地布注释的基因涉及45个功能组,生草栽培注释的基因组涉及37个功能组,均主要集中在细胞组分、分子功能和生物学过程等。图1,表3
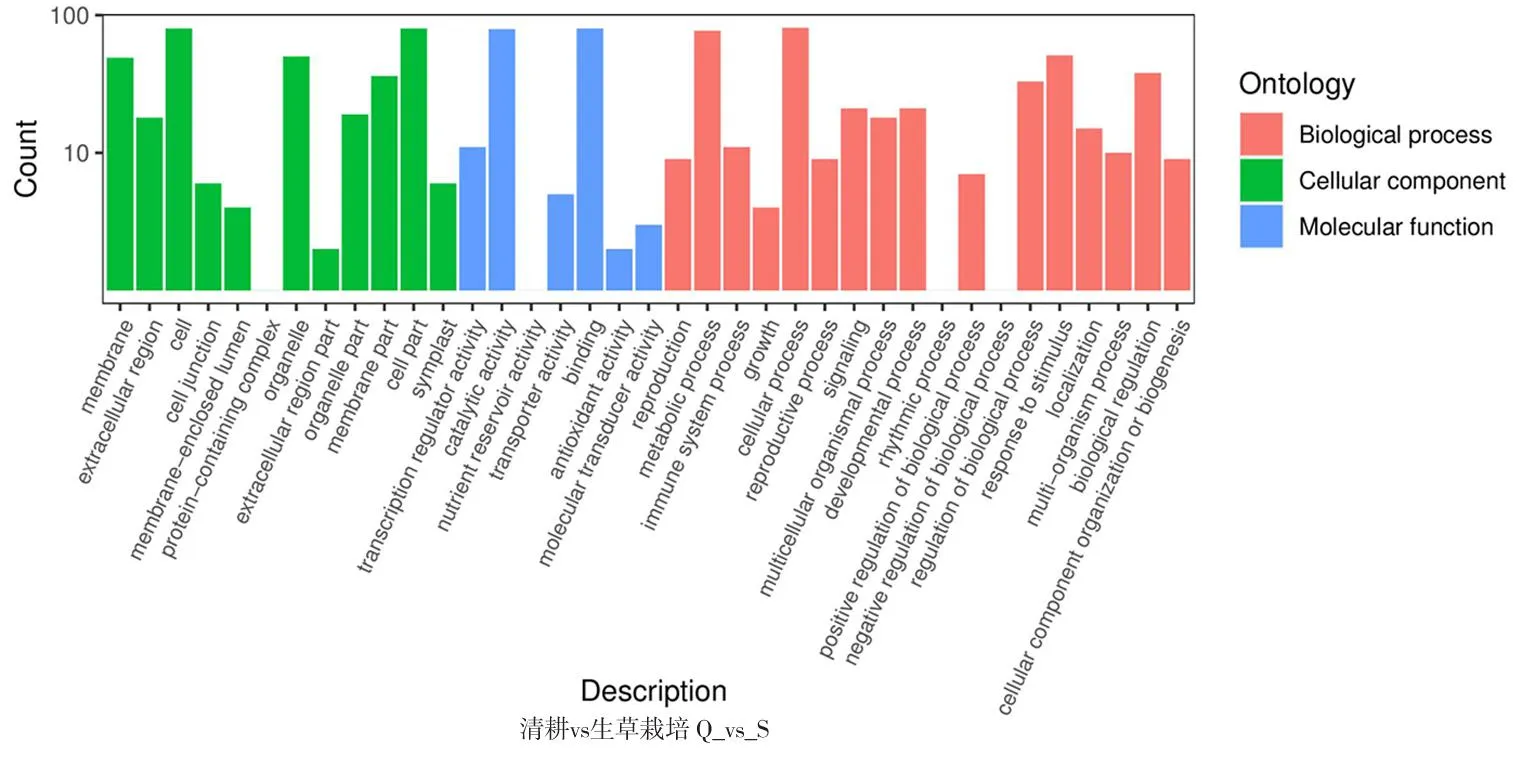
注(Note):生物学过程(Biological process);细胞组分(Cellular component);分子功能(Molecular function);细胞膜(Membrane);胞外区(Extracellular region);细胞(Cell);细胞连接(Cell junction);膜内腔(Membrane-enclosed lumen);蛋白复合体(Protein-containing complex);细胞器(Organelle);细胞外基质部分(Extracellular region part);细胞器组件(Organelle part);细胞膜组件(Membrane part);细胞组件(Cell part);共质体(Symplast);超分子复合物(Supramolecular complex);翻译调节活性(Transcription regulator activity);催化活性(Catalytic activity);营养储层活动(Nutrient reservoir activity);结构分子活性(Structural molecule activity);转运器活动(Transporter activity);绑定(Binding);抗氧化活性(Antioxidant activity);分子功能调节(Moleular function regulator);分子传感器活性(Molecular transducer activity);生殖(Reproduction);代谢过程(Metabolic process);生长(Growth);细胞增殖(Cell proliferation);细胞进程(Cellular process);生殖过程(Reproductive process);生物黏附(Biological adhesion);信号(Signaling);多细胞有机体进程(Multicellular organismal process);发育进程(Developmental process);运动力(Locomotion);节律进程(Rhythmic process);生物过程的正调控(Positive regulation of biological process);生物过程的负调控(Negative regulation of biological process);应激反应(Response to stimulus);定位(Localization);多有机体进程(Multi-organism process);生物调节(Biological regulation);细胞成分组织或生物合成(Cellular component organization or biogenesis);解毒(Detoxification);横坐标表示二级GO条目,纵坐标表示GO条目的差异基因的数量(The abscissa represents the second-level GO entry,and the ordinate represents the number of differential genes in the GO entry)

表3 GO数据库三大功能主类DEG数
2.1.4 差异表达基因KOG注释
研究表明,分别将园艺地布和生草栽培注释到KOG数据库的175个和86个DEGs进行直系同源分类,各自获得22个和16个功能分类。在园艺地布覆盖方式下,R(一般功能预测)获得46个注释结果,占16.73%,Q(次级代谢物的生物合成、转运和代谢),获得38个注释结果,占13.82%;在生草栽培模式下,Q(次级代谢物的生物合成、转运和代谢)获得21个注释结果,占24.42%,R(一般功能预测)获得17个注释结果,占19.77%。图2
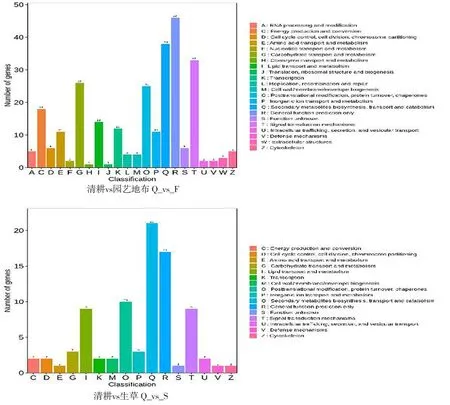
注:(Note)A,RNA的加工与修饰(RNA processing and modification);C,能源的产生与转化(Energy production and conversion);D,细胞周期调控,细胞分裂,染色体分配(Cell cycle control,cell division,chromosome partitioning);E,(氨基酸转运与代谢)Amino acid transport and metabolism;F,(核苷酸转运与代谢)Nucleotide transport and metabolism;G,碳水化合物转运与代谢(Carbohydrate transport and metabolism);H,辅酶转运与代谢(Coenzyme transport and metabolism);I,脂质转运与代谢(Lipid transport and metabolism);J,翻译、核糖体结构和生物合成(Translation,ribosome structure and biosynthesis); K,转录(transcription);L,复制、重组和修复(Replication,recombination and repair);M,细胞壁/细胞膜的生物发生(Cell wall/membrane/envelope biogenesis);O,次生代谢物合成、转运和代谢(Posttranslational modification,protein turnover,chaperones);P,无机离子转运与代谢(Inorganic ion transport and metabolism);Q,次级代谢物的生物合成、转运和代谢(Secondary metabolites biosynthesis,transport and cetabolism);R,一般功能预测(General function prediction only);S,未知功能(Function Unknown);T,信号转导机制(Signal transduction mechanisms);U,胞质运输、分泌和囊泡运动(intracellular trafficking,secretion and vesicle transport);V,防御机制(Defense mechanisms); W,细胞外结构(xtracellular structures);Z, 细胞骨架(cytoskeleton)
2.1.5 差异表达基因KEGG注释与富集
研究表明,园艺地布覆盖的193个差异基因被注释到KEGG通路中,与黄酮物质生物合成的相关富集途径有次级代谢物生物合成、苯丙醇生物合成、类黄酮生物合成、苯丙氨酸生物合成、植物昼夜节律、二苯乙烯类二芳庚类和姜辣素类。生草栽培的61个差异基因被注释到KEGG通路中,与黄酮相关富集途径有次级代谢物生物合成。图3、图4
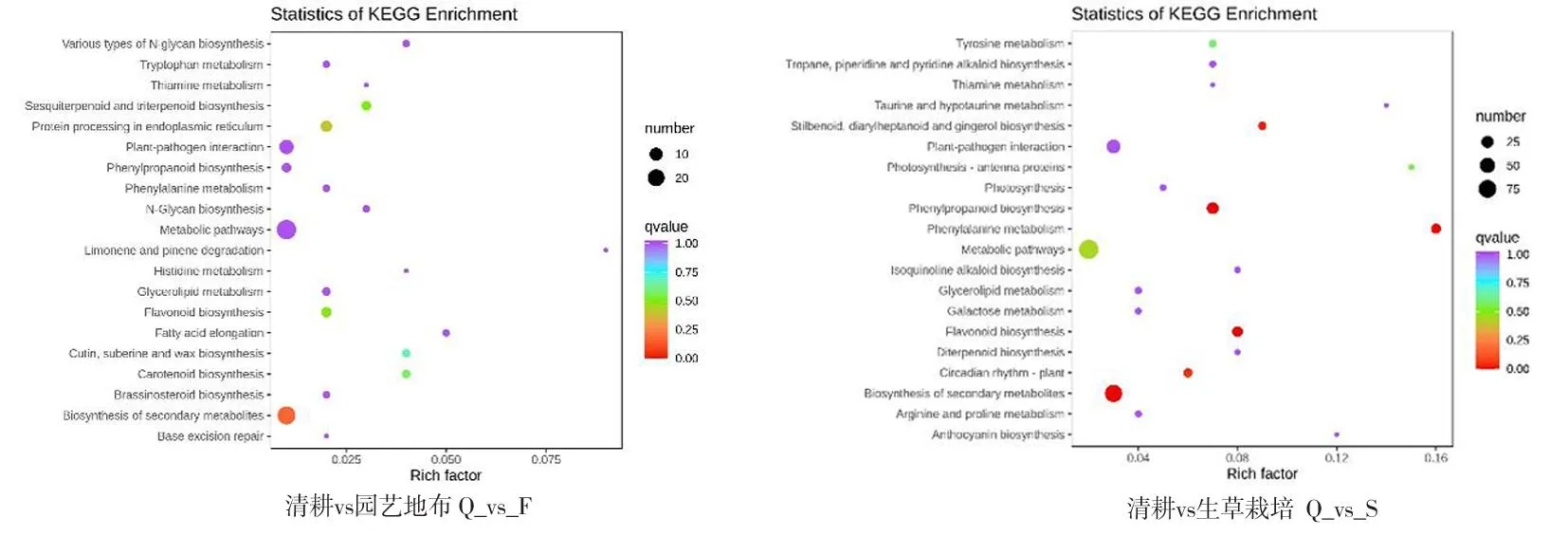
注(Note):纵坐标表示KEGG通路。横坐标表示Rich factor。Rich factor越大,富集的程度越大。点越大,通路富集的差异基因的数量越多。点的颜色越红,代表富集越显著(The ordinate represents the KEGG pathway. Abscissa represents the Rich Factor. The larger the Rich factor,the greater the degree of enrichment. Larger point indicates more number of differential genes enriched by pathway. Color shows significance with most significant in red);酪氨酸代谢(Tyrosine metabolism);莨菪烷、哌啶和吡啶生物碱的生物合成(Tropane,piperidine and pyridine alkaloid biosynthesis);硫胺素新陈代谢(Thiamine metabolism);牛磺酸和次牛磺酸代谢(Taurine and hypotaurine metabolism);二芳基庚烷和姜醇的生物合成(Stilbenoid,diarylheptanoid and gingerol biosynthesis);植物-病原互作(Plant-pathogen interaction);光合作用-天线蛋白(Photosynthesis-antenna proteins);光合作用(Photosynthesis);苯丙烷生物合成途径(Phenylpropanoid biosynthesis);苯丙烷类的代谢途径(Phenylalanine metabolism);代谢途径(Metabolic pathways);异黄酮生物合成途径(Isoquinoline alkaloid biosynthesis);甘油酯代谢(Glycerolipid metabolism);半乳糖代谢(Galactose metabolism);类黄酮生物合成途径(Flavonoid biosynthesis);二萜生物合成(Diterpenoid biosynthesis);昼夜节律-植物(Circadian rhythm-plant);次级代谢物生物合成(Biosynthesis of secondary metabolites);精氨酸和脯氨酸代谢(Arginine and proline metabolism);花青素生物合成(anthocyanin biosynthesis);各种类型的N -聚糖生物合成(Various types of N-glycan biosynthesis);色氨酸代谢(Tryptophan metabolism);酪氨酸代谢(Thiamine metabolism);类倍半萜烯和三萜(Sesquiterpenoid and triterpenoid);内质网中的蛋白质加工(Protein processing in endoplasmic reticulum);N-寡糖生物合成(N-Glycan biosynthesis);柠檬烯和蒎烯的降解(Limonene and pinene degradation);组氨酸代谢(Histidine metabolism);甘油酯代谢(Glycerolipid metabolism);脂肪酸延伸(Fatty acid elongation);角质、亚伯碱和蜡的生物合成(Cutin,suberine and wax biosynthesis);类胡萝卜素合成(Carotenoid biosynthesis);油菜素类固醇生物合成(Brassinosteroid biosynthesis);碱基切除修复(Base excision repair)。
2.2 不同地面覆盖方式下黄酮代谢组变化
2.2.1 黄酮代谢组
研究表明,园艺地布和生草栽培模式下的新郁葡萄果皮共检测到60种代谢物,共分为12类,其中花青素1种,查尔酮类6种,黄烷醇类6种,二氢黄酮类4种,二氢黄酮醇类6种,黄酮类11种,黄酮醇类17种,异黄酮类3种,酚酸类3种,异芒果苷1种,茶黄素1种,黄酮碳糖苷1种。
黄烷醇类含量最高,对照、园艺地布和生草栽培的黄烷醇含量占总黄酮含量的比例高达52.41%~63.70%,其次是黄酮醇,占总黄酮含量的24.32%~29.40%,再次是二氢黄酮醇含量,占总黄酮含量的5.93%~8.03%,黄酮碳糖苷所占比例最低,几乎可以忽略不计。生草栽培的黄烷醇类含量显著高于对照(P<0.05),比对照提高了19.42%,园艺地布的黄烷醇类含量虽较对照有所增加,但无显著差异;园艺地布的黄酮醇含量较对照有所提高,生草栽培降低了黄酮醇含量,但和对照间均无显著差异;园艺地布的二氢黄酮醇含量高于对照,生草栽培的二氢黄酮醇含量低于对照,但和对照间无显著差异性。
园艺地布覆盖差异代谢物7种,下调2种,包括异黄酮类如毛蕊异黄酮(Flavonoid_96),其他1种(Flavonoid_154),对照的黄酮类如毛蕊异黄酮含量极低,几乎为0.000 mg/kg,对照的含量为0.005 mg/kg,Flavonoid_154的含量比对照降低了99.70%;上调5种,包括黄酮醇类4种,如杨梅素类(Flavonoid_92、Flavonoid_178)、异鼠李苏(Flavonoid_58)、西伯利亚落叶松黄酮(Flavonoid_188),查尔酮1种(Flavonoid_177)。园艺地布覆盖栽培的杨梅素(Flavonoid_92)类是对照的3.10倍、杨梅(Flavonoid_178)是对照的2.67倍、异鼠李苏含量是对照的2.25倍、Phloretin(Flavonoid_177)是对照的2.25倍。园艺地布覆盖栽培的西伯利亚落叶松黄酮含量是0.058 mg/kg,而对照的含量几乎为0.000 mg/kg。
生草栽培覆盖差异代谢物11种,且全部下调,查尔酮1种如新橙皮甙二氢查尔酮(Flavonoid_22),二氢黄酮醇2种如二氢杨梅素(Flavonoid_40)和异水飞蓟宾(Flavonoid_04),黄酮1种Nicotiflorin(Flavonoid_42),黄酮醇6种如杨梅素(Flavonoid_92)、紫云英苷(Flavonoid_119)、异鼠李素-3-O-新橙皮苷(Flavonoid_54)、Baimaside(Flavonoid_138)、Afzelin(Flavonoid_175)和堪非醇 3-新橙皮糖苷(Flavonoid_52),异黄酮1种,毛蕊异黄酮苷(Flavonoid_96)。新橙皮甙二氢查尔酮、二氢杨梅素、Nicotiflorin、杨梅素、紫云英苷、异鼠李素-3-O-新橙皮苷、Baimaside、Afzelin和堪非醇 3-新橙皮糖苷分别比对照增加了82.61%、51.21%、55.13%、62.275%、52.91%、57.82%、62.26%、68.38%和58.82%;生草栽培的异水飞蓟宾和毛蕊异黄酮苷含量极低,而对照的含量分别为0.008和0.005 mg/kg。表4

续表 4 不同地面覆盖方式下葡萄果皮黄酮代谢物组分和含量变化
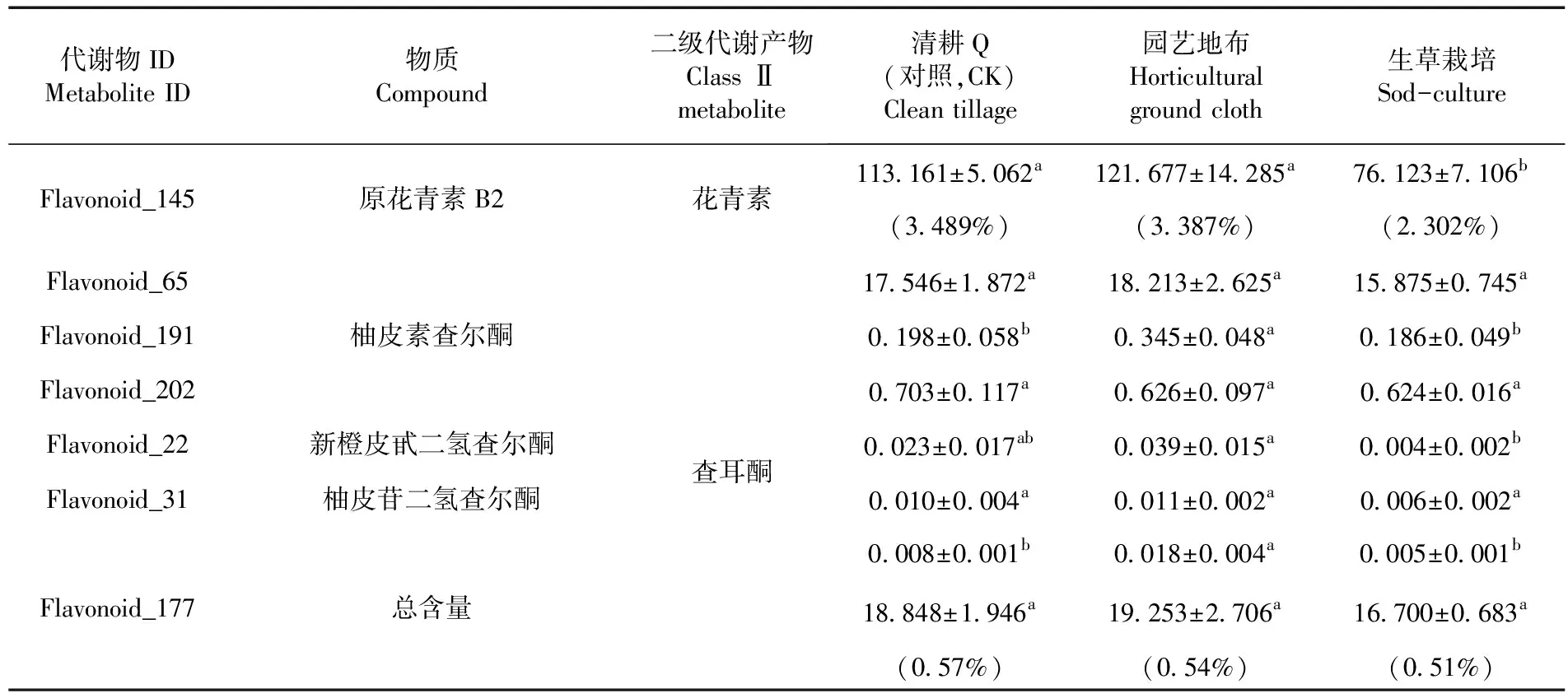
表4 不同地面覆盖方式下葡萄果皮黄酮代谢物组分和含量变化
2.2.2 不同地面覆盖方式下黄酮差异代谢物KEGG功能注释及富集
研究表明,园艺地布覆盖的8个代谢物被注释到代谢过程,黄酮和黄酮醇生物合成是主要的,其次是类黄酮生物合成,再次是次级代谢产物的生物合成。生草覆盖栽培的9个代谢物被注释到代谢过程,黄酮和黄烷醇代谢物生物合成是主要的,其次是次生代谢产物的生物合成,再次是类黄酮的生物合成。2种地面覆盖方式下与黄酮类物质合成最重要的途径是黄酮和黄酮醇生物合成途径。图5
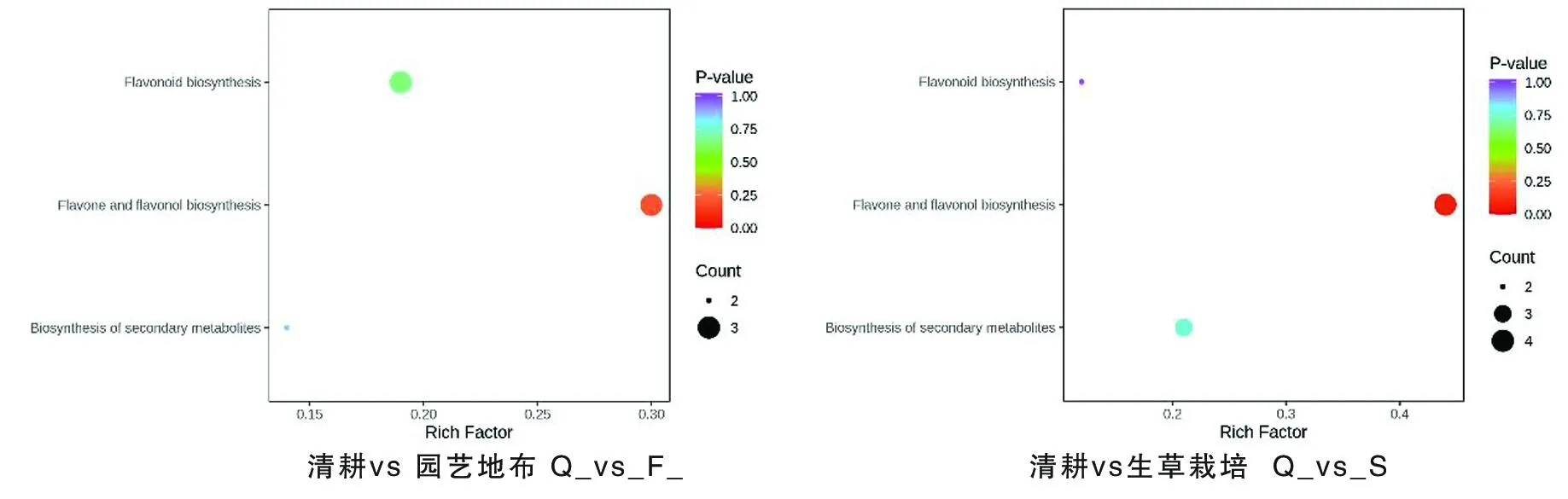
注(Note):纵坐标表示每个通路对应的Rich factor,纵坐标为通路名称,点的颜色为P value,越红表示富集越显著。点的大小代表富集到的差异代谢物的个数多少(The ordinate represents the Rich factor corresponding to each pathway,the ordinate represents the pathway name,and the color of the point is P value. The redder indicates the more significant enrichment. The size of the dot represents the number of enriched differential metabolites);类黄酮生物合成(Flavonoid biosynthesis); 黄酮和黄烷醇代谢物生物合成(Flavone and flavonol biosynthesis); 次级代谢物生物合成(Biosynthesis of secondary metabolites)
Q-F组的5种差异代谢物中,杨梅素(Flavonoid_92)、杨梅素(Flavonoid_178)、查尔酮(Flavonoid_177)和异鼠李素(Flavonoid_58)地布高于对照,差异倍数为1.16~1.63,黄酮碳糖苷(Flavonoid_154)含量地布低于对照,差异倍数为1.47。Q-S组的9种差异代谢物中,二氢杨梅素(Flavonoid_40)、紫云英苷(Flavonoid_119)、黄酮(Flavonoid_42)、异鼠李素-3-O-新橙皮苷(Flavonoid_54)、堪非醇3-新橙皮糖苷(Flavonoid_52)、黄酮醇(Flavonoid_138)、杨梅素(Flavonoid_92)、黄酮醇(Flavonoid_175)和新橙皮甙二氢查尔酮(Flavonoid_22)含量生草低于对照,差异倍数为1.04~2.68。图6
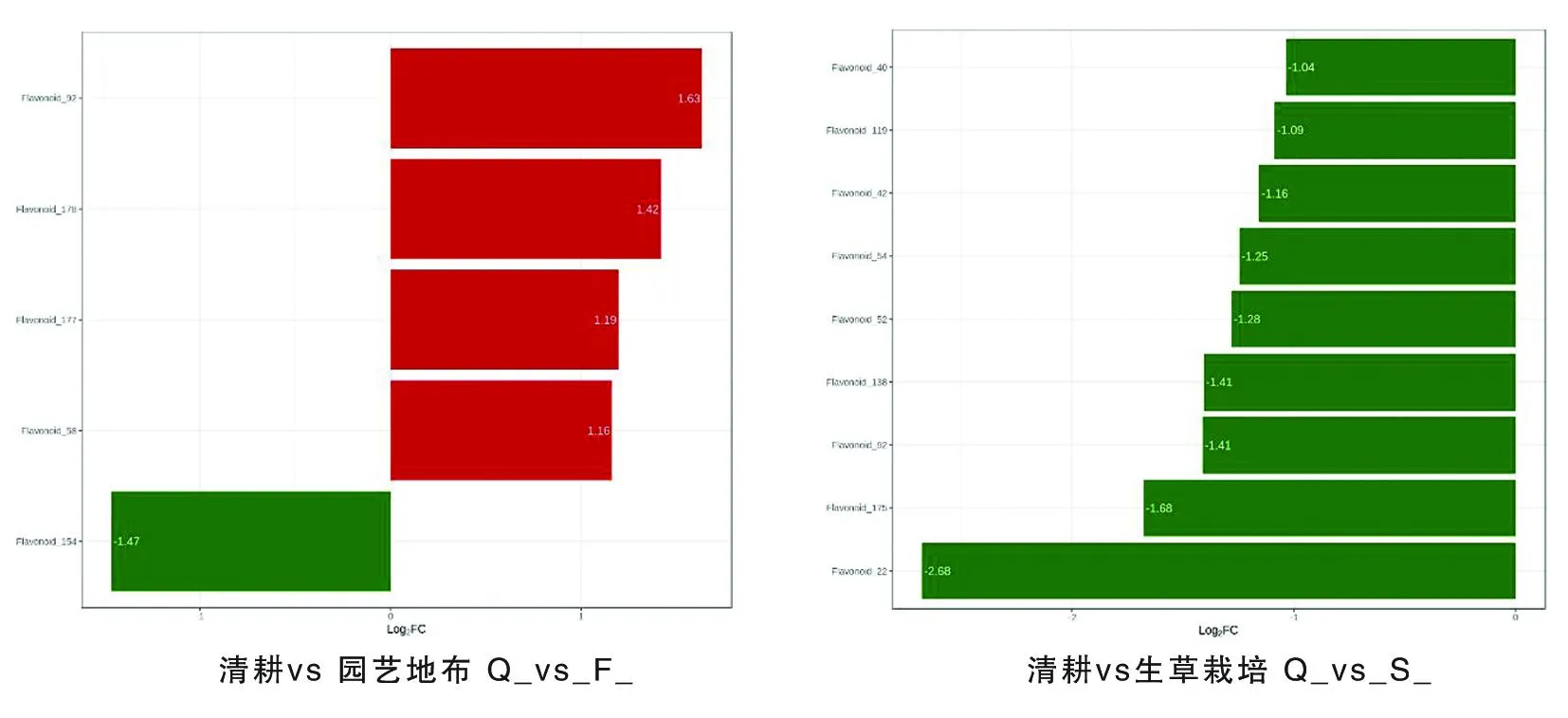
图6 不同地面覆盖方式下葡萄果皮差异代谢物差异倍数
2.3 不同地面覆盖方式下黄酮定量转录组和代谢组联合
研究表明,与黄酮合成相关富集途径主要集中在黄酮和黄酮醇、类黄酮生物合成。参与园艺地布覆盖类黄酮合成的基因有1个C4H、6个CHS、6个F3H、3个LAR、4个HCT、4个FLS和2个C12RT1,参与黄酮和黄酮醇生物合成的有2个C12RT1;参与生草覆盖类黄酮生物合成有6个CHS、6个F3H、8个F3′5′H、3个FLS和3个LAR,参与黄酮和黄酮醇生物合成的有3个F3′5′H。表5,图7
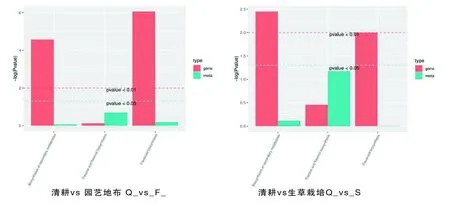
注(Note):横坐标代表代谢通路,纵坐标中红色代表差异基因的富集P value值,绿色代表差异代谢物的富集P value值,用log(P-value)表示,纵坐标越高,代表富集程度越强(The abscissa represents metabolic pathway,the red in the ordinate represents the enriched P value of differential genes,and the green represents the enriched P value of differential metabolites,represented by log(P-value). The higher the ordinate is,the stronger the enrichment degree is);次级代谢物生物合成(Biosynthesis of secondary metabolites);黄酮和黄烷醇代谢物生物合成(Flavone and flavonol biosynthesis);类黄酮生物合成(Flavonoid biosynthesis)
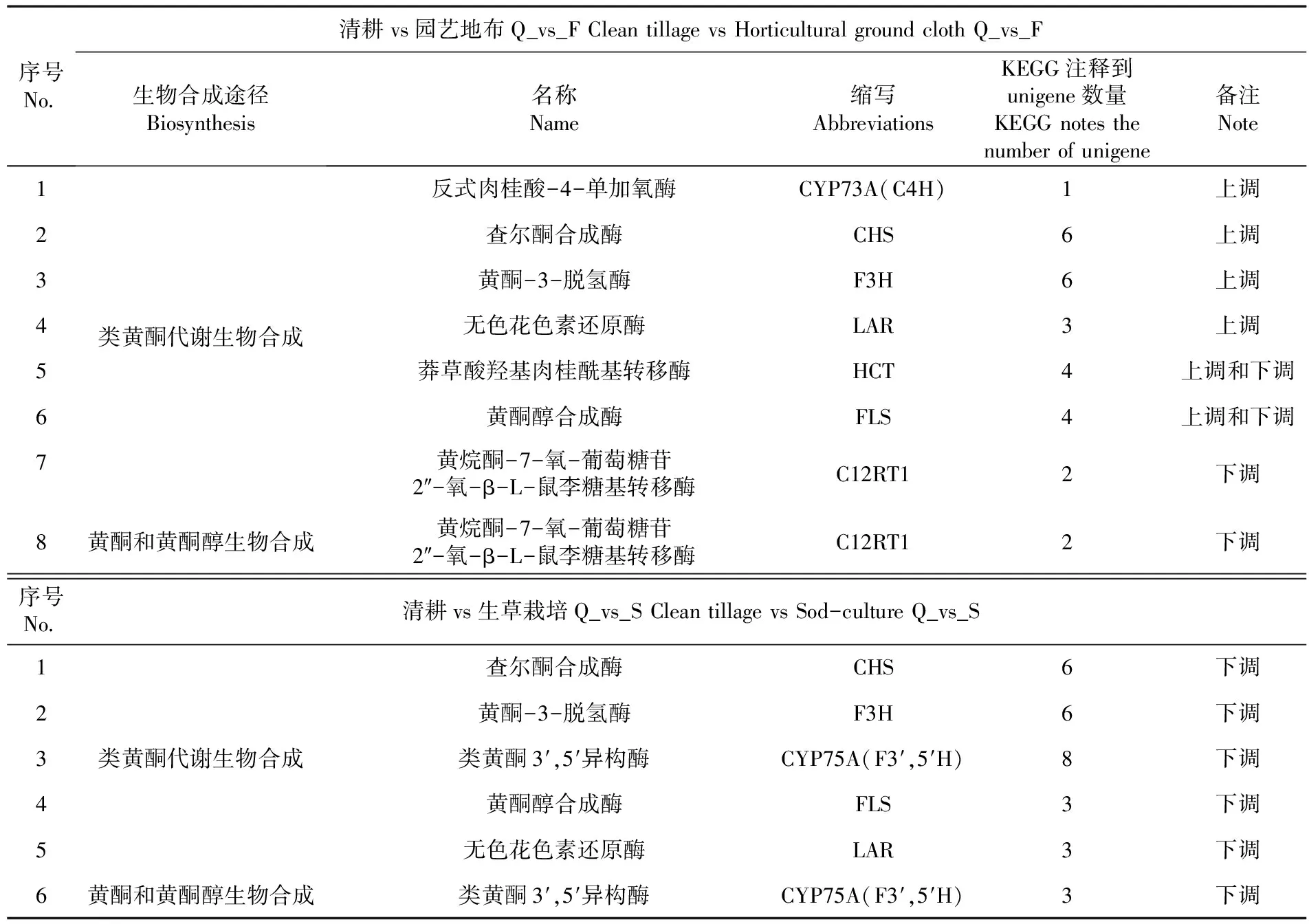
表5 新郁葡萄果皮黄酮生物合成途径中候选基因
3 讨 论
3.1黄酮是葡萄中含量最为丰富的一类次生代谢物,其在细胞质中合成,然后储存在液泡中[17],这些化合物不仅能保护葡萄免受紫外线、病虫害等伤害,还对葡萄的风味品质以及营养价值起着决定性作用[18]。
目前已报道的黄酮种类达9 000种[19-20],根据吡喃环的饱和取代状态,可以分为花青素、黄酮、黄烷醇、黄烷酮、黄酮醇、查尔酮、原花青素和异黄酮等[21]。目前已报道的酿酒葡萄黄酮种类有40种[22]。研究利用UPLC-MS/MS方法测定不同地面覆盖方式下的黄酮组分,均得到12大类60种黄酮物质,较前人[22]研究相比,极大地丰富了葡萄黄酮组分。在12类黄酮物质中,黄烷醇和黄酮醇所占比例较高,构成了黄酮物质的主要组成部分,与BAYDAR等[23]的研究结果相同。黄烷醇类的比例大于50%,生草栽培的高达63.73%,对照的占54.41%,园艺地布所占比例较低(52.83%),第二大比例的是黄酮醇,对照占总黄酮的比例最高为29.40%,园艺地布的为28.84%,生草栽培的较低为24.32%。在前期的研究结果中发现,园艺地布和生草栽培的花色苷含量显著高于对照,生草栽培可以提高果实外观和内在品质[24]。经进一步分析发现地布覆盖的差异代谢物共有7种(下调2种,上调5种),生草覆盖差异代谢物12种(全部下调),计算发现园艺地布覆盖的总黄酮含量(3 592.749 mg/kg)高于对照的总黄酮含量(3 243.242 mg/kg),而Wang等[25]研究却发现地布覆盖降低黄酮含量。黄酮种类和含量除受遗传因素影响外,还与光照、温湿度和栽培管理措施密切相关,这些因素相互作用,共同调节果实的黄酮代谢[26]。
关于黄酮组分及其合成酶基因一直是近年来研究的热点,也是目前研究较为清楚的次生代谢途径之一[27]。该通路上主要存在2个基因群:上游基因群(early biosynthesis genes,EBGs)与下游基因群(later biosynthesis genes,LBGs)[28-29]。上游基因群主要包括查尔酮合成酶(Chalcone synthase,CHS)、查尔酮异构酶(Chalcone isomaerase,CHI)、黄酮-3-脱氢酶(Naringenin 3-dioxygenase,F3H)、类黄酮3′,5′异构酶(Flavonoid 3′,5′-hydroxylase,F3′5′H)等基因[30-31],下游基因群包括二氢黄酮醇4-还原酶(Dihydroflavonol 4-ruductase,DFR)、黄酮醇合成酶(Flavonol synthase,FLS)、花青素苷合成酶(Anthocyanidin,ANS)、花青素还原酶(Anthocyanin reductase,ANR)、糖基转移酶(Glucosyltransferase,GT)、酰基转移酶(Acyl transferase,AT)和甲基转移酶(Methyl transferase,MT)等[32]。
3.2试验通过Illumina HiSep高通量测序技术,对2种地面覆盖方式下的葡萄果皮进行RNA-Seq转录组测序并进行组装,共获得63.26G测序数据,各样品的总碱基数6.26 G~8.30 G,碱基质量超过Q30的比例91.57%~94.20%,GC含量44.16%~46.55%,该试验测序组装精度高,保障试验的准确性。园艺地布覆盖下新郁葡萄果皮中有587个表达差异显著的基因,其中上调基因317个、下调基因270个,生草覆盖下果皮中共有177个表达差异显著的基因,其中上调基因56个、下调基因121个。并通过KEGG通路分析,园艺地布覆盖中与黄酮相关富集途径有次级代谢物生物合成、苯丙醇生物合成、类黄酮生物合成、苯丙氨酸生物合成、植物昼夜节律、二苯乙烯类二芳庚类和姜辣素类的生物合成,生草栽培中与黄酮相关富集途径有次级代谢物生物合成。造成园艺地布覆盖和生草栽培覆盖下差异基因和黄酮代谢途径不同的原因可能是由于地面覆盖方式导致的。
转录组和代谢组联合分析发现,参与园艺地布覆盖类黄酮合成的候选基因有C4H、CHS、F3H、LAR、HCT、FLS和C12RT1,其中C4H、CHS、F3H、LAR上调,HCT和FLS即有上调也有下调,C12RT1下调,参与园艺地布黄酮和黄酮醇生物合成的候选基因C12RT1下调。参与生草覆盖类黄酮生物合成的候选基因有CHS、F3H、F3′5′H、FLS和LAR,参与生草黄酮和黄酮醇生物合成的候选基因有F3′5′H,均表现为下调。黄酮物质的合成是一个复杂的生理生化过程,与环境如生物(细菌、真菌、昆虫等)和非生物胁迫(低温、高温、盐害、干旱、温度、重金属等)等息息相关[33]。但研究中,新郁葡萄果皮代谢通路中仍有部分基因未被发现,如查尔酮异构酶、花青素还原酶(Anthocyanin reductase,ANR)和黄酮合成酶(Flavone synthase,FNS),可能是这些基因未在成熟果皮中表达所致。此外造成同一类候选基因在不同地面覆盖方式中表现为上调或下调的原因可能是地面覆盖方式不同造成果穗微环境的差异造成的,Gaiotti等[34]、Mori等[35]也发现,CHS、F3H、F3′5′H的表达与温度有关系。
下一步将开展不同地面覆盖方式对葡萄果皮基因表达量方面的研究,对该研究结果进行验证。
4 结 论
4.1获得了新郁葡萄果皮的转录组数据,并通过转录组数据的生物信息分析和代谢物组分分析,对新郁葡萄果皮的代谢通路有了初步认识:园艺地布覆盖与黄酮合成相关富集途径主要集中在类黄酮生物合成,生草覆盖栽培与黄酮合成相关富集途径主要集中在次级代谢物和类黄酮生物合成,园艺地布覆盖和生草覆盖栽培的总黄酮含量高于对照。筛选出参与园艺地布覆盖黄酮合成的候选基因有7个,分别是C4H、CHS、F3H、LAR、HCT、FLS、C12RT1;参与生草覆盖栽培黄酮生物合成的候选基因有5个分别是是CHS、F3H、F3′5′H、FLS和LAR。
4.2对照园艺地布和生草栽培共检测到12大类、60类黄酮物质,黄烷醇占总黄酮的比例最高,其中生草栽培黄烷醇类占总黄酮的比例为63.73%,园艺地布的比例最低为52.83%,对照为54.41%;其次是黄酮醇的比例,生草栽培占总黄酮的24.32%,园艺地布占28.84%,对照占29.40%。园艺地布的黄酮物质含量最高3 592.749 mg/kg,其次是生草栽培为3 306.859 mg/kg,对照的总黄酮物质含量最低为3 234.242 mg/kg。在吐鲁番极端干旱区鲜食葡萄新郁可选择生草栽培。

