西方蜜蜂AmAGO1蛋白的分子特性、时空表达谱及抗体制备
叶亚萍, 刘治滩, 李琪明, 臧 贺,2,3, 冯佩林, 王 宁,王 杰, 黄枳腱, 陈大福,2,3,*, 郭 睿,2,3,*
(1. 福建农林大学蜂学与生物医药学院, 福州 350002; 2. 天然生物毒素国家地方联合工程实验室, 福州 350002;3. 福建省蜂疗研究所, 福州 350002; 4. 四川省农业农村厅畜牧总站, 成都 610041)
Argonaute (AGO)家族在模式植物拟南芥Arabidopsisthaliana中被首次发现(Bohmertetal., 1998),是一类在进化上高度保守的蛋白家族,虽然不同物种含有的AGO蛋白数量存在较大差异,但不同的AGO蛋白都包含N末端、PAZ结构域、MID结构域和PIWI结构域(Vaucheret, 2009; Poterala and Rzeszowska-wolny, 2016; Xuetal., 2016)。Wang等(2013)在家蚕Bombyxmori中鉴定到4个AGO蛋白(BmAgo1, BmAgo2, BmAgo3和BmPiwi)及其编码基因,进一步分析发现BmAgo1,BmAgo2和BmAgo3在家蚕的不同组织与发育阶段均有表达,而BmPiwi主要在精原细胞中表达,当受到家蚕核型多角体病毒(Bombyxmorinucleopolyhedrovirus, BmNPV)侵染后上述4个基因在家蚕体内均被激活表达。AGO蛋白在小RNA诱导的基因沉默过程中发挥关键功能,如miRNA通过结合AGO被整合进miRNA诱导沉默复合体(miRNA-induced silencing complex, miRISC),进而识别靶mRNA的3′UTR上的同源靶位点切割靶mRNA或抑制其翻译(Bartel, 2004)。miRISC通常能够保护miRNA免受核酸酶的降解,但当miRISC配对到一些特殊的靶RNA时可触发靶标降解(Shietal., 2020)。
相比于智人Homosapiens(Sheu-Gruttadauria and Macrae, 2018)和拟南芥(Oliver and Martinez and Martinez, 2022)等模式生物,昆虫AGO蛋白的研究较为滞后。有研究表明AGO在昆虫的蛋白翻译、生长发育及免疫应答(van Rjjetal., 2006; Iwasaki and Tomari, 2009)等生物学过程中发挥重要功能。例如, van Rjj等(2006)曾通过RNAi沉默黑腹果蝇Drosophilamelanogaster的RNA诱导沉默复合体(RNA-induced silencing complex, RSCI)中的催化组分ago-2的编码基因,发现沉默ago-2基因后宿主对果蝇C病毒(DrosophilaC virus, DCV)感染的敏感程度远高于正常果蝇,说明RISC活性在果蝇的抗病毒免疫防御中起到核心作用;王艳丽等(2016)通过注射dsRNA沉默飞蝗LocustamoratoriaAGO1基因的表达,发现飞蝗的生长发育和存活率均受到显著影响;Karamipour等(2019)发现银纹夜蛾多核多角体病毒(Autographacalifornicamultiple nucleopolyhedrovirus, AcMNPV)感染草地贪夜蛾SpodopterafrugiperdaSf9细胞后,Ago1的表达量显著升高,然而当相应dsRNA转染Sf9细胞沉默Ago1后,病毒DNA的复制能力增强,说明Ago1潜在参与宿主的侵染应答。
此前,在西方蜜蜂Apismellifera中已鉴定到3种AGO基因,其中AmAGO1(GenBank登录号: LOC552062)和AmAGO2(GenBank登录号: LOC411577)编码的蛋白属于AGO蛋白亚家族,而AmAGO3(GenBank登录号: LOC725111)编码的蛋白属于PIWI蛋白亚家族。目前,关于蜜蜂AGO蛋白的研究还十分有限。廖珍(2009)克隆到意大利蜜蜂A.melliferaligusticapiwi-like-1蛋白基因Am-ago3的全长序列,并通过测定表达谱发现Am-ago3在雄蜂中的表达量显著高于工蜂中的表达量;Zhao等(2019)曾对意大利蜜蜂和狄斯瓦螨Varroadestructor之间的相互作用进行研究,发现AGO2的表达量在狄斯瓦螨寄生2 d后显著上升达到峰值,且与抗菌肽基因AMP及转录因子Dorsal的表达趋势相同,表明AGO2可能发挥了类似于抗菌肽或转录因子的作用。目前,GenBank数据库收录了西方蜜蜂的AGO1基因(AmAGO1)的预测序列,但AmAGO1的分子克隆和功能研究仍然缺失。因此,通过预测AmAGO1的理化性质和分子特性,测定AmAGO1在西方蜜蜂中的时空表达谱及制备AmAGO1的多克隆抗体,可为深入开展AmAGO1的功能与机制研究提供参考和基础。本研究对AmAGO1的编码序列(coding sequence, CDS)进行分子克隆,利用生物信息学解析AmAGO1蛋白的理化性质和分子特性,构建原核表达质粒并诱导表达AmAGO1融合蛋白,进而制备AmAGO1的多克隆抗体,并通过ELISA, Western blot和免疫沉淀(immunoprecipitation, IP)分别检测抗体效价、灵敏度和特异性,旨在丰富AmAGO1的基本信息,为进一步开展AmAGO1的功能和机制研究提供了参考和基础。
1 材料与方法
1.1 供试昆虫
西方蜜蜂工蜂卵、3日龄幼虫、7日龄预蛹、8日龄预蛹、12日龄蛹以及1, 2, 6, 12, 15和18日龄成虫均取自福建农林大学蜂学与生物医药学院教学蜂场的饲养蜂群。
1.2 AmAGO1基因CDS区的PCR扩增、TA克隆及Sanger测序
利用RNA提取试剂盒(普洛麦格(北京)生物技术有限公司,北京)提取西方蜜蜂工蜂6日龄幼虫(n=3)肠道总RNA,再利用Hifair®AdvanceFast 1st Strand cDNA Synthesis Kit (上海翌圣生物科技有限公司,上海)进行反转录得到cDNA模板。根据NCBI数据库中收录的西方蜜蜂AmAGO1(GenBank登录号: LOC552062) CDS区核苷酸序列,利用Primer Premier 5软件(Singhetal., 1998)设计特异性扩增引物(TA-AGO1-F: 5′-TGCTCGACTATTTTA CATA-3′; TA-AGO1-R: 5′-TTTGTATCAATTGCATG TG-3′)。使用高保真酶PCR Mix (擎科生物技术有限公司,北京)进行PCR扩增,反应在梯度PCR仪(Bio-Rad公司,美国)上进行,反应体系(20 μL): PCR mix 10 μL, 无菌水 7 μL, 上下游引物(2.5 pmol/μL)各1 μL, cDNA模板1 μL。反应程序: 95 ℃预变性5 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸2 min, 共34个循环。产物经1.8%的琼脂糖凝胶电泳后再紫外凝胶成像仪(上海培清科技有限公司,上海)下观察。参照郭意龙等(2022)的方法,利用FastPure®Gel DNA Extraction Mini Kit (诺唯赞生物科技股份有限公司,南京)回收目的片段,连接产物转化大肠杆菌Escherichiacoli感受态细胞DH5α (上海唯地生物技术有限公司,上海),涂板后培养过夜,次日挑取单菌落于LB液体培养基(氨苄抗性)振荡培养12 h,取少量菌液进行PCR鉴定,结果阳性的菌液送至生工生物工程(上海)股份有限公司进行Sanger测序。
1.3 AmAGO1蛋白的生物信息学分析
利用Expasy网站(https:∥www.expasy.org/)上的Protparam, ProtScale, SignalP 4.1 Server, NetPhos 3.1 Server和SMART等软件(Letunicetal., 2012; Duvaudetal., 2021)预测和分析AmAGO1编码蛋白的磷酸化位点、亲水性、信号肽、二级结构、三级结构和结构域。在NCBI (https:∥www.ncbi.nlm.nih.gov)数据库中下载智人、黑腹果蝇、家蚕、西方蜜蜂、东方蜜蜂A.ceranacerana、欧洲熊蜂Bombusterrestris和斑马鱼Daniorerio的AGO1蛋白氨基酸序列,使用MEGA7.0软件(Kumaretal., 2016)进行多重序列比对,进而采用邻接法(neighbor-joining, NJ)构建系统进化树,进行3次重复,其余参数为软件默认。
1.4 AmAGO1的时空表达谱检测
利用Primer Premier 5软件设计AmAGO1的qPCR引物(AmAGO1-F: 5′-CAAGTTCTTCTGTTGG AGCA-3′, AmAGO1-R: 5′-AGGTTGAGGAGGAGTGT GTG-3′)。参照吴鹰等(2023)的方法,收集刚出房的西方蜜蜂工蜂成虫置于冰上麻醉,利用干净的眼科镊和眼科剪在超净工作台上小心剖取触角、咽下腺、脑、表皮、中肠、脂肪体和毒腺等组织,3次生物学重复,每次生物学重复含3头工蜂成虫。分别提取上述7种组织,工蜂卵、3日龄幼虫、7日龄预蛹、8日龄预蛹和12日龄蛹,以及1, 2, 6, 12, 15和18日龄工蜂成虫的总RNA,作为模板进行反转录,得到的cDNA作为模板进行qPCR以检测AmAGO1的时空表达谱。反应体系和程序均按照吴鹰等(2023)的报道设置。每个反应进行3次技术重复和3次平行重复。
1.5 原核表达载体构建
鉴于AmAGO1的核苷酸序列较长,因此选择AmAGO1的部分片段进行原核表达载体构建。利用DNASTAR软件(Burland, 1999)中的protean工具对AmAGO1的氨基酸序列进行分析,选取抗原指数较高、亲水性较强及表面可及性较强的区域进行扩增。利用Primer Premier 5软件设计上述区域的上下游引物并在上下游引物的5′端分别添加NcoⅠ和XhoⅠ的酶切位点及保护碱基,引物分别命名为AGO1-F(5′-CATGCCATGGGCTTAGACATTCGAGAT ATAG-3′)和AGO1-R(5′-CCGCTCGAGTTGAACGTA TGAATCATTA-3′)。按照1.2节的方法设置反应体系并进行PCR扩增,反应程序: 94 ℃预变性5 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸10 min, 共30个循环。同样按照1.2节的方法进行扩增片段的回收、TA克隆及Sanger测序。
将测序正确的菌液转接至新鲜LB培养基(氨苄抗性),继续震荡培养。利用FastPure Plasmid Mini Kit (诺唯赞生物科技股份有限公司,南京)提取质粒,再使用NcoⅠ和XhoⅠ(TaKaRa,日本)对提取的pESI-T-AmAGO1质粒和pET-28a载体(索莱宝生物科技有限公司,北京)进行双酶切。酶切产物经琼脂糖凝胶电泳检测后切胶回收,再将回收片段与酶切后的pET-28a载体混合后进行连接反应。连接产物转化大肠杆菌DH5α感受态细胞后进行涂板、挑斑及测序。将测序结果正确的菌液进行扩增,提取质粒后转化Transetta (DE3)感受态细胞(全式金生物技术有限公司,北京),同时转化未插入片段的空载pET-28a质粒作为对照,转化产物复苏后涂板于LB固体培养基(卡那霉素抗性),挑斑后摇菌过夜。将菌液加入50%甘油后保存于-80 ℃超低温冰箱(Sanyo公司,日本)备用。
1.6 AmAGO1融合蛋白的原核表达
1.6.1蛋白小量表达和验证:取50 μL 1.5节保存的菌液加入到2 mL LB液体培养基(卡那霉素抗性),37 ℃,200 r/min摇菌。待菌液的OD值达到0.6左右后加入异丙基-β-d-硫代半乳糖苷(Isopropyl-β-d-thiogalactoside, IPTG) (索莱宝生物科技有限公司,北京),使其终浓度达到1 mmol/L。继续摇菌8 h后12 000 r/min 4 ℃离心,加入20 μL 5×蛋白上样缓冲液以及80 μL PBS缓冲液重悬沉淀,100 ℃孵育5 min,12 000 r/min 4 ℃离心5 min后取上清进行SDS-PAGE电泳检测。由于构建的pET-28a-AmAGO1质粒蛋白C端带有6×His标签,因此通过Western blot对融合蛋白进行检测,采用鼠Anti-His Mouse多克隆抗体(博奥森生物技术有限公司,北京)作为一抗,使用HRP标记的兔抗鼠单克隆抗体(博奥森生物技术有限公司,北京)作为二抗,ECL显色后进行曝光观察。
1.6.2IPTG最佳浓度筛选:分别取50 μL保存的菌液,加入到5管2 mL LB液体培养基(卡那霉素抗性),在菌液OD值达到0.6左右时加入IPTG进行诱导表达,使其终浓度分别达到0.1, 0.2, 0.6, 1.0和2.0 mmol/L。按照1.6.1节的方法分别对诱导表达出的融合蛋白进行SDS-PAGE检测。
1.6.3蛋白表达形式鉴定:取1 mL保存的菌液加入到50 mL LB液体培养基(卡那霉素抗性),按照1.6.1节的方法选取蛋白表达最高时的IPTG浓度进行蛋白的诱导表达,24 h后8 000 r/min 4 ℃离心5 min,收集菌液沉淀,加入5 mL PBS缓冲液后使用超声波细胞破碎仪(新芝生物科技有限公司,宁波)破碎菌体,程序设置为:超声功率200 W,超声2 s,间隔3 s,共20 min。破碎后的菌液转移至离心管,8 000 r/min 4 ℃离心5 min以分离上清和沉淀,再通过SDS-PAGE鉴定融合蛋白的表达形式。
1.6.4蛋白大量表达与纯化:按照1∶100的比例将保存的菌液加入到总共2 L的LB液体培养基(卡那霉素抗性),按照1.6.1节的方法进行诱导表达。摇菌完成后离心菌液,用裂解液(50 mmol/L Tris, 300 mmol/L NaCl, pH 8.0)重悬沉淀,加入苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)使其终浓度达到1 mmol/L,超声波破碎菌体后离心收集包涵体。使用洗涤液(2 mol/L尿素, 50 mmol/L Tris, 300 mmol/L NaCl, 1% Triton X-100, pH 8.0)进行洗涤包涵体1 h后离心收集沉淀,再用包涵体溶解液(8 mol/L 尿素, 50 mmol/L Tris, 300 mmol/L NaCl, pH 8.0)溶解包涵体2 h,离心收集上清,用0.45 μmol/L滤器进行过滤,参照杨付来等(2020)报道的方法进行蛋白纯化。将纯化过程中的上样液、流穿液、洗杂液、不同咪唑浓度(50, 100, 200, 300和500 mmol/L)下的洗脱液进行SDS-PAGE以检测蛋白纯化效果。收集纯化蛋白,使用透析膜进行梯度透析,然后使用PEG20000进一步浓缩。最后使用BCA蛋白浓度测定试剂盒(上海翌圣生物科技有限公司,上海)测定纯化蛋白的浓度。
1.7 多克隆抗体制备
参照吴鹰等(2023)的方法,将1.6.4节纯化后的AmAGO1蛋白作为抗原与等体积弗式完全佐剂(Sigma,美国)和不完全佐剂(Sigma,美国)混匀用于免疫2只新西兰大白兔,第1, 21, 35和49天连续免疫5次;第42和56天进行耳静脉采血后利用ELISA试剂盒(上海谷研实业有限公司,上海)检测抗血清效价;待抗血清效价达到要求后,通过颈动脉采集全血离心后收集血清,随后进行抗原亲和纯化,抗原包被量为2~5 μg/mL;再次利用ELISA试剂盒检测抗体效价。
1.8 抗体检测
1.8.1Western blot检测灵敏度:收集重量约100 mg的西方蜜蜂工蜂6日龄幼虫,液氮速冻后充分研磨,向粉末中加入1 mL蛋白提取液,冰上静置30 min后14 000 r/min 4 ℃离心10 min,吸取上清(即幼虫总蛋白);取40 μL上清,加入10 μL蛋白上样缓冲液后100 ℃加热5 min,12 000 r/min 4 ℃离心5 min,取20 μL进行SDS-PAGE,然后转膜到0.45 μm的PVDF膜上,封闭液中封闭2 h后加入AmAGO1多克隆抗体(1∶1 000稀释),孵育1 h,洗膜液洗膜3次,每次5 min;加入HRP标记的山羊抗兔2抗(1∶10 000稀释),室温孵育1 h,洗膜液洗膜3次,每次5 min;吸干PVDF膜表面多余液体,将事先混合好的ECL显色液滴加到膜上,在利用GE AI600多功能成像仪(GE,美国)进行观察和拍照,检测抗体灵敏度。
1.8.2免疫沉淀检测特异性:取50 μL Protein A/G磁珠(碧云天生物技术有限公司,上海),PBS缓冲液洗涤后在磁力架上放置1 min,吸取上清,重复2次;用20 μL PBS缓冲液重悬磁珠后加入到1 mL的1.8.1节西方蜜蜂工蜂幼虫蛋白提取液中,室温孵育1 h,在磁力架上放置5 min,收集上清;将上清分为2份,一份加入5 μg的AmAGO1多克隆抗体,另一份加入兔IgG抗体作为对照,4 ℃旋转孵育过夜;次日向两组中分别加入50 μL洗涤过的Protein A/G磁珠,室温旋转孵育2 h,离心后弃上清,加入1 mL PBS缓冲液重复洗涤5次;用100 μL PBS缓冲液重悬磁珠,加入蛋白上样缓冲液后进行SDS-PAGE,转膜后进行Western blot检测,使用AmAGO1多克隆抗体作为一抗,HRP标记的山羊抗兔(生工生物工程(上海)股份有限公司,上海)作为二抗照,检测抗体特异性。
1.9 数据分析
采用SPSS Statistics软件对AmAGO1在不同组织和虫态及工蜂不同日龄成虫中的相对表达量进行单因素方差分析(ANOVA),以P<0.05为显著性阈值,采用Tukey氏检验法和字母显著标记法两两比较分析实验数据。
2 结果
2.1 AmAGO1的CDS分子克隆和序列特征
琼脂糖凝胶电泳结果显示,通过PCR能够扩增出单一且符合预期大小(2 884 bp)的片段,Sanger测序结果证实目的片段与GenBank数据库收录的AmAGO1(GenBank登录号: LOC552062)序列完全一致,说明成功克隆到AmAGO1的CDS。生物信息学预测结果显示,AmAGO1含928个氨基酸,分子式为C4624H7332N1316O1325S51,分子量约为104.2 kD,等电点为9.31;AmAGO1含35个丝氨酸磷酸化位点,10个酪氨酸磷酸化位点及41个苏氨酸磷酸化位点;AmAGO1的平均亲水系数为-0.2965,亲水氨基酸数量多于疏水氨基酸;AmAGO1中不存在典型的信号肽;AmAGO1含302(32.54%)个α-螺旋,165条(17.78%)延长链, 54个(5.82%)β-转角和407个(43.86%)无规则卷曲;AmAGO1含典型的PAZ结构域和PIWI结构域。
多重序列比对结果显示(图1),AmAGO1与东方蜜蜂、欧洲熊蜂、家蚕、腹黑果蝇、斑马鱼及智人的AGO1均具有较高的序列一致性。系统进化树显示(图1),同为脊椎动物的智人和斑马鱼的AGO1聚为一支,同为无脊椎动物的西方蜜蜂、东方蜜蜂、家蚕和黑腹果蝇的AGO1聚为一支;西方蜜蜂与东方蜜蜂的AGO1蛋白同源性最高。

图1 邻接法构建的基于氨基酸序列的西方蜜蜂和其他6个物种的AGO1蛋白系统进化树
2.2 AmAGO1的时空表达谱
RT-qPCR检测结果显示,AmAGO1在西方蜜蜂工蜂卵、幼虫、预蛹、蛹和成虫等不同发育阶段中均有表达,但表达量也存在差异;相较于AmAGO1在卵中的表达量,3日龄幼虫和7日龄预蛹中AmAGO1的表达量显著降低,而8日龄预蛹和12日龄蛹中AmAGO1的表达量显著升高(P<0.05)(图2: A);AmAGO1在西方蜜蜂1, 2, 6, 12, 15和18日龄工蜂成虫体内也均有表达,但表达量也存在差异,相较于AmAGO1在1日龄成虫体内的表达量, 2, 6, 12, 15和18日龄成虫体内AmAGO1的表达量显著降低(P<0.05)(图2: B)。AmAGO1在西方蜜蜂工蜂成虫触角等7种组织中均有表达但表达量存在差异,相较于AmAGO1在触角中的表达量,AmAGO1在毒腺、脑、中肠、脂肪体和表皮中的表达量显著降低(P<0.05),而AmAGO1在咽下腺中的表达量无显著差异(P>0.05),表皮中AmAGO1的表达量最低(图2: C)。

图2 AmAGO1在西方蜜蜂工蜂不同发育阶段(A, B)和成虫不同组织(C)中的相对表达量
2.3 AmAGO1融合蛋白的诱导表达
SDS-PAGE结果显示,加入IPTG后在Transetta细胞中成功诱导表达出大小符合预期(约20 kD)的目的蛋白(图3: A),进一步利用6×His标签的特异性抗体对诱导表达出的融合蛋白进行Western blot,可检测到大小约20 kD的蛋白,说明成功诱导表达出AmAGO1融合蛋白(图3: B)。
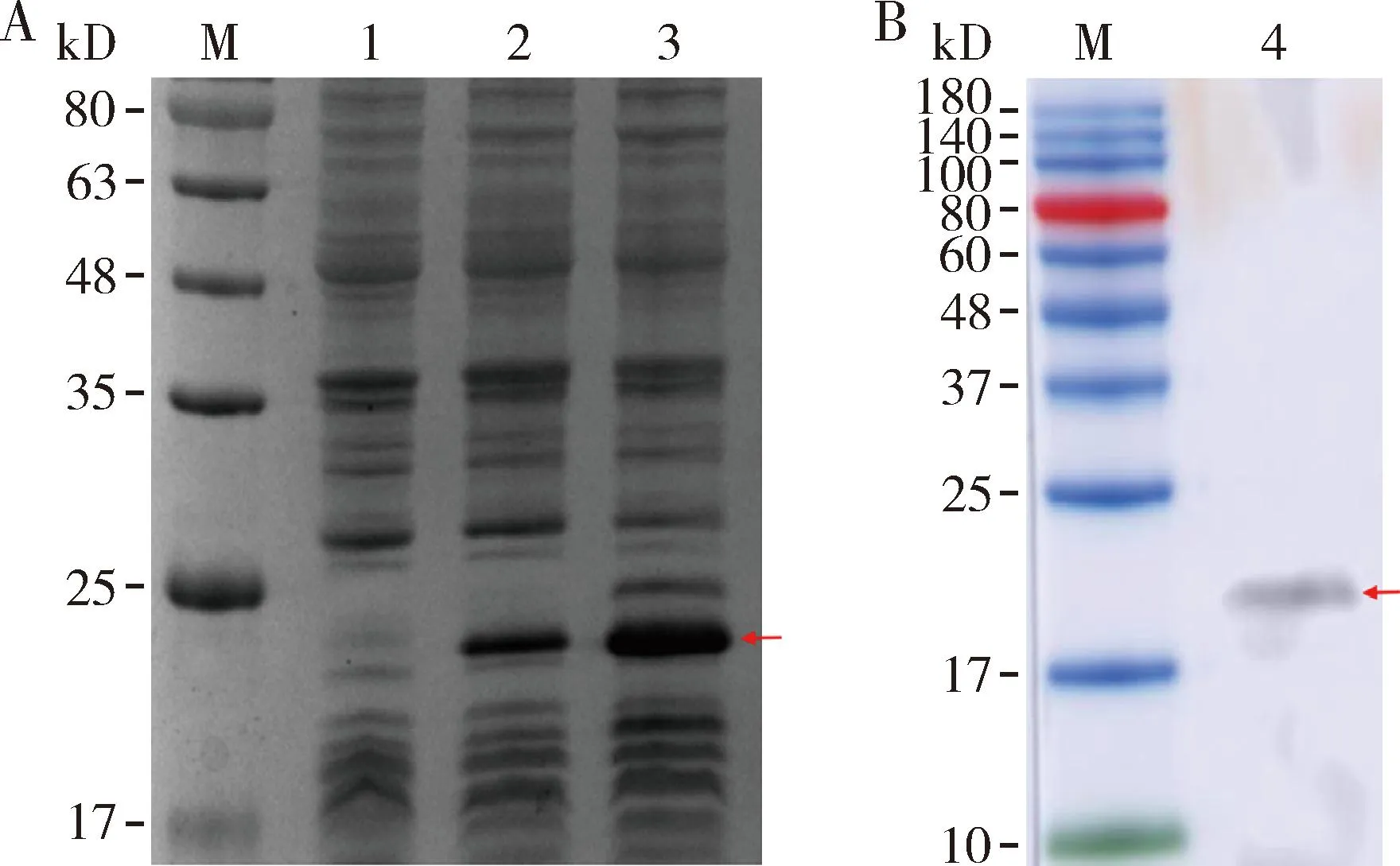
图3 IPTG诱导重组质粒pET-28a-AmAGO1表达蛋白的 SDS-PAGE(A)和Western blot检测(B)
分别使用不同IPTG浓度对重组质粒pET-28a-AmAGO1进行蛋白诱导表达,SDS-PAGE检测结果显示当IPTG浓度为0.1, 0.2, 0.6, 1和2 mmol/L时均能诱导蛋白表达,其中0.6 mmol/L时能诱导出更高的蛋白表达量(图4)。
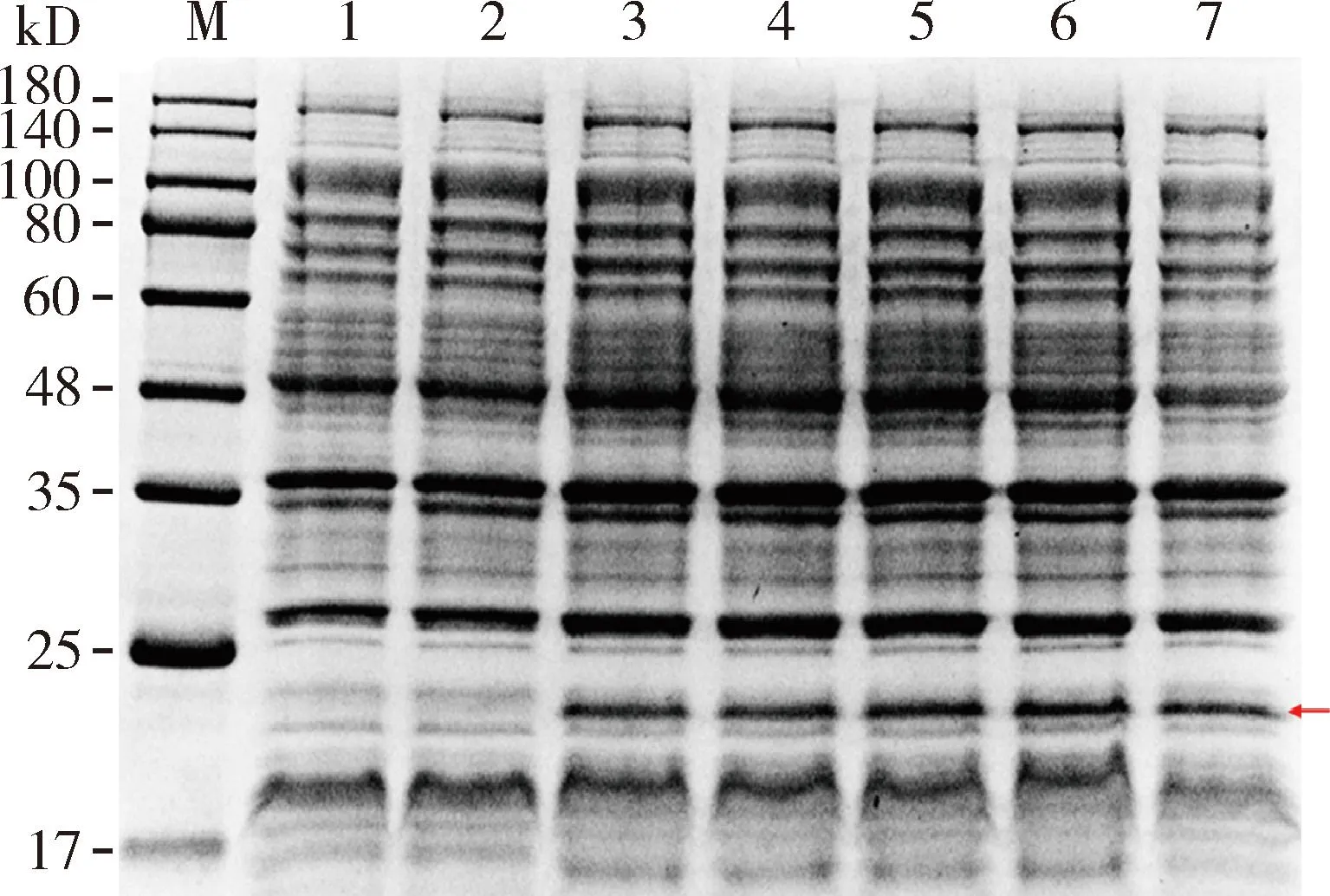
图4 37 ℃条件下不同浓度IPTG诱导表达AmAGO1 的SDS-PAGE检测
对菌液破碎离心后得到的上清液以及沉淀进行SDS-PAGE电泳检测,结果显示在沉淀中检测到明显的目的条带,而在上清中仅能检测到微弱的目的条带,说明诱导表达的蛋白为包涵体形式(图5)。大量表达及纯化得到纯度较高的AmAGO1融合蛋白的浓度达到0.8 mg/mL(图6)。

图5 pET-28a-AmAGO1质粒诱导表达形式鉴定
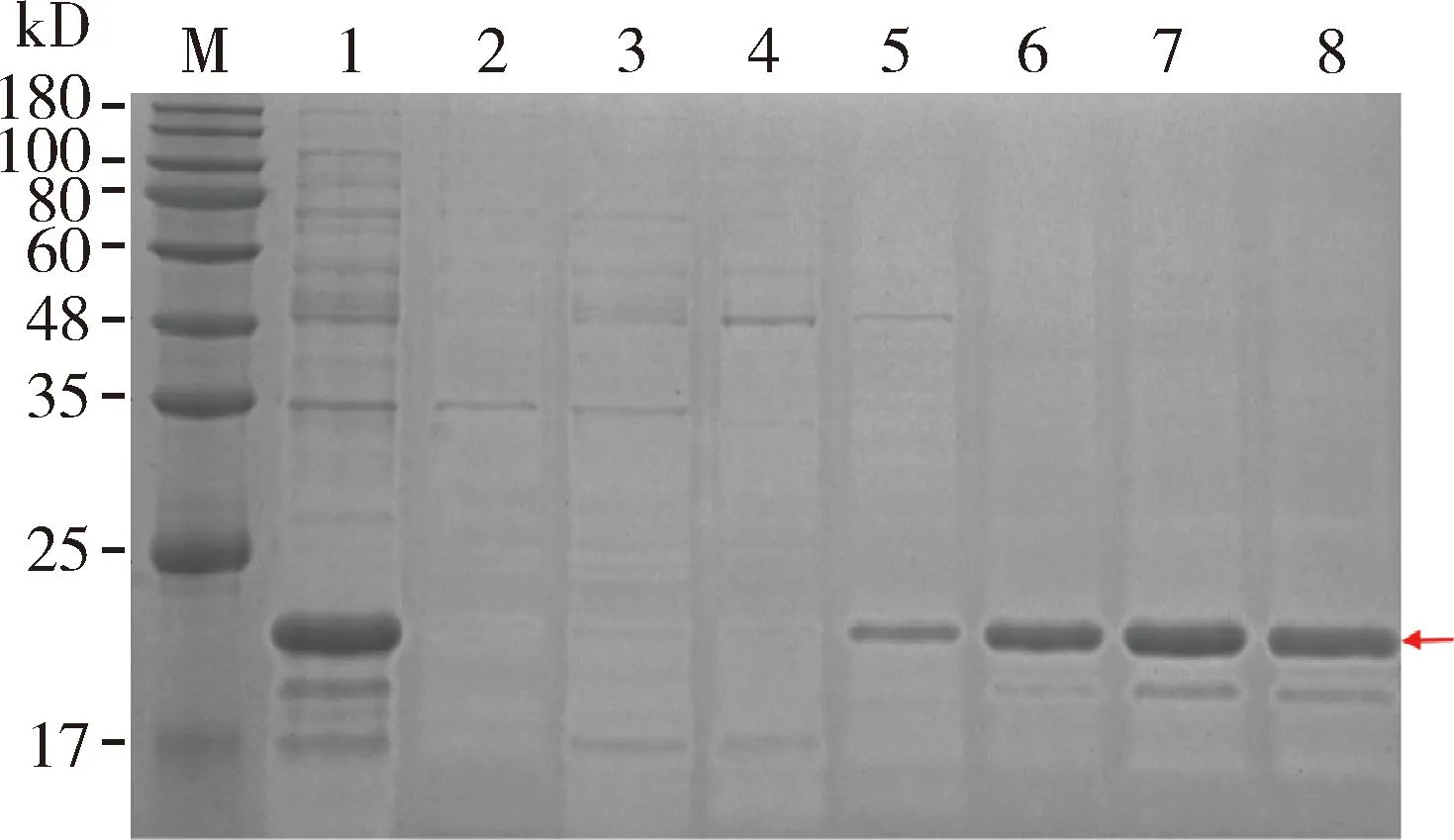
图6 纯化的AmAGO1融合蛋白的SDS-PAGE检测
2.4 AmAGO1多克隆抗体
ELISA检测结果显示AmAGO1多克隆抗体效价大于512 K,说明制备的抗体具有较高的效价和灵敏度。Western blot检测结果显示可以特异性检测到AmAGO1蛋白(图7: A),灵敏度高。免疫沉淀检测结果显示,AmAGO1多克隆抗体可以特异性富集AmAGO1蛋白,而兔IgG无法富集AmAGO1蛋白(图7: B),表明制备的AmAGO1多克隆抗体具有较强的特异性。

图7 免疫沉淀(IP)检测AmAGO1多克隆抗体的特异性
3 讨论
本研究首次克隆到西方蜜蜂AmAGO1的CDS,为持续深入开展相关研究提供了序列基础。生物信息学分析结果显示AmAGO1含928个氨基酸,分子式为C4624H7332N1316O1325S51,分子量约为104.2 kD,等电点为9.31;亲水性指数-0.2965,暗示其为亲水性蛋白;AmAGO1含有典型的PAZ结构域和PIWI结构域,说明其属于AGO蛋白家族;西方蜜蜂、东方蜜蜂、欧洲熊蜂、家蚕和黑腹果蝇的AGO1氨基酸序列相似度较高,且西方蜜蜂、东方蜜蜂、家蚕和黑腹果蝇的AGO1聚为一支(图1),表明上述4种昆虫的AGO1同源性较高;西方蜜蜂和东方蜜蜂的AGO1进化距离最近,符合二者互为姐妹种的客观事实。以上结果为进一步探究AmAGO1的生物学功能提供了有价值的参考信息和理论依据。
AGO蛋白是昆虫miRNA通路中的重要组成部分,AGO蛋白通过靶向泛素-蛋白酶体通路中的蛋白水解暴露miRNA进行降解,即能够与miRNA形成靶向miRNA降解机制(target-directed miRNA degradation, TDMD),进而参与昆虫体内的诸多生物学过程(Shietal., 2020)。本研究发现,AmAGO1在西方蜜蜂工蜂成虫组织中均有表达(图2: C),说明AmAGO1在西方蜜蜂体内广泛分布和表达,暗示其功能的重要性。触角是蜜蜂感知化学信号的主要器官,本研究发现AmAGO1在西方蜜蜂工蜂成虫触角中表达且表达量显著高于毒腺、脑、中肠、脂肪体和表皮中的表达量,说明AmAGO1与西方蜜蜂工蜂的化学信号感知密切相关。蜜蜂咽下腺由两条呈葡萄状的腺泡组成,哺育蜂的咽下腺主要分泌蜂王浆哺育幼虫,而采集蜂咽下腺行使加工碳水化合物代谢酶的功能(Corby-Harris and Snyder, 2018)。本研究中,刚出房的工蜂成虫咽下腺中AmAGO1表达量显著高于毒腺、脑、中肠、脂肪体和表皮中的表达量(图2: C),推测AmAGO1参与蜂王浆的合成与分泌过程。蜜蜂中肠是消化食物、吸收营养和抵御病原入侵的重要器官(吴鹰等, 2023),本研究发现工蜂中肠中AmAGO1的表达量显著高于毒腺、脂肪体和表皮中的表达量,暗示AmAGO1在西方蜜蜂工蜂的消化吸收和免疫防御中扮演重要角色。下一步拟通过对AmAGO1进行RNAi探究AmAGO1在西方蜜蜂工蜂化学信号感知、蜂王浆合成与分泌及消化吸收和免疫防御中的功能。
蜜蜂是一种完全变态昆虫,其生活史历经卵、幼虫、预蛹、蛹和成虫5个发育阶段。本研究中,AmAGO1在工蜂卵、幼虫、预蛹、蛹和成虫中呈动态差异表达,说明AmAGO1在西方蜜蜂工蜂的变态发育过程中的各个阶段持续发挥功能。此外,8日龄预蛹中AmAGO1的表达量显著高于7日龄预蛹中的表达量(图2: A),鉴于预蛹中组织器官发生剧烈的消解和重组,推测AmAGO1在此过程中发挥重要功能,值得进一步深入研究。王艳丽等(2016)研究发现,注射dsRNA干扰的飞蝗4龄若虫AGO1后,待若虫蜕皮至5龄期时发生大量死亡,说明AGO1与飞蝗的生长发育相关。本研究发现,AmAGO1在1, 2, 6, 12, 15和18日龄工蜂成虫体内均有表达且总体表现为持续下降-上升-下降的表达趋势(图2: B),表明AmAGO1在西方蜜蜂成虫发育过程中具有重要功能。在蜜蜂成蜂的发育过程中,6-16日龄的工蜂分泌腺十分发达,其中6-12日龄的工蜂上鄂腺十分发达,12日龄之后的工蜂蜡腺发达,负责制造大量巢脾(曾志将, 2003)。本研究中,AmAGO1在1日龄工蜂体内表达量最高,而在12日龄工蜂体内表达量最低(图2: B),表明AmAGO1与西方蜜蜂工蜂出房、腺体变化、制造巢脾之间具有相关性。上述结果为西方蜜蜂工蜂变态发育过程中AmAGO1的功能研究的时间点选取提供了重要参考。
原核表达系统具有表达量高、成本较低和操作简易等优点,是目前应用最为广泛的蛋白表达系统之一(Fernández, 2004)。大肠杆菌细胞具有密码子偏好性,因而含有较多稀有密码子的基因在其中无法正常表达(Fernández, 2004)。由于Transetta (DE3)感受态细胞中含有大肠杆菌细胞缺乏的稀有密码子对应的tRNA,理论上可用于外源基因的原核表达(Carmignotto and Azzoni, 2019)。本研究中,鉴于AmAGO1的核苷酸序列较长(约2 884 bp),我们首先对AmAGO1蛋白进行抗原表位分析,并结合亲水性指数、抗原指数和表面可及性筛选出299~456个氨基酸区域用于构建原核表达载体。本研究成功构建含AmAGO1部分片段的pET-28a-AmAGO1重组质粒并转化Transetta (DE3)感受态细胞,加入IPTG后可诱导表达出约20 kD的目的蛋白(图3: A);进一利用6×His标签的特异性抗体进行Western blot,可检测到大小约20 kD的蛋白(图3: B)。上述结果表明成功诱导表达出AmAGO1融合蛋白。这说明对于核苷酸序列较长的基因,筛选部分片段进行原核表达质粒构建是一种可行方法(Chenetal., 2005),本研究提供了又一例证。
利用原核表达系统表达外源蛋白,常由于蛋白合成速度过快而导致无法正确折叠,从而形成包涵体(Sánchezetal., 2022)。此外,由于大肠杆菌细胞无法像真核生物一样对合成的蛋白进行糖基化和甲基化等修饰,进一步降低了蛋白的可溶性表达(Fernández, 2004)。有研究表明降低温度可以提高原核表达过程中可溶性蛋白的含量(张磊等, 2021)。本研究尝试在16 ℃进行融合蛋白的诱导表达,但发现目的蛋白仍然存在于包涵体。考虑到本研究的主要目的是制备AmAGO1的多克隆抗体,故采用对包涵体蛋白进行复性的方法获得目的蛋白。本研究在37 ℃条件下大量表达AmAGO1融合蛋白(图4),进而使用高浓度尿素溶解包涵体蛋白(图5),SDS-PAGE结果显示纯化蛋白较为清晰、浓度较高,可满足抗体制备的需要(图6)。ELISA试剂盒检测结果显示制备的AmAGO1多克隆抗体的效价大于512 K,说明该抗体具有较高的效价和灵敏度。Western blot检测结果显示上述抗体可以在西方蜜蜂工蜂幼虫蛋白样本中检测到约100 kD的条带(图7: A),符合预期大小,说明制备的AmAGO1多克隆抗体特异性较好。IP技术的原理是通过抗原与抗体的结合形成复合物沉淀以富集抗原蛋白,具有特异性强和灵敏度高等优点,广泛用于鉴定蛋白质及验证蛋白互作登方面的研究(DeCaprio and Kohl, 2017)。本研究中,IP组可以特异性富集AmAGO1蛋白(图7: B),而IgG组不能富集AmAGO1蛋白,进一步表明制备的AmAGO1多克隆抗体具有较强的特异性。
AGO1蛋白能结合miRNA形成miRISC,进而发挥基因沉默作用(Bartel, 2004)。目前,利用AGO抗体验证miRNA和靶基因的结合及互作关系已见诸于家蚕(杨帆等, 2019)、埃及伊蚊Aedesaegypti(Zhangetal., 2016)、褐飞虱Nilaparvatalugens(Yeetal., 2019)和朱砂叶螨Tetranychuscinnabarinus(冯楷阳, 2020)等节肢动物的研究报道。但到目前为止,蜜蜂中的相关研究仍然缺失。本研究制备出的高效价、高灵敏度和强特异性的AmAGO1多克隆抗体可用于后续的RNA免疫沉淀(RNA immunoprecipitation, RIP)等实验,以及西方蜜蜂miRNA与靶基因的互作及miRNA的调控功能及机制研究。另外,鉴于西方蜜蜂和东方蜜蜂AGO1蛋白同源性高,本研究获得的AmAGO1多克隆抗体有望用于东方蜜蜂的相关研究。

