茶尺蠖羧酸酯酶EoCarE592的重组表达及其对农药的降解能力测定
税良勇, 赵忠祎, 冯 印, 谢晓倩, 袁晓琴, 毛新芳, 刘忠渊
(四川轻化工大学化学工程学院, 自贡 643000)
羧酸酯酶(carboxlesterase, CarE,EC3.1.1.1)属于具有α /β水解酶活性的丝氨酸水解酶(Lietal., 2022)家族成员,是一种广泛存在于生物体内的多功能水解酶,可以水解大量内源性或外源性含有酯键、硫酯键和酰胺键化合物(Johanetal., 2021)。其一级结构在进化上具有高度的保守性,其活性中心(Ser/Cys-Asp/Glu-His)残基形成高度保守的催化三联体;催化三联体在肽链的一级结构式不连续,在肽链三级结构中互相关联成为活性中心;其次,亲核活性中心的Ser/Cys位于高度保守的五肽氨基酸序列(G-X-S/C-X-G)中(陆巧颖, 2021)。羧酸酯酶的功能具有多样性,在哺乳动物体内参与酯质的稳态平衡、含酯类药物和环境毒物的代谢(Márciaetal., 2016),同时参与生长代谢的调节和神经递质的传递(Wangetal., 2018);在微生物体内参与细胞内酯的合成(Johanetal., 2021);在昆虫体内,羧酸酯酶不仅参与生长发育、营养代谢及环境适应(Fengetal., 2018),还与昆虫对农药产生抗性密切相关。根据功能和氨基酸序列的相似性,昆虫羧酸酯酶分为生长发育、营养代谢以及环境适应性3类,包括α-酯酶、β-酯酶、幼年激素酯酶、外皮酯酶、乙酰胆碱酯酶、神经递质、突触受体、胶质肌动蛋白和谷氨酸肌动蛋白9个分支(Ransonetal., 2002)。在昆虫羧酸酯酶的9个分支中,α-酯酶、β-酯酶和乙酰胆碱酯酶与对杀虫剂抗性有关(Coppinetal., 2012)。近20年来,研究人员从昆虫体内陆续分离了多种羧酸酯酶,其结构和功能上的相似性表明羧酸酯酶与农药的抗性及解毒机制密切相关,例如白微微等(2018)在不同剂量的吡虫啉刺激下,麦长管蚜Sitobionavenae羧酸酯酶基因SaEST3 mRNA的相对表达量均上调;尹菲等(2020)研究发现飞蝗Locustamigratoria羧酸酯酶基因LmCesA1和LmCesA2在马拉硫磷的刺激下的表达量成倍地上调,比农药处理前的抗性提高了1.5倍,羧酸酯酶基因LmCesA2可能参与飞蝗对马拉硫磷的代谢解毒过程;Kai等(2022)通过RNA干扰降低CarE基因表达,显著增加了褐飞虱Nilaparvatalugens对毒死蜱的抗性。此外,多种农药的刺激下,昆虫体内单一的羧酸酯酶基因表达并产生对多种杀虫剂的抗药性,例如小菜蛾Plutellaxylostella体内的羧酸酯酶基因PxaE14可对6种杀虫剂(β-氯氰菊酯、联苯菊酯、毒死蜱、氰戊菊酯、马拉硫磷和辛硫磷)产生抗性,羧酸酯酶基因PxE8可对两种杀虫剂(α-氯氰氰菊酯和马拉对硫磷)产生抗性(Lietal., 2021)。多种证据表明羧酸酯酶与昆虫抗药性产生和发展密切相关。
茶尺蠖Ectropisobliqua是主要的茶园害虫之一,其繁殖能力及幼虫活动能力较强,交配和传代时间较短,短期内暴发会对茶叶生产造成危害(张帅琪等, 2020)。近20年来,农药的过度使用及昆虫抗性产生一度成为困扰农业生产和环境治理的问题(Hüesker and Lepenies, 2022)。一方面,昆虫的抗药性产生会加剧害虫对农业生产造成的破坏;另一方面,加大对害虫的防护可能会促使农药的过度使用和滥用,进而加剧环境污染和农药残留问题。本实验室前期研究发现茶尺蠖对农药产生抗性(Pengetal., 2022)可能与羧酸酯酶CarE592、乙酰胆碱酯酶EoPPase672相关。通过克隆得到茶尺蠖羧酸酯酶基因EoCarE592(GenBank登录号: ON110139),其核苷酸序列长度1 626 bp,编码541个氨基酸。本研究构建了重组表达载体pET-32a-EoCarE592,并进行原核表达和包涵体蛋白变复性,通过气相色谱检测重组EoCarE592对农药的降解研究,为进一步研究羧酸酯酶参与茶尺蠖体内农药解毒过程奠定基础,同时为解决农药过度使用及农药残留问题提供一种新的研究思路。
1 材料与方法
1.1 主要试剂和仪器
氯化钠、氢氧化钠、丙酮和冰乙酸均购买自重庆川东化工有限公司;胰蛋白胨、酵母膏、氨苄青霉素钠、异丙基β-D-硫代半乳糖苷、三羟甲基氨基甲烷、十二烷基磺酸钠、丙烯酰胺、甲叉丙烯酰胺、过硫酸铵、Triton X-100、乙二胺四乙酸、尿素、丙三醇、甘氨酸、精氨酸、聚乙二醇400、GSH、BSA均购自上海生工生物工程有限公司;高效氯氟氰菊酯、异丙维和甲基对硫磷(色谱纯)均购自上海泰坦科技股份有限公司,其他未标明试剂均为国产分析纯。
7890A气相色谱仪(配有FID检测器)购买自安捷伦科技有限公司;智能型电热恒温培养箱(DHP-9160B)购自上海一恒科学仪器有限公司;超纯水制造系统(UPH-Ⅱ-20T)购自四川优普超纯科技有限公司;恒温培养摇床(HZ150L)购自上海精胜科学仪器有限公司;电泳系统(Trans-blot SD Cell、SDS-PAGE)购自Bio-Rad;超声波实验设备(JY92-IIDN)购自宁波新芝生物科技股份有限公司;医用冷冻离心机(TGL-16)购自四川蜀科仪器有限公司;台式离心机(TGL-16M)购自上海卢湘仪; 全波长酶标仪(ReadMax1200)购自上海闪谱生物科技有限公司。
1.2 生物信息学分析
基于实验室茶尺蠖转录组数据库获得EoCarE592基因的cDNA序列和氨基酸序列,登录NCBI数据库下载其他昆虫的羧酸酯酶氨基酸序列,利用在线软件Espript (https:∥espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)进行多序列比对。利用MEGA 6软件的邻接法(neighbor-joining, NJ)构建茶尺蠖EoCarE592与其他鳞翅目昆虫的羧酸酯酶系统发育树。利用在线软件Swiss-model (https:∥swissmodel.expasy.org/)进行二级、三级结构预测与同源建模。
1.3 原核表达
将实验室保存的重组表达载体pET-32a-EoCarE592载体转化大肠杆菌EscherichiacoliBL21感受态细胞中,并接种到含有100 mg/L氨苄青霉素的LB固体培养基中,37 ℃下过夜培养;挑选阳性克隆菌种在含有100 mg/L氨苄青霉素的LB培养基上180 r/min 37 ℃培养4 h;加入IPTG至终浓度60 μmol/L诱导表达4 h,并以不添加IPTG的阳性菌作为空白对照组;8 000 r/min 4 ℃离心15 min,收集上清液和细菌沉淀;细菌沉淀用pH 8.0 Tris-HCl 重悬洗涤两次,8 000 r/min 4 ℃离心15 min,超声破碎(功率200 W、超5 s停10 s),收集上清液和破碎后沉淀,SDS-PAGE检测蛋白表达情况。
1.4 包涵体蛋白纯化与变复性
将超声破碎后的细菌沉淀用包涵体洗涤液(50 mmol/L Tris-HCl, 100 mmol/L NaCl, 0.1% Triton X-100, pH 8.0)洗涤2次,再用含8 mol/L尿素的Tris-HCl缓冲溶液溶解包涵体;BCA法测定蛋白浓度,并将包涵体蛋白加入到镍柱中,4 ℃震荡2 h,用含有8 mol/L尿素不同浓度的咪唑缓冲溶液(20, 50, 100, 250和500 mmol/L)进行洗脱,并收集洗脱液,将洗脱后的蛋白稀释到100 mg/L;用含有6, 5, 4, 3, 2, 1和0 mol/L尿素的蛋白复性缓冲溶液(50 mmol/L Tris-HCl, 100 mmol/L NaCl, 1 mmol/L氧化型谷胱甘肽, 1 mmol/L还原性谷胱甘肽, 5%甘油, 10 mmol/L甘氨酸和1%精氨酸)进行梯度透析复性(每个浓度透析4 h);透析后的重组蛋白用超滤膜浓缩。
1.5 Western-blot检测目的蛋白EoCarE592
SDS-PAGE检测1.4节复性后的蛋白。用含1%脱脂奶粉的TBST按1∶5 000(v/v)稀释一抗(Anti 6×His-Tag 小鼠多克隆抗体), 4 ℃过夜孵育,洗膜5次;1∶50 000 (v/v)稀释二抗(HRP-conjugated Goat Anti-Mouse IgG),37 ℃孵育2 h,洗膜5次;ECL(Ultrasensitive ECL Chemiluminscence Kit)染色液避光染色1 min, 曝光15 s观察显色情况。
1.6 EoCarE592酶活性测定
固蓝B盐比色法测定EoCarE592的酶活性(周帅, 2013)。1 mol/L 1-萘酚(无水乙醇溶)稀释为0, 60, 120, 240, 360, 480和600 mmol/L的梯度溶液;取25 μL 1-萘酚梯度溶液至2.925 mL的pH 7.0磷酸盐缓冲溶液中,再加入50 μL氯化四氮邻二甲氧基苯胺(固蓝B盐),30 ℃避光水浴10 min测定OD600值, 每个浓度梯度重复3次。以OD600值和1-萘酚浓度分别作横纵坐标,作1-萘酚浓度与吸光度标准曲线;酶活性单位定义:单位时间内催化产生1 μmol 1-萘酚所需酶量定义为1个酶活性单位:1 U=1 μmol/(mL·min)(周帅, 2013)。
参照1-萘酚浓度与吸光度标准曲线制作方法,添加100 μL复性后的重组EoCarE592,以100 μL 100 mg/L牛血清白蛋白(BSA)为空白对照,底物为25 μL 30 mmol/L 1-乙酸萘酯,30 ℃ 避光水浴10 min,测定OD600值,根据1-萘酚浓度与吸光度的标准曲线计算1-萘酚的产量,平行重复3次。
1.7 温度、pH对EoCarE592酶活性的影响测定
参照1.6节酶活测定方法,设置15, 20, 25, 30, 35, 40和50 ℃温度梯度;每个温度梯度在pH 7.0的磷酸盐缓冲溶液中避光水浴10 min。以添加100 μL 100 mg/L牛血清白蛋白为空白对照,紫外分光光度计测定梯度温度下OD600值,每个梯度平行重复3次。根据1-萘酚标准曲线计算1-萘酚的产量,以确定EoCarE592酶活性的最适温度。
参照1.6节酶活测定方法,设置不同梯度的pH值(3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0和10.0)的缓冲溶液,每组pH梯度在30 ℃避光水浴10 min,紫外分光光度计测定不同pH梯度下OD600值,每个梯度平行重复3次根据1-萘酚标准曲线计算1-萘酚的产量,以确定EoCarE592酶活性的最适pH。
1.8 金属离子对EoCarE592酶活性影响的测定
以不含任何金属离子的Tris-HCL溶液中(pH 8.0)作为缓冲体系,参照1.6节酶活性测定方法,向EoCarE592酶促反应中添加Li+, Na+, K+, Ca2+, Mg2+, Zn2+, Fe2+, Ni2+, Cd2+, Cu2+, Al3+和Fe3+。每种金属离子的终浓度均5 mmol/L,在30 ℃下孵育 10 min,再加入底物1-乙酸萘酯反应10 min,测定产物的量来计算其酶活性,空白对照组不添加任何金属金属离子,相同条件下测定1-萘酚的产量。每组实验重复3次,以空白对照组为参考,评定不同金属离子对酶促反应的影响。
1.9 EoCarE592对高效氯氟氰菊酯、甲基对硫磷和异丙威的降解率测定
以丙酮为溶剂分别配制2 g/L的高效氯氟氰菊酯、甲基对硫磷和异丙威标准品溶液,依次用丙酮稀释母液为25, 50, 100, 200和400 mg/L的工作液,测定每个工作液中高效氯氟氰菊酯、甲基对硫磷和异丙威的气相色谱峰面积,以峰面积对应的浓度制作高效氯氟氰菊酯、甲基对硫磷和异丙威的浓度与峰面积标准曲线。
处理组在5.3 mL pH 7.0的磷酸盐缓冲溶液分别添加100 μL复性后的EoCarE592、 600 μL 2 g/L高效氯氟氰菊酯、甲基对硫磷和异丙威的标准品溶液(终浓度200 mg/L);空白对照组添加100 μL 100 mg/L BSA,混匀后于30 ℃避光分别孵育0, 4, 8, 12, 16, 20和24 h;处理组反应中加入12 mL 二氯甲烷震荡萃取15 min;6 000 r/min离心15 min,吸取上层水相于另一离心管中加入12 mL 二氯甲烷二次震荡萃取15 min;合并两次萃取液旋转蒸发去除有机溶剂。加入6 mL 丙酮超声溶解产物;气相色谱检测检测处理组和对照组中高效氯氟氰菊酯、甲基对硫磷和异丙威的残留量,依据高效氯氟氰菊酯、甲基对硫磷和异丙威的标准曲线计算高效氯氟氰菊酯、甲基对硫磷和异丙威的残留浓量,每组反应重复3次。降解率(%)=(C0-C1)÷C0×100,C0为BSA对照组中农药浓度,C1为重组蛋白EoCarE592孵育后农药浓度。
在Matlab/Simulink中建立基于模糊控制器的机械臂拾取系统的仿真模型如图3,图4为机械臂拾取系统模型。
高效氯氟氰菊酯气相色谱条件参考国标《GB/T 20695-2021》,色谱柱: 30 m×0.250 mm×0.25 μm(型号Agilent 1909I1-433,HP-5)进样量1 μL,无分流比,载气(N2)2.0 mL/min,氢气60 mL/min,空气300 mL/min,气化室温度280 ℃,柱温:230 ℃恒温保持14 min,FID检测器温度280 ℃。
甲基对硫磷气相色谱条件:进样量1 μL,无分流比,载气(N2) 1.0 mL/min,氢气30 mL/min,空气300 mL/min,气化室温度280 ℃,柱温:70 ℃保持1 min,以20 ℃/min升温到180 ℃,再以50 ℃/min升温至280 ℃保持3 min,FID检测器温度250 ℃。
异丙威气相色谱条件:进样量1 μL,无分流比,载气(N2) 1.0 mL/min,氢气30 mL/min,空气300 mL/min,气化室温度280 ℃,柱温:初始70 ℃保持1 min, 然后20 ℃/min升高至180 ℃,再以30 ℃/min到230 ℃保持1 min,FID检测室温度250 ℃。
1.10 数据分析
利用IBM SPASS Statistic 27分析金属离子对酶活性的影响,采用单因素方差分析和LSD多重分析比较差异性和显著性, Origin 2018软件用于作图。
2 结果
2.1 多序列比对和系统发育树
茶尺蠖EoCarE592的多序列对比如图1所示,EoCarE592与苹果卷叶蛾Ectropispostvittana的EpCarE(GenBank登录号: 7MP4_H)、甜菜夜蛾Spodopteraexigua的SeCarE(GenBank登录号: CAH0692026.1)、家蚕Bombyxmori的BmCarE(GenBank登录号: NP_001182393.1)、大豆尺夜蛾Chrysodeixisincludens的CiCarE(GenBank登录号: CAH0585492.1)具有高度的保守性, 羧酸酯酶家族的催化三联体活性中心如图中黑色方框所示, 为Ser(183)-Glu(313)-His(436),亲核活性中心的Ser所在的五肽氨基酸序列(G-C-S-A-G)如图蓝色方框所示。茶尺蠖羧酸酯酶EoCarE592与鳞翅目昆虫羧酸酯酶在进化上高度保守,具有α/β水解酶超家族成员的催化三联体活性中心和保守的五肽序列。
登录NCBI数据库对茶尺蠖EoCarE592的氨基酸序列进行保守结构域分析,该蛋白属于羧酸酯酶家族(GenBank登录号: PFAM00135),其功能结构域位于第102-189位氨基酸, 为α/β水解酶超家族成员(GenBank登录号: PFAM07859);具有丝氨酸、谷氨酸天冬氨酸或组氨酸的催化三联体特征。
系统发育树显示,茶尺蠖EoCarE592与粉纹夜蛾、大豆尺夜蛾CarE亲缘关系最近,与鳞翅目昆虫CarE归为一个分支(图2)。

图2 邻接法构建的基于氨基酸序列的茶尺蠖EoCarE592 和其他物种CarE的系统发育树
2.2 重组EoCarE592的表达
如图3(A)所示,得到表达、融合蛋白EoCarE592共有644个氨基酸,相对分子质量78 kD、经IPTG诱导表达后的蛋白在78 kD左右出现表达量较高的条带(图3: A, 泳道3),与EoCarE592理论分子量大小相符,重组EoCarE592在细胞内以包涵体蛋白形式存在(图3: A, 泳道4);Ni柱亲和层析结果如图3(B)所示,最适洗脱咪唑浓度为250 mmol/L(图3: B,泳道10),Western blot检测结果(图3: C)表明重组EoCarE592正确表达。复性后的重组EoCarE592采用BCA法进行定量,根据蛋白标准曲线计算出复性后的蛋白浓度为0.0917 mg/mL,超滤浓缩后的重组EoCarE592蛋白含量0.212 mg/mL。
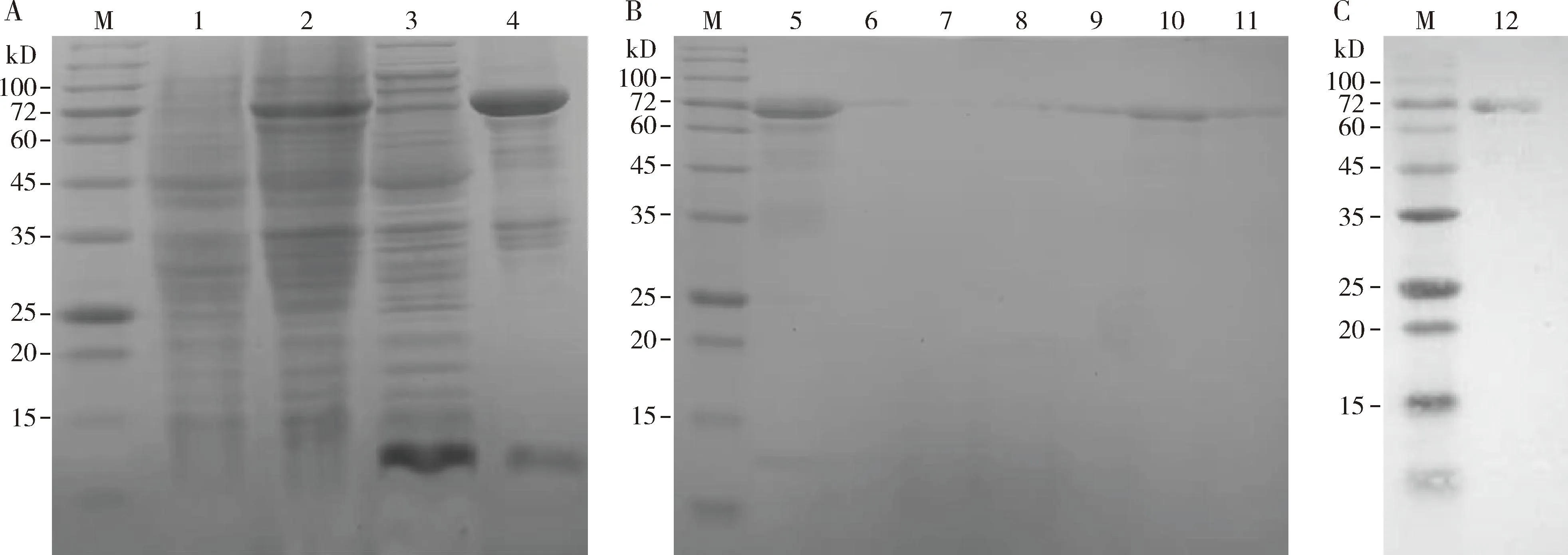
图3 重组EoCarE592表达(A)和纯化(B) SDS-PAGE及Western blot检测(C)
2.3 重组EoCarE592的酶活性
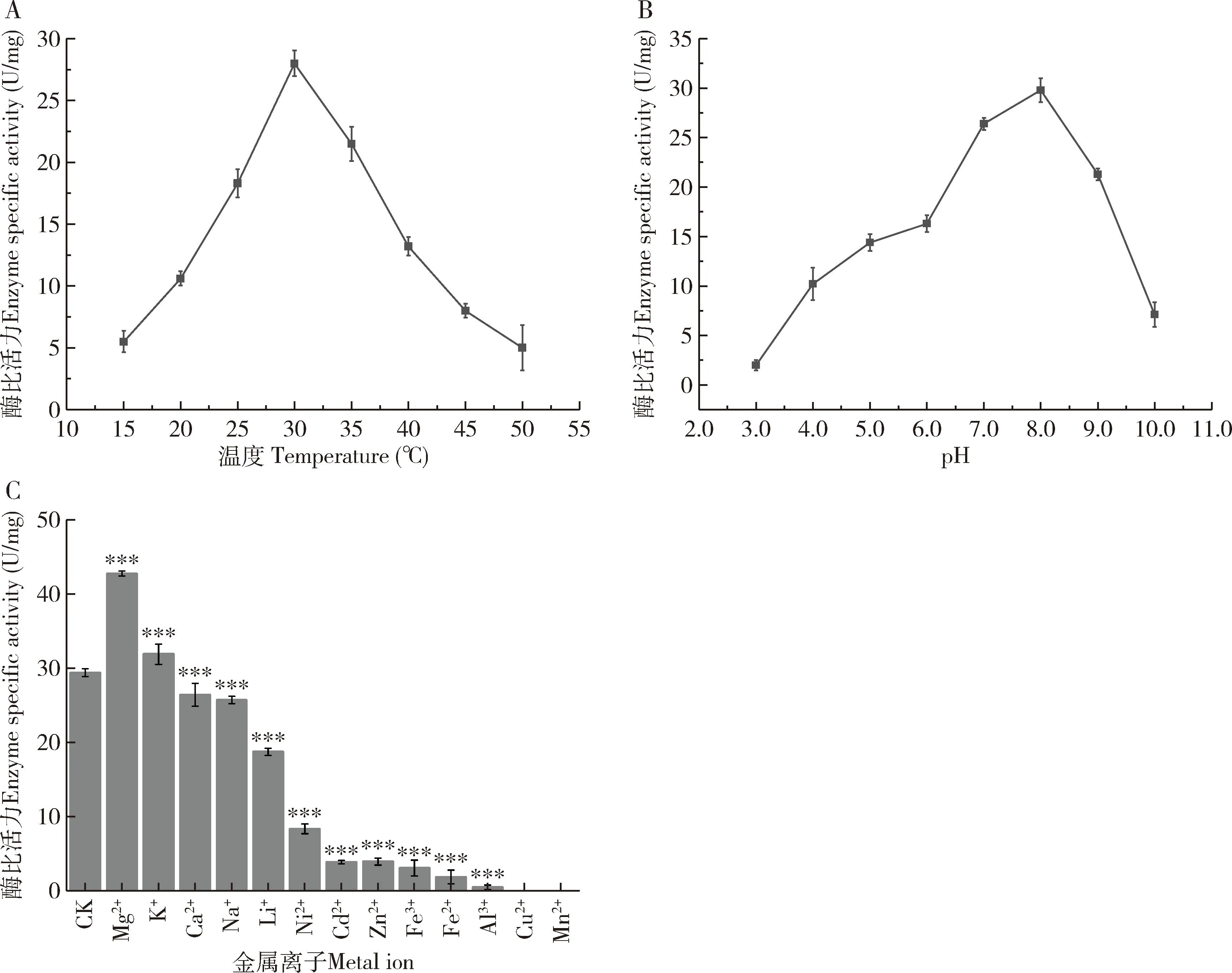
图4 温度(A)、pH(B)及金属离子(C)对重组EoCarE592酶比活力的影响
与空白对照组(无任何金属离子孵育后的重组EoCarE592酶活性)相比,Mg2+和K+对重组EoCarE592的酶活性具有促进作用,其中添加了Mg2+的相对活性提高了33%左右,Ca2+, Li+, Na+, Ni2+, Cd2+, Zn2+, Fe3+, Fe2+, Al3+和Cu2+对重组EoCarE592的酶活性具有明显的抑制作用(图4: C)。
2.4 重组EoCarE592对3种农药的降解率
如图5所示,与BSA处理的空白对照相比,3种农药与重组EoCarE592孵育24 h后的残留量分别为35.28, 27.16和38.00 mg/L,重组EoCarE592对高效氯氟氰菊酯、 甲基对硫磷和异丙威具有降解作用, 且24 h内对3种农药的降解率分别为81.30%, 83.94%和79.83%。
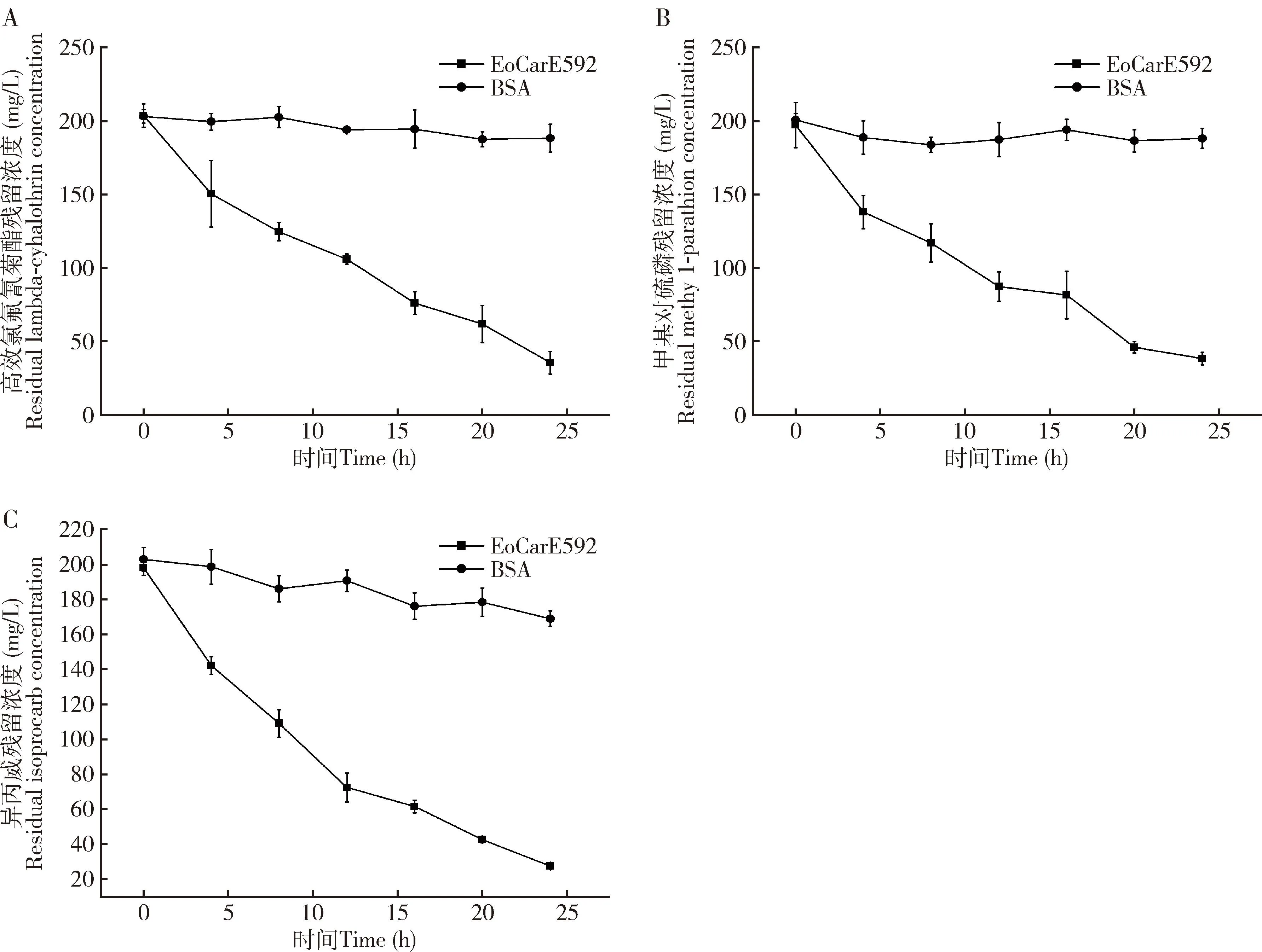
图5 重组EoCarE592对高效氯氟氰菊酯(A)、甲基对硫磷(B)和异丙威(C)的24 h内降解曲线
3 讨论
羧酸酯酶是生物体内重要的多功能水解酶之一,不仅与昆虫生长发育、营养代谢和环境适应密切相关,还与农业害虫对农药产生抗药性密切相关(Wangetal., 2020)。由于羧酸酯酶在昆虫体内参与化学农药试剂的代谢和和隔离作用,其被认为是一种昆虫农药解毒剂,能够良好地消除农药对昆虫产生的氧化应激和杀伤作用(Zhang, 2013)与细胞色素P450(Lu, 2021)和谷胱甘肽-S-转移酶(Vandenholeetal., 2021)并称昆虫的三大解毒基因(Amezianetal., 2021)。因此,羧酸酯酶在农业害虫防治和昆虫抗药性机理方面越来越受到重视和关注。
本研究前期从菊酯类杀虫剂刺激茶尺蠖的转录组数据库中筛选到羧酸酯酶基因片段(尹恒等, 2022),该基因片段全长1 626 bp,共编码644个氨基酸片段。通过生物信息学分析表明,茶尺蠖EoCarE592与其他20中鳞翅目昆虫羧酸酯酶有较高的同源性,其中与斜翅科昆虫粉纹夜蛾、大豆尺夜蛾羧酸酯酶亲缘关系最近(图2);多序列比对结果表明,茶尺蠖羧酸酯酶EoCarE592与苹果卷叶蛾、大豆尺夜蛾、家蚕和甜菜夜蛾的氨基酸序列具有高度的保守性(图1),其α/β水解超基因家族的催化三联体结构和保守的五肽序列完全一致,分别为Ser(183)-Glu(313)-His(436)和G-C-S-A-G,二级结构分析表明(图1),茶尺蠖羧酸酯酶EoCarE592有17个α螺旋、16个β折叠,其余为无规则卷曲,保守的氨基酸残基贯穿整个蛋白序列。
大肠杆菌异源表达羧酸酯酶EoCarE592为无活性的包涵体蛋白,通常情况下原核表达蛋白速率过快,蛋白质二硫键不能正确的的折叠。异源表达的EoCarE592可以通过8~0 mol/L的尿素变复性,复性后的蛋白酶活性为29.8 U。其在15~50 ℃内都具有一定的活性,最适温度为30 ℃左右(图4: A),在pH小于6.0或大于9.0时活性降低。最适pH在7.0~8.0左右(图4: B)。Mg2+能够显著提升EoCarE592酶活性,推测其为酶的活性中心或者启动剂,而Li+, Ni2+, Cd2+, Zn2+, Fe3+, Fe2+, Al3+, Cu2+对重组EoCarE592的酶活具有明显的抑制作用(图5: B)。
已有文献报道,羧酸酯酶作用于氨基甲酸酯类,拟除虫菊酯和其他含酯类农药的酯键,使其发生水解反应进而分裂为相应的羧酸和醇(Yan, 2014)。EoCarE592在30 ℃、pH 7.0的磷酸盐缓冲溶液中能降解大部分始浓度为200 mg/L高效氯氟氰菊酯,降解率达到81.30%(图5: A)。Ding等(2022)的研究表明,羧酸酯酶CarCB2使得高效氯氟氰菊酯的酯键断裂,生成产物主要为3-苯氧基苯甲醛,且3-苯氧基苯甲醛的色谱峰出现在未降解的高效氯氟氰菊酯色谱峰之后,与本研究的结果一致。Li等(2020)异源表达棉铃虫Helicoverpaarmigera的羧酸酶基因CarE001A和CarE001H均能够水解β-氯氰菊酯(β-cypermethrin),高效氯氟氰菊酯和毒死蜱(chlorpyrifos),但是对甲基对硫磷没有降解作用。这种底物特异性可能与羧酸酯酶的催化三联体活性中心的“酰基结合袋”相关(Oakeshottetal., 1999),也有可能与农药和羧酸酯酶催化三联体的结合程度相关(Lietal., 2021)。另外,农药化学结构不同或者空间位阻不同也可能导致酶的底物转一性不同(Baietal., 2019)。
羧酸酯酶是昆虫抵御各种杀虫剂等外源物质的重要物质之一(Wheelocketal., 2005),昆虫通过大量表达羧酸酯酶参与有机磷类农药的解毒,羧酸酯酶与有机磷农药的结合,从而屏蔽有机磷农药的毒害作用(Farnsworthetal., 2010);或者通过水解作用分解有机磷类农药进而参与农药的解毒(Cuietal., 2011)。EoCarE592表现出对有机磷类农药甲基对硫磷(图5: B),在24 h内降解率达到了83.94%,表明EoCarE592对甲基对硫磷存在降解作用而非屏蔽作用(Chevillonetal., 1999)。这与Sanchez-Hernandez等(2019)研究中甲基对硫磷抑制蚯蚓羧酸酯酶的活性作用不同。周帅(2014)异源表达小鼠羧酸酯酶,研究发现该酶对甲基对硫磷和联苯菊酯都具有显著的降解作用。推测EoCarE592可能作用于甲基对硫磷的磷酯键。研究结果为茶尺蠖解毒机理的研究提供新的思路与依据。

